2. 中国环境科学研究院 城市水环境科技创新基地, 北京 100012;
3. 中国矿业大学(北京) 化学与环境工程学院, 北京 100083
2. Department of Urban Water Environmental Research, Chinese Research Academy of Environmental Sciences, Beijing 100012;
3. College of Chemistry and Environment Engineering, China University of Mining and Technology (Beijing), Beijing 100083
双酚A(Bisphenol A,BPA)是一种具有内分泌干扰性的类雌性激素,被广泛应用于制造聚碳酸酯、环氧树脂等高分子材料,也被用在热稳定剂、增塑剂、橡胶防老剂、阻燃剂和涂料等精细化工产品中(Ahmad et al.,2005; 张廷健等,2014).BPA可通过城市污水和工业废水的排放等途径进入环境中,污染地表水和地下水.由于BPA可诱导脊椎动物产生前凸反应,导致哺乳动物子代变异效应,且进入人体后会干扰体内正常激素分泌,从而影响人类生殖功能,因此,BPA进入水体后对水生生物和人体健康构成极大的威胁(Park and Choi,2009;杨帆等,2014; 周飞飞等,2014).随着工农业的快速发展,水体受到BPA污染的形势更加严峻,人们也逐渐认识到净化水中BPA的重要性和紧迫性.
目前,净化水中BPA的方法主要有吸附法(Park et al.,2014)、生物降解法(Gassara et al.,2011),以及光催化(Chiang and Doong,2014; 李前等,2014)、电催化(Zhao et al.,2014)和臭氧氧化(汤茜等,2014)等高级氧化法.生物降解法具有成本低、作用范围广及持续时间长等特点,是一种安全有效的降解水中BPA的方法.生物法降解BPA有两种途径,一是筛选优势微生物菌株降解BPA,二是利用菌株分泌的酶对BPA进行降解(Chouhan et al.,2014).相比之下,酶不受微生物代谢抑制剂影响,对环境中营养等条件要求不高,且酶可更高效快速地降解一些特定的污染物(Gassara et al.,2013).因此,采用酶催化技术降解水中的BPA受到越来越多环境领域研究学者的关注.
漆酶是一种含铜的多酚氧化酶,研究表明其对BPA有较强的催化氧化能力(Asadgol et al.,2014; Telke et al.,2009).但是,由于游离漆酶对环境条件十分敏感,如pH、温度变化等都有可能使其丧失活性,且游离漆酶参与反应后不能回收,难以实现重复利用,限制其在实际中的应用.因此,常采用固定化技术提高酶的稳定性和重复使用性(Homaei et al.,2013).静电纺丝是一种借助高压静电场力使聚合物溶液或熔体快速、高效地形成纳米或微米级纤维的方法.静电纺丝纤维膜具有孔隙率高、比表面积大、均一性好且制备简单等优点,将其作为固定化酶的载体,有利于酶与底物充分接触,能有效提高酶的催化效率,且容易从反应体系中分离回收,因此它被人们认为是一种优良的酶固定化基质(Dai et al.,2010b).
本研究采用静电纺丝纤维膜作为漆酶的固定化载体,利用乳液电纺技术法原位包埋固定化漆酶,对所得载漆酶电纺纤维膜的形貌结构和酶学性能进行表征、分析.同时,利用电纺纤维膜固定化漆酶降解水中BPA,考察不同漆酶浓度、反应温度及pH值等因素对BPA降解效率的影响,并与游离漆酶进行比较.此外,本文还阐明了电纺纤维膜固定化漆酶的酶活保持及其对水中BPA的降解机理.
2 材料与方法(Materials and methods) 2.1 实验药品实验所用BPA(分析纯,纯度98%),杂色云芝漆酶(EC 1.10.3.2,活性5.43 U · mg-1)及其底物2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)(ABTS,纯度99%)购自美国Sigma-Aldrich公司.聚乳酸-乙醇酸共聚物(PDLGA,〖(C6H8O4)3(C4H4O4)1〗n)购自济南岱罡生物工程有限公司,分子量为10万;嵌段共聚物F108(PEO106-PPO70-PEO106)购自德国BASF公司.实验所用超纯水电阻率≥18.2 MΩ · cm,来自美国Millipore Simplicity 185超纯水系统.其他药品均为分析纯,购自国药集团化学试剂北京公司.
2.2 实验装置静电纺丝的实验装置外壳材质为有机玻璃,内部组件由高压直流电源(HB-Z503-2AC,天津市恒博高压电源厂)、双通道微量注射泵(TJ-3A/W0109-1B,保定兰格恒流泵有限公司)、喷丝头和接收板组成.本实验装置的喷丝头采用的是带针头(内径为0.5 mm)的锁紧头微量进样器(上海高鸽工贸有限公司),接收板为带升降功能的普通铁板,可调距离为0~25 cm.该设备中喷丝、接收、中间控制装置均可调、可换,且可控制实验条件如温度(10~60 ℃)、湿度(20%~80%)、电压(0~50 kV)等.
2.3 实验过程 2.3.1 电纺纤维膜固定化漆酶的制备将1 g聚合物加入盛有7 g二氯甲烷和1 g N-N二甲基甲酰胺溶液的玻璃锥形瓶中,然后再加入0.15 g嵌段共聚物F108作为乳化剂,混合后置于磁力搅拌器上在室温条件下搅拌3 h得到混合溶胶.称取一定质量的漆酶溶于pH=4.0的磷酸盐缓冲溶液中,振荡至全部溶解.取250 μL一定浓度的酶溶液(1.0~10.0 mg · mL-1)加入上述混合溶胶中,在旋涡混合器上混合20 min直至形成均质乳液.然后将乳液引入静电纺丝装置的微量进样器中待纺.调节注射泵,设定纺丝液的流速为1.5 mL · h-1,调节升降板,设定极板间距为15 cm,调节纺丝电压为10 kV,获得稳定连续的喷射流,在覆盖有铝箔纸的接收板上收集纤维产品.5~6 h后待纤维膜厚度达到0.8~1 mm,停止纺丝,即得到载漆酶电纺纤维膜.纺丝过程控制温度为25±1 ℃,湿度为40%左右.为了观察漆酶在电纺纤维膜中的分布形态,采用相同浓度的异硫氰酸荧光素(FITC)标记漆酶代替上述实验中的酶液制备电纺纤维膜固定化漆酶样品.作为吸附对照实验,采用灭活后的漆酶溶液(煮沸10 min)代替上述酶液制备灭活的电纺纤维膜固定化漆酶样品.
2.3.2 纤维膜的表征采用场发射扫描电子显微镜(FESEM S-4800,HITACHI,日本)观察载漆酶电纺纤维膜的表面形貌,并从10张扫描电镜(SEM)图片中任选100条纤维计算电纺纤维的平均直径.采用全自动比表面积分析仪(Micromeritics ASAP 2020,美国)测量电纺纤维膜的比表面积和孔隙体积.为了观察漆酶在纤维中的分布情况,采用FITC标记漆酶制备电纺纤维膜固定化漆酶样品,并用激光共聚焦扫描显微镜(LCSM,LSM510,ZEISS,德国)观察标记漆酶在纤维中的分布情况,其激发波长和发射波长分别为488 nm和535 nm.
2.3.3 漆酶活性测定以磷酸盐缓冲溶液(pH=4.0)配制浓度为0.5 mmol · L-1的ABTS溶液为底物,采用紫外-可见分光光度计(Cary 50,瓦里安仪器公司,美国)记录催化反应5 min时在420 nm处的吸光度值,然后根据酶活力定义计算漆酶酶活.一个酶活力单位定义为每min氧化1 μmol底物所需要的酶量.具体的酶活性和酶固定化率测量与计算方法参照文献(Dai et al.,2010a).
2.3.4 BPA降解实验量取30 mL一定浓度的BPA水溶液(pH=7.0,0.5~50 mg · L-1)于玻璃锥形瓶中,向其中加入8片载漆酶电纺纤维膜(1 cm× 1 cm,总重量130~150 mg),然后置于摇床在避光条件下振荡(30 ℃,140 r · min-1)反应5 h.作为对照,本实验采用等量的游离漆酶和灭活的电纺纤维膜固定化漆酶于相同条件下反应.每次取样时向样品中加入50 μL 叠氮化钠(20 mmol · L-1)以终止反应.所有实验均设3个平行样.在每个取样时间点取1.0 mL溶液用高效液相色谱(HPLC Agilent 1260,美国)分析其中的BPA含量.同时,制备含有不同酶量的电纺纤维膜固定化漆酶样品,考察不同漆酶浓度对BPA的降解规律.为探讨溶液pH值对漆酶降解水中BPA的影响,采用不同pH值(2.0~9.0)初始浓度为10 mg · L-1的BPA溶液在30 ℃条件下进行降解实验;设定溶液pH为7.0,考察不同反应温度(10~50 ℃)下游离漆酶和固定化漆酶对BPA的降解效率.
3 结果与讨论(Results and discussion) 3.1 电纺纤维膜的形貌表征从图 1a中看出,所得纤维丝较均匀,且排列良好,平均直径约为(650±30)nm,纤维丝中几乎没有珠泡,纤维表面有许多直径约为几十nm的孔结构.表 1中孔体积的测定结果(0.0169 cm3 · g-1)也表明纤维表面多孔结构的存在.这些纤维多孔结构是在静电纺丝的相分离过程中形成的.在高压静电的作用下,纺丝液中的聚合物可能分布不均匀,容易形成聚合物富集区域(polymer-rich)和聚合物贫乏区域(polymer-poor).在溶剂挥发的过程中,由于聚合物富集区域和聚合物贫乏区域发生相分离,在聚合物贫乏区域更容易形成孔结构(Huang et al.,2003).此外,静电纺丝参数也可能会影响孔结构的形成.这些多孔结构可以增加纤维膜的比表面积,可以为吸附质提供更多的吸附空间,也可以为酶与底物的接触反应提供通道(Niu et al.,2013).
 |
| 图 1 电纺纤维膜固定化漆酶的SEM(a)和LCSM(b)图片 Figure.1 SEM(a) and LCSM(b)micrographs of laccase-carrying electrospun fibrous membranes |
| 表 1 载漆酶电纺纤维膜的形貌表征结果和酶活性效率 Table 1 The morphology characterization results and retained activity of laccase-carrying electrospun fibrous membranes |
由于从SEM图片中不能确定漆酶是否存在或以何种形式分布于电纺纤维膜中,因此本研究采用激光共聚焦扫描显微镜(LCSM)观察FITC标记漆酶在电纺纤维膜中的分布形态,如图 1b所示.从图中可以看出,纤维丝发出绿色荧光,证明漆酶被成功包埋于纤维内部,酶固定化率达到80%;且漆酶在纤维中分布均匀,也表明载漆酶电纺纤维呈现出壳-核结构.在油包水乳液电纺过程中,乳液液滴在电场力作用下迅速向垂直方向运动以实现往轴中心区域富集,被拉伸成椭圆形状.由于乳液中的油相(聚合物溶液)中的二氯甲烷挥发速度比水快,纤维外层的粘度迅速增加.正是这种粘度差异使得椭圆液滴向纤维内部运动,然后被包埋在纤维中,形成壳-核结构的纤维(Dai et al.,2010a; Yang et al.,2008).
此外,因为本研究中所用聚合物具有良好的生物相容性,形成的纤维外壳可以为包埋在纤维内部的漆酶提供稳定的环境,使漆酶少受外界不良因素的干扰;同时纤维表面的多孔结构可以为底物提供通道,便于漆酶与底物的反应,因此漆酶得以保持较高的酶活性(最优为79.8%).
3.2 BPA的降解效率 3.2.1 漆酶浓度影响漆酶能催化氧化多种酚类化合物,在治理含酚废水方面有着很大的应用前景(Asadgol,et al.,2014).但高质量的工业化漆酶来源仍然较少,导致漆酶价格偏高.本实验通过探究不同浓度的游离漆酶和电纺纤维膜固定化漆酶对BPA的降解效率,确定实验中最佳的漆酶用量,控制成本.
从图 2中可知,随着漆酶浓度的升高,游离漆酶和电纺纤维膜固定化漆酶对BPA的降解效率都呈现上升趋势.当实验中使用灭活的电纺纤维膜固定化漆酶(即漆酶浓度为0 U · mL-1)时,电纺纤维膜对水中BPA有一定的吸附作用,吸附效率可达25%左右,这主要归功于纤维膜较大的比表面积和丰富的多孔结构(如表 1和图 1所示).当溶液中漆酶溶液较低时(0.036 U · mL-1),5 h后游离漆酶和固定化漆酶对BPA 的降解率差别不明显.但随着漆酶浓度增加,固定化漆酶对BPA的降解效率较游离酶低,当漆酶浓度增加到0.36 U · mL-1时,游离漆酶对BPA的降解率接近100%,而固定化漆酶对BPA的降解率为80%左右.电纺纤维膜固定化漆酶的酶活性效率为72.5%~79.8%,当固定化过程中使用的漆酶浓度过高时,酶活性效率反而降低.这主要是由于高浓度漆酶溶液使得纺丝溶液的性质发生变化,导致部分漆酶可能无法被包埋进纤维中,在纺丝过程中已造成部分漆酶活性损失.综合以上因素考虑,实验选定最优漆酶浓度为0.18 U · mL-1.
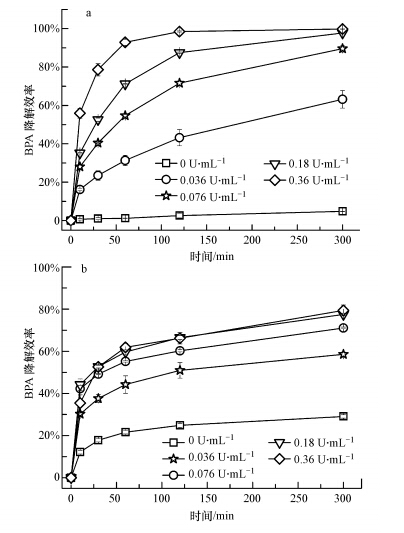 |
| 图 2 不同浓度游离漆酶(a)和电纺纤维膜固定化漆酶(b)对BPA的降解效率 Figure.2 Effects of enzyme concentration on the degradation efficiency of BPA by free laccase and laccase-carrying electrospun fibrous membranes |
漆酶对不同浓度BPA的降解效率随时间变化趋势如图 3所示.从图中可以看出,游离漆酶和电纺纤维膜固定化漆酶对不同浓度的BPA的降解效率均随时间递增,但随BPA的浓度增加而降低.在5 h的反应时间内,游离漆酶对中低浓度BPA溶液的降解效率要高于固定化漆酶.游离漆酶在5 h内几乎完全降解低浓度的BPA溶液(0.5 mg · L-1和1 mg · L-1),而固定化酶的降解效率在75%左右.一方面,这是由于固定化过程会对酶活不可避免地造成一定的损失;另一方面酶固定化后与反应物的接触机率比游离酶小,且对底物的亲和力也比游离酶低.本研究结合漆酶降解水中BPA的反应初始浓度和速率,利用Hanes-Woolf图得到动力学参数,然后计算出游离漆酶和固定化漆酶的米氏常数(Km)分别为0.015 mmol · L-1和0.114 mmol · L-1,表明经过纤维膜固定化后,漆酶对水中BPA的亲和力降低.因此,固定化酶在相同时间内对BPA的降解效率低于游离酶.尽管酶被包埋固定在纤维中后与反应物的接触机率减小,但得益于电纺纤维膜对水中BPA的吸附作用(吸附效率为25%左右),使电纺纤维膜固定化漆酶对低浓度BPA的降解效率仍高于70%.然而,对于高浓度的BPA溶液(50 mg · L-1),游离酶及固定化酶的降解效率均可达到60%以上,表明在高浓度底物条件下,固定化漆酶与底物接触机率不佳的问题也可以被部分克服.
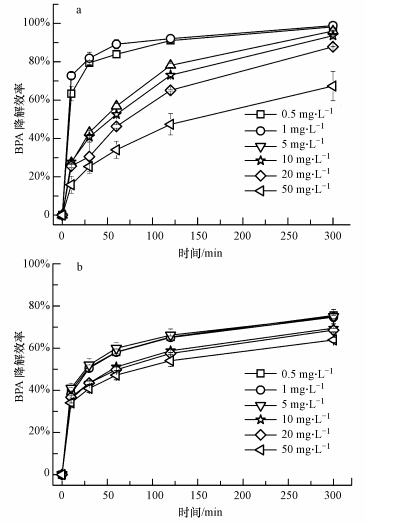 |
| 图 3 游离漆酶(a)和电纺纤维膜固定化漆酶(b)对不同浓度BPA的降解效率 Figure.3 The degradation efficiencies of different concentration BPA by free laccase(a) and laccase-carrying electrospun fibrous membranes(b) |
不同来源的漆酶,最适pH值也不同,漆酶的活性受pH值影响很大(钞亚鹏和钱世钧,2001).本文考察了溶液pH值对游离漆酶和电纺纤维膜固定化漆酶降解水中BPA的影响,结果如图 4所示.从图中可以看出,电纺纤维膜固定化漆酶受溶液pH值影响较小,在pH值4.0~9.0范围内均能保持较高的活性,而游离漆酶则受pH值影响相当明显.当pH值为5.0时,游离漆酶对BPA的降解效率最高,达到90%左右.但是,当溶液pH值过高(> 9.0)或者过低(<2.0)时,游离漆酶几乎完全失去活性,对BPA的降解效率均低于5%,而电纺纤维膜固定化漆酶仍然能降解56%以上的BPA.结果表明电纺纤维膜固定化漆酶对pH变化的耐受性要远远强于游离酶,可以在更广泛的pH值范围内高效降解水中的BPA.这主要是因为通过乳液电纺技术可以将漆酶原位包埋固定在纤维内部,纤维的聚合物外壳(聚乳酸-乙醇酸共聚物)具有良好的生物相容性,对漆酶的活性结构影响较小,且它可以成为漆酶分子与酸性溶液(pH=2.0)或碱性溶液(pH=9.0)接触的缓冲区,保护漆酶的分子结构,减少外界酸碱环境变化对漆酶活性的影响(Niu et al.,2013; Vikartovská et al.,2007).
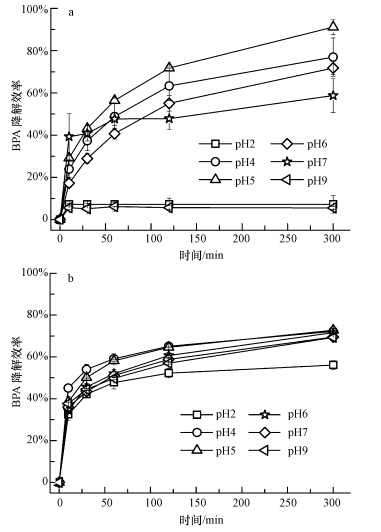 |
| 图 4 不同pH条件下游离漆酶(a)和电纺纤维膜固定化漆酶(b)对BPA的降解效率 Figure.4 Effects of solution pH on the degradation efficiency of BPA by free laccase(a) and laccase-carrying electrospun fibrous membranes(b) |
由于温度对漆酶的活性也有较大影响,因此本文比较了5个温度梯度(10~50 ℃)下漆酶对BPA溶液的降解效率.从图 5中可以看出,随着温度的升高,游离漆酶和电纺纤维膜固定化漆酶对BPA的降解效率都有所提高.本研究选用的游离漆酶对高温的耐受性较好,但对低温的耐受性略差.在较低的温度下,漆酶活性受到抑制.当温度为10 ℃时,5 h内游离酶对BPA的降解率为79%,固定化酶的降解率也可达74%.此外,固定化酶对BPA的降解率随温度变化波动较小,游离酶则变化较大.漆酶固定化后受温度影响比游离漆酶小,表明漆酶经固定化后其稳定性得到了提高.固定化漆酶对温度变化耐受性的提高也是归功于漆酶被包埋在纤维内部,纤维的聚合物外壳结构可以保护漆酶,减少外界温度条件变化对漆酶活性的影响.
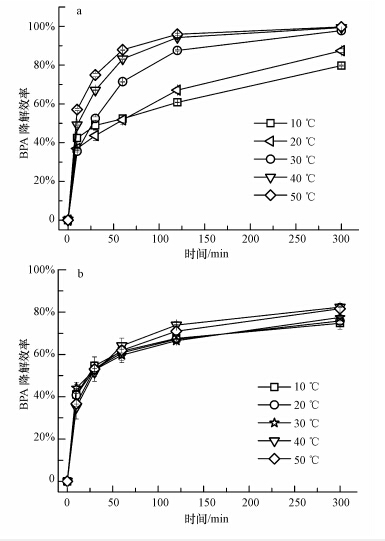 |
| 图 5 不同温度下游离漆酶(a)和电纺纤维膜固定化漆酶(b)对BPA的降解效率 Figure.5 Effects of temperature on the degradation efficiency of BPA by free laccase(a) and laccase-carrying electrospun fibrous membranes(b) |
1)采用乳液静电纺丝技术可以将漆酶成功包埋固定于纤维内部,且归功于聚合物纤维外壳的保护与纤维表面多孔结构提供的反应通道,电纺纤维膜固定化漆酶能保留79.8%的酶催化活性.
2)综合考虑污染物去除效率和成本,实验选定最优漆酶浓度为0.18 U · mL-1;在该漆酶浓度条件下,电纺纤维膜固定化漆酶对水中不同浓度BPA均有较高的降解效率.
3)随着溶液pH值和温度的变化,游离漆酶对水中BPA的降解效率变化较大,而电纺纤维膜固定化漆酶对BPA降解效率的波动明显较小,表明漆酶经静电纺丝电纺纤维膜固定化后对pH值和温度等环境因素变化的耐受性明显增强,稳定性得到提高.
| [1] | Ahma d S, Ashraf S M, Hassan S N, et al. 2005. Synthesis, characterization, and performance evaluation of hard, anticorrosive coating materials derived from diglycidyl ether of bisphenol A acrylates and methacrylates [J]. Journal of Applied Polymer Science, 95(3): 494-501 |
| [2] | Asadgol Z, Forootanfar H, Rezaei S, et al. 2014. Removal of phenol and bisphenol-A catalyzed by laccase in aqueous solution [J]. Journal of Environmental Health Science & Engineering, 12: 93-93 |
| [3] | 钞亚鹏, 钱世钧. 2001. 真菌漆酶及其应用 [J]. 生物工程进展, 21(5): 23-28 |
| [4] | Chiang L F, Doong R A. 2014. Cu-TiO2 nanorods with enhanced ultraviolet- and visible-light photoactivity for bisphenol A degradation [J]. Journal of Hazardous Materials, 277: 84-92 |
| [5] | Chouhan S, Yadav S K, Prakash J, et al. 2014. Effect of Bisphenol A on human health and its degradation by microorganisms: a review [J]. Annals of Microbiology, 64(1): 13-21 |
| [6] | Dai Y R, Niu J F, Liu J, et al. 2010a. In situ encapsulation of laccase in microfibers by emulsion electrospinning: Preparation, characterization, and application [J]. Bioresource Technology, 101(23): 8942-8947 |
| [7] | Dai Y R, Niu J F, Yin L F, et al. 2010b. Electrospun nanofiber membranes as supports for enzyme immobilization and its application [J]. Progress in Chemistry, 22(9): 1808-1818 |
| [8] | Gassara F, Brar S K, Tyagi R D, et al. 2011. Dégradation biologique du bisphénol A dans les eaux usées [J]. Environmental Reviews, 19: 32-54 |
| [9] | Gassara F, Brar S K, Verma M, et al. 2013. Bisphenol A degradation in water by ligninolytic enzymes [J]. Chemosphere, 92(10): 1356-1360 |
| [10] | Homaei A A, Sariri R, Vianello F, et al. 2013. Enzyme immobilization: an update [J]. Journal of Chemical Biology, 6(4): 185-205 |
| [11] | Huang Z M, Zhang Y -Z, Kotaki M, et al. 2003. A review on polymer nanofibers by electrospinning and their applications in nanocomposites [J]. Composites Science and Technology, 63(15): 2223-2253 |
| [12] | 李前, 冯想, 张晓, 等. 2014. 载钛羟基磷灰石光催化降解内分泌干扰物双酚A [J]. 催化学报, 35(1): 90-98 |
| [13] | Niu J F, Dai Y R, Guo H Y, et al. 2013. Adsorption and transformation of PAHs from water by a laccase-loading spider-type reactor [J]. Journal of Hazardous Materials, 248-249: 254-260 |
| [14] | Park S Y, Choi J. 2009. Genotoxic effects of nonylphenol and bisphenol A exposure in aquatic biomonitoring species: freshwater crustacean, Daphnia magna, and aquatic midge, Chironomus riparius[J]. Bulletin of Environmental Contamination and Toxicology,83(4):463-468 |
| [15] | Park Y, Sun Z M, Ayoko G A, et al. 2014. Bisphenol A sorption by organo-montmorillonite: Implications for the removal of organic contaminants from water [J]. Chemosphere, 107: 249-256 |
| [16] | 汤茜, 周玲妹, 陆丽, 等. 2014. 活性炭负载Fe3+催化臭氧氧化水中双酚A [J]. 辽宁化工, 43(6): 664-667 |
| [17] | Telke A A, Kalyani D C, Jadhav U U, et al. 2009. Purification and characterization of an extracellular laccase from a Pseudomonas sp. LBC1 and its application for the removal of bisphenol A [J]. Journal of Molecular Catalysis B: Enzymatic, 61(3/4): 252-260 |
| [18] | Vikartovská A, Bučko M, Mislovičová D, et al. 2007. Improvement of the stability of glucose oxidase via encapsulation in sodium alginate-cellulose sulfate-poly (methylene-co-guanidine) capsules [J]. Enzyme and Microbial Technology, 41(6/7): 748-755 |
| [19] | 杨帆, 陈临琪, 金美芳, 等. 2014. 新生儿期不同剂量双酚A暴露对雌性大鼠青春发育的影响 [J]. 中国当代儿科杂志, 16(7): 754-758 |
| [20] | Yang Y, Li X H, Cui W G, et al. 2008. Structural stability and release profiles of proteins from core-shell poly (DL-lactide) ultrafine fibers prepared by emulsion electrospinning [J]. Journal of Biomedical Materials Research Part A, 86A(2): 374-385 |
| [21] | 张廷健, 杨先贵, 王公应, 等. 2014. 双酚S和双酚A与碳酸二苯酯共聚合成阻燃性聚碳酸酯 [J]. 高分子材料科学与工程, 30(4): 22-25 |
| [22] | Zhao J, Zhu C Z, Lu J, et al. 2014. Electro-catalytic degradation of bisphenol A with modified Co3O4/β-PbO2/Ti electrode [J]. Electrochimica Acta, 118: 169-175 |
| [23] | 周飞飞, 谭季春, 王莎莎, 等. 2014. 环境雌激素双酚A与多囊卵巢综合征的相关性研究 [J]. 中国妇幼保健, (13): 2049-2051 |
 2015, Vol. 35
2015, Vol. 35


