2. 同济大学环境科学与工程学院, 污染控制与资源化研究国家重点实验室, 上海 200092
2. State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092
目前,p-CNB(对氯硝基苯)作为一种重要的化工基础原料在世界上许多地方被广泛使用,而我国已成为世界上p-CNB的主要生产国和供应国(陈良文,2011).排放到环境中的p-CNB是一种持久性难降解有机物,可对人类健康产生一定威胁,故而被国家环保部列为优先控制污染物之一.由于p-CNB苯环上硝基和氯原子的吸电子特性,致使好氧微生物很难攻击苯环从而将其降解(Park et al., 1999).有研究表明,在厌氧或还原条件下,厌氧微生物可利用有机或无机电子供体(醋酸、甲醇、氢气等)将氯代硝基苯还原转化,产生氯代苯胺和苯胺类产物(Heijman et al., 1993; Susarla et al., 1996; Park et al., 1999; Xia et al., 2011; Li et al., 2014).
氢气作为一种洁净无残留、无二次污染的电子供体,已广泛应用于修复氯代苯类有机污染物(Deweerd et al.,1991; Chang et al., 2003; Chung and Rittmann, 2007).在厌氧条件下,氢基质自养微生物可利用氢气作为电子供体还原转化p-CNB生成p-CAN(对氯苯胺)和AN(苯胺)(Xia et al., 2011; Li et al., 2014).MBfR(氢基质生物膜反应器)有效地将中空纤维膜微孔扩散氢气和生物膜法结合,为氢自养微生物体提供了良好的生长载体和营养环境,同时加强了气液传质,提高了氢气利用效率.氢基质生物膜技术被运用于去除水中多种氧化性污染物(Chung et al., 2006a; Chung et al., 2006b; Chung and Rittmann, 2007; Chung et al., 2008; Xia et al., 2009; Xia et al., 2011; Li et al., 2014),并越来越多的受到研究者们的关注.这种生物处理技术为水中p-CNB的去除开辟了一种新的途径或方法.
影响生物膜技术处理效能的因素很多,如pH、营养物质、有毒物质、进水底物组份及负荷、温度、生物量等(Rittmann and McCarty, 2001; 高廷耀等,2007).pH对微生物降解污染物的影响较大,亦成为氢基质生物膜技术的主要影响因素之一.前人研究发现,大部分氢自养细菌适宜的pH范围为7.0~8.0(Lee and Rittmann, 2003; Chung et al., 2006a; Chung et al., 2006b; 张彦浩等,2010).pH变化幅度过大,会明显影响微生物的处理效率,甚至对微生物造成毒性致使反应器失效,这是因为pH的改变可能会引起细胞膜电荷的变化,进而影响微生物对营养物质吸收和微生物代谢过程中酶的活性(Rittmann and McCarty, 2001; 高廷耀等,2007).因此,pH作为一种易控制因素,考察其对p-CNB还原降解的影响具有重要意义.在前期研究基础上,系统考察pH变化对污染物去除效率、去除通量及当量电子转移通量的影响,以寻求氢自养微生物还原降解p-CNB最适宜的pH环境,以期为MBfR运行提供技术支持.
2 材料与方法(Materials and methods) 2.1 氢基质生物膜反应器本研究所使用的氢基质生物膜反应器如图 1所示.反应器内部设有两组中空纤维膜组件,氢气从膜组件上端通入.设置在反应器下部的磁力搅拌器产生蜗旋剪切力,从而将反应器内的混合液搅拌均匀.受污染的水体(液相)在中空纤维膜外部流动,污染物质(p-CNB)在生物膜中扩散与氢气逆向接触,在生物膜微生物作用下,p-CNB逐步经过硝基还原和还原脱氯作用产生p-CAN和AN.反应器的基本参数和指标见前期研究所列(Li et al., 2014).
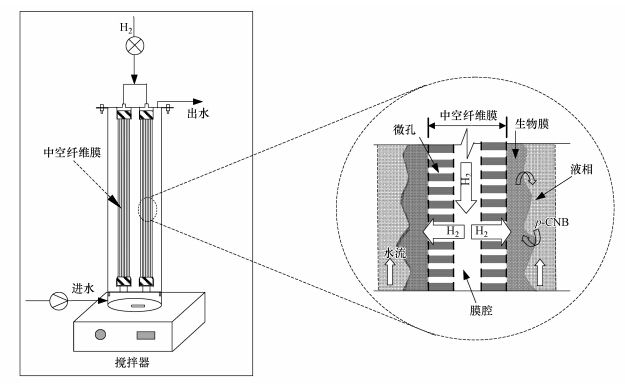 |
| 图 1 氢基质生物膜反应器示意图 Fig.1 Schematic of the lab-scale hydrogen based membrane biofilm reactor |
实验用水为人工模拟配水,以NaHCO3和NaNO3作为微生物生长的碳源和氮源,以缓冲液(KH2PO4+Na2HPO4)调节进水中的pH以及缓解还原反应进行中pH剧烈升高.具体营养成分为(mg · L-1):KH2PO4 128、Na2HPO4 434、CaCl2 · 2H2O 1、 FeSO4 · 7H2O 1、NaHCO3 252、NaNO3 30、ZnSO4 · 7H2O 0.013、MnCl2 · 4H2O 0.004、H3BO3 0.038、CoCl2 · 6H2O 0.025、CuCl2 · 2H2O 0.001、NiCl2 · 6H2O 0.001、Na2MoO4 · 2H2O 0.004和Na2SeO3 0.004.营养液中添加目标污染物模拟实际进水,并配制到10 L的棕色玻璃瓶中.实验开始前,鼓吹氮气以消除水中的溶解氧.
由于硝酸盐(NO3--N)和硫酸盐(SO42-)是地表水和地下水中较为常见的污染物(电子受体),而且反硝化菌和硫酸盐还原菌在环境中普遍存在,因此在反应器进水中投加NO3--N和SO42-以更准确模拟实际水质背景以及评价其它电子受体共存时pH对p-CNB还原降解的影响.
2.3 反应器启动运行反应器启动运行条件见前期研究方法(Li et al., 2014).当反应器挂膜成功后,调节流量为2 mL · min-1,进水投加p-CNB、NO3--N和SO42-进行长期稳定运行阶段.在pH=7.5,氢气压力0.04 MPa,进水p-CNB、NO3--N和SO42-浓度分别为1000 μg · L-1、15 mg · L-1和50 mg · L-1时,经过100 d的持续运行,p-CNB还原降解速率达到稳定,出水p-CAN、AN和氯离子(Cl-)的浓度分别为(48±2)μg · L-1、(383±19)μg · L-1和(197±23)μg · L-1(Li et al., 2014).
2.4 pH变化下的短期实验pH变化下的短期实验条件见表 1.每一阶段试验之前调节反应器在缓冲工况下运行3 d,使反应器达到相同的平衡状态(准一级稳定状态),具体条件为进水流速为2 mL · min-1,HRT为5.2 h,氢气压力为0.04 MPa,NO3--N为10 mg · L-1,SO42-为50 mg · L-1,p-CNB为1000 μg · L-1,pH为7.2.短期实验运行周期为4d,每一水平下连续运行24h后开始取水样(因为大于4倍水力停留时间,系统达到拟稳定状态),此时溶液混合均匀、浓度达到恒定,但生物膜累积和生物量无明显变化(Chung et al., 2006a; Chung et al., 2006b; Rittmann and Mccarty, 2001).具体取样方法与前期研究方法一致(Li et al., 2014).
| 表 1 短期实验运行条件 Table 1 System conditions of the short-term experiments |
水样中NO3--N和SO42-浓度均采用离子色谱法测定(戴安ICS-1000,AS-19分析柱).p-CNB、p-CAN和AN均通过高效液相色谱法测定(HPLC,Agilent 1200).测定参数如下,分析柱:Polaris C18,5μm,4.6 mm×250 mm,25 ℃;流动相:乙腈/水=60/40(V/V);流速:1.0 mL · min-1;检测器:UV,254 nm;检测限:p-CNB 16.8 μg · L-1,p-CAN 11.3 μg · L-1,AN 27.4 μg · L-1.
2.6 基本参数及其计算生物膜中污染物质的去除通量(J)表征单位膜面积上承载的污染物去除量,是衡量反应器处理能力的指标.标准通量(k)是基于准一级反应动力学基础上的用于表征实验条件变化引起通量变化程度或幅度的参数.为了更准确地分析同一反应体系中各种不同的污染物(电子受体)对氢气利用(电子供体)的竞争关系,可以在生物膜去除通量的基础上计算出电子转移过程中的通量,即当量电子转移通量(Eeq),以间接表征pH变化下微生物对氢气利用的竞争特性.上述3个参数均是影响因素分析中的重要指标,计算公式分别如下:
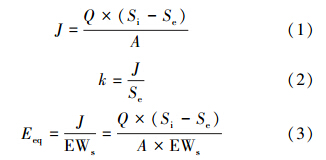
在进水p-CNB、NO3--N和SO42-浓度分别为1000 μg · L-1、10 mg · L-1和50 mg · L-1,氢气压力0.04MPa时,考察pH在5.7、6.2、6.7、7.2、7.7、8.2和8.7条件下对氢基质自养微生物还原降解p-CNB的影响,结果如图 2和图 3所示.从图中可以看出,p-CNB的去除效率随pH变化呈先增大后降低的趋势.当pH为5.7和8.7时,出水p-CNB浓度、转化产生p-CAN浓度分别为234 μg · L-1、620 μg · L-1和146 μg · L-1、692 μg · L-1,p-CNB去除率分别为76.6%和85.4%.pH为7.7时,p-CNB去除率最高(95.5%),对应的p-CNB出水浓度、转化产生p-CAN浓度分别为45 μg · L-1、773 μg · L-1.比较可知,pH为7.7时的p-CNB去除效率分别是pH为5.7、8.7时的1.25倍、1.12倍.随着pH升高,p-CNB的去除通量和标准通量也呈先升高后降低的趋势,与p-CNB去除效率变化相对应(图 3). pH为7.7时的p-CNB去除通量为0.0278 g · m-2 · d-1,分别是pH为5.7、8.7时的1.25倍、1.12倍.比较标准通量变化发现,pH对p-CNB标准通量的影响程度高于去除通量,pH为7.7时的标准通量是pH为5.7、8.7时的8.14倍、3.62倍.
 |
| 图 2 pH对氢自养微生物还原降解p-CNB的影响 Fig.2 Effect of pH on p-CNB reductive degradation by autohydrogenotrophic microorganisms |
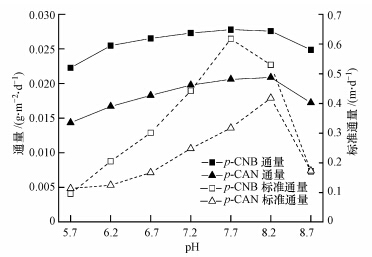 |
| 图 3 pH变化对生物膜内p-CNB和p-CAN去除通量及标准通量的影响 Fig.3 Effect of pH on removal fluxes and normalized fluxes of p-CNB and p-CAN in biofilm |
pH变化下,p-CAN还原脱氯的变化趋势与p-CNB硝基还原类似(图 2).可以发现,p-CAN去除效率和AN出水浓度均呈先升高后降低的动态变化,而伴随的是出水p-CAN浓度先降低后升高.当pH为5.7和8.7时,出水p-CAN、AN浓度分别为127 μg · L-1、189 μg · L-1和100 μg · L-1、231 μg · L-1,p-CAN去除率分别为79.5%和85.5%.pH为8.2时,p-CAN去除率达到最大(93.5%),对应的出水p-CAN、AN浓度分别为50 μg · L-1、400 μg · L-1.p-CAN还原脱氯的最佳pH为8.2,此时去除通量和标准通量达到最大,分别是0.0209 g · m-2 · d-1和0.42 m · d-1(图 3).值得注意的是,p-CAN标准通量变化幅度也高于去除通量,pH为7.7时的标准通量是pH为5.7、8.7时的3.70倍、2.42倍,而去除通量仅有1.46倍和1.21倍.
p-CNB和p-CAN的标准通量变化幅度大,则表明pH在5.5~8.7之间变化时对p-CNB生物降解的影响较大.在pH处于7.2~8.2时,氢自养微生物对p-CNB的生物还原效率较好.p-CNB硝基还原和p-CAN还原脱氯的效率及通量变化趋势相似,但两者最适宜的pH分别为7.7和8.2,这可能与氢基质生物膜中硝基还原微生物与还原脱氯微生物的种群结构有关.基于以上分析,p-CNB生物还原的适宜pH范围为7.2~8.2(偏碱性环境),低于6.2或高于8.7时均使氢基质自养微生物的酶活性受抑制,导致p-CNB还原降解效率明显降低.
3.2 对硝酸盐和硫酸盐还原的影响反硝化和硫酸盐还原与p-CNB还原有类似的变化趋势,如图 4和图 5所示.当pH处于7.2~8.2时,NO3--N反硝化效率、去除通量和标准通量高于其它pH;最佳pH为7.2(87.3%),去除效率分别是pH为5.7、8.7时的1.07倍、1.15倍,当pH低于5.7或高于8.7时,反硝化效率明显降低(图 4).NO3--N的标准通量变化幅度高于去除通量,pH=7.2时为 0.2001 g · m-2 · d-1,分别是pH为5.7(0.1265 g · m-2 · d-1)、 8.7(0.0916 g · m-2 · d-1)的1.58倍、2.18倍(图 5).由此可见,pH对反硝化作用的影响程度较大,尤其低于5.7或高于8.7时反硝化细菌对pH变化更具敏感性.从硫酸盐去除率的变化趋势看,SO42-还原的适宜pH为6.7~8.2,最佳pH为7.2(此时的去除率为26.0%,分别是pH为5.7、8.7时的2.6倍、2.9倍)(图 4).SO42-的去除通量和标准通量变化幅度显著,pH为7.2时的去除通量和标准通量超过pH为8.7时的190%和257%(图 5).综上所述,反硝化和硫酸盐还原的适宜pH为6.7~8.2,最佳pH均为7.2,低于5.7或高于8.7时明显抑制了反硝化菌和硫酸盐还原菌的活性.
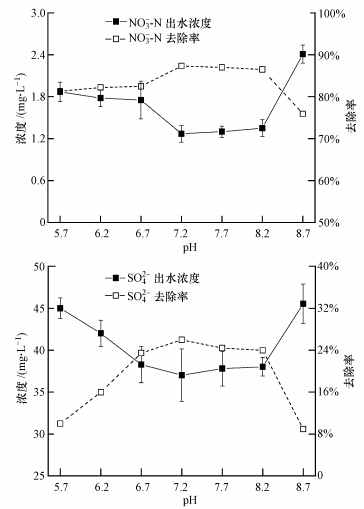 |
| 图 4 pH对氢自养微生物降解硝酸盐和硫酸盐的影响 Fig.4 Effect of pH on nitrate and sulfate reductive degradation by autohydrogenotrophic microorganisms |
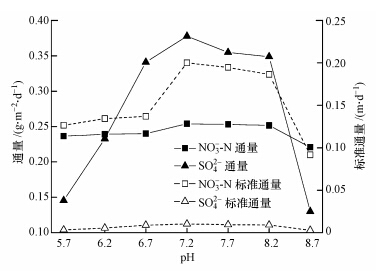 |
| 图 5 pH变化对生物膜内硝酸盐和硫酸盐去除通量及标准通量的影响 Fig.5 Effect of pH on removal fluxes and normalized fluxes of nitrate and sulfate in biofilm |
表 2列出了生物膜内微生物还原降解p-CNB、NO3--N和SO42-过程中的平均当量电子转移通量及其分配,间接反映了pH变化下生物膜内各物质还原对氢气利用的竞争特性.可以看出,NO3--N和SO42-电子通量分别占73.43%~86.74%、11.92%~25.48%,p-CNB和p-CAN当量电子转移通量明显小于NO3--N或SO42-.由此可见,反硝化过程消耗的电子供体数量最多,其次是SO42-还原,p-CNB和p-CAN远低于NO3--N或SO42-.在pH不断上升中,各物质还原的当量电子转移通量均有先升高后降低的趋势.总体来看,在pH处于6.7~8.2时,各物质的当量电子转移通量均高于其它pH.由当量电子转移通量及其分配情况得出,NO3--N和SO42-的变化幅度明显高于p-CNB或p-CAN.pH变化时反硝化和硫酸盐还原(电子供体最大消耗者)对氢气利用的竞争抢夺比p-CNB或p-CAN还原更为激烈,即反硝化菌和硫酸盐还原菌摄取或利用氢气对pH变化的敏感性强于p-CNB或p-CAN.这意味着,在p-CNB、NO3--N和SO42-的共还原体系中,为保持较高水平的同步去除效率,pH的调控需倾向于NO3--N和SO42-的适宜pH范围.
| 表 2 电子受体的当量电子转移通量及其分配 Table 2 Electron-equivalent fluxes of electron acceptors and their distributions |
本研究在建立的一种氢基质生物膜反应器(MBfR)中深入考察pH对氢自养微生物还原降解p-CNB的影响.通过对生物膜内p-CNB、NO3--N和SO42-的去除效率、去除通量、标准通量及当量电子转移通量的比较分析,得出氢基质自养微生物生长较适宜的pH为6.7~8.2,其中p-CNB硝基还原、p-CAN还原脱氯的最佳pH分别是7.7和8.2.前人也在以氢基质为基础的反应器中考察了pH对氢自养细菌去除氧化性物质的影响.Chung等(2006a; 2006b)在MBfR中考察了pH对氢自养微生物还原硒酸盐(SeO2-3)和铬酸盐(CrO42-)的影响,得出生物还原的最适宜pH处于7.0~7.5之间(最佳pH为7.5),与本研究结果相近.Chang等(2003; 2004)研究了pH对氢自养微生物还原降解二氯酚(2-CP)的影响,发现pH变化对2-CP降解的影响程度较大,2-CP还原脱氯较适宜的pH范围为6.0~7.0(最佳为7.0),低于6.0或高于9.0时将对还原脱氯完全抑制.
对于以氯代硝基苯为唯一氮源和碳源的非氢自养型微生物的探索研究也有报道.Wu等(2009)利用以邻氯硝基苯(o-CNB)为唯一氮源和碳源的菌株Pseudomonas putida OCNB-1处理o-CNB废水,研究得出最适宜的pH处于6.0~9.0(最佳pH为8.0).吴建峰等(2004)研究pH对菌株CNB1降解p-CNB的影响时发现,菌株CNB1较适宜在偏碱性条件下生长(pH为8.0-10.0),最佳pH为9.0.Glaus(1992)研究了pH对硫自养型细菌Streptomyces sp.还原降解p-CNB的影响,得出pH为7.0~8.2时p-CNB的去除速率维持在较高的水平,其中pH=7.6时去除速率最大,这意味着该细菌生长较适宜的pH在7.0~8.2之间.虽然上述研究与本研究所在还原条件有本质区别,但微生物适宜的pH条件与本研究得出的结论差异不大.
在p-CNB、NO3--N和SO42-的共还原去除体系中,微生物对污染物的降解规律及pH变化产生的影响与氢基质自养微生物种群的组成有很大关系.若反应器中只接种p-CNB的高效降解菌株,反硝化和硫酸盐还原过程基本不发生,此时适宜pH范围的控制相对单一,不受反硝化和硫酸盐还原的影响.但是,从反应器接种与运行情况看,本实验条件下氢自养微生物具有复杂的种群结构,包括多种不同还原酶功能基因的种群,如单一硝基还原菌、还原脱氯菌、反硝化菌、硫酸盐还原菌或是兼有多种还原酶功能的细菌等,因此,反硝化和硫酸盐还原所处的适宜pH范围及最佳pH(均是7.2)与p-CNB硝基还原、p-CAN还原脱氯不同.由于氢气作为唯一的电子供体,对氢气的竞争强度直接影响电子受体还原过程.pH改变会影响微生物对电子供体的摄取或利用,因此从当量电子转移通量这一角度能更为准确地评价pH对各种污染物质去除的影响程度.由当量电子转移通量及其分配可知,硫酸盐还原对pH的敏感性最高,其次是反硝化、硝基还原和还原脱氯.因此,pH调控在7.2左右时对NO3--N和SO42-的去除最有利,而对于p-CNB的去除则需维持在7.7~8.2.显然,为了维持较高水平的p-CNB、NO3--N和SO42-同步去除效率,将pH调控在7.2~8.2是最适宜的.
综上所述,若反应体系中没有NO3--N和SO42-,则pH维持在7.7~8.2范围是最适宜的,但为保证MBfR中氢基质自养微生物共还原降解p-CNB、NO3--N和SO42-的效果,维持pH在7.2~8.2这一稳定的范围显然有利.然而,在利用MBfR处理实际污染废水过程中还需考虑还原过程中碱度升高(pH增大)和水中硬度的影响,因为碱度或pH过高时,将会引起水中的矿物质沉淀,与生物膜共同附着在中空纤维膜表面,从而阻碍氢气的扩散导致反应器去除性能的降低.适当的调节pH有利于微生物的生长和控制中空纤维膜表面的矿物质沉淀引起的膜污染.
5 结论(Conclusions)1)去除效率、去除通量及标准通量的分析表明,pH在5.7~8.7变化时对p-CNB、NO3--N和SO42-生物还原的影响程度较大.氢基质自养微生物还原降解污染物质的适宜pH为6.7~8.2,其中硝基还原、还原脱氯、反硝化和硫酸盐还原的最佳pH分别是7.7、8.2、7.2和7.2.pH变化幅度过大,将明显抑制氢自养微生物摄取营养物质及代谢过程中的酶活性.
2)当量电子转移通量及其分配揭示了在p-CNB、NO3--N和SO42-的共还原体系中,硫酸盐还原和反硝化对pH变化的敏感性强于p-CNB硝基还原或p-CAN还原脱氯.p-CNB去除的最适宜pH为7.7~8.2,但为了维持较高水平的p-CNB、NO3--N和SO42-同步去除效率,将pH调控在7.2~8.2之间是最适宜的.适当的调节pH有利于微生物的生长和控制中空纤维膜表面的矿物质沉淀引起的膜污染.
| [1] | Chan g C C, Tseng S K, Chang C C, et al. 2003. Reductive dechlorination of 2-chlorophenol in a hydrogenotrophic, gas-permeable, silicone membrane bioreactor [J]. Bioresource Technology, 90(3): 323-328 |
| [2] | Chang C C, Tseng S K, Chang C C, et al. 2004. Degradation of 2-chlorophenol via a hydrogenotrophic biofilm under different reductive conditions [J]. Chemosphere, 56(10): 989-997 |
| [3] | 陈良文. 2011. 硝基氯化苯市场分析报告[J]. 精细化工原料及中间体, (7): 41-45; 29 |
| [4] | Chung J, Nerenberg R, Rittmann B E. 2006a. Bioreduction of selenate using a hydrogen-based membrane biofilm reactor [J]. Environmental Science & Technology, 40(5): 1664-1671 |
| [5] | Chung J, Nerenberg R, Rittmann B E. 2006b. Bio-reduction of soluble chromate using a hydrogen-based membrane biofilm reactor [J]. Water Research, 40(8): 1634-1642 |
| [6] | Chung J, Rittmann B E. 2007. Bio-reductive dechlorination of 1,1,1-trichloroethane and chloroform using a hydrogen-based membrane biofilm reactor [J]. Biotechnology and Bioengineering, 97(1): 52-60 |
| [7] | Chung J, Ahn C H, Chen Z, et al. 2008. Bio-reduction of N-nitrosodimethylamine (NDMA) using a hydrogen-based membrane biofilm reactor [J]. Chemosphere, 70(3): 516-520 |
| [8] | Deweerd K A, Concannon F, Suflita J M. 1991. Relationship between hydrogen consumption, dehalogenation, and the reduction of sulfur oxyanions by Desulfomonile tiedjei [J]. Applied and Environmental Microbiology, 57(7): 1929-1934 |
| [9] | 高廷耀, 顾国维, 周琪. 2007. 水污染控制工程(第3版)[M]. 北京: 高等教育出版社 |
| [10] | Glaus M A, Heijman C G, Schwarzenbach R P, et al. 1992. Reduction of nitroaromatic compounds mediated by Streptomyces sp. exudates[J]. Applied and Environmental Microbiology, 58(6): 1945-1951 |
| [11] | Heijman C G, Hollinger C, Claus M A, et al. 1993. Abiotic reduction of 4-chloronitrobenzene to 4-chloroaniline in a dissimilatory iron-reducing enrichment culture [J]. Applied and Environmental Microbiology, 59(12): 4350-4353 |
| [12] | Lee K C, Rittmann B E. 2003. Effects of pH and precipitation on autohydrogenotrophic denitrification using the hollow-fiber membrane-biofilm reactor [J]. Water Research, 37(7): 1551-1556 |
| [13] | Li H X, Zhang Z Q, Xu X Y, et al. 2014. Bioreduction of para-chloronitrobenzene in a hydrogen-based hollow-fiber membrane biofilm reactor: effects of nitrate and sulfate [J]. Biodegradation, 25(2): 205-215 |
| [14] | Park H S, Lim S J, Chang Y K, et al. 1999. Degradation of chloronitrobenzenes by a coculture of Pseudomonas putida and a Rhodococcus sp. [J]. Applied and Environmental Microbiology, 65(3): 1083-1091 |
| [15] | Rittmann B E, McCarty P L. 2001. Environmental Biotechnology: Principles and Applications [M]. New York: The McGraw-Hill Companies |
| [16] | Susarla S, Masunaga S, Yonezawa Y. 1996. Transformations of chloronitrobenzenes in anaerobic sediment [J]. Chemosphere, 32(5): 967-977 |
| [17] | Wu H Z, Wei C H, Wang Y Q, et al. 2009. Degradation of o-chloronitrobenzene as the sole carbon and nitrogen sources by Pseudomonas putida OCNB-1 [J]. Journal of Environmental Sciences, 21(1): 89-95 |
| [18] | 吴建峰, 沈锡辉, 周宇光, 等. 2004. 一株降解对氯硝基苯的Comamonas sp.CNB1的分离鉴定及其降解特性[J]. 微生物学报, 44(1): 8-12 |
| [19] | Xia S Q, Zhang Y H, Zhong F H. 2009. A continuous stirred hydrogen-based polyvinyl chloride membrane biofilm reactor for the treatment of nitrate contaminated drinking water [J]. Bioresource Technology, 100(24): 6223-6228 |
| [20] | Xia S Q, Li H X, Zhang Z Q, et al. 2011. Bioreduction of para-chloronitrobenzene in drinking water using a continuous stirred hydrogen-based hollow fiber membrane biofilm reactor [J]. Journal of Hazardous Materials, 192(2): 593-598 |
| [21] | 张彦浩, 谢康, 钟佛华, 等. 2010. pH对氢自养型反硝化菌反硝化性能的影响[J]. 环境污染与防治, 32(4): 40-43; 47 |
 2015, Vol. 35
2015, Vol. 35


