2. 湖南大学环境生物与控制教育部重点实验室, 长沙 410082
2. Key Laboratory of Environmental Biology and Pollution Control, Ministry of Education, Hunan University, Changsha 410082
磷(P)是生物体内的重要营养源,而水体中磷过剩会引发水体富营养化(Jarvie et al., 2006).强化生物除磷(EBPR)是一种经济有效的除磷方法(Oehmen et al., 2007),其原理聚磷菌(PAOs)在厌氧条件下吸收水体中挥发性脂肪酸(VFAs)合成聚羟基脂肪酸酯(PHAs),并在随后的好氧环境中氧化PHAs供能,超量吸收水中的磷酸盐(Chen et al.,2004).
近年来,Wang等(2008)提出了好氧/延长闲置(O/EI)序批式反应器(SBR).O/EI反应器省略了传统除磷理论认为必需的厌氧段,将闲置期由120 min适当延长至210~450 min,系统仍能保持良好的除磷效果(王冬波等,2007).与传统EBPR不同,O/EI反应器中PAOs在好氧段吸收VFAs合成PHAs和糖原(Glycogen),并在随后的好氧环境中将其氧化供能,超量吸收磷酸盐并合成聚磷(poly-P),合成的poly-P在延长闲置期逐渐水解以维持微生物代谢(王冬波等,2008).刘医璘等(2010)研究了葡萄糖和乙酸钠作为单一碳源,对O/EI系统除磷的影响.Wang等(2012a)研究证实,以丙酸钠为碳源时,O/EI系统也能取得良好的除磷效果.
废水中碳源充足时,EBPR可达到良好的除磷效果(De Bashan et al. 2004).而实际废水中有机物的含量较低,除磷性能也随之受到影响,因此,需补充外加碳源以达到预期的除磷效果(吴昌永等,2009).现阶段用于生物除磷的有机碳源主要是乙酸、丙酸等VFAs,这些物质虽易被PAOs利用,但由于成本较高,因此,并不是一种经济的碳源(Puig et al., 2007).近年来,醇类作为一种价廉易得的碳源得到了广泛关注(Puig et al., 2008).
甘油是生产生物柴油的副产物,产量大而需求量小,且处置费用较高(Johnson et al.,2007).同时,甘油是反硝化系统的良好碳源,在厌氧消化过程中可促进甲烷的产生(Akunna et al., 1993; Amon et al., 2006).Yuan等(2010)发现,甘油作为单一碳源时,会导致EBPR崩溃. Guerrero等(2012)通过延长厌氧段将甘油分解为VFAs(主要为丙酸),并通过延长好氧段使得VFAs被PAOs充分吸收用于磷的去除,取得了较好的除磷效果. O/EI反应器好氧段前未设置厌氧段,PAOs代谢途径与传统EBPR有较大区别(Tay et al., 1996).因此,甘油能否被O/EI系统吸收利用尚未明确,且不同乙酸钠/甘油比对O/EI系统除磷性能的影响有待研究.
本文旨在通过比较不同乙酸钠/甘油比例条件下O/EI反应器的除磷效果,考察不同乙酸钠/甘油比对O/EI系统除磷性能的影响,并通过分析典型周期磷元素及微生物体内各储能物质的变化,初步探究甘油影响O/EI反应器除磷性能的机理.
2 材料与方法(Materials and methods) 2.1 实验装置与运行方法研究在5个有效体积约为1.6L的玻璃烧杯(分别标记为R1、R2、R3、R4、R5)中进行.接种活性污泥取自长沙市第二污水处理厂,初始污泥浓度约为4000 mg · L-1.反应器具体运行方式为:瞬时进水→曝气(4 h)→沉淀出水(0.5 h)→闲置(3.5 h).每周期开始前瞬时进水1 L,好氧段采用鼓风曝气,曝气速率为1.8 L · min-1,每天在好氧段末排泥水混合物100mL,污泥停留时间控制在16d左右,好氧段结束沉淀0.5 h后排水1 L,水力停留时间约为14h.整个反应过程中不控制pH,反应器在室温((23±2)℃)条件下运行.按上述方式驯化培养16 d后,污泥外观呈黄褐色,活性及沉淀效果均较好,开始试运行.
2.2 污水水质进水采用合成废水,各反应器中碳元素的投加量相等(15 mmol · L-1,即COD为480 mg · L-1),乙酸钠/甘油比分别为1 ∶ 0、1 ∶ 4、1 ∶ 1、4 ∶ 1和0 ∶ 1,其他进水成分及浓度为:磷酸二氢钾15 mg · L-1(以PO43--P计)、氯化铵30 mg · L-1(以NH4+-N计)、硫酸镁5 mg · L-1(以Mg2+计)、氯化钙5 mg · L-1(以Ca2+计)、微量元素0.1 mL,微量元素成分及浓度见文献(Tay et al.,1996).
2.3 分析方法Glycogen:苯酚-硫酸法(Wang et al., 2009);PHAs:气相色谱法(Takabatake et al., 2002;Oehmen et al.,2005a);乳酸:高效液相色谱法(景丽洁等,2000);溶解性正磷酸盐(SOP):钼锑抗分光光度法;混合液悬浮固体(MLSS)与混合液挥发性悬浮固体(MLVSS):重量法;pH:玻璃电极法;COD:重铬酸钾法.具体方法见文献(国家环境保护局《水和废水监测分析方法》编委会,2002).
3 结果与讨论(Results and discussion) 3.1 各反应器中MLSS和MLVSS变化各反应器长期运行过程中,MLSS、MLVSS的变化情况如表 1所示.由表 1可知,随着甘油比例的增加,各反应器MLVSS相差不大,而MLSS相差较多,R3中较低的MLVSS/MLSS(0.61±0.06)说明微生物体内有更多的聚磷合成(Oehmen et al., 2005b).
| 表 1 各反应器长期运行中MLSS和MLVSS Table 1 MLSS and MLVSS in the SBRs during the long-term operation |
长期运行过程中,各反应器SOP去除率变化情况如图 1所示. 由图 1可知,运行的前16 d内,各反应器除磷率波动较大,16 d后磷酸盐去除率趋于稳定.R1中出水磷浓度约为1.49 mg · L-1(表 2),去除率可达90.1%,单位污泥除磷量为5.32 mg · g-1(以每克VSS中去除的P计),与以往研究(刘医璘,2010)结果相似(除磷率为85.2%,单位污泥磷的去除量为3.8~4.6 mg · g-1).R2和R3除磷率较高,分别为92.5%和97.3%,单位污泥磷的去除量分别为5.51和5.69 mg · g-1.而R4中乙酸钠/甘油降至1∶4及R5中甘油作为单一碳源时,系统除磷性能逐渐减弱,除磷率分别降至65.7%和53.4%,单位污泥除磷量分别仅为3.79和3.08 mg · g-1.
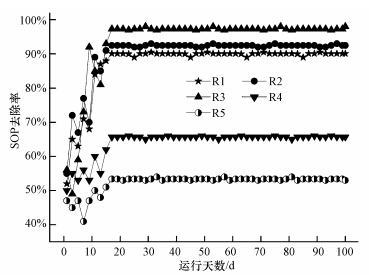 |
| 图 1 各反应器长期运行中SOP的去除情况 Fig.1 SOP removal in the SBRs during the long-term operation |
表 2中显示了长期运行中各反应器的COD去除效果,如表中所示,各反应器COD去除情况相似,去除率均高于90.0%.这表明尽管各反应器中除磷效果不尽相同,微生物对碳源的利用情况基本一致.
| 表 2 各反应器中COD和SOP去除情况 Table 2 COD and SOP removal in the SBRs during the long-term operation |
图 2为各反应器典型周期pH的变化情况. 由图 2可知,曝气开始后120 min内,R1、R2、R3中pH均升高,随后逐渐下降,最终分别稳定在8.01、7.82和7.65左右.而R4、R5中pH值的变化与R1、R2、R3有较大不同,曝气初期R4、R5中pH值逐渐升高,于10 min时达到最大(分别为6.68、6.48),随后逐渐下降,45 min时降至最低(分别为6.21、5.98).曾薇等(2002)的研究表明,曝气吹脱CO2可引起反应器内pH上升.此外,poly-P合成导致氢离子的吸收也会导致系统pH升高(Seufferheld et al., 2003).
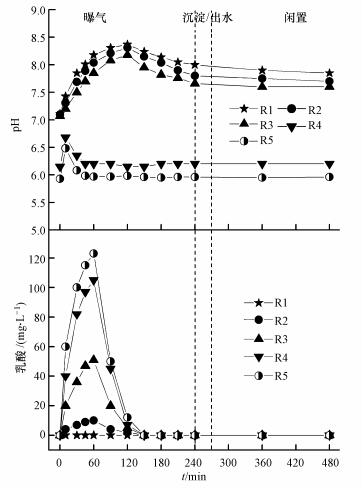 |
| 图 2 各反应器中典型周期内pH和乳酸的变化 Fig.2 Variations of pH and lactic acid during one typical cycle in the SBRs |
此外,R2~R5有不同浓度的乳酸生成(图 2),30 min时乳酸积累达到最大,随后逐渐下降,而R1中未检测到乳酸的存在.这说明甘油在直接被微生物利用的同时,会有部分氧化生成乳酸.同时,R4和R5中较高的乳酸积累也解释了反应器内pH较低的原因.
各反应器典型周期内SOP和COD变化情况如图 3所示.好氧初期,各反应器均有磷释出,释磷量分别为7.45、7.85、11.15、3.71和1.89 mg · L-1.这可能是由于好氧初期PAOs利用溶解氧的速率较快,导致混合液中溶解氧浓度较低(Wang et al., 2012a).好氧末,各反应器SOP出水浓度分别为1.49、1.13、0.41、5.15和7.01 mg · L-1,SOP去除速率(以每小时每克VSS去除的P计)分别为1.91、2.11、2.52、1.22和0.92 mg · g-1 · h-1.可见,少量甘油的存在有利于PAOs好氧吸磷,而较多的甘油会抑制好氧段磷的吸收.闲置期,R1、R2、R3有较多的磷释出,单位污泥释磷量分别为2.25、2.39和2.47 mg · g-1.而R4和R5释磷量较少,仅分别为1.32、0.73 mg · g-1.
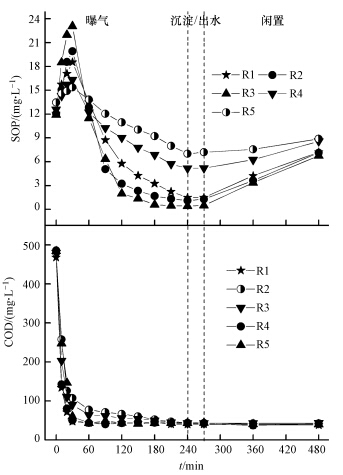 |
| 图 3 各反应器中典型周期内SOP和COD的变化 Fig.3 Variations of SOP and COD during one typical cycle in the SBRs |
曝气开始后30 min内,R1、R2、R3中外碳源大部分被消耗掉,剩余的外碳源在好氧末被消耗完全.虽然R4和R5除磷性能减弱,然而,其COD去除率均高于90%,这可能是由于R4和R5系统中有除PAOs外的其他微生物存在,这些微生物虽然对除磷无贡献,但可以参与COD的去除.
在聚磷微生物的代谢过程中,其胞内储存物PHAs和糖原发挥着非常重要的作用,是重要的能量储存与供给物质(祝贵兵等,2005).王冬波等(2009)的研究表明,当葡萄糖为碳源时,生物除磷所需的能量主要来自糖原的分解,而乙酸盐为碳源时,生物除磷所需能量主要来自PHAs的分解.由此可知,微生物细胞内储能物质的合成和分解会随有机碳源的不同而变化,从而生物除磷的效率也会有差异.为进一步探讨各反应器的不同除磷性能,本研究监测了各反应器运行稳定后典型周期内PHAs和糖原的变化情况(图 4).
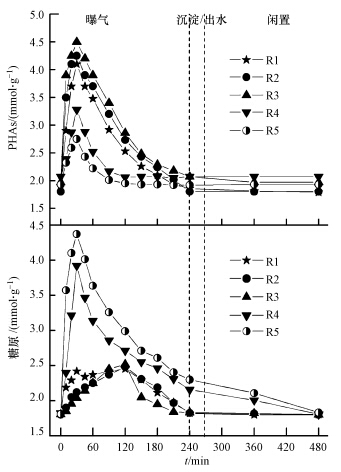 |
| 图 4 各反应器中典型周期内PHAs和糖原的变化 Fig.4 Variations of PHAs and glycogen during one typical cycle in the SBRs |
由图 4可知,各反应器典型周期PHAs和糖原积累和降解情况有所不同.好氧初期,随着外碳源迅速消耗,R1、R2和R3中PHAs和糖原大量积累.R1中,30 min时PHAs积累量达到最大值,为2.25 mmol · g-1(以每克VSS积累的C计,下同);在随后的好氧段PHAs逐渐下降,而糖原继续上升,并于120 min达到顶点,积累量为0.64 mmol · g-1,好氧末,PHAs和糖原均降至初始水平,这与Zeng等(2013)的研究一致.R2和R3中,PHAs积累量分别为2.40和2.55 mmol · g-1,糖原积累量分别为0.68和0.71 mmol · g-1.可见,低含量甘油的存在有利于PHAs合成,且随着甘油比例增大,系统中PHAs合成量逐渐增加,这可能是由于低含量甘油的存在可促进VFAs(乙酸钠)吸收,进而增强系统PHAs合成(Guerrero et al., 2012).
由图 4和表 3可知,与R1、R2、R3不同,R4和R5中好氧初期PHAs积累量较小(分别为1.21和0.82 mmol · g-1),而糖原积累量较大(分别为2.11和2.56 mmol · g-1,以每克VSS积累的C计);随后,PHAs与糖原逐渐下降;曝气结束时,PHAs基本恢复至曝气开始时的水平,而糖原浓度仍高于初始值.R5中PHAs各组分所占分例与文献(Guerrero et al., 2012)相似.闲置期,剩余的糖原逐渐被消耗,R4和R5糖原消耗量分别为0.35和0.47 mmol · g-1.由此可知,甘油含量较高时,会生成较多的乳酸,导致pH较低,糖原合成量较大,糖原作为主要能源物质,维持闲置期微生物的代谢和生长.
| 表 3 各反应器好氧初期与传统厌氧段的化学计量数及PHAs各组分百分比 Table 3 Stoichiometries and percentages of PHB,PHV and PH2MV in PHAs of conventional anaerobic period and the initial oxic period in the SBRs |
王冬波(2011)的研究表明,O/EI反应器闲置期内外基质贫乏,微生物分解poly-P维持自身生长,强化了PAOs的代谢作用,从而诱导PAOs好氧段过量摄磷.本试验闲置期,各反应器外碳源消耗完全.而R1,R2和R3中PHAs和糖原在好氧段末均降至曝气开始时水平.因此,微生物直接分解poly-P维持自身生长,并以磷酸盐的形式释放于水体中.而R4、R5曝气结束时,糖原浓度仍高于初始水平.Lu等(2007)研究表明,聚磷和糖原同时存在时,微生物将优先利用糖原来维持自身生命和代谢,当糖原浓度较低时再分解其他能源物质(poly-P).可见,R1、R2、R3中维持微生物生命和代谢的能量全部来自poly-P的水解,而R4、R5则由糖原降解和poly-P水解共同提供,这与各反应器不同程度的释磷一致.
3.4 不同乙酸钠/甘油比对好氧/延长闲置反应器除磷性能的影响传统EBPR系统中,乙酸钠为碳源时,PAOs在厌氧段利用poly-P和糖原分解产生的ATP吸收乙酸钠合成PHAs,用于好氧段磷的吸收、糖原合成及微生物代谢(Chen et al., 2004).甘油作为单一碳源不能直接被PAOs吸收,而首先经厌氧发酵生成VFAs,随后被PAOs利用(Guerrero et al., 2012).
本研究好氧段前未设置厌氧段,乙酸钠和甘油在外碳源消耗期有不同的代谢途径.1 mol乙酸钠消耗1 mol腺嘌呤核苷三磷酸(ATP)生成1 mol乙酰辅酶A,然后通过三羧酸(TCA)循环和乙醛酸循环氧化分解.1 mol甘油首先消耗1 mol ATP,在甘油激酶的催化下磷酸化生成3-磷酸甘油,然后经脱氢(产生2.5 mol ATP)、氧化(产生4.5 mol ATP)、脱羧(产生2.5 mol ATP),生成1 mol乙酰辅酶A,乙酰辅酶A通过TCA循环和乙醛酸循环氧化分解.由此可知,单位甘油氧化分解产生的ATP数量多于乙酸钠.因此,R1~R5中外碳源氧化分解产生的ATP数量随着甘油比例的增加而逐渐增多.外碳源氧化分解产生的ATP主要用于从污水中吸磷、微生物自身代谢及内源物质的积累.由图 3可知,外碳源消耗期各反应器仅有少量的磷去除,表 2中也显示各反应器MLVSS相差不大,因此,用于微生物生长的ATP数量也几乎相等.由此可知,随着甘油比例增加,越来越多的ATP用于内源物质的合成,这与各反应器内源物质的合成量相一致.
各反应器中,随着甘油比例增大,PHAs转化量逐渐增加,乙酸钠/甘油比为1 ∶ 1时,系统PHAs合成量达到最大(图 4).Mino等(1998)的研究表明,PHAs含量高可以为后续内碳源阶段磷的吸收和聚磷合成提供更多的能量,这与R1、R2、R3逐渐升高的除磷率一致.甘油在直接被微生物利用的同时,会有部分氧化生成乳酸(图 5).R4、R5中,随着甘油比例增加,乳酸合成量逐渐增多,导致pH逐渐下降(分别为6.21、5.98).此时碳源代谢产生的内源物质以糖原为主,乳酸和磷酸二羟丙酮除了经丙酮酸进入TCA循环外,还可经糖异生途径生成糖原,因而R4、R5糖原积累量较大.
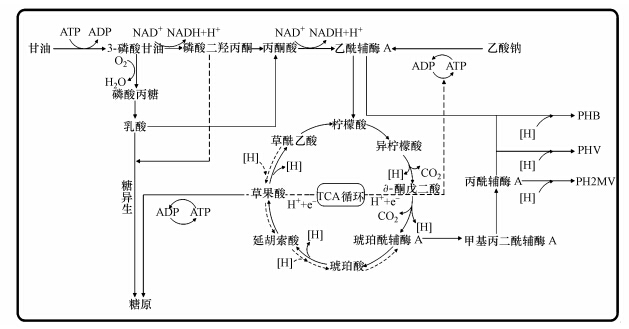 |
| 图 5 乙酸钠和甘油的好氧代谢机制 Fig.5 The metabolic mechanism of acetate and glycerol during aerobic zone |
Mino等(1998)的研究表明,内聚物PHAs和糖原的转化与PAOs和聚糖菌(GAOs)的代谢有关,曝气阶段较高的糖原积累量更有利于GAOs代谢.本研究中,R4、R5糖原转化量较大,而PHAs合成及聚磷合成较少,即R4、R5中GAOs活性较高而PAOs活性较低,这与R4、R5较低的除磷率一致,同时,也解释了R4、R5虽除磷性能减弱,而外碳源利用率仍较高的原因.
Wang等(2012b)研究证实,O/EI系统中单位污泥磷的去除量随闲置期释磷量的增多而增加,二次释磷不仅不会恶化除磷系统,反而可驱动PAOs在好氧段过量吸磷.本研究中,曝气结束时,各反应器糖原浓度水平不同,因此,闲置期对poly-P的依赖程度不同见3.3节,即释磷量不同,进而导致了不同的除磷性能.
综上所述,进水甘油的含量较低时,随着甘油比例增加,微生物分解外碳源时合成的PHAs逐渐增多,为除磷提供更多的能量,因而除磷性能逐渐增强.随甘油比例继续增加,较多的乳酸生成导致pH较低,糖原合成量较大,系统除磷性能减弱.
4 结论(Conclusions)1)甘油作为辅助碳源有利于提高系统除磷性能,而作为单一碳源时,系统除磷性能减弱.
2)低含量甘油存在可促进VFAs吸收,有利于PHAs合成,可增强延长闲置段处于“饥饿”状态的聚磷菌对磷的吸收,诱导其好氧段过量摄磷;甘油含量较高时,会生成较多的乳酸,导致pH较低,糖原合成量较大,系统除磷性能减弱.
| [1] | Akun na J C,Bizeau C,Moletta R.1993.Nitrate and nitrite reductions with anaerobic sludge using various carbon sources: Glucose,glycerol,acetic acid,lactic acid and methanol[J].Water Research,27(8): 1303-1312 |
| [2] | Amon Th,Amon B,Kryvoruchko V,et al.2006.Optimising methane yield from anaerobic digestion of manure: Effects of dairy systems and of glycerine supplementation[J].International Congress Series,1293: 217-220 |
| [3] | Chen Y G,Randall A A,McCue T.2004.The efficiency of enhanced biological phosphorus removal from real wastewater affected by different ratios of acetic to propionic acid[J].Water Research,38(1): 27-36 |
| [4] | De-Bashan L E,Bashan Y.2004.Recent advances in removing phosphorus from wastewater and its future use as fertilizer (1997-2003)[J].Water Research,38(19): 4222-4246 |
| [5] | Guerrero J,Tayà C,Guisasola A,et al.2012.Glycerol as a sole carbon source for enhanced biological phosphorus removal[J].Water Research,46(9): 2983-2991 |
| [6] | 国家环境保护局《水和废水监测分析方法》编委会.2002.水和废水监测分析方法(第4版)[M].北京:中国环境科学出版社 |
| [7] | Jarvie H P,Neal C,Withers P J A.2006.Sewage-effluent phosphorus: A greater risk to river eutrophication than agricultural phosphorus?[J].Science of the Total Environment,360(1/2/3): 246-253 |
| [8] | 景丽洁,王树清,邱俊,等.2000.高效液相色谱法测定玉米浸渍水中乳酸[J].环境工程,18(4): 46-47 |
| [9] | Johnson D T,Taconi K A.2007.The glycerin glut: Options for the value-added conversion of crude glycerol resulting from biodiesel production[J].Environmental Progress,26(4): 338-348 |
| [10] | 刘医璘,王冬波,李小明,等.2010.2种典型基质作为碳源对单级好氧生物除磷影响的研究[J].环境科学,31(1): 124-128 |
| [11] | Lu H B,Keller J,Yuan Z G.2007.Endogenous metabolism of Candidatus Accumulibacter phosphastis under various starvation conditions[J].Water Research,41(20): 4646-4656 |
| [12] | Mino T,Van Loosdrecht M C M,Heijnen J J.1998.Microbiology and biochemistry of the enhanced biological phosphaste removal process[J].Water Research,32(11): 3193-3207 |
| [13] | Oehmen A,Keller-Lehmann B,Zeng R J,et al.2005a.Optimisation of poly-β-hydroxyalkanoate analysis using gas chromatography for enhanced biological phosphorus removal systems[J].Journal of Chromatography A,1070(1/2): 131-136 |
| [14] | Oehmen A,Vives M T,Lu H B,et al.2005b.The effect of pH on the competition between polyphosphate-accumulating organisms and glycogen-accumulating organisms[J].Water Research,39(15): 3727-3737 |
| [15] | Oehmen A,Lemos P C,Carvalho G,et al.2007.Advances in enhanced biological phosphorus removal: From micro to macro scale[J].Water Research,41(11): 2271-2300 |
| [16] | Pereira H,Lemos P C,Reis M A M,et al.1996.Model for carbon metabolism in biological phosphorus removal processes based on in vivo C-NMR labelling experiments[J].Water Research,30(9): 2128-2138 |
| [17] | Puig S,Corominas Li,Balaguer M D,et al.2007.Biological nutrient removal by applying SBR technology in small wastewater treatment plants: carbon source and C/N/P ratio effects [J].Water Science & Technology,55(7): 135-141 |
| [18] | Puig S,Coma M,Monclús H,et al.2008.Selection between alcohols and volatile fatty acids as external carbon sources for EBPR[J].Water Research,42(3): 557-566 |
| [19] | Seufferheld M,Vieira M C F,Ruiz F A,et al.2003.Identification of organelles in bacteria similar to acidocalcisomes of unicellular eukaryotes[J].Journal of Biological Chemistry,278(32): 29971-29978 |
| [20] | Takabatake H,Satoh H,Mino T,et al.2002.PHA(polyhydroxyalkanoate) production potential of activated sludge treating wastewater[J].Water Science & Technology,45(12): 119-126 |
| [21] | Tay J,Show K,Jeyaseelan S.1996.Effect of media characteristics on performance of upflow anaerobic packed-bed reactors[J].Journal of Environmental Engineering,122(6): 469-476 |
| [22] | Wang D B,Li X M,Yang Q,et al.2008.Biological phosphorus removal in sequencing batch reactor with single-stage oxic process[J].Bioresource Technology,99(13): 5466-5473 |
| [23] | Wang D B,Li X M,Yang Q,et al.2009.The probable metabolic relation between phosphate uptake and energy storages formations under single-stage oxic condition [J].Bioresource Technology,100(17): 4005-4011 |
| [24] | Wang D B,Li X M,Yang Q,et al.2012a.Improved biological phosphorus removal performance driven by the aerobic/extended-idle regime with propionate as the sole carbon source[J].Water Research,46(12): 3868-3878 |
| [25] | Wang D B,Yang G J,Li X M,et al.2012b.Inducing mechanism of biological phosphorus removal driven by the aerobic/extended-idle regime[J].Biotechnology and Bioengineering,109(11): 2798-2807 |
| [26] | 王冬波,李小明,曾光明,等.2007.内循环 SBR反应器无厌氧段实现同步脱氮除磷[J].环境科学,28(3): 534-539 |
| [27] | 王冬波,李小明,杨麒,等.2008.SBR无厌氧段实现生物除磷[J].环境科学,29(7): 1867-1873 |
| [28] | 王冬波,李小明,杨麒,等.2009.碳源对SBR单级好氧工艺中微生物摄磷能力的影响及其机理研究[J].中国科学(B辑: 化学),39(6): 560-568 |
| [29] | 王冬波.2011.SBR单级好氧生物除磷机理研究[D].长沙: 湖南大学 |
| [30] | 吴昌永,彭永臻,万春黎,等.2009.碳源对EBPR代谢过程及微生物特性的影响[J].环境科学,30(7): 1990-1994 |
| [31] | Yagci N,Artan N,okgör E U,et al.2003.Metabolic model for acetate uptake by a mixed culture of phosphate- and glycogen-accumulating organisms under anaerobic conditions[J].Biotechnology and Bioengineering,84(3): 359-373 |
| [32] | Yuan Q,Sparling R,Lagasse P,et al.2010.Enhancing biological phosphorus removal with glycerol[J].Water Science & Technology,61(7): 1837-1843 |
| [33] | Zeng T J,Wang D B,Li X M,et al.2013.Comparison between acetate and propionate as carbon sources for phosphorus removal in the aerobic/extended-idle regime[J].Biochemical Engineering Journal,70: 151-157 |
| [34] | 曾薇,彭永臻,王淑莹,等.2002.pH值与温度对SBR法反应时间控制的影响[J].中国环境科学,22(5): 456-459 |
| [35] | 祝贵兵,彭永臻.2005.生物除磷设计与运行手册[M].北京: 中国建筑工业出版社 |
 2015, Vol. 35
2015, Vol. 35


