电镀工业会产生大量镀镍漂洗废水,废水中的镍主要以硫酸镍、氯化镍及络合镍的形态存在,而镍是第一类污染物,其超标排放会对环境造成严重污染.电镀废水中高浓度非络合态Ni较易去除,传统的处理方法有化学法(戴文灿等,2009;魏岱金等,2012;Tanaka et al., 2008)、电解法(李峥等,2003)、铁氧体法(江洪龙等,2013)、生物法(Sathyavathi et al., 2014)等.化学沉淀法因其处理效果佳,出水稳定可靠,工艺成熟而得到广泛应用.废水中低浓度络合态Ni的脱除比较难,常见的处理方法有离子交换法(Huang et al., 2009)、膜分离技术(Qin et al., 2003)、电渗析法(Li et al., 1999;Dermentzis,2010)、吸附法(Martín-Lara et al., 2014)、多种方法联合(Fu et al., 2009)等,但处理后出水Ni2+浓度仍然较高(>0.1 mg·L-1),因此,需要寻找一种高效的方法对废水中低浓度络合态Ni进行深度脱除.
重金属捕集剂由于具有强大的螯合能力,能与废水中金属形成强稳定性的螯合物,从而高效去除废水中的金属污染物,因此得到广泛应用(相波等,2003).近年来,研究人员已经开始研究利用重金属捕集剂来处理含Ni废水,并取得了良好的效果.王贞等(2010)以含Ni2+、Cr3+、EDTA-Cu、焦磷酸铜的单一模拟废水为处理对象,筛选出效果较佳的二硫代氨基甲酸类物质CM-1,对Ni2+、Cu2+的去除率达90%以上;沈友良等(2005)用DDTC作化学捕集剂去除含Ni废水中的Ni2+,Ni去除率大于99.99%,且不受溶液温度和pH影响;令玉林等(2011)合成了一种新的长链型二硫代氨基甲酸盐类重金属螯合剂RDTC,对模拟废水中游离Ni和络合Ni的去除率分别在99%和98%以上,出水Ni2+浓度分别为0.043 mg·L-1和0.208 mg·L-1.然而,目前的研究主要集中在重金属捕集剂对模拟废水中高浓度游离态Ni2+(>100 mg·L-1)去除方面,对实际废水中低浓度络合态Ni研究甚少.而广东省环保厅对于含Ni电镀废水的处理提出了更高的要求,残留Ni2+浓度要求低于《电镀污染物排放标准(GB21900—2008)》特别排放限值0.1 mg·L-1(广东省环境保护厅,2013).因此,本研究结合目前实际要求,以实际电镀废水中低浓度络合态Ni为研究对象,筛选出最佳Ni捕集剂并考察各种因素对Ni去除效果的影响,探讨了该重金属捕集剂脱除Ni的机理,以期为实际电镀废水深度脱Ni技术研究提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料二硫代氨基甲酸盐钠(EDTC)、硫化钠(Na2S·9H2O)、 聚合氯化铝(PAC)、聚丙烯酰胺(PAM)、氯化镍(NiCl2·6H2O)、乙二胺四乙酸二钠(C10H14N2O8Na·2H2O)、 氢氧化钠、浓硫酸等均为分析纯.实际含Ni电镀废水A取自广东东莞某电镀厂Na2S预处理后废水,该废水pH=11,废水中金属浓度如表 1所示.
| 表 1 电镀废水A中金属浓度 Table 1 Metals concentrations of electroplating wastewater A mg·L-1 |
室温条件下,取100 mL水样置于150 mL烧杯中,调节pH至所需值,加入一定量捕集剂,置于六联搅拌器中快速(200 r·min-1)搅拌一定时间,加入一定量的混凝剂PAC,缓慢(70 r·min-1)搅拌2 min,然后加入助凝剂PAM 2.5 mg·L-1,缓慢(70 r·min-1)搅拌2 min,静置30 min后取10 mL上层清液,用火焰原子吸收分光光度计测定溶液中残留的Ni浓度.
采用单因素实验的方法对比不同捕集剂对Ni去除效果及考察采用最佳捕集剂时,废水pH、投加量、反应时间、混凝剂投加量对Ni去除效果的影响.
2.3 分析方法pH采用雷磁pHS-25酸度计测定;Ni2+浓度采用火焰原子吸收分光光度计测定(日立Z2000型,检出限0.02 mg·L-1);捕集剂反应前后表征:采用KBr压片法,用Nicolet380傅里叶变换红外光谱仪(Nicolet380,美国THERMO Fisher Scientific)在波长4000~400 cm-1范围内测定透光率;采用有机元素分析仪(2400Ⅱ,美国PerkinElmer)测定沉淀产物碳氮硫比.
3 结果与讨论(Results and discussion) 3.1 不同捕集剂对Ni去除效果的比较选用NaOH、Na2S和有机巯基类化合物(EDTC)作为金属捕集剂,比较三者在相同的实验条件下对Ni去除效果.Ni初始浓度为6.41 mg·L-1,调节水样pH=7,各捕集剂按100 mg·L-1过量投加,反应时间为1 min,实验结果如图 1所示.由图可知,3种捕集剂对Ni去除效果为EDTC>Na2S>NaOH.EDTC对Ni的去除效果最为显著,去除率达71.14%,Ni剩余浓度为1.75 mg·L-1.
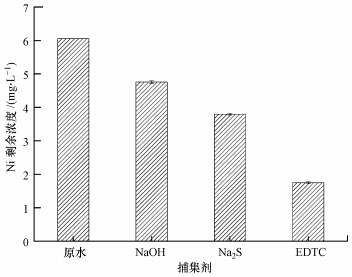 |
| 图 1 不同捕集剂对Ni去除效果影响 Fig.1 Effects of different capturing agents on the removal of Ni |
废水中Ni2+与OH-生成Ni(OH)2沉淀,但该沉淀物稳定性较差(溶度积常数为1.0×10-14),S2-与Ni2+的结合能力较OH-强,可生成稳定性较Ni(OH)2强的NiS(溶度积常数为1.0×10-24.9).EDTC对Ni的去除效果较Na2S和NaOH好,可能的原因是经预处理后电镀废水中低浓度Ni主要以络合Ni形态存在,表现为〖Ni(en)3〗2+、〖Ni(CN)4〗2-、(C5H7O5COO)2Ni3等(江霜英等,2004;闰洪,1999),少量Ni以Ni2+形式存在,而OH-和S2-与Ni2+形成的化学键均无法打破上述络合态Ni中存在的配位键,从而难以使络合态Ni以NiS和Ni(OH)2沉淀析出(杨帆等,2002;陈黄浦等,2000).而EDTC在废水中抢夺Ni能力比Y4-、C5H7O5COO-更强,通过置换原配位体,生成稳定沉淀物,达到深度脱除Ni的目的.因此,选择EDTC作为Ni的理想捕集剂作下一步实验研究.
3.2 加药方式对EDTC去除Ni效果的影响已知EDTC在酸性介质中易发生分解失效(朱玉霜等,1996),因此,利用EDTC脱除废水中络合Ni必须在弱碱性或碱性环境中进行,查阅文献发现,EDTC最佳pH范围在6~10之间(王淀佐等,1990;薛玉兰等,1991);同时,考虑到过碱会造成经济成本高,故本研究的pH范围设定为7~12.本文中EDTC加药方式有两种:一种是先调节pH值后投加EDTC,另一种是先加EDTC后调节pH值.
EDTC按nEDTC/nNi=3投加,反应时间为1 min,PAM投加量为2.5 mg·L-1,反应时间为2 min,在此条件下考察不同加药方式对Ni去除效果的影响,通过对比两种加药方式找到EDTC的最佳pH值.如图 2所示,先投加EDTC后调节pH值方式下,随着pH值的增大,Ni去除率逐渐降低,在pH=7时,Ni去除率较高,达56.03%,剩余浓度为 2.66 mg·L-1.先调节pH值后投加EDTC方式下,pH<9时,随着pH值的增大,Ni去除率降低;pH在9~11范围内,Ni去除率保持稳定;pH>11时,Ni去除率开始升高;在pH=7时,Ni去除率较高,达62.44%,Ni剩余浓度2.28 mg·L-1.消耗相同的酸量,为达到较高的去除率,宜采用先调节pH值后投加EDTC的方式.
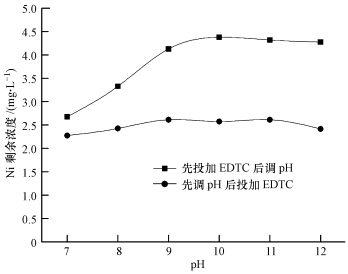 |
| 图 2 pH值对EDTC去除Ni效果影响 Fig.2 Effects of pH on the removal of Ni by EDTC |
当pH=7时,Ni去除率较高.分析认为:当pH>>pKa(pKa =3.4)时,溶液中EDTC主要以离子形式存在(胡为柏,1989),反应活性高且H+的存在抑制了废水中柠檬酸、酒石酸、乙二胺四乙酸等有机络合剂向C5H7O5COO-、C4H4O2-6、Y2-等电离(李姣,2011),从而降低配位体的浓度,使Ni以Ni2+形式逐步析出.例如,由于H+浓度增大,NH3与H+结合生成了NH+4,镍氨络合离子开始解离,反应方程式如下:〖Ni(NH3)6〗2++4H+=Ni2++4NH+4,EDTC在弱碱性条件下与Ni2+反应生成颗粒沉淀物.故选择pH=7.0为最佳反应pH值进行后续研究.这与王淀佐等研究用捕收剂对镍钴冶炼废水进行离子浮选,Ni浮选最佳pH范围在6~10之间的研究结果一致(王淀佐等,1990;薛玉兰等,1991).
3.3 EDTC投加量对EDTC去除Ni效果的影响调节水样pH为7.0,反应时间为1 min,考察EDTC投加量对Ni去除效果的影响,结果如图 3所示.随着EDTC投加量的增加,Ni剩余浓度迅速减小;当EDTC投加量为100 mg·L-1时,Ni去除率较高,去除率达71.51%,出水浓度为1.73 mg·L-1.当EDTC投加量大于100 mg·L-1时,Ni去除率稍有降低,降低幅度较小.
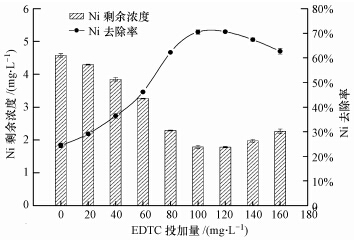 |
| 图 3 EDTC投加量对EDTC去除Ni效果影响(PAM=2.5 mg·L-1,搅拌2 min Fig.3 Effects of EDTC dosage on the removal of Ni by EDTC |
PAM的加入有助于Ni的去除,但作用很微弱,主要起作用的是EDTC,但少量的PAM可以加快絮凝过程,增大沉淀絮体体积使污泥成团较紧密,降低含水率(付念等,2013).考虑到工程应用的成本,选取100 mg·L-1(即nEDTC/nNi=4)为EDTC最佳的投加量.
3.4 EDTC反应时间对EDTC去除Ni效果的影响调节水样pH为7.0,EDTC投加量为nEDTC/nNi=4,考察反应时间(0~30 min)对Ni去除效果的影响,结果如图 4所示.随着反应时间的延长,Ni剩余浓度减小,反应前15 min时,降低幅度较大,后15 min Ni剩余浓度降低幅度微小,几乎不变.反应时间为15 min时,Ni从初始浓度6.41 mg·L-1降为1.37 mg·L-1,去除率达77.32%.
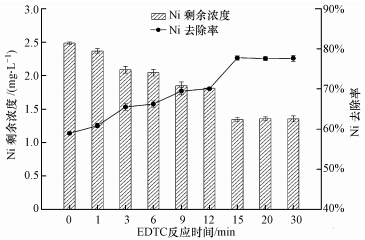 |
| 图 4 EDTC反应时间对EDTC去除Ni效果影响(PAM=2.5 mg·L-1,搅拌2 min) Fig.4 Effects of EDTC′s reaction time on the removal of Ni by EDTC |
EDTC与Ni反应迅速,反应基本在前15 min内完成,延长反应时间对Ni去除率的提升有限,反应时间的长短关系到实际工程应用时反应池容积的大小,考虑到经济成本,故选择反应时间为15 min较佳.
3.5 混凝剂PAC投加量对EDTC脱除Ni效果的影响调节水样pH为7.0,EDTC投加量为nEDTC/nNi=4,反应时间为15 min,考察PAC投加量对Ni去除效果的影响,结果如图 5所示.Ni剩余浓度随着PAC投加量的增加而减小,Ni去除率随着PAC投加量的增加而增大,PAC投加量为100 mg·L-1时,去除率较高,达83.15%,Ni剩余浓度为1.08 mg·L-1.
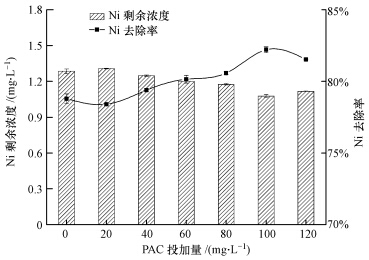 |
| 图 5 PAC投加量对EDTC去除Ni效果影响(t=15 min,PAM=2.5 mg·L-1,搅拌2 min) Fig.5 Effects of PAC dosage on the removal of Ni by EDTC |
单独使用PAC对离子态Ni有较好的去除效果,对络合态Ni去除效果甚微,经处理后Ni剩余浓度远高于0.1 mg·L-1(付念等,2013).本研究中主要起作用是EDTC,实验发现经长时间静置后,Ni剩余浓度仍无明显变化,由此推断EDTC与Ni形成的沉淀体积细小,不易自然沉降;投加PAC后,利用高分子絮凝剂的吸附架桥作用,使体积较小的沉淀物絮凝形成大的矾花,利于固液分离,减少了沉淀时间.
3.6 EDTC对不同含Ni电镀废水中Ni的去除效果综上所述,选用捕集剂EDTC处理低浓度络合Ni废水在技术上是可行的,Ni去除率高达83.15%.不同电镀厂镀Ni工艺不同,因此,废水中成分及含量也不一.针对不同含Ni电镀废水,使用巯基化合物EDTC,按优化后工艺条件运行,对比EDTC去除 Ni的效果.实际含Ni电镀废水分别取自广东省3家电镀厂经Na2S预处理后废水,废水金属浓度如表 2所示.
| 表 2 废水金属浓度 Table 2 Metals concentrations of waste water |
优化后工艺条件:调节水样pH=7,nEDTC/nNi=4,t1=15 min,PAC=100 mg·L-1,t2=2 min,PAM=2.5 mg·L-1,t3=2 min,静置30 min.在最优工艺条件下应用EDTC对表 2中的3种电镀废水进行处理,处理结果如表 3所示:EDTC对上述3种不同类型电镀废水中Ni的去除率均能达到80%,部分废水Ni剩余浓度甚至低于0.1 mg·L-1,达到排放标准.由于实际废水成分复杂,除Ni以外,往往还存在Cu、Fe、Zn、Cr等金属,这些金属离子均可能与EDTC形成螯合物,当它们中的某一种或者几种与Ni同时存在时,可能会影响EDTC对Ni的去除效果.这些金属与EDTC形成的螯合物,其稳定性大小为Cu2+>Ni2+>Zn2+>Fe3+>Cr3+(朱玉霜等,1996;朱声逾等,1990).废水A中由于Ni与其他金属相互竞争导致Ni不能被完全转移到污泥中,EDTC对Ni虽有一定的去除效果但不能彻底去除;而废水C中Ni与Fe之间既存在相互竞争也存在相互协调,其协调作用大于竞争作用,故Ni2+和Fe2+/ Fe3+在碱性条件下发生共沉淀(张学洪等,2003;倪婷,2014),Ni被完全转移到污泥中从而被完全去除.
| 表 3 巯基捕集剂对不同含Ni电镀废水中Ni去除效果 Table 3 Effects of heavy metal chelating agent with thiol on removal of Ni from different nickel platings |
用NiCl2与EDTA-2Na(乙二胺四乙酸二钠)按1 ∶ 1(物质的量比)配制Ni浓度为6 mg·L-1的EDTA-Ni模拟废水.模拟EDTA-Ni络合废水与含Ni电镀废水A按上述优化工艺条件得到沉淀产物,沉淀产物经洗涤、干燥后进行红外光谱表征.两者沉淀产物红外光谱图如图 6所示:两者出峰位置及峰强度基本一致,表明含Ni电镀废水A经EDTC捕获后的沉淀产物与EDTA-Ni络合废水经EDTC沉淀后的沉淀产物官能团一致,故可用EDTA-Ni络合废水来模拟含Ni电镀废水,进一步探讨EDTC脱除Ni的机制.
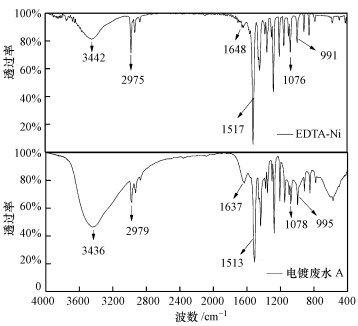 |
| 图 6 EDTA-Ni模拟废水和电镀废水A经EDTC沉淀后沉淀产物红外光谱图 Fig.6 FTIR spectrum of sediments from EDTA-Ni simulated and nickel plating wastewater A treated by EDTC |
分别对EDTC、模拟废水沉淀产物EDTC-Ni进行红外光谱表征,两者红外光谱图如图 7所示:EDTC在3421 cm-1处有最强吸收峰,此峰为N—H的伸缩振动;2936 cm-1为C—H伸缩振动,且低于3000 cm-1,该峰为C—H的饱和吸收峰;2700 cm-1处为—SH很弱的特征吸收峰;1672 cm-1为—SH的伸缩振动吸收峰;1063 cm-1为C S伸缩振动吸收峰;1496 cm-1为N—CS2的伸缩振动吸收峰,此峰介于C—N单键(1300 cm-1)和C N双键(1600 cm-1)之间,具有很大的双键性质;1476 cm-1处为C—S特征吸收峰,982 cm-1为C—S伸缩振动吸收峰,表明EDTC是双齿配位体,即S C—S.
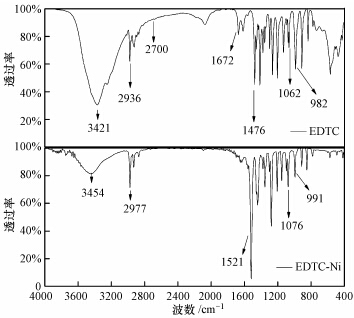 |
| 图 7 EDTC和EDTC-Ni的红外光谱图 Fig.7 FTIR spectra of EDTC and EDTC-Ni |
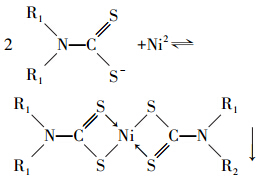
EDTC与Ni反应前后在2700 cm-1处的—SH特征吸收峰和在1672 cm-1 处的S—H伸缩振动吸收峰基本消失,其它吸收峰出现的位置基本没有变化.由此可推断,EDTC捕集金属Ni的主要官能团是—SH,而EDTC其它官能团没有与Ni发生反应.进一步对模拟废水沉淀产物EDTC-Ni进行元素分析,其元素含量百分比如表 4所示.由表 4可看出,模拟废水沉淀产物EDTC-Ni碳、氮、硫百分含量与Ni(EDTC)2理论值几乎一致,由此推断出EDTC-Ni化学式为Ni(EDTC)2.由红外光谱和元素分析结果推断出EDTC能高效脱除废水中络合态Ni主要起作用的是EDTC中的—SH,—SH中硫原子半径较大,带负电,易极化变形而产生负电场,从而捕捉Ni2+并趋向成键生成疏水性螯合产物(汤婷媚,2011),其主要反应方程式为:
| 表 4 模拟废水沉淀产物元素分析值和Ni(EDTC)2理论元素含量对比 Table 4 Organic elemental analysis of sediment from simulated nickel plating wastewater and Ni(EDTC) |
1)巯基重金属捕集剂EDTC脱除实际电镀废水中低浓度络合Ni的效果明显优于常规沉淀剂NaOH和Na2S.
2)在Ni初始浓度为6.41 mg·L-1,pH为7,EDTC投加量为nEDTC/nNi=4,反应时间15 min,PAC为2.5 mg·L-1,反应时间为2 min,PAM为100 mg·L-1,反应时间为2 min的条件下,处理后出水Ni剩余浓度为1.08 mg·L-1,去除率达83.15%,表明使用捕集剂EDTC处理低浓度络合Ni废水在技术上是可行的;而pH及EDTC投加量对Ni的去除效果影响较大.
3)使用巯基化合物EDTC处理3种不同含Ni电镀废水,均有较高的Ni去除率,部分废水出水Ni2+浓度低于电镀污染物排放标准中的特别限值(0.1 mg·L-1),进一步表明了该巯基重金属捕集剂深度脱除废水中低浓度络合Ni的适应性和有效性.
4)EDTC能深度脱除废水中Ni主要起作用的是—SH,随着反应的进行—SH减少,—SH与Ni2+生成四边形配位化合物,这种dsp2杂化的平面四方形结构极其稳定,故能直接抢夺NiY中的Ni生成Ni-EDTC螯合物.
| [1] | 陈黄浦, 宗瑜瑾.2000.配位离子在化学镀镍中的动态演变和作用[J].西安交通大学学报,34(10): 57-61 |
| [2] | 戴文灿,孙水裕,陈涛.2009.沉淀浮选法处理电镀废水的试验研究[J].有色金属(选矿部分),(5): 17-20 |
| [3] | Dermentzis K.2010.Removal of nickel from electroplating rinse waters using electrostatic shielding electrodialysis/electrodeionization[J].Journal of Hazardous Materials,173(1/2/3): 647-652 |
| [4] | Fu F L,Wang Q,Tang B.2009.Fenton and Fenton-like reaction followed by hydroxide precipitation in the removal of Ni(II) from NiEDTA wastewater: A comparative study[J].Chemical Engineering Journal,155(3): 769-774 |
| [5] | 付念,毛祖国,丁运虎,等.2013.3种典型絮凝剂处理电镀废水的效果[J].电镀与装饰,32(8): 38-41 |
| [6] | 广东省环境保护厅.2013.广东省环境保护厅关于珠江三角洲地区执行国家排放标准水污染物特别排放限值的通知(粤环(2012)83号).广州: 广东省环境保护厅,2013-12-30.http://www.gdep.gov.cn/zcfg/hbwj/201312/t20131230_165715.html |
| [7] | 胡为柏.1989.浮选[M].长沙:冶金工业出版社.126-128 |
| [8] | Huang Y,Tanaka M.2009.Analysis of continuous solvent extraction of nickel from spent electroless nickel plating baths by a mixer-settler[J].Journal of Hazardous Materials,164(2/3): 1228-1235 |
| [9] | 江洪龙,俞马宏.2013.Fenton-铁氧体法联合工艺处理络合电镀废水[J].电镀与涂饰,32(4): 43-47 |
| [10] | 江霜英,高廷耀,胡惠康.2004.化学镀镍废液的预处理[J].同济大学学报(自然科学版),32(2): 226-228 |
| [11] | Li C L,Zhao H X,Tsuru T,et al.1999.Recovery of spent electroless nickel plating bath by electrodialysis[J].Journal of Membrane Science,157(2): 241-249 |
| [12] | 李峥,吴效东,程鸣,等.2003.微电解法处理电镀废水[J].安全与环境工程,10(3): 35-37 |
| [13] | 李姣.2011.化学沉淀法处理电镀废水的实验研究.长沙: 湖南大学 |
| [14] | 令玉林.2011.重金属螯合剂RDTC的研制及处理重金属废水性能研究.湘潭: 湘潭大学 |
| [15] | Martín-Lara M A,Blázquez G,Trujillo M C,et al.2014.New treatment of real electroplating wastewater containing heavy metal ions by adsorption onto olive stone[J].Journal of Cleaner Production,81: 120-129 |
| [16] | 倪婷,李良超,孙代红.2014.铁氧体-共沉淀法处理工业废水的模拟研究[J].华中师范大学学报(自然科学版),48(2): 228-232 |
| [17] | Qin J J,Oo M H,Wai M N,et al.2003.Effect of feed pH on an integrated membrane process for the reclamation of a combined rinse water from electroless nickel plating[J].Journal of Membrane Science,217(1/2): 261-268 |
| [18] | 闰洪.1999.现代化学镀镍和复合镀新技术[M].北京: 国防工业出版社.5-7 |
| [19] | Sathyavathi S,Manjula A,Rajendhran J,et al.2014.Extracellular synthesis and characterization of nickel oxide nanoparticles from Microbacterium sp.MRS-1 towards bioremediation of nickel electroplating industrial effluent[J].Bioresource Technology,165: 270-273 |
| [20] | 沈友良,聂基兰.2005.用化学捕收剂处理含镍废水[J].南昌大学学报(理科版),29(4): 367-369 |
| [21] | Tanaka M,Huang Y,Yahagi T,et al.2008.Solvent extraction recovery of nickel from spent electroless nickel plating baths by a mixer-settler extractor[J].Separation and Purification Technology,62(1): 97-102 |
| [22] | 汤婷媚.2011.燃煤烟气脱硫液及脱硫石膏中汞的稳定化研究.杭州: 浙江大学 |
| [23] | 王淀佐,潘焕基,薛玉兰.1990.冶炼废水中镍钴离子浮选的溶液化学研究[J].有色金属,42(2): 21-26; 35 |
| [24] | 王贞,叶国祥,杨岳平.2010.重金属捕集剂法处理低浓度电镀废水[J].浙江大学学报(理学版),37(6): 665-669 |
| [25] | 魏岱金,陈帅华.2012.低浓度含镍废水的处理[J].有色冶金设计与研究,33(6): 49-51 |
| [26] | 相波,刘亚菲,李义久,等.2003.DTC类重金属捕集剂研究的进展[J].电镀与环保,23(6): 1-4 |
| [27] | 薛玉兰,王淀佐,伏雪峰.1991.冶炼废水中镍钴离子浮选的试验研究[J].有色金属,43(2): 30-34 |
| [28] | 杨帆,林纪筠,单永奎.2002.配位化学[M].上海: 华东师范大学出版社.54-60 |
| [29] | 张学洪,王郭球,程利,等.2003.铁氧体法处理电解锌厂生产废水[J].环境科学与技术,26(1): 36-37; 65 |
| [30] | 朱声逾,周永洽,申泮文.1990.配位化学简明教程[M].天津: 天津科学技术出版社.115 |
| [31] | 朱玉霜,朱建光.1996.浮选药剂的化学原理[M].长沙: 中南工业大学出版社.35 |
 2015, Vol. 35
2015, Vol. 35


