2. 南京信息工程大学应用气象学院生态气象环境中心, 南京 210044
2. International Center for Ecology, Meteorology and Environment (Ice Me), School of Applied Meteorology, Nanjing University of Information Science and Technology, Nanjing 210044
沉水植物作为湖泊生态系统的重要组成成分之一,能够改变水体的营养盐浓度,降低水中污染物的含量,抑制藻类的生长,提高水体的自净能力(边归国等,2012;伏彩中等,2006;孙作登等,2012).但是迄今为止,富营养湖泊中沉水植物恢复与重建效果并不完全理想(Brix,1997;Huang et al., 2009),沉水植物衰败机理仍然不是很明确.近年来,附植藻类对沉水植物的影响引起了人们的关注.有关附植藻类的研究表明,富营养湖泊中附植藻类的大量繁殖或许是沉水植物衰退的重要原因(Laugaste and Lessok, 2004).目前有关附植藻类对沉水植物的影响问题存在分歧,一部分学者认为附植藻类与沉水植物互利共生,两者是长期进化的结果( Vander Zanden and Vadeboncoeur, 2002;张强和刘正文,2010;Burkholder and Wetzel, 1990);也有一部分学者认为附植藻类的繁殖会影响沉水植物的代谢和光合作同,进而抑制沉水植物正常的生长发育,甚至导致其死亡(Irfanullah and Moss, 2004;Feldmann and Peeter Nõges,2007).
狐尾藻为常见的沉水植物,在我国南北方都有分布,具有繁殖速度快、适应性强、耐污能力较强等特点,在氮磷去除能力方面表现突出(宋福等,1997;刘弋潞和何宗健,2006).本文拟研究附植藻类对狐尾藻生长和生理特征的影响,以期为了解富营养化湖泊中沉水植物衰退的机理、揭示附植藻类与沉水植物之间的相互作用以及指导浅水富营养化湖泊生态修复提供科学依据.
2 材料与方法(Materials and methods) 2.1 实验材料与设计狐尾藻采自溱湖国家湿地公园,用清水将其小心洗净,去除枯黄和衰败的叶片.挑选5棵长势基本一致、生长状况良好的狐尾藻移栽至塑料杯中,塑料杯中装有8 cm厚的洗净的沙子.
本实验在阳光充足、通风条件良好的大棚中进行,在大棚中放置等体积的塑料箱(30 cm×40 cm×50 cm),每箱中装有40 L的自来水.其中1个箱子为培养狐尾藻使用,培养期间定期换水.其余箱子中加入配制好的氮(NH+4 ∶ NO-3=1 ∶ 1)、磷(NaH2PO4)营养盐溶液,设置每个箱子的初始水体总氮(TN)浓度为4.5 mg · L-1、总磷(TP)浓度为0.45 mg · L-1.把装有植株的塑料杯均匀地放入塑料箱中,每3 d测量1次水体的TN、TP并补充水量,培养4周.
添加的附植藻类来源于狐尾藻植物本身的附植藻类,将所有的狐尾藻用软毛刷刷洗叶片表面,采集并定容刷洗液,其中一部分用于藻类鉴定,一部分用于藻类的添加.向其中的6个箱子内加入每箱6 g即0.1 mg · cm-2(以Chl.a计)的附植藻类,每种处理设置3个重复.
2.2 附着藻类的鉴定与计数用软毛刷刷下测量植物叶片上的附植藻类,加入鲁哥试剂(胡鸿钧和魏印心,2006),静置48 h后计数.经测定,实验前用于狐尾藻实验的附植藻类经鉴定共有3门11属,包括蓝藻门的隐杆藻,微囊藻,色球藻,鱼腥藻,念珠藻;硅藻门的直链藻,小环藻,脆杆藻,舟形藻,桥弯藻;绿藻门的小球藻等.其中直链藻占21%,隐杆藻占19%,舟形藻占13%,小环藻占9%,具体组成如图 1所示.
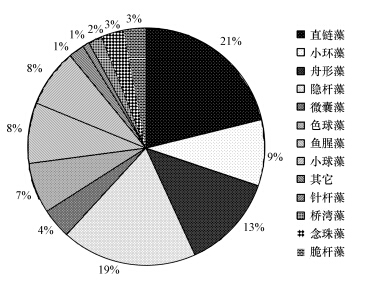 |
| 图 1 附植藻类的组成 Fig.1 Composition of the epiphyte |
在每个处理中随机取5株狐尾藻用自来水洗去底泥,冲去吸附在植株表面的杂质,再用蒸馏水冲洗3~5次.用滤纸吸干植物表面的水分后用游标卡尺分别测量植株的根长和株长.将植株放入研钵中,加入6 mL预冷的酶提取液(pH 7.8,50 mmol · L-1的磷酸缓冲液)冰浴研磨,提取液于10000 r · min-1离心20 min,收集上清液保存在5 ℃下并在48 h内进行酶活力的测定,主要包括过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)这3种抗氧化保护酶活性的测定.植物叶绿素含量的测定采用乙醇萃取分光光度计法,可溶性蛋白含量的测定采用紫外吸收法,丙二醛(MDA)含量的测定采用硫代巴比妥酸比色法(李合生,2006;陈建勋和王晓峰,2002).
2.4 数据处理利用Origin9.0对数据进行图形处理,采用EXCEL2003和SPSS19.0软件对所有数据进行统计分析.
3 结果与分析(Results and discussion) 3.1 附植藻类对狐尾藻生长的影响 3.1.1 狐尾藻生物量的变化由图 2a可知,实验前两周添加藻类处理组的根长为11 cm长于未添加藻类处理组的10 cm,但随着实验时间的延长,实验3周后未添加藻类处理组的根长长于添加藻类处理组的,差值约为1 cm.添加藻类处理组中狐尾藻的根长呈现出先上升后下降的趋势,最大值为11 cm.但是两组狐尾藻的根长无显著性差异(p>0.05).
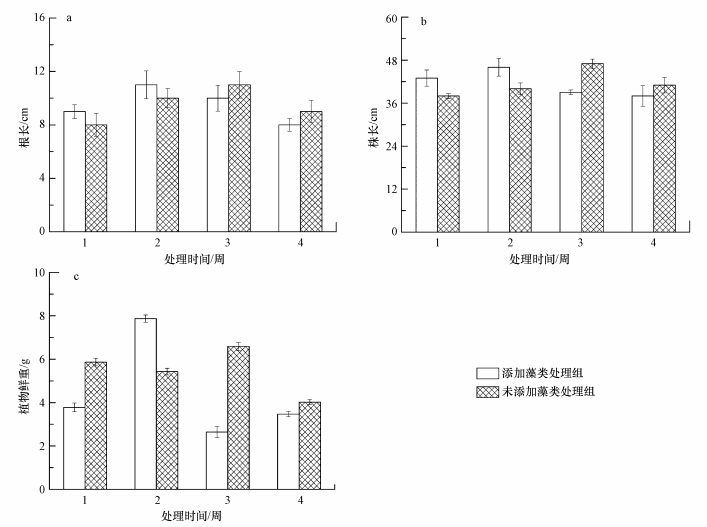 |
| 图 2 狐尾藻的根长、株长和生物量 Fig.2 Root length,plant length, and biomass of Myriophyllum Spicatum |
图 2b的变化情况与图 2a正好相反,实验前两周添加藻类处理组的株长长于未添加藻类处理组的,分别为46 cm和40 cm,但实验3周后未添加藻类处理组的株长长于添加藻类处理组的.添加藻类处理组中狐尾藻的株长呈现出先上升后下降的趋势,在实验3周时达到最大值47 cm,实验末期未添加藻类处理组的株长是添加藻类处理组的1.08倍.
由图 2c可知,除了实验两周时,添加藻类处理组中狐尾藻的生物量大于未添加藻类处理组的,其余时间均是未添加藻类处理组中狐尾藻的生物量较大.实验3周时,两个处理组的差距最大,未添加藻类处理组中狐尾藻的生物量是添加藻类处理组的2.49倍,且有显著差异(p<0.01).
3.1.2 狐尾藻蛋白质和叶绿素的变化由图 3a可知,除了实验两周外,在其余实验时间内,未添加藻类处理组的可溶性蛋白含量高于添加藻类处理组的,实验三周时未添加藻类处理组中狐尾藻的可溶性蛋白含量达到最大值12.613 mg · g-1,添加藻类处理组中狐尾藻的可溶性蛋白含量呈现出先上升后下降的趋势.实验四周前,两组狐尾藻的可溶性蛋白含量有显著差异(p<0.05).
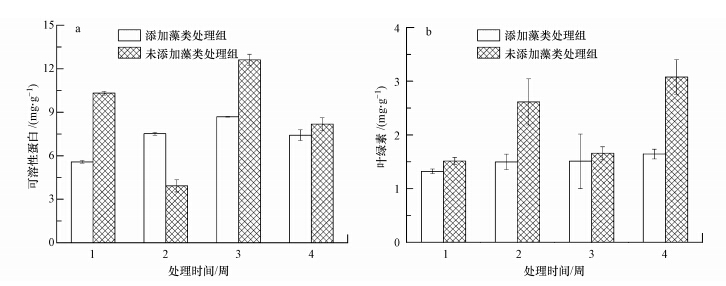 |
| 图 3 狐尾藻的蛋白质和叶绿素 Fig.3 Soluble protein content and chlorophyll content of Myriophyllum Spicatum |
由图 3b可知,无论在实验的哪个阶段,未添加藻类处理组的叶绿素含量均高于添加藻类处理组的,并且添加藻类处理组中狐尾藻的叶绿素含量基本上没有变化,实验末期未添加藻类处理组的叶绿素含量是添加藻类处理组的1.87倍,且两组有显著差异(p<0.01).
3.2 附植藻类对狐尾藻生理的影响由图 4a可知,实验1周时,添加藻类处理组中狐尾藻的SOD活性是未添加藻类处理组的1.99倍,但是实验两周时添加藻类处理组的SOD活性迅速下降,实验末期达到了最小值14.53 U · mg-1,与实验前相比减少了83.73%.而未添加藻类处理组中狐尾藻的SOD活性在实验3周前一直处于下降的趋势,实验末期处理组中SOD活性与实验前相比减少了49.33%.实验1周时,两组中狐尾藻的SOD活性有显著差异(p<0.01).
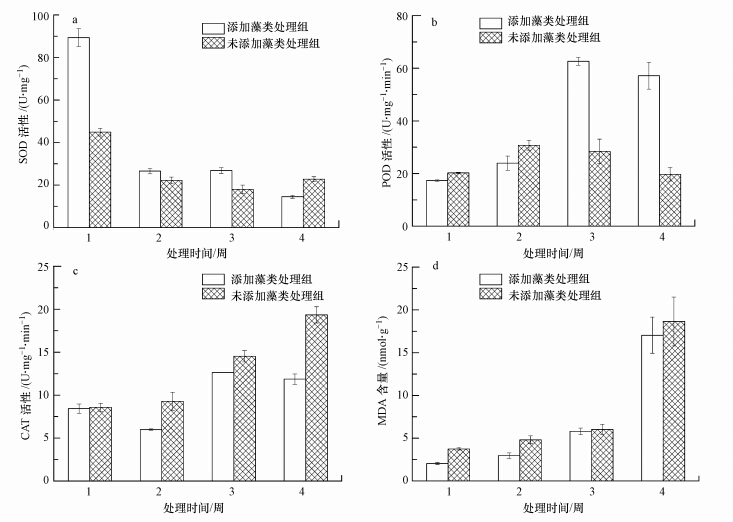 |
| 图 4 狐尾藻的SOD、POD、CAT活性和MDA含量的变化曲线 Fig.4 Change of SOD,POD,CAT and MDA content |
由图 4b可知,实验2周前未添加藻类处理组中狐尾藻的POD活性略高于添加藻类处理组的,而实验3周时,添加藻类处理组的POD活性达到最大值62.6 U · mg-1 · min-1,是未添加藻类处理组的2.2倍.实验末期两个处理组中的POD活性都略有下降,添加藻类处理组的POD活性是未添加藻类处理组的2.9倍,且两组有显著差异(p<0.01).
由图 4c可知,未添加藻类处理组中狐尾藻的CAT活性均高于添加藻类处理组的,且未添加藻类处理组的CAT活性随着时间的延长不断增加,而添加藻类处理组中的CAT活性呈现下降-上升-下降的趋势.实验末期,未添加藻类处理组的CAT活性是添加藻类处理组的1.63倍,且两组有显著差异(p<0.05).
由图 4d可知,实验3周前,两个处理组中的MDA含量变化不显著,在实验末期,两个处理组中的MDA含量显著上升,分别是实验初期的9.14倍和4.54倍.整个实验过程中,未添加藻类处理组中狐尾藻的MDA含量均高于添加藻类处理组的,但是两组无显著性差异(p>0.05).
3.3 附植藻类生物量的变化由图 5可知,在整个实验阶段,添加藻类处理组中附植藻类的生物量呈现出先下降后上升的趋势,在实验两周时,附植藻类的生物达到了最小值0.1921 μg · g-1,与其它时间段内的附植藻类生物量有显著的差异(p<0.01),出现这一现象的原因可能是实验初期附植藻类对水体环境还未完全适应,导致其生物量的下降,其余时间附植藻类的生物量都在3 μg · g-1左右.
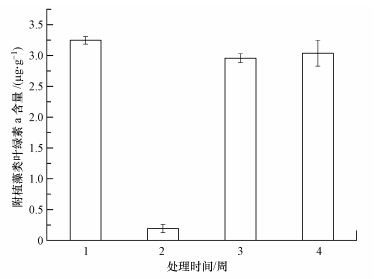 |
| 图 5 附植藻类的生物量 Fig.5 Biomass of epiphyte |
有研究表明,沉水植物的衰亡是藻类过量生长的结果,其中附植藻类的大量生长对沉水植物的影响较大(宋玉芝等, 2007,2010;Barko and Smart, 1983).一部分学者认为沉水植物与附植藻类是互利共生的关系,附植藻类能够通过繁衍抑制浮游植物的生长,降低水中的营养盐浓度,为沉水植物提供较好的生活环境.另一部分则认为沉水植物与附植藻类是竞争关系,尤其是沉水植物与附植藻类对水中营养盐、光等的竞争,附植藻类阻碍宿主植物对水中营养盐的吸收利用,尤其是对无机碳的吸收利用(Jones et al., 2002),从而影响沉水植物的光合作用,抑制其生长发育.本实验中,添加附植藻类的处理组株长和根长呈现出先增加后减少的变化规律,这与附植藻类生物量的变化情况刚好相反,并且实验两周后添加藻类处理组中狐尾藻的生物量明显减少,而同一时间段附植藻类的生物量明显上升,说明附植藻类的大量繁殖会对狐尾藻的生长产生一定的限制作用.宋玉芝等(2007)对伊乐藻的研究表明,随着附着藻类的生物量的增加,伊乐藻的生物量、叶绿素含量和光合作用速率均显著下降.本实验过程中,添加藻类处理组中的蛋白质含量先上升后下降,未添加藻类处理组中狐尾藻的叶绿素含量显著高于添加藻类处理组的,且添加藻类处理组中的叶绿素含量没有什么变化,说明在受试水体中,狐尾藻的生长受到抑制.因此附植藻类的大量繁殖会影响狐尾藻生物量的合成,降低狐尾藻的叶绿素含量.
当植物处在逆境中时,其体内会产生大量的活性氧自由基,而活性氧自由基会破坏植物的蛋白质、核酸等,导致系统功能紊乱,严重时会导致植物细胞死亡.为了维持植物正常的生长发育,植物会启动抗氧化保护酶系统对活性氧自由基进行清除(Tracy et al.,2003;De Groot,1971;Anderson and Kalff, 1988;何学利,2010).在抗氧化活性酶系统中,首先发挥作用的是超氧化物歧化酶(SOD),在植物受到胁迫时,其活性会发生改变(田敏等,2005).过氧化物酶(POD)是活性较高的适应性酶,它能配合超氧化物歧化酶完成对自由基的消除(张凤琴等,2006).MDA是常用的膜脂过氧化指标,是植物器官衰老或在逆境条件下发生膜脂过氧化的产物之一(陈开宁等,2006;Gulati and Van Donk,2002;Lauridsen et al.,2003).过氧化氢酶(CAT)是生物氧化过程中一系列抗氧化酶的终端,能够有效清除植物体内多余的 H2O2,保护细胞膜结构(黄玉山等,1997).实验结果表明,添加附植藻类处理组的POD和CAT酶活性在实验后期均显著高于无附植藻类的处理组,且在处理3周达到最大值,这应该与同一时期附植藻类的大量繁殖有关,说明附植藻类的大量繁殖破坏了狐尾藻体内的自由基代谢平衡,造成细胞膜受损,影响了狐尾藻正常的光合和代谢作用,导致植物衰败显著.无论附植藻类的生物量如何变化,SOD活性随着时间的增加都呈现下降的趋势,有研究表明SOD活性在短时间内对环境因子有较强的敏感性,但是其活性会随着叶片的衰老以及实验的延长而下降(许秋瑾等,2007),这与本文的实验结果一致,实验末期添加藻类处理组中的狐尾藻衰败明显.实验末期,两个处理组中,狐尾藻的MDA含量显著上升,说明狐尾藻的细胞膜受到一定的损害,且添加藻类处理组中狐尾藻细胞膜收到的损害较大.因此,附植藻类的大量繁殖使狐尾藻细胞膜损害严重,影响了抗氧化保护酶系统,对狐尾藻的正常生长产生了不利影响,最终导致狐尾藻衰败显著.
在实验前期添加藻类处理组中狐尾藻的MDA含量的变化不显著,其根长、总长、生物量、可溶性蛋白和叶绿素含量均有上升,且这一时间段内附植藻类的生物量显著下降,实验后期,随着附植藻类的大量繁殖,狐尾藻的说明附植藻类的根长、总长、生物量、可溶性蛋白含量均有所下降,MDA含量显著上升,出现这种现象的原因可能是在富营养化的水体中,水中的营养盐等给附植藻类提供了一个良好的生存环境,从而促进了附植藻类的大量繁殖.但同时,沉水植物也需要吸收水体中的营养盐供其自身繁殖,而附植藻类的大量繁殖导致沉水植物营养物质吸收不足,影响了植物正常的光合作用,加剧了植物细胞的膜脂过氧化反应,导致植物生长不理想,甚至出现衰败现象,说明附植藻类的大量繁殖是沉水植物衰败的主要原因之一.
1)附植藻类的大量繁殖会影响狐尾藻生物量的合成,降低狐尾藻的叶绿素含量,但是对狐尾藻根生长的影响较小.
2)附植藻类的大量繁殖使狐尾藻细胞膜损害严重,影响了抗氧化保护酶系统,最终导致狐尾藻衰败显著.
3)附植藻类的大量繁殖是沉水植物衰败的主要原因之一.
| [1] | Ande rson M R, Kalff J. 1988. Submerged aquatic macrophyte biomass in relation to sediment characteristics in ten temperate lakes [J]. Freshwater Biology, 19(1): 115-121 |
| [2] | Barko J W, Smart R M. 1983. Effects of organic matter additions to sediment on the growth of aquatic plants [J]. Journal of Ecology, 71(1): 161-175 |
| [3] | 边归国, 赵卫东, 来达. 2012. 沉水植物化感作用抑制藻类生长的研究与应用[J]. 北方环境, 24(1): 59-64 |
| [4] | Brix H. 1997. Do macrophytes play a role in constructed treatment wetlands? [J]. Water Science and Technology, 35(5): 11-17 |
| [5] | Burkholder J M, Wetzel R G. 1990. Epiphytic alkaline phosphatase on natural and artificial plants in an oligotrophic lake: Re-evaluation of the role of macrophytes as a phosphorus source for epiphytes [J]. Limnology and Oceanography, 35(3): 736-747 |
| [6] | 陈建勋, 王晓峰. 2006. 植物生理学实验指导 (第2版)[M]. 广州: 华南理工大学出版社. 119-122 |
| [7] | 陈开宁, 陈小峰, 陈伟民, 等. 2006. 不同基质对四种沉水植物生长的影响[J]. 应用生态学报, 17(8): 1511-1516 |
| [8] | De Groot A J. 1971. Contents and behavior of mercury as compared with other heavy metals in sediments from the rivers, Rhine and Ems [J]. Geologie en Mijnbouw, 50: 393-398 |
| [9] | Feldmann T, Nõges P. 2007. Factors controlling macrophyte distribution in large shallow Lake Vrtsjärv[J]. Aquatic Botany, 87(1): 15-21 |
| [10] | 伏彩中, 肖瑜, 高士祥. 2006. 模拟水生生态系统中沉水植物对水体营养物质消减的影响[J]. 环境污染与防治, 28(10): 753-756 |
| [11] | Gulati S D, Van Donk E. 2002. Lakes in the Netherlands, their origin, eutrophication and restoration: state-of-the-art review[J]. Hydrobiologia, 478(1/3): 73-106 |
| [12] | 何学利. 2010. 植物体内的保护酶系统[J]. 现代农业科技, (10): 37-38 |
| [13] | 胡鸿钧, 魏印心. 2006. 中国淡水藻类-系统、分类及生态[M]. 北京: 科学出版社 |
| [14] | Huang J, Wang S H, Zhong Q S, et al. 2009. Influence of plant eco-physiology characteristics on nitrogen removal effect in constructed wetlands[J]. Ecology and Environmental Sciences, 18(2): 471-475 |
| [15] | 黄玉山, 罗广华, 关棨文. 1997. 镉诱导植物的自由基过氧化损伤[J]. 植物学报, 39(6): 522-526 |
| [16] | Irfanullah H M, Moss B. 2004. Factors influencing the return of submerged plants to a clear-water, shallow temperate lake[J]. Aquatic Botany, 80(3): 177-191 |
| [17] | Jones J I, Young J O, Eaton J W, et al. 2002. The influence of nutrient loading, dissolved inorganic carbon and higher trophic levels on the interaction between submerged plants and periphyton[J]. Journal of Ecology, 90(1): 12-24 |
| [18] | Laugaste R, Lessok K. 2004. Planktonic algae and epiphyton of the littoral in lake Peipsi, Estonia[J]. Limnologica-Ecology and Management of Inland Waters, 34(1/2): 90-97 |
| [19] | Lauridsen T L, Jensen J P, Jeppesen E, et al. 2003. Response of submerged macrophytes in Danish lakes to nutrient loading reductions and biomanipulation[J]. Hydrobiologia, 506-509(1/3): 641-649 |
| [20] | 李合生. 2006. 植物生理生化实验原理和技术 (第2版)[M]. 北京: 高等教育出版社. 164-261 |
| [21] | 刘弋潞, 何宗健. 2006. 水生植物净化富营养化水质的机理探讨和研究进展[J]. 江西化工, (1): 27-30 |
| [22] | 宋福, 陈艳卿, 乔建荣, 等. 1997. 常见沉水植物对草海水体(含底泥)总氮去除速率的研究[J]. 环境科学研究, 10(4): 47-50 |
| [23] | 宋玉芝, 秦伯强, 高光. 2007. 附着生物对太湖沉水植物影响的初步研究[J]. 应用生态学报, 8(4): 928-932 |
| [24] | 宋玉芝, 黄瑾, 秦伯强. 2010. 附着生物对太湖常见的两种沉水植物快速光曲线的影响[J]. 湖泊科学, 22(6): 935-940 |
| [25] | 孙作登, 宋祥甫, 付子轼, 等. 2012. 不同沉水植物对水质净化效能的研究[J]. 上海农业学报, 28(2): 30-35 |
| [26] | 田敏, 饶龙兵, 李纪元. 2005. 植物细胞中的活性氧及其生理作用[J]. 植物生理学通讯, 41(2): 235-241 |
| [27] | Tracy M, Montante J M, Allenson T E, et al. 2003. Long-term responses of aquatic macrophyte diversity and community structure to variation in nitrogen loading [J]. Aquatic Botany, 77(1): 43-52 |
| [28] | Vander Zanden M J, Vadeboncoeur Y. 2002. Fishes as integrators of benthic and pelagic food webs in lakes[J]. Ecology, 83(8): 2152-2161 |
| [29] | 许秋瑾, 金相灿, 王兴民, 等. 2007. 不同浓度铵态氮对镉胁迫轮叶黑藻生长及抗氧化酶系统的影响[J]. 应用生态学报, 18(2): 420-424 |
| [30] | 张凤琴, 王友绍, 董俊德, 等. 2006. 重金属污水对木榄幼苗几种保护酶及膜脂质过氧化作用的影响[J]. 热带海洋学报, 25(2): 66-70 |
| [31] | 张强, 刘正文. 2010. 附着藻类对湖水磷浓度的影响[J]. 环境科学与技术, 33(9): 31-34 |
 2015, Vol. 35
2015, Vol. 35


