伴随水资源的日益短缺,再生水的回用显得十分必要,但再生水回用一直存在病原菌的污染问题,尤其是一些高致病性病原菌流入环境,会严重威胁公共健康与生态安全 (Jebri et al., 2012;Giangaspero et al., 2009;Shanahan et al., 2010).近年来,水体由于受病原菌污染,时常引发一些传染病的爆发(Shannon et al., 2007;Schaechter,2009;张崇淼等,2012;García et al., 2011;Anastasi et al., 2012).据估计,单由水媒型传染病所造成的死亡人数约占全世界总死亡人数的4%(Prüss et al., 2002).由此可见,增强对污水处理各环节高致病性病原菌的调查研究,查清其变化趋势,对控制致病菌的环境排放,保障环境安全有着十分重要的现实意义.水体中传统的病原菌检测常以总大肠杆菌、粪大肠杆菌等用作水体病原菌污染评估(Groisman,2001;Zhang et al., 2007;Piterina et al., 2010)及病原菌去除效率评价的指示微生物,然而,这些指示菌并不能有效地代表全部的病原菌(Wéry et al., 2008).这是因为大肠杆菌与其它病原菌来源不尽相同,存在各自对污水处理过程的敏感性不同(Sinclair et al., 2009),生存时间与生存环境差异较大(Pote et al., 2009),相互之间相关性较低(Savichtcheva et al., 2006;Kaper et al., 2004),以及对相关因子影响大肠杆菌检测结果的作用方式知之甚少(Field et al., 2003)等问题,因此,仅仅检测大肠杆菌并不能反映水体中病原菌存在的真实状况.
过去,由于检测技术受限,针对其它一些高危性致病菌的直接调查很难进行.近年来,随着分子生物学技术的进步,这一问题基本上已迎刃而解.伴随着中水回用的日益普及,对污水处理系统中高致病性病原菌开展系统调查与去除效率的研究已是迫在眉睫.2009年,北京市再生水利用量高达65亿m3,已超过本地地表水供水量,再生水已成为北京市水资源的重要组成部分(王强,2010),因此,对污水处理系统开展病原菌分布和去除效率研究具有积极的现实意义.
本文针对北京市4种典型的污水处理系统(包括缺氧-好氧(A/O)工艺、厌氧-缺氧-好氧法(A2/O)工艺、氧化沟(Oxidation Ditch)工艺及序列间歇式活性污泥法(SBR)工艺),选取大肠杆菌、沙门氏菌和嗜肺军团菌为研究对象,大肠杆菌、沙门氏菌为肠道病原菌的代表菌群,而军团菌为天然水体中普遍存在的病原菌,选取这3类菌群进行研究具有一定的代表性;另外,工艺选型具有一定的普遍性.鉴于定量PCR技术检测快速且准确可靠(Viau et al., 2009;Wong et al., 2010),本研究采用该技术同步追踪北京市4个不同污水处理系统中各病原菌的沿程分布变化及四季的数量演变,并比较各系统病原菌的去除效果,研究结果将有助于减少病原菌的环境排放,为保障生态安全提供参考和数据支持.
2 材料与方法(Materials and methods) 2.1 样品采集污水样品分别采集于北京市GBD污水处理厂(Anaerobic/Aerobic(A/O)工艺,简称G-AO)、QH污水处理厂(Anoxic-Anaerobic-Aerobic(A2/O)工艺,简称Q-A2O)、JXQ污水处理厂(Oxidation Ditch工艺,简称J-OD)和WJC污水处理厂(Sequencing Batch Reactor(SBR)工艺,简称W-SBR).以上4个污水处理厂工艺概况如表 1所示.采样时间为2010年7月—2011年5月,考虑到夏末秋初是流行病的高发季节,故在2010年7、8、9月各采样1次,而在秋季(2010年11月)、冬季(2011年2月)、春季(2011年5月)各采样1次.每次所取水样充分混合后保存于样品冷藏箱,并在2 h内带回实验室.
| 表 1 北京市4个污水处理厂的基本概况 Table 1 Basic information of four wastewater treatment plants in Beijing |
进水样品和初沉池出水样各100 mL,各工艺中段样品10 mL,剩余污泥样品5 mL,二沉池出水500 mL,且各采样点进行等体积平行取样.水样处理采取抽滤的方式,将样品通过0.22 μm的滤膜,微生物被截留在滤膜上,将滤膜剪碎,放入DNA提取试剂盒配套的管子中.按照FASTprep系列试剂盒(MP,美国)的说明书进行逐步提取(Nazarian et al., 2008).且每个平行样品提取时均做一重复,提取后将每个平行样品的两份DNA溶液进行混合,以减少单一水样采集和DNA提取时造成的误差.最后采用Nanodrop微量分光光度计(Thermo,美国)进行DNA的含量测定,并对所提取基因组DNA分装备份保存于-20 ℃条件下,以用作后续PCR及定量PCR分子生物学分析中的DNA样品.
2.2.2 PCR引物特异性及反应体系所用引物如表 2所示,其中,对于大肠杆菌检测引物的选用主要参照文献(Tsai et al., 1993;Bej et al., 1991;Maheux et al., 2009),研究证实,uidA基因具有更好的特异性和灵敏性;沙门氏菌检测引物的选用主要参照Hadjinicolaou等(2009)和Rahn等(1992)基于invA基因设计引物;而军团菌特异性引物的选用,则主要依据文献中(Miyamoto et al., 1997;heehan et al., 2005;Wullings et al., 2006;Carvalho et al., 2007)的研究应用.PCR反应体系(50 μL)为:5 μL PCR 缓冲液,4 μL 0.25 mmol · L-1 dNTPs,1μL 10 mmol · L-1正向引物,1 μL 10 mmol · L-1反向引物,0.25 μL 20 mg · L-1 BSA,0.25 μL 1.25 U Taq DNA聚合酶,2 μL水样 DNA(约10 ng),灭菌去离子水36.5 μL.反应条件为:95 ℃预变性5 min;95 ℃变性1min,退火温度(表 2)下退火1 min,72 ℃延伸1.5 min,整个过程进行35个循环;最后 72 ℃下延伸10 min.通过1%的琼脂糖凝胶电泳检测PCR产物.
| 表 2 PCR扩增中采用的引物 Table 2 List of primers used in PCR |
利用Fermentas DNA纯化试剂盒(MBI Fermentas,加拿大)对上述PCR产物进行纯化.连接到pGEM-T Easy 载体上(Promega,荷兰),利用化学方法转化到DH5-α感受态细胞中(Takara,日本),在37 ℃、170 r · min-1条件下培养1 h.接着将转化混合液涂布于含有氨卡青霉素(50 μg · mL-1)、X-Gal和IPTG的培养皿中,在37 ℃下培养15 h.通过蓝白斑筛选阳性克隆体,采用M13F(5′-GTAAAACGACGGCCA G-3′)和M13R(5′-CAGGAAACAGCTATGAC-3′)对阳性克隆体中的目标基因片段进行特异性扩增.通过琼脂糖凝胶电泳检测M13PCR产物,采用ABI3730基因测序仪进行测序分析(Attard et al., 2010).将测序结果提交到NCBI,进行BLAST比对.将插入正确的菌液,利用TIANGEN质粒提取试剂盒(TIANGEN,中国),取3 mL菌液进行质粒提取,由nano-drop仪器测定该质粒浓度,其质量浓度为C1(ng · μL-1),即质粒DNA在单位微升溶液中的质量,并可由公式(1)换算成单位为copies · μL-1的质粒浓度C2,从而以该质粒作为定量 PCR 的标准品.
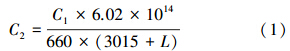
以上述已知质粒浓度的标准品为标准模板,进行10倍梯度稀释.以水样中各细菌DNA为待测模板,采用与普通PCR相同的引物(表 2).采用实时荧光定量PCR,药品采用Taq SYBR GREEN 1(Takara,日本),其反应总体系为25 μL:12.5 μL的SYBR Green 1染料(2X),0.5 μL 100 μmol · L-1正向引物,0.5 μL 100 μmol · L-1反向引物,0.5 μL的ROX染料(50X),0.5 μL的BSA,2 μL水样DNA(约10 ng),灭菌去离子水8.5 μL.将定量PCR混合液放入8连管(ABI美国)中,用超净管盖封闭,将反应管放入定量PCR仪(ABI7300,美国)中进行分析.其中,标准样品和待测样品均为同一批次内进行平行测定3次,并计算3次CT值间的变异系数,以验证结果的精确度.最终结合SDS system software 软件分析,得到动力学曲线及标准曲线,进而计算出单位毫升待测水样溶液中相应细菌基因的拷贝数,为绝对定量,单位为copies · mL-1水样.对3种菌的标准曲线进行线性回归分析得到标准曲线方程分别为:①大肠杆菌标准曲线方程:CT = -3.3511X0 + 40.073,R2 = 0.9958;②沙门氏菌标准 曲线方程:CT = -3.1902X0 + 35.142,R2= 0.9902;③军团菌标准曲线方程:CT = -3.1674X0 + 38.22,R2 = 0.9958;其中,X0为标准模板浓度的对数.
3种菌的标准曲线可决系数R2均大于0.990,且对同批次3个平行样品间CT值的变异系数分析发现,大肠杆菌、沙门氏菌和军团菌的变异系数均较小,分别≤1.541%、2.326%和2.115%,说明所建立的标准曲线具有较高的精确度和可信度.
3 结果与分析(Results and analysis) 3.1 不同污水处理厂四季中大肠杆菌调查分析利用定量PCR技术,连续对Q-A2/O、J-OD、W-SBR和G-A/O 4个污水处理厂中大肠杆菌浓度变化进行为期1年的调查,结果如图 1所示.整体而言,4个季节中大肠杆菌在4个污水处理厂各水处理阶段都可检出.从大肠杆菌进水浓度的季节性分布来看,夏季进水中大肠杆菌浓度最高,为107~108 copies · mL-1,明显高于其他3个季节1个数量级左右,这也与Molleda等(2008)和Thurston等(2001)针对大肠杆菌的季节变化研究结果基本一致;大肠杆菌在冬季进水中的浓度普遍偏低,在106 copies · mL-1左右.从4个污水处理厂大肠杆菌出水浓度来看,也表现出明显的季节性差异,尤以夏季出水浓度最高,为105 copies · mL-1左右,春、秋季次之,而基本以冬季为最低,主要在103~104 copies · mL-1之间.尽管各污水处理厂中大肠杆菌出水浓度依旧较高,但相比于进水浓度107~108 copies · mL-1,已大致减少了3个数量级以上,可见4个污水处理厂对大肠杆菌的去除均表现出了良好的效果,其中以G-A/O去除效果最好,四季平均去除效率达99.88%;其次为W-SBR和J-OD,四季平均去除效率分别为99.73%和98.45%;尽管Q-A2/O相较于其他三者其处理效果有一定波动,四季中去除效率最低也可达90%,而四季平均去除率为96.45%,可见其去除效果已属良好.但从各厂污泥样品中大肠杆菌浓度来看,主要集中在105 copies · mL-1左右,最高甚至达到106 copies · mL-1以上,相较于其它污水处理工艺段程度均有所回升,且高于出水浓度近1个数量级.此外,大肠杆菌在Q-A2/O的沉砂池、J-OD的沉砂池及G-A/O的初沉池中的分布浓度相较于以上3个工艺进水中的浓度而言,并未表现出显著性的降低.
 |
| 图 1 四个污水处理厂四季中大肠杆菌浓度的变化 Fig.1 Quantity changes of E. coli in the four wastewater treatment plants and seasons |
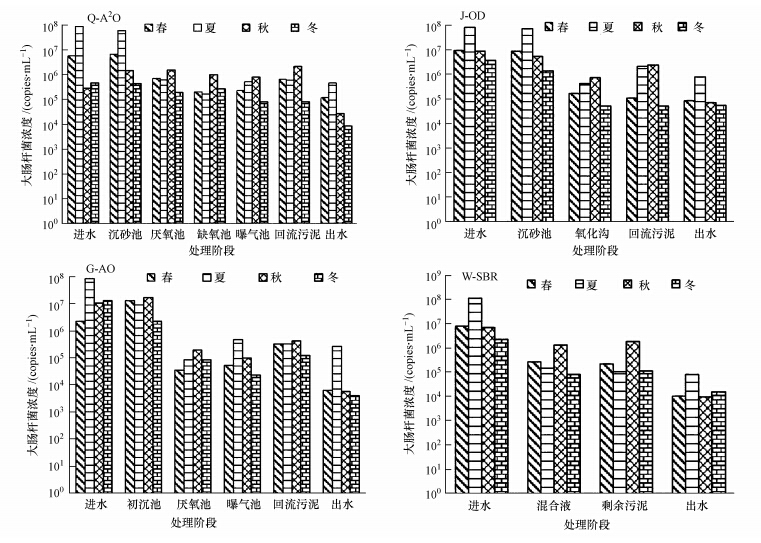
军团菌在Q-A2/O、J-OD、G-A/O和W-SBR 4个污水处理厂四季中的含量变化如图 2所示.军团菌在4个污水处理厂中的含量变化相较于大肠杆菌的分布变化来说,二者差异显著.尽管军团菌在各污水处理阶段均可检出,但就进水浓度季节性变化来说,4个污水处理厂的四季进水浓度基本接近,为104~105 copies · mL-1,并未显示出明显的季节性变化.从各污水处理厂对军团菌处理效果来看,军团菌数量减少并不明显,出水浓度仍基本维持在104 copies · mL-1左右,与进水浓度几乎持平,甚至部分水厂出现二沉池出水浓度反而升高的现象.此外,从军团菌在各污水处理厂各工艺段中的分布情况来看,也有差异.其中,在污水进入Q-A2/O、W-SBR与G-A/O的曝气阶段及回流污泥和剩余污泥阶段后,军团菌浓度出现了不同程度的升高,其中,以W-SBR升高幅度最为明显,其曝气后污泥中军团菌浓度相比于进水浓度升高约2个数量级,在106 copies · mL-1以上,出水中浓度下降亦不明显;而军团菌在J-OD中的浓度变化表现出了与前三者明显的差异,其氧化沟及回流污泥中军团菌数量相比于进水,锐减数量超2个数量级,浓度不到102 copies · mL-1的1/2,而军团菌在出水中却表现出了激增,排放浓度超过103 copies · mL-1,甚至达到104 copies · mL-1.就工艺类型对军团菌去除效果来看,以G-A/O去除效果最好,四季平均去除效率达93.48%;其次为J-OD,可达90%,而Q-A2/O只表现出了一定的去除效果,四季平均去除率为41.63%,且主要在秋、冬两季有去除效果,而W-SBR工艺出水中浓度反而高于进水浓度.
 |
| 图 2 四个污水处理厂四季中军团菌含量的变化 Fig.2 Quantity changes of Legionella in the four Wastewater Treatment Plants and seasons |
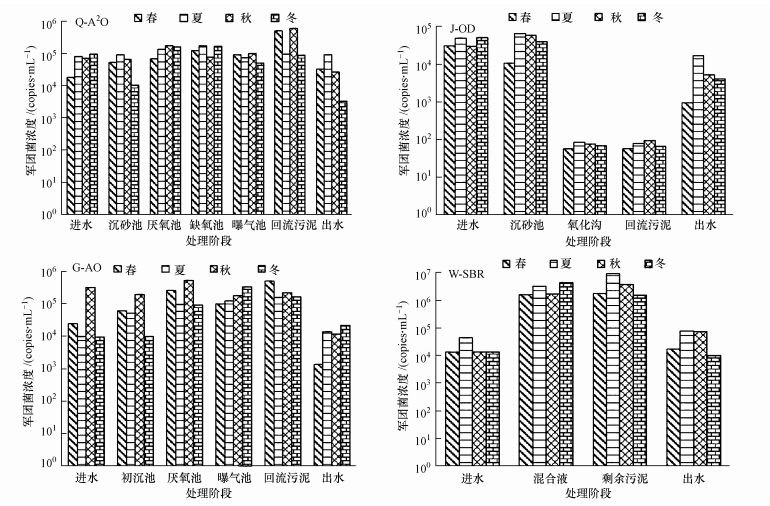
图 3为沙门氏菌在4个污水处理厂四季中的分布变化调查结果.沙门氏菌在4个污水处理厂四季中的分布变化与大肠杆菌、军团菌也大不相同,其进水浓度较低,基本在102~103 copies · mL-1左右,而在J-OD和G-A/O的春季进水中均未检出,除了在冬季进、出水中保持了相对较高含量外,并未表现出明显的季节性变化规律;就去除效果来看,经各污水处理厂处理后,出水中沙门氏菌浓度有一定的削减,但并不明显,其中以G-A2/O和Q-A/O去除效果相对较好,J-OD、W-SBR较弱;相对其它季节而言,冬季进水中沙门氏菌的浓度相对较高,4个污水处理系统对其去除效果并不理想,出水中浓度降低并不显著,可见冬季较低的温度对沙门氏菌影响不大.另一方面,从沙门氏菌在各处理工艺沿程分布情况来看,除其在Q-A2/O、J-OD的沉砂池及G-A/O的初沉池中均可检出外,在此4个工艺处理的其他阶段均未检出,尤其在剩余污泥样品中也未有沙门氏菌检出,这与魏梦楠(2010)针对污水再生水检测研究的结果基本一致.
 |
| 图 3 四个污水处理厂及四季中沙门氏菌含量的变化 Fig.3 Quantity changes of Salmonellasppin the four Wastewater Treatment Plants and seasons |
我国最新颁布的城镇污水处理厂污染物排放标准(GBl8918-2002)中仅对粪大肠杆菌(其中大肠杆菌属于粪大肠菌群中的一种)数量做出明确规定,但未涉及其它高致病菌的限定.因此,对于污水处理系统中其它高致病菌的分布开展调查研究显得十分必要.
从本研究针对北京市Q-A2/O、J-OD、G-A/O和W-SBR 4个污水处理厂为期1年的调查结果来看,大肠杆菌在4种系统中的浓度变化表现出明显的季节性规律,其在夏季的进水和出水中浓度为最高;沙门氏菌仅在冬季进、出水中保持了相对较高含量;而军团菌并未表现出明显的季节性规律.就大肠杆菌、军团菌和沙门氏菌在污水处理系统中含量差异而言,军团菌在4种系统进水中的浓度在104~105 copies · mL-1之间,较大肠杆菌进水浓度低约2个数量级,而其在出水中的浓度却与大肠杆菌出水中浓度较为相近,主要集中在104 copies · mL-1左右;沙门氏菌在4种系统进水中的浓度低于103 copies · mL-1,不及进水中大肠杆菌浓度的1/1000,且沙门氏菌主要在冬季进、出水中有所检出,而在水处理的主要工艺段并未被检出.可见,所调查的北京市4个污水处理厂污水中的病原菌主要还是以大肠杆菌为主,军团菌次之,沙门氏菌最少.此外,研究结果也从侧面反映出大肠杆菌、军团菌和沙门氏菌在4种系统中的分布并未表现出直接的相关性,这与早期Rahman等(1996)有关大肠杆菌、沙门氏菌及其他病原菌的水域传染病相关性研究的结果一致.
从季节变化对病原菌去除效果的影响来看,4种系统在冬季对3种病原菌的去除率均较低;而在夏季,除军团菌外,4种系统对于大肠杆菌和沙门氏菌的去除效果最好,可见季节性变化对于病原菌的去除效果具有一定的影响,这一结果与印度污染控制委员会2007年所发布的水质报道(Bhawan,2008)结果基本一致.然而,在夏季,虽然病原菌的去除率高,但排放的病原菌浓度依然保持较高水平,尤其军团菌在夏季的排放浓度较其他季节高出很多,这也进一步印证了为什么往往在夏季水媒型传染病暴发风险较高.在冬季,沙门氏菌在4种系统中含量相对较高,这与Stampi等(2000)研究发现,沙门氏菌在温度较低和湿度较高的10月—次年3月期间含量更高的结果基本一致,其原因是沙门氏菌在温度较低和湿度较高的冬季表现出更强的活性,从而更容易在与其他菌群竞争中获得优势;在夏季,温度较高,有利于其它细菌繁殖生长,含量较低的沙门氏菌在与其它菌群的竞争中处于劣势,较难存活.此外,Plachá等(2001)也研究发现,相比于温度较高的夏季,沙门氏菌在温度更低的冬季活性更高,而且发现在夏季和冬季相同pH变化幅度下,夏季pH的波动更容易导致沙门氏菌的死亡.
本研究发现,大肠杆菌和军团菌在剩余污泥样品中的分布较出水中更高,这与Gaspard 等(1997)对法国89个污水处理厂污泥中病原物分布调查发现的结果一致.以上结果也与多数研究(Déportes et al.,1995; Sahlstrm et al.,2003; Lewis et al., 2002)一致,证实了微生物易于被活性污泥絮体吸附而沉积,因此,更多研究者更倾向将活性污泥看作微生物生长繁殖的温床.此外,军团菌在除G-A/O外的其他3种系统活性污泥中浓度均高于进水中浓度,可见军团菌对活性污泥工艺有更好的适应性.然而,沙门氏菌在剩余污泥样品中均未检出,而部分出水中出现沙门氏菌浓度上升的现象.究其原因,可能一方面是由于在污水处理中,沙门氏菌主要分布在水相,很少进入活性污泥絮体之中;或者又从污泥絮体中分离出来,如Hendricks(1971)研究发现,近90%沙门氏菌可从人工湿地的基质和沉积物中分离出来,重新进入水体,进而在部分出水中出现浓度升高现象.另一方面,在活性污泥中,占优势的多是本土微生物,而沙门氏菌来源于肠道,数量本就不多,进入曝气池后,沙门氏菌在与其他数量巨大的细菌竞争中往往处于劣势,进而走向死亡;再者,由于原生动物的捕食作用(Curds,1982; Pillai et al.,1942),使得沙门氏菌数量更低.
此外,4种工艺对大肠杆菌、军团菌和沙门氏菌3种菌的去除效果也各不同.相较于其他3种工艺,G-A/O工艺对大肠杆菌和军团菌的处理效果较好,其对大肠杆菌和军团菌的四季平均去除效率最高,分别达到99.88%和93.48%.然而,即便4个污水处理厂对大肠杆菌的去除效率可达90%以上,大肠杆菌在出水中浓度依然较高,维持在104 copies · mL-1左右,甚至高达105 copies · mL-1,可见二沉池出水中较高浓度的大肠杆菌对生态安全具有不可忽视的潜在危险.在Q-A2/O、W-SBR与G-A/O污水处理过程中,存在军团菌浓度升高的现象,尤其在W-SBR处理工艺中,军团菌浓度远高于进水浓度.据有关军团菌生长条件的研究(邵祝军,2005)发现,大量的污泥浓度、原生虫类和有机物含量均有助于军团菌的生长.而W-SBR其污水来源100%为生活污水,且系统中污泥浓度较高,有机物含量丰富,军团菌本身就具有很强的环境适应性,遇到人工创造的良好环境条件(曝气、有机质等)时,军团菌即得到大量繁殖和增生,从而表现出浓度反升的现象.而在J-OD氧化沟处理过程中,污泥中的军团菌数量较少,其原因可能是由于氧化沟污水处理工艺属延时曝气工艺,污泥龄较长,污泥稳定化程度高,其不利的环境条件和微生物竞争压力导致军团菌活性降低,致使其数量减少;然而在出水中军团菌浓度又出现升高,可能一方面是因为军团菌具有较强生命力,另一方面,Kuchta等(1985)研究发现,军团菌由于没有相应的噬菌体,且与许多细菌和原虫存在共生关系,尤其是阿米巴等原生动物不仅可源源不断地为军团菌提供所需的营养,而且阿米巴可分泌出厚的囊壁包裹军团菌,从而可依附于生物膜或寄宿于原虫这些屏障之中.因而,军团菌可相应地减轻延时曝气工艺对其所造成的不利影响,待军团菌遇见合适的繁殖条件时,将再度“苏醒”并大量增殖,即病原菌的重新生长现象(Erdal et al., 2003;Iranpour et al., 2002).正是因为军团菌对水处理工艺乃至消毒工艺所表现出的超强耐受性,若处理不当,军团菌可通过出水再次污染地表水,并形成气溶胶扩散到环境中,进而对公共健康和生态环境造成潜在威胁(Baertsch et al., 2007).另外,需要注意的是,由于细菌死亡后DNA仍可存留一定时间,利用DNA进行定量PCR定量的方法也可能会高估病原菌含量.
综上所述,大肠杆菌和军团菌在污水处理厂的剩余污泥和出水中仍具有较大的生态和健康风险,应加强二沉池出水或中水回用的消毒强度.如果条件允许,应该适当布点增设病原菌的常规检测,尤其是军团菌在夏季出水中含量过高,宜在夏季加强对军团菌的监测预防.此外,沙门氏菌在冬季出水中浓度也相对较高,也应该引起足够重视.同时,更应加快对病原菌低成本、高效防治技术的研发,以减少病原菌的环境排放风险.
5 结论(Conclusions)1)3种病原菌在北京市4个污水处理厂进水中的分布主要以大肠杆菌(106~108 copies · mL-1)为主,军团菌(104~105 copies · mL-1)次之,而沙门氏菌(102~103 copies · mL-1)最少.
2)大肠杆菌在污水处理系统中的分布具有一定的季节变化规律,其在夏季进水和出水中浓度最高,分别在107~108 copies · mL-1和105 copies · mL-1左右;而沙门氏菌和军团菌在污水中的分布并未表现出明显的季节性变化现象.
3)从4个污水处理系统对病原菌去除效率来看,以G-A/O对大肠杆菌的去除效率最高,其平均去除率可达99.88%;而各工艺系统并未对沙门氏菌和军团菌表现出明显的去除效果.
4)污水处理厂的出水和污泥排放仍存在一定的生态和健康风险.尽管大肠杆菌在4个污水处理系统的去除率均在90%以上,但大肠杆菌在出水和活性污泥中的浓度依然较高,其出水中浓度在103 copies · mL-1以上,而在活性污泥中浓度更高,基本高达105 copies · mL-1.军团菌在4个污水系统中的削减并不明显,甚至在W-SBR系统出现出水浓度高于进水浓度的现象,其平均进水浓度为2.07×104 copies · mL-1,而平均出水浓度达4.33×104 copies · mL-1,高出进水1倍;此外,军团菌在Q-A2/O、W-SBR和G-A/O系统的污泥样品中浓度则更高,均在8.56×104 copies · mL-1及以上,而W-SBR系统也尤为突出,其污泥中军团菌浓度相比于进水浓度升高约2个数量级,在106 copies · mL-1以上.沙门氏菌在各污水处理系统进水中浓度相对较低,在102~103 copies · mL-1左右,但其在冬季出水中浓度也相对较高,基本在102 copies · mL-1左右.
| [1] | Anas tasi E M,Matthews B,Stratton H M,et al.2012.Pathogenic Escherichia coli found in sewage treatment plants and environmental waters [J].Applied and Environmental Microbiology,78(16): 5536-5541 |
| [2] | Attard E,Poly F,Commeaux C,et al.2010.Shifts between Nitrospira-and Nitrobacter-like nitrite oxidizers underlie the response of soil potential nitrite oxidation to changes in tillage practices [J].Environmental Microbiology,12(2): 315-326 |
| [3] | Baertsch C,Paez-Rubio T,Viau E,et al.2007.Source tracking aerosols released from land-applied class B biosolids during high-wind events [J].Applied and Environmental Microbiology,73(14): 4522-4531 |
| [4] | Bej A K,DiCesare J L,Haff L,et al.1991.Detection of Escherichia coli and Shigella spp.in water by using the polymerase chain reaction and gene probes for uid [J].Applied and Environmental Microbiology,57(4): 1013-1017 |
| [5] | Bhawan P, Nagar E A, Delhi.2008.Evaluation of operation and maintenance of sewage treatment plants in India-2007[R].Monitoring of Indian Aquatic Resources. 1-63 |
| [6] | Carvalho F R S,Vazoller R F,Foronda A S,et al.2007.Phylogenetic study of Legionella species in pristine and polluted aquatic samples from a tropical Atlantic forest ecosystem [J].Current Microbiology,55(4): 288-293 |
| [7] | Curds C R.1982.The ecology and role of protozoa in aerobic sewage-treatment processes [J].Annual Review of Microbiology,36: 27-28 |
| [8] | Déportes I,Benoit-Guyod J L,Zmirou D.1995.Hazard to man and the environment posed by the use of urban waste compost: a review [J].Science of the Total Environment,172(2/3): 197-222 |
| [9] | Erdal Z K,Mendenhall T C,Neely S K,et al.2003.Implementing improvements in a North Carolina residuals management program[J]. Proceedings of the Water Environment Federation, 2003(1): 720-736 |
| [10] | Field K G,Bernhard A E,Brodeur T J.2003.Molecular approaches to microbiological monitoring: fecal source detection[J]. Environ Monitor Assess, 81(1/3): 313-316 |
| [11] | García A,Goñi P,Clavel A,et al.2011.Potentially pathogenic free-living amoebae (FLA) isolated in Spanish wastewater treatment plants [J].Environmental Microbiology Reports,3(5): 622-626 |
| [12] | Gaspard P,Wiart J,Schwartzbrod J.1997.Parasitological contamination of urban sludge used for agricultural purposes [J].Waste Management & Research,15(4): 429-436 |
| [13] | Giangaspero A,Cirillo R,Lacasella V,et al.2009.Giardia and Cryptosporidium in inflowing water and harvested shellfish in a Lagoon in Southern Italy [J].Parasitology International,58(1): 12-17 |
| [14] | Groisman E A.2001.Principles of Bacterial Pathogenesis [M].New York: Academic Press |
| [15] | Hadjinicolaou A V,Demetriou V L,Emmanuel M A,et al.2009.Molecular beacon-based real-time PCR detection of primary isolates of Salmonella Typhimurium and Salmonella Enteritidis in environmental and clinical samples [J].BMC Microbiology,9(1): 97 |
| [16] | Hendricks C W.1971.Increased recovery rate of Salmonellae from stream bottom sediments verses surface waters [J].Applied Microbiology,21(2): 379-380 |
| [17] | Iranpour R,Oh S,Cox H J,et al.2002.Effects of dewatering on bacteria inactivation: centrifuge simulation and field tests at the Hyperion treatment plant [J]. Proceedings of the Water Environment Federation, 2002(12): 679-696 |
| [18] | Jebri S,Jofre J,Barkallah I,et al.2012.Presence and fate of coliphages and enteric viruses in three wastewater treatment plants effluents and activated sludge from Tunisia [J].Environmental Science and Pollution Research,19(6): 2195-2201 |
| [19] | Kaper J B,Nataro J P,Mobley H L.2004.Pathogenic Escherichia coli [J].Nature Reviews Microbiology,2(2): 123-140 |
| [20] | Kuchta J M,States S J,McGlaughlin J E,et al.1985.Enhanced chlorine resistance of tap water-adapted Legionella pneumophila as compared with agar medium-passaged strains [J].Applied and Environmental Microbiology,50(1): 21-26 |
| [21] | Lewis D L,Gattie D K.2002.Peer reviewed: Pathogen risks from applying sewage sludge to land [J].Environmental Science & Technology,36(13): 286A-293A |
| [22] | Maheux A F,Picard F J,Boissinot M,et al.2009.Analytical comparison of nine PCR primer sets designed to detect the presence of Escherichia coli/Shigella in water samples [J].Water Research,43(12): 3019-3028 |
| [23] | Miyamoto H,Yamamoto H,Arima K,et al.1997.Development of a new seminested PCR method for detection of Legionella species and its application to surveillance of legionella in hospital cooling tower water [J].Applied and Environmental Microbiology,63(7): 2489-2494 |
| [24] | Molleda P,Blanco I,Ansola G,et al.2008.Removal of wastewater pathogen indicators in a constructed wetland in Leon,Spain [J].Ecological Engineering,33(3/4): 252-257 |
| [25] | Nazarian E J,Bopp D J,Saylors A,et al.2008.Design and implementation of a protocol for the detection of Legionella in clinical and environmental samples [J].Diagnostic Microbiology and Infectious Disease,62(2): 125-132 |
| [26] | Pillai S C,Subrahmanyan V.1942.Role of protozoa in the activated sludge process [J].Nature,150(3809): 525-525 |
| [27] | Piterina A V,Bartlett J,Pembroke T J.2010.Evaluation of the removal of indicator bacteria from domestic sludge processed by autothermal thermophilic aerobic digestion (ATAD) [J].International Journal of Environmental Research and Public Health,7(9): 3422-3441 |
| [28] | Plachá I,Venglovský J,Sasáková N,et al.2001.The effect of summer and winter seasons on the survival of Salmonella typhimurium and indicator micro-organisms during the storage of solid fraction of pig slurry [J].Journal of Applied Microbiology,91(6): 1036-1043 |
| [29] | Pote J,Haller L,Kottelat R,et al.2009.Persistence and growth of faecal culturable bacterial indicators in water column and sediments of Vidy Bay,Lake Geneva,Switzerland [J].Journal of Environmental Sciences,21(1): 62-69 |
| [30] | Prüss A,Kay D,Fewtrell L,et al.2002.Estimating the burden of disease from water,sanitation,and hygiene at a global level [J].Environmental Health Perspectives,110(5): 537-542 |
| [31] | Rahman I,Shahamat M,Chowdhury M A,et al.1996.Potential virulence of viable but nonculturable Shigella dysenteriae type 1 [J].Applied and Environmental Microbiology,62(1): 115-120 |
| [32] | Rahn K,De Grandis S A,Clarke R C,et al.1992.Amplification of an invA gene sequence of Salmonella typhimurium by polymerase chain reaction as a specific method of detection of Salmonella [J].Molecular and Cellular Probes,6(4): 271-279 |
| [33] | Sahlström L.2003.A review of survival of pathogenic bacteria in organic waste used in biogas plants [J].Bioresource Technology,87(2): 161-166 |
| [34] | Savichtcheva O,Okabe S.2006.Alternative indicators of fecal pollution: relations with pathogens and conventional indicators,current methodologies for direct pathogen monitoring and future application perspectives [J].Water Research,40(13): 2463-2476 |
| [35] | Schaechter M.2009.Encyclopedia of Microbiology [M].New York: Academic Press |
| [36] | 邵祝军.2005.军团菌病的监测与防治[J].疾病监测,20(6): 281-282 |
| [37] | Shanahan E F,Roiko A,Tindale N W,et al.2010.Evaluation of pathogen removal in a solar sludge drying facility using microbial indicators [J].International Journal of Environmental Research and Public Health,7(2): 565-582 |
| [38] | Shannon K,Lee D Y,Trevors J T,et al.2007.Application of real-time quantitative PCR for the detection of selected bacterial pathogens during municipal wastewater treatment [J].Science of the Total Environment,382(1): 121-129 |
| [39] | Sheehan K B,Henson J M,Ferris M J.2005.Legionella species diversity in an acidic biofilm community in Yellowstone National Park [J].Applied and Environmental Microbiology,71(1): 507-511 |
| [40] | Sinclair R,Jones E L,Gerba C P.2009.Viruses in recreational water-borne disease outbreaks: a review [J].Journal of Applied Microbiology,107(6): 1769-1780 |
| [41] | Stampi S,Zanetti F,Crestani A,et al.2000.Occurrence and seasonal variation of airborne gram negative bacteria in a sewage treatment plant [J].The New Microbiologica,23(1): 97-104 |
| [42] | Tantawiwat S,Tansuphasiri U,Wongwit W,et al.2005.Development of multiplex PCR for the detection of total coliform bacteria for Escherichia coli and Clostridium perfringens in drinking water [J].Southeast Asian Journal of Trop Med Public Health,36(1): 162-169 |
| [43] | Thurston J A,Foster K E,Karpiscak M M,et al.2001.Fate of indicator microorganisms,giardia and cryptosporidium in subsurface flow constructed wetlands [J].Water Research,35(6): 1547-1551 |
| [44] | Tsai Y L,Palmer C J,Sangermano L R.1993.Detection of Escherichia coli in sewage and sludge by polymerase chain reaction [J].Applied and Environmental Microbiology,59(2): 353-357 |
| [45] | Viau E,Peccia J.2009.Evaluation of the enterococci indicator in biosolids using culture-based and quantitative PCR assays [J].Water Research,43(19): 4878-4887 |
| [46] | 王强.2010.关于北京市中心城污水再生利用的若干思考[J].中国建设信息(水工业市场),(8): 21-23 |
| [47] | 魏梦楠.2010.污水再生水中典型肠道病原菌的培养鉴定及定量检测研究[D].西安:西安建筑科技大学 |
| [48] | Wéry N,Lhoutellier C,Ducray F,et al.2008.Behaviour of pathogenic and indicator bacteria during urban wastewater treatment and sludge composting,as revealed by quantitative PCR [J].Water Research,42(1/2): 53-62 |
| [49] | Wong K,Onan B M,Xagoraraki I.2010.Quantification of enteric viruses,pathogen indicators,and salmonella bacteria in class B anaerobically digested biosolids by culture and molecular methods[J].Applied and Environmental Microbiology,76(19): 6441-6448 |
| [50] | Wullings B A,Van Der Kooij D.2006.Occurrence and genetic diversity of uncultured Legionella spp.in drinking water treated at temperatures below 15 ℃ [J].Applied and Environmental Microbiology,72(1): 157-166 |
| [51] | 张崇淼,王晓昌,周进宏,等.2012.城市地表水中肠道病原微生物与粪便污染指示菌的关系研究[J].环境科学学报,32(11): 2789-2794 |
| [52] | Zhang K,Farahbakhsh K.2007.Removal of native coliphages and coliform bacteria from municipal wastewater by various wastewater treatment processes: Implications to water reuse [J].Water Research,41(12): 2816-2824 |
 2015, Vol. 35
2015, Vol. 35


