2. 福建师范大学环境科学与工程学院, 福州 350007
2. School of Environmental Science and Engineering, Fujian Normal University, Fuzhou 350007
纳米铁因具有粒径小、比表面积大、反应活性高等优点而被广泛应用于修复环境水体污染物.目前,利用硼氢化钠作为还原剂的化学合成法在纳米技术发展中起着积极作用,但其在应用过程中存在着成本高、二次污染和耗能等问题进而导致无法大规模原位修复.与传统的合成方法相比,“绿色”合成纳米金属技术具有高的经济效益、环境效益和资源再利用等优点.通过“绿色”方法合成纳米金属材料,特别是在纳米金属合成过程中植物提取液作为还原剂和稳定剂参与纳米金属的合成已引起人们的广泛关注(Li et al., 2006;Sun et al., 2007).
近年来,各种植物叶子提取液已被用于制备纳米铁材料(Fe NPs).植物提取液中的多酚、咖啡因等生物活性还原剂将金属铁盐还原为纳米铁,这些成分同时可作为合成过程的还原剂、分散剂和稳定剂.课题组前期利用不同茶叶提取液合成Fe NPs,如使用绿茶提取液作为还原剂还原Fe2+制备Fe NPs并将其用于还原降解孔雀绿(Weng et al., 2013; Huang et al., 2014),以及利用Fenton体系氧化氯苯(Kuang et al., 2013),利用桉树叶提取液合成纳米铁降解富营养废水(Wang et al., 2014).此外,还有学者用绿茶萃取液合成纳米铁,在类Fenton体系中降解阴阳离子型染料(Shahwan et al., 2011).这些是在空气气氛下合成的纳米铁,其合成的产物主要为纳米零价铁和氧化铁及氢氧化铁的混合物,但纳米零价铁和氧化铁及氢氧化铁在环境修复中的性能不同,而目前有关这一研究尚鲜见报道.
为此,本文通过调控“绿色”合成纳米铁颗粒过程中的合成气氛,探讨不同反应气氛对所合成的纳米铁颗粒的组分和活性的影响,并利用SEM、EDS、XPS和FTIR等表征手段对不同反应气氛条件下合成的纳米铁材料进行表征.在前期工作基础上,通过比较3种反应气氛合成的纳米铁去除MB的实验,探讨纳米铁活性的变化.同时,通过调控不同的反应气氛来控制纳米铁的主要成分,充分利用纳米零价铁的还原特性和氧化铁的吸附性,以期为提高“绿色”合成的纳米铁系材料的反应活性提供直接科学依据,并将为工业化低价格“绿色”生产纳米铁提供技术支撑,促使纳米铁系材料用于大规模原位修复环境污染物成为现实.
2 材料与方法(Materials and methods) 2.1 实验材料绿茶购自福建省福州市青宁茶叶厂,无食品添加剂;MB购自国药集团化学试剂有限公司(分析纯);七水合硫酸亚铁购自西陇化工股份有限公司(分析纯);高纯氮气、高纯氧气.
2.2 主要仪器GZX-9070MBE数显鼓风干燥箱,THZ-320台式恒温振荡器,DZF-6020型真空干燥箱,TG16-WS 台式高速离心机,SHZ-D(Ⅲ)循环水式真空泵,722N 可见分光光度计;采用日本JEOL公司的JSM-7500型扫描电子显微镜(SEM)观察样品的表面形貌及元素组成;附件能量色散谱仪(EDS)采用英国Thermo Scientific公司的ESCALAB 250型X 射线光电子能谱仪(XPS)分析样品表面的元素价态和成分;采用美国THERMO NICOLET公司的Thermo Nicolet 5700型傅里叶变换红外光谱(FTIR)获取试样的FTIR谱图,溴化钾压片,扫描范围 4000~400 cm-1.
2.3 不同气氛下制备GT-Fe NPs颗粒 2.3.1 绿茶提取液的制备称取60 g绿茶叶加入到1 L蒸馏水中,在353 K下水浴加热1 h(在此温度下加热的目的是使茶叶中的酶失活,避免多酚类物质被氧化).冷置30 min后,真空抽滤,滤液装入锥形瓶并放置于4 ℃冰箱中备用.
2.3.2 硫酸亚铁溶液的配制称取0.7805 g FeSO4 · 7H2O 固体,加入蒸馏水溶解后定容于100 mL容量瓶中,制得含0.1 mol · L-1 Fe2+的溶液.
2.3.3 Fe NPs固体颗粒的制备量取200 mL绿茶提取液并移入三颈烧瓶中,通入N2或O2搅拌10 min后,逐滴加入100 mL新配制好的Fe2+溶液,直至滴完,停止搅拌并继续通气10 min,整个反应过程保持通气状态.将反应后的混合溶液即时抽滤,并用无水乙醇洗涤,快速置于60 ℃真空干燥箱中干燥12 h后取出,研磨过筛即获得Fe NPs颗粒.在空气条件下Fe NPs颗粒的制备方法与前期工作所描述的一致(Weng et al., 2013).
2.4 实验过程去除MB实验在温度为303 K、转速为125 r · min-1的摇床中进行.移取30 mL MB溶液至干净的离心管中,再加入0.03 g Fe NPs 固体颗粒,到一定反应时间点后取出试样置于离心机中离心5 min,利用移液管移取1 mL上清液至玻璃管并稀释到10 mL,用可见分光光度计测量反应后溶液的吸光度,算出反应后MB的浓度.MB溶液的吸光度在最大吸收波长665 nm下测定,根据式(1)算出去除率,以去除率的变化情况评价不同条件下合成的Fe NPs固体颗粒(GT-Fe NPs)的活性.
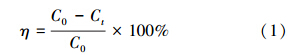
图 1是在不同气氛下合成的Fe NPs 的扫描电镜图.据文献报道,Fe NPs表面微观形态均呈现球形或椭球形,但不同反应气氛下合成的Fe NPs的粒径存在差异(Huang et al., 2013).图 1a中显示,空气气氛下合成的Fe NPs粒径为(117.8±26.2)nm,其中,部分纳米铁粒子趋向于形成不规则团聚态,其原因可能是纳米铁暴露在空气中极易团聚,类似现象已经有文献报道(Shahwan et al., 2011).比较图 1b和1c可知,通入N2合成的纳米铁平均粒径为(84.7±11.5)nm,而通入O2的纳米铁平均粒径为(141.2±26.3)nm,合成的Fe NPs颗粒差别来自通入O2后纳米铁被O2氧化成纳米氧化铁或铁的氢氧化物覆盖在纳米铁表面导致Fe NPs颗粒增大(Shahwan et al., 2011;Njagi et al., 2011).相反,在制备过程中通入N2,可减少纳米铁被氧化成氧化铁包围在纳米铁表面,因此,平均粒径偏小.这些结果将在XPS和FTIR表征数据中获得支持.
 |
| 图 1 GT-Fe NPs的扫描电镜图和粒径分布图(a.空气; b.通入N2; c.通入O2) Fig. 1 SEM scanning and size images of GT-Fe NPs with air(a),by inletting N2(b) and O2(c) |
为了进一步理解合成的Fe NPs的元素成分,对以上不同气氛下合成的3种样品进行X射线能谱分析,结果如图 2所示.首先,C元素百分含量分别为49.2%、20.3%和49.7%,C元素主要来源于绿茶提取液中的有机活性成分(Weng et al., 2013),说明纳米铁表面覆盖有茶多酚类物质,作为稳定剂将合成的Fe NPs 包裹,从而减少 Fe NPs 被氧化(Iravani,2011).通入N2导致C的百分含量降低,可能是由于N2气氛下合成的Fe NPs 含有较高的 Fe成分而导致吸附有机物能力下降,而相反在空气和通O2下合成的Fe NPs含有更多氧化铁,氧化铁对提取液中多酚类物质和有机物可通过官能团键与键的结合将其吸附在表面(Philip,2010).其次,O元素的百分含量分别为37.7%、33.3%和41.0%,可以看出,在通空气或O2下,O元素的含量比较高,可能由于对这种情况下合成Fe NPs对提取液中多酚类物质和有机物吸附量比较高,而O元素主要来自提取液中含有羰基或羟基类基团的有机物(Weng et al., 2013);此外,合成的Fe NPs中氧化铁成分比较高也是一个原因.最后,Fe元素的含量分别为5.7%、32.9%和8.5%,很清楚地说明在空气或通O2下合成的Fe NPs含有更多氧化铁,导致Fe含量降低,而通N2下Fe元素的百分含量明显增大到32.9%,原因是部分纳米铁被N2保护避免被空气氧化,此结果与SEM结果基本类似.
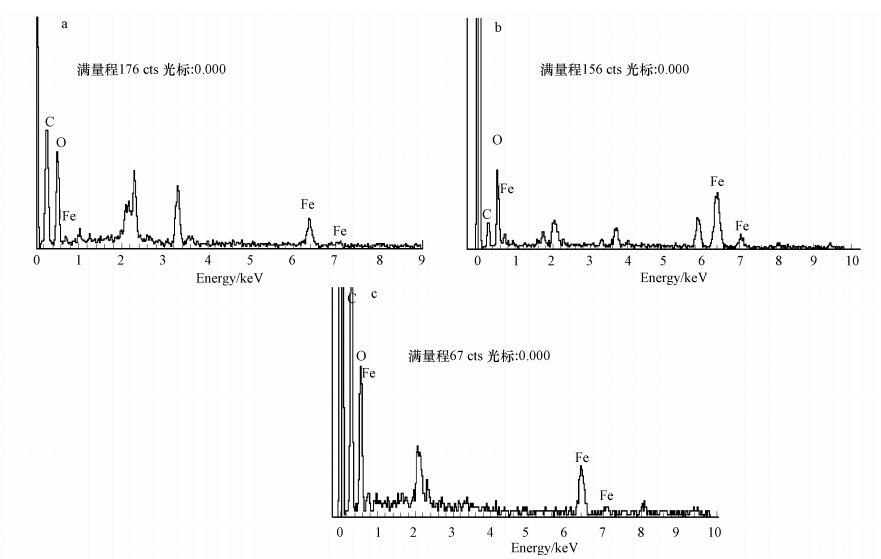 |
| 图 2 GT-Fe NPs的EDS图(a.空气; b.通入N2; c.通入O2) Fig. 2 EDS spectrum of GT-Fe NPs with air(a),by inletting N2(b) and O2(c) |
为进一步确认不同气体对合成Fe NPs元素形态的影响,分别对在通N2和通O2条件下合成的Fe NPs样品中Fe元素和O元素的形态进行XPS分析,结果如图 3所示.图 3a中,706.0 eV和721.9 eV 处出现Fe0 的峰(Dickinson et al., 2010),而在710 eV和719.1 eV处表明存在纳米氧化铁的混合物,同时在712.2 eV处出现铁的氢氧化物的特征峰(Fujii et al., 1999;Li et al., 2007),说明在通N2条件下合成的Fe NPs不仅包含零价铁,而且含有氧化铁成分.而从图 3b可以看出,Fe0的峰发生偏移,峰值分别转变为704.4 eV和721.0 eV,同时,在Fe 2p3/2轨道处出现多个纳米氧化铁和铁的氢氧化物的特征峰,说明在通O2条件下合成的Fe NPs主要成分是纳米氧化铁和氢氧化铁的混合物.并且对通N2和通O2两种气体条件下制备的样品进行O1s轨道的形态分析,结果如图 3c和d所示.图 3c中,530.7 eV和532.8 eV分别代表的是纳米氧化铁和—OH中的O(Shahwan et al., 2011),而通入O2条件下,这些峰在图 3d中显示为530.5 eV和532.1 eV,同时,在533.5 eV处出现来自物理吸附水中的O的特征峰(Shahwan et al., 2011),可以为进一步证明通入O2提高氧化物含量提供依据.
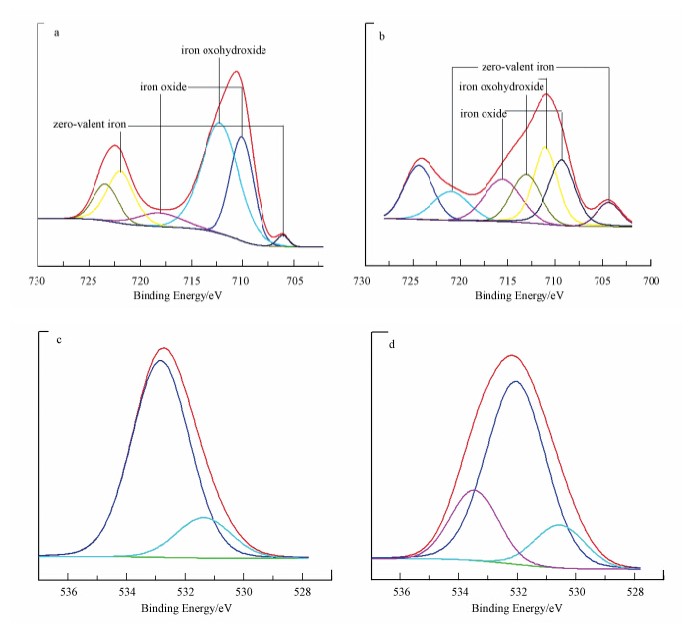 |
| 图 3 通入N2(a,c)和O2(b,d)条件下合成Fe NPs的Fe 2p轨道(a,b)和O1s轨道(c,d)的XPS图 Fig. 3 XPS peak corresponding to Fe 2p(a,b) and O 1s(c,d)of GT-Fe NPs by inletting N2(a,c) and O2(b,d) |
图 4是在空气、通入N2和O2 3种条件下制备的Fe NPs在400~4000 cm-1范围内扫描的红外光谱图.图中3436.7、1628.9和1043.5 cm-1处分别是O—H、C C和C—O—C的伸缩振动峰(Weng et al., 2013;Chen et al., 2011),比较图中曲线a、b和c可以看出,这些吸收峰在通入气体后明显增大,说明绿茶提取液中的茶多酚和咖啡因类物质在气体的作用下更好地覆盖在Fe NPs颗粒表面(Weng et al., 2013; Huang et al., 2014).在549.0 cm-1处是Fe3O4和Fe2O3中Fe—O键的振动吸收峰,表明通入N2制备的Fe NPs还是有纳米氧化铁的存在,与XPS分析的结果基本一致.通入O2后Fe—O键在634.6 cm-1和544.0 cm-1处的振动吸收峰加强,Fe NPs的表面沉积氧化铁,这种现象是Fe NPs表面的Fe0被O2氧化成纳米氧化铁或铁的氢氧化物,导致Fe—O键的吸收峰加强.此外,在空气存在情况下合成的Fe NPs未被检测出Fe—O键的振动吸收峰,可能是因为绿茶提取液中大量的有机物覆盖在 Fe NPs表面导致FTIR没法检测出Fe—O键,这进一步说明绿茶提取液中的有机物能作为包裹剂抑制纳米铁团聚.
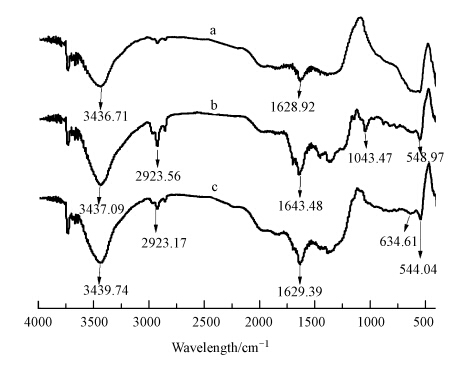 |
| 图 4 GT-Fe NPs的红外光谱图(a.空气; b.通入N2; c.通入O2) Fig. 4 FTIR spectrum of GT-Fe NPs with air(a),by inletting N2(b) and O2(c) |
根据以上表征结果,探讨不同气氛下合成的Fe NPs与它们去除环境污染物之间的关系,即反应活性.为此,将不同气氛下合成的Fe NPs用于去除MB,结果如图 5所示.通入N2合成的Fe NPs去除效果最好,在反应5 min时,98.7%的MB就已被去除.而通入O2合成的纳米铁去除速率较慢,在50 min时,仅有95.2%的MB被去除.在空气条件下合成的 Fe NPs对MB的去除效果介于二者之间.这可能是来自2种不同去除的机理,通入N2合成的FeNPs主要是以纳米Fe0还原降解MB,通入O2合成的FeNPs主要是氧化铁吸附MB.而在空气下合成的Fe NPs去除MB同时含有吸附和降解机理.通入N2合成的Fe NPs大部分是Fe0,这是由于N2 对 Fe NPs起到保护作用,防止纳米铁被氧化,但通入O2加速纳米铁氧化成氧化铁或铁的氢氧化物(Shi et al., 2011;Zhang et al., 2011).Fe0具有还原性,反应活性强,而纳米氧化铁表面尺寸大,具有明显的吸附作用,对MB的去除实验中通入N2合成的纳米铁比通入O2的效果好.这些结果说明不同反应气氛对合成Fe NPs的组成和活性影响不同,为调控绿色合成Fe NPs主要成分和纳米修复提供了依据.
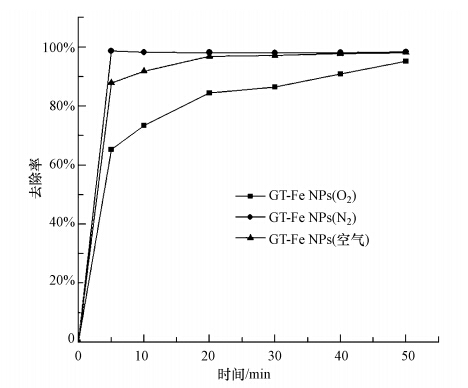 |
| 图 5 在通入空气、N2和O2条件下合成的GT-Fe NPs对MB的去除(温度303 K,转速125 r · min-1,投加量1 g · L-1,MB初始浓度50 mg · L-1) Fig. 5 Degradation of MB by GT-Fe NPs with air,by inletting N2 and O2 on the temperature of 303K,rotary speed of 125 r · min-1,dose of 1 g · L-1 and MB initial concentration of 50 mg · L-1 |
1)研究发现,不同反应气氛下绿色合成的纳米铁组成和活性不同.在合成过程中通入N2,所得的纳米铁粒子尺寸小,平均粒径为(84.7±11.5)nm,所含Fe元素含量高(32.9%),XPS表征显示有Fe0特征峰存在;通入O2制备的纳米铁粒子尺寸变大,平均粒径为(141.2±26.3)nm,EDS结果显示O元素含量(41.0%)增大,Fe元素含量(8.5%)显著下降,而XPS和FTIR同时表明了纳米氧化铁的存在.通入N2和O2与空气相比,N2使纳米铁粒径变小,相应比表面积增大,O2使纳米铁粒径增大,原因是零价铁被O2氧化成纳米氧化铁包裹在纳米铁表面,导致合成的纳米铁平均粒径变大,说明在合成过程中通入N2和O2会影响纳米铁的组成.
2)纳米铁的组成发生改变,其反应活性随之发生变化.在合成过程中通入N2得到的GT-Fe NPs去除MB时可快速达到98.7%的去除率,通入O2时去除率仅为65.3%,说明不同气氛对纳米铁的活性会产生显著影响.
| [1] | Chen Z X, Jin X Y, Chen Z L, et al. 2011. Removal of methyl orange from aqueous solution using bentonite-supported nanoscale zero-valent iron [J]. Journal of Colloid and Interface Science, 363(2): 601-607 |
| [2] | Chen Z X, Cheng Y, Chen Z L, et al. 2012. Kaolin-supported nanoscale zero-valent iron for removing cationic dye-crystal violet in aqueous solution [J]. Journal of Nanoparticle Research, 14: 899(14): 1-8 |
| [3] | Dickinson M, Scott T B. 2010. The application of zero-valent iron nanoparticles for the remediation of a uranium-contaminated waste effluent [J]. Journal of Hazardous Materials, 178(1/2/3): 171-179 |
| [4] | Fujii T, De Groot F M F, Sawatzky G A. 1999. In situ XPS analysis of various iron oxide films grown by NO2-assisted molecular-beam epitaxy[J]. Physical Review B, 59(4): 3195-3202 |
| [5] | Huang L L,Weng X L,Chen Z L,2013.Green synthesis of iron nanoparticles using green tea extracts and its application in degradation of malachite green [J]. Journal of Fujian Normal University(Natural Science Edition), 29(4): 65-71 |
| [6] | Huang L L, Weng X L, Chen Z L, et al. 2014. Synthesis of iron-based nanoparticles using oolong tea extract for the degradation of malachite green [J]. Spectrochimica Acta (Part A: Molecular and Biomolecular Spectroscopy), 117: 801-804 |
| [7] | Iravani S. 2011. Green synthesis of metal nanoparticles using plants [J]. Green Chemistry, 13(10): 2638-2650 |
| [8] | Kuang Y, Wang Q P, Chen Z L, et al. 2013. Heterogeneous Fenton-like oxidation of monochlorobenzene using green synthesis of iron nanoparticles [J]. Journal of Colloid and Interface Science, 410: 67-73 |
| [9] | Li X Q, Elliott D W, Zhang W X. 2006. Zero-valent iron nanoparticles for abatement of environmental pollutants: materials and engineering aspects [J]. Critical Reviews in Solid State and Materials Sciences, 31(4): 111-122 |
| [10] | Li X Q, Zhang W X. 2007. Sequestration of metal cations with zerovalent iron nanoparticles-a study with high resolution X-ray photoelectron spectroscopy (HR-XPS)[J]. The Journal of Physical Chemistry C, 111(19): 6939-6946 |
| [11] | Lin Y M, Chen Z L, Megharaj M, et al. 2012. Degradation of scarlet 4BS in aqueous solution using bimetallic Fe/Ni nanoparticles[J]. Journal of Colloid and Interface Science, 381(1): 30-35 |
| [12] | Njagi E C, Huang H, Stafford L, et al. 2011. Biosynthesis of iron and silver nanoparticles at room temperature using aqueous sorghum bran extracts [J]. Langmuir, 27(1): 264-271 |
| [13] | Philip D. 2010. Green synthesis of gold and silver nanoparticles using Hibiscus rosa sinensis [J]. Physica E: Low-dimensional Systems and Nanostructures, 42(5): 1417-1424 |
| [14] | Shahwan T, Abu Sirriah S, Nairat M, et al. 2011. Green synthesis of iron nanoparticles and their application as a Fenton-like catalyst for the degradation of aqueous cationic and anionic dyes [J]. Chemical Engineering Journal, 172(1): 258-266 |
| [15] | Shi L N, Zhang X, Chen Z L. 2011. Removal of Chromium (VI) from wastewater using bentonite-supported nanoscale zero-valent iron [J]. Water Research, 45(2): 886-892 |
| [16] | Sun Y P, Li X Q, Zhang W X, et al. 2007. A method for the preparation of stable dispersion of zero-valent iron nanoparticles [J]. Colloids and Surfaces (A: Physicochemical and Engineering Aspects), 308(1/2/3): 60-66 |
| [17] | Wang T, Jin X Y, Chen Z L, et al. 2014. Green synthesis of Fe nanoparticles using eucalyptus leaf extracts for treatment of eutrophic wastewater [J]. Science of the Total Environment, 466-467: 210-213 |
| [18] | Weng X L, Huang L L, Chen Z L, et al. 2013. Synthesis of iron-based nanoparticles by green tea extract and their degradation of malachite [J]. Industrial Crops and Products, 51: 342-347 |
| [19] | Zhang X, Lin S, Chen Z L, et al. 2011. Kaolinite-supported nanoscale zero-valent iron for removal of Pb2+ from aqueous solution: reactivity, characterization and mechanism[J]. Water Research, 45(11): 3481-3488 |
 2015, Vol. 35
2015, Vol. 35


