2. 湖南农业大学资源环境学院, 长沙 410128;
3. 辽宁石油化工大学生态环境研究院, 抚顺 113001
2. College of Resource and Environment, Hunan Agricultural University, Changsha 410128;
3. Institute of Eco-environmental Sciences, Liaoning Shihua University, Fushun 113001
传统氯盐型融雪剂带来的负面影响体现在破坏区域生态环境、腐蚀钢筋混凝土和柏油路面等基础设施以及交通车辆等各个方面(Fay and Shi, 2012; Findlay and Kelly, 2011).随着融雪剂使用量的逐年递增,其对生态环境的危害已日益凸现(Allert et al., 2012; 张营等,2012; Kim and Koretsky, 2013).西方发达国家自20世纪70年代开始研究开发氯盐融雪剂的替代品,并于20世纪90年代初期投入使用,以期降低化学融雪剂使用后产生的环境污染和生态破坏问题(Ramakrishna and Viraraghavan, 2005).美国科罗拉多州交通部历时两年对有机型融雪剂的融雪效率和环境效应进行评估后,选用醋酸钾(KAc,KCH3COO)、醋酸钙(CaAc,Ca(CH3COO)2)、醋酸镁(MgAc,Mg(CH3COO)2)、 醋酸钙镁(CMA,Ca3Mg7(CH3COO)20)、甲酸钾(KFo,KCOOH)等有机型融雪剂替代NaCl、MgCl2和CaCl2混合氯盐型融雪剂(Fischel,2001).融雪剂成分不同,其对生态环境的影响具有明显差异.CMA融化后进入土壤,Ca离子和Mg离子则更有利于保持土壤肥力和土壤结构的稳定性(Fay and Shi, 2012).与NaCl相比,CMA对植物的伤害作用更小(Akbar et al., 2006).然而也有研究表明,因醋酸降解带来的氧气消耗是使用有机类融雪剂一个重大的潜在影响(Brenner and Horner, 1992; Robidoux and Delisle, 2001).在土壤环境中有机化合物的分解会消耗O2,干扰土壤氧化还原条件,从而改变土壤理化性质(Fay and Shi, 2012).Rasa等(2006)的研究认为KCOOH是NaCl的最优替代品,与醋酸盐融雪剂相比考虑到其较低的碳含量及环境降解中较低的耗氧量,其对环境的影响更小.Hellstén等(2005)的实验研究也证实与醋酸盐融雪剂相比KCOOH更不容易迁移至地下水层,且在低温条件下(-2 ℃至+6 ℃)更易被土壤微生物降解.目前,国内也开始关注于非氯盐型融雪剂的开发和环境效应的研究.赵菲(2012)开展了CMA对土壤中重金属形态和地表水中溶解氧含量影响的实验室模拟研究.蒋新元等(2012)利用竹醋液与氧化钙制得的竹醋基有机酸钙,研究对盆栽建兰生长和土壤理化性质的影响.
沈阳位于中国东北,属温带半湿润大陆性季风气候.冬冷夏暖,寒冷期长,每年11月至来年3月为降雪期,降雪量较大.2003—2009年沈阳市市区化学融雪剂的使用量逐年上升,从2003年融雪剂(或融雪剂与沙的混合物)使用量6000 t增加至2009年融雪剂使用量24000 t.沈阳市政府于2010年开始限制城市范围内融雪剂的施用量,市内桥梁也从2010年冬季开始使用有机融雪剂.课题组于2010年春季采集沈阳市城区主要街道的绿化土壤样品,测定土壤中Na+含量为352~513 mg · kg-1,Cl-含量为577~2353 mg · kg-1(Li et al., 2011),远高于波兰欧波兰市(Na+含量34~330 mg · kg-1,Cl-含量8~170 mg · kg-1,Czerniawska-Kusza et al., 2004)和美国马萨诸塞州(Na+含量16~101 mg · kg-1,Bryson and Barker, 2002)城市街道绿化土壤中Na+和Cl-的积累.同时,沈阳作为中国东北老工业基地,旧工业区表层土壤重金属Pb和Cu污染严重(Li et al., 2009).综合国内外研究进展关于KCOOH对土壤重金属迁移影响的研究甚少.因此,本研究采用土柱淋溶方法探讨3个不同浓度梯度NaCl和KCOOH处理对沈阳市街道绿化土壤中Pb和Cu迁移行为的影响,通过测定淋溶液中溶解态的重金属、有机质含量、pH和氧化还原电位,旨在比较传统型融雪剂NaCl和替代型融雪剂KCOOH对城市街道绿化土壤中重金属迁移性影响的异同.研究成果为探究替代型有机融雪剂的环境效应,合理选择融雪剂以降低环境风险提供科学依据.
2 材料与方法(Materials and methods) 2.1 试验材料在前期评价沈阳市城区街道绿化土壤重金属含量空间分布特征的研究中(Li et al., 2011),15号采样点土壤在41个测试样品中重金属污染权重最高,土壤重金属Pb和Cu含量分别为80.3 mg · kg-1和166.6 mg · kg-1,分别是沈阳市土壤Pb污染起始值(37.5 mg · kg-1)和Cu污染起始值(40.0 mg · kg-1)的2.1倍和4.2倍(罗雪梅等,2004).土柱淋溶试验用于评估融雪剂作用下污染土壤中重金属的迁移转化.因此,选择重金属污染权重最高的土壤为淋溶试验对象,以评估融雪剂对重金属迁移的最大风险.测定土壤理化性质如下:0~20 cm土壤粒径分布为砂粒46%,粉粒39%和粘粒15%.1 ∶ 5去离子水浸提土壤测定pH值为6.5,电导率110.4 μS · cm-1,有机质17.6 g · kg-1,阳离子交换量 16.7 cmol · kg-1.采集回新鲜土壤样品混匀后过4 mm 塑料土壤筛,4 ℃恒温冷藏,以备填充土柱.
高30 cm、直径3 cm土柱(材质为PVC)共16根,土柱底部和上层分别填入5 cm高的石英砂,中间为20 cm供试土壤.将试验土柱置于支架上,土柱上方设加水装置,下方用塑料瓶收集淋滤液.按土壤实际容重填装土柱,淋溶试验开始时,先以去离子水淋洗至土壤达到田间持水量,淋出液不计入测定范围.
2.2 试验设计依据沈阳市融雪剂的最大使用量为上限,分别配制浓度为0.01 mol · L-1、0.05 mol · L-1和0.1 mol · L-1的NaCl和KCOOH溶液作为淋溶处理液.共16根土柱,其中8根为NaCl处理,另8根为KCOOH处理.以去离子水为对照淋洗液,即每种淋洗液分别为4个处理浓度,每个处理2个重复(2根土柱).Wahlström(1996)的研究表明如果污染介质的淋洗量是有限的,推荐淋溶固液比为2,表示试验结果为短期研究的数据.因此本试验设定总固液比为2(L/S),20 cm 供试土壤干土重为180 g,总淋洗量为360 mL,用以评估融雪剂对土壤中重金属迁移的短期影响.在Wahlström(1996)关于淋溶试验参数的优化选择研究中,淋溶速率推荐值为每天0.03~0.1 L/S.因此选择每天的淋溶速率为0.1 L/S,即每天淋洗量为18 mL.为了控制试验条件的一致性,采用蠕动泵(HUXI,Model BT-100-8)进行淋洗,泵速0.1 r · min-1(约0.035 mL · min-1),每天运行9.5 h.为模拟残雪中融雪剂进入城市街道绿化土壤后降雨冲刷的整个过程,首先淋洗融雪剂处理液,每次(每天)淋洗18 mL,共淋洗5次;再每天淋洗18 mL去离子水,共淋洗5次;后重复整个过程,直到总固液比达到2 L/S.对照柱在试验的整个过程中均淋洗去离子水.淋出液置于密闭容器中,用7 mol · L-1的HNO3 酸化至pH<2,放置于冰箱4 ℃保存待测.
2.3 测定项目电极法测定淋出液pH和氧化还原电位(Eh),采用石墨炉原子吸收光谱法(Varian,Spectr-AA220)测定Pb和Cu含量.淋洗液KCOOH中碳含量会对淋出液中TOC含量产生干扰,研究表明254 nm波长吸光度值可以用于量化土壤淋溶液中腐殖酸和富里酸含量,且淋出液中254nm吸光度值与TOC含量呈显著正相关(Amrhein et al., 1992),同时经本试验测定0.1 mol · L-1的HCOOH溶液吸光度与蒸馏水相近,因此本试验中选择用254nm吸光度值表示土壤可溶性有机质含量.
2.4 数据处理试验数据采用Origin 7.0绘图,采用SPSS(Version 13.0)统计分析软件进行线性回归分析和不同处理间差异显著性检验.
3 结果(Results) 3.1 土壤淋出液中pH、氧化还原电位和可溶性有机质的淋溶特征随NaCl处理浓度的增加土壤pH的升高均不显著(p>0.05),而0.05 mol · L-1和0.1 mol · L-1 KCOOH处理下土壤pH显著升高,从对照的6.1升高至8.3.KCOOH处理显著降低土壤的氧化还原电位,从对照的534.33 mV降至230.30 mV(表 1).
| 表1 不同浓度NaCl和KCOOH处理下土壤淋出液中pH和Eh的变化 Table 1 Soil pH and Eh in the leachate under the treatment of NaCl and KCOOH |
随NaCl和KCOOH处理浓度的增加,淋出液中有机质的含量增大.从NaCl和KCOOH处理对土壤有机质的淋溶释放动态变化情况看(图 1),淋出液中有机质含量的高峰值均出现在低离子强度(去离子水)淋洗的过程中,即L/S=0.7~1.0和1.6~2.0,且高浓度处理对土壤有机质的释放量高于低浓度处理.与KCOOH处理相比,淋溶后期NaCl处理对土壤有机质的释放量更高.
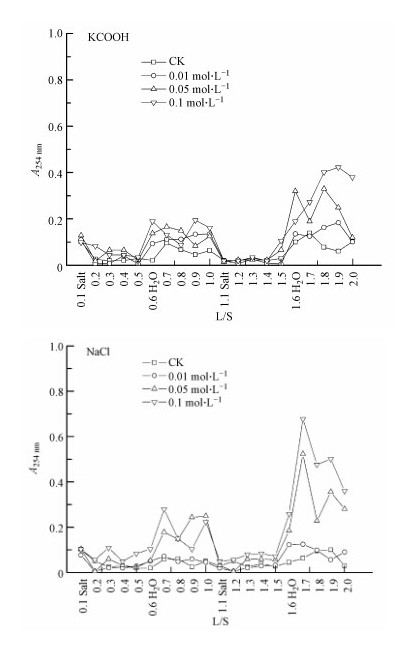 |
| 图 1 NaCl和KCOOH处理下土壤可溶性有机质的淋溶特征 Fig. 1 Concentration of soluble organic matter(as determined by absorbance at 254 nm wavelength)in the leachate under the treatment of NaCl and KCOOH |
随NaCl和KCOOH处理浓度的增加,土壤对Pb的释放量均增大(图 2).0.01 mol · L-1 的NaCl和KCOOH处理下土壤对Pb的释放量很低,与对照相比差异不显著.从土壤对Pb的淋溶释放动态变化情况看,土壤对Pb释放量的高峰值均出现在0.05 mol · L-1和0.1 mol · L-1 NaCl和KCOOH处理下,低离子强度(去离子水)淋洗过程中.与NaCl处理不同,从KCOOH对土壤Pb的淋溶释放动态变化情况看,淋出液中Pb含量的高峰值出现在淋溶初期.NaCl作用下土壤对Pb的释放量明显高于KCOOH,在0.1 mol · L-1 NaCl处理下淋洗量为2.0 L/S时,试验柱中土壤对Pb的释放量达到最高值1333 μg · L-1.
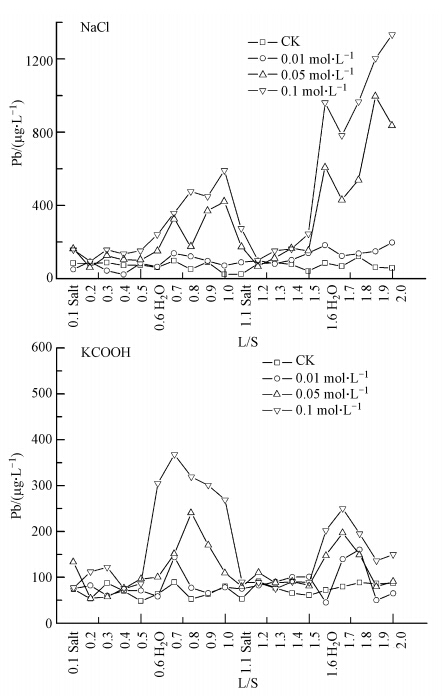 |
| 图 2 NaCl和KCOOH处理下土壤中Pb的淋溶特征 Fig. 2 Concentration of lead in the leachate under the treatment of NaCl and KCOOH |
土壤Pb释放量和土壤可溶性有机质含量(254 nm吸光度值)的相关性分析表明(图 3),NaCl处理下土壤对Pb释放量和254 nm吸光度值之间具有显著的相关性(r=0.823,p<0.01),KCOOH处理下土壤对Pb释放量和254 nm吸光度值之间的相关性显著(r=0.421,p<0.05).
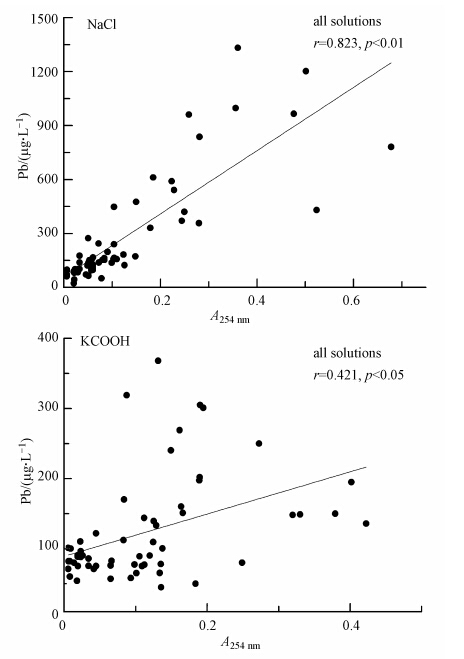 |
| 图 3 NaCl和KCOOH处理下土壤中Pb释放量与可溶性有机质含量的相关分析 Fig. 3 Linear relationship between Pb concentration and organic matter concentration under the treatment of NaCl and KCOOH |
通过对20个淋出液中Pb含量的测定,结果表明,土壤对Pb的释放量与土壤Pb全量相比,0.01 mol · L-1 NaCl处理下土壤对Pb的释放量为土壤Pb全量的1.54%(n=20),0.05 mol · L-1 NaCl处理下土壤对Pb的释放量为土壤Pb全量的4.50%,0.1 mol · L-1 NaCl处理下土壤对Pb的释放量为土壤Pb全量的6.63%.与对照柱相比,对照柱中土壤对Pb的释放量为土壤Pb全量的1.06%.与NaCl处理相比,KCOOH对Pb的释放量更低.0.01 mol · L-1、0.05 mol · L-1 和0.1 mol · L-1 KCOOH处理下土壤对Pb的释放量分别为土壤Pb全量的1.27%、1.70%和2.62%.对照柱中土壤对Pb的释放量为土壤Pb全量的1.07%(n=20).
3.3 淋溶试验中Cu的淋溶特征随NaCl和KCOOH处理浓度的增加,土壤对Cu的释放量均增大(图 4).土壤对Cu的淋溶释放动态变化情况与土壤对Pb的淋溶释放特征相似,土壤对Cu释放量的高峰值均出现在0.05 mol · L-1和0.1 mol · L-1 NaCl和KCOOH处理下,低离子强度(去离子水)淋洗过程中.与NaCl处理不同,KCOOH处理对土壤Cu释放高峰值出现在淋溶初期.NaCl作用下土壤对Cu的释放量明显高于KCOOH,在0.1 mol · L-1 NaCl处理下淋洗量为1.7 L/S时,试验柱中土壤对Cu的释放量达到最高值5.06 mg · L-1.
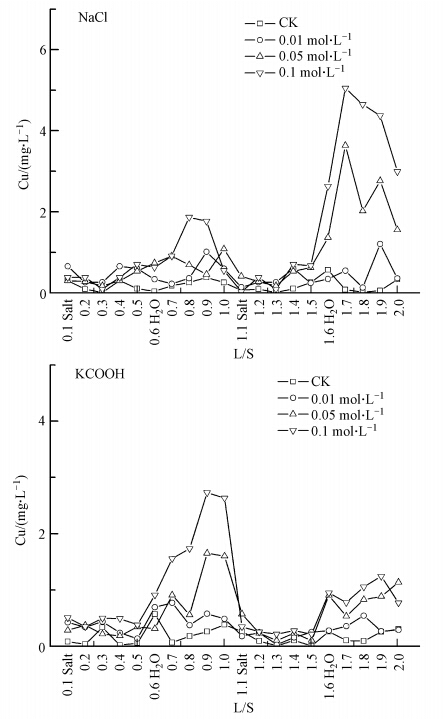 |
| 图 4 NaCl和KCOOH处理下土壤中Cu的淋溶特征 Fig. 4 Concentration of copper in the leachate under the treatment of NaCl and KCOOH |
土壤Cu释放量和土壤可溶性有机质含量(254 nm吸光度值)的相关性分析表明(图 5),NaCl处理下土壤对Cu释放量和254 nm吸光度值之间具有显著的相关性(r=0.903,p<0.01),KCOOH处理下土壤对Cu释放量和254 nm吸光度值之间的相关性显著(r=0.436,p<0.01).
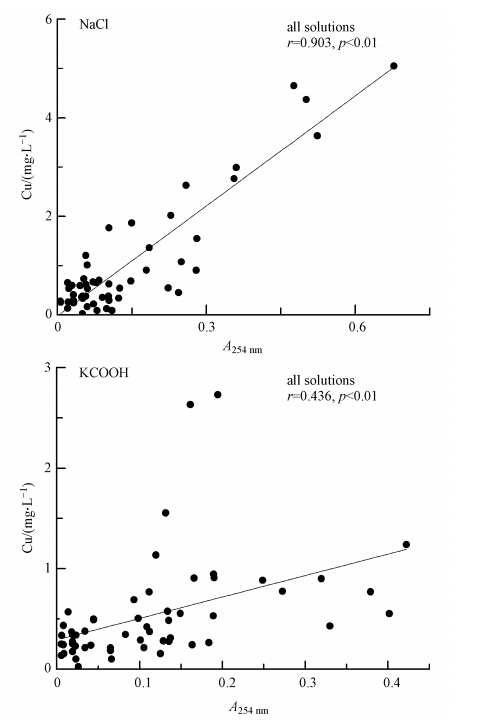 |
| 图 5 NaCl和KCOOH处理下土壤中Cu释放量与可溶性有机质含量的相关分析 Fig. 5 Linear relationship between Cu concentration and organic matter concentration under the treatment of NaCl and KCOOH |
通过对20个淋出液中Cu含量的测定,结果表明,土壤对Cu的释放量远高于对Pb的释放量,与土壤中Cu全量相比,0.01 mol · L-1 NaCl处理下土壤对Cu的释放量为土壤Cu全量的4.79%(n=20),0.05 mol · L-1 NaCl处理下土壤对Cu的释放量为土壤Cu全量的9.96%,0.1 mol · L-1 NaCl处理下土壤对Cu的释放量为土壤Cu全量的15.48%.与对照柱相比,对照柱中土壤对Cu的释放量为土壤Cu全量的1.84%.与NaCl处理相比,KCOOH对Cu的释放量更低.0.01 mol · L-1、0.05 mol · L-1和0.1 mol · L-1 KCOOH处理下土壤对Cu的释放量分别为土壤Cu全量的4.22%、7.16%和10.72%.对照柱中土壤对Cu的释放量为土壤Cu全量的1.81%(n=20).
4 讨论(Discussion)在NaCl和对照处理中,土壤pH和Eh变化很小.KCOOH淋溶土壤后,土壤pH值从6.1升高至8.3,土壤酸碱度变化显著(p<0.05).pH 值增加时,土壤中的H+含量降低,土壤阳离子交换能力增强,使重金属阳离子易于固定(彭丽成等,2011).同时KCOOH处理显著降低土壤的氧化还原电位,从对照的534 mV降至230 mV(p<0.05).KCOOH处理土壤的pH显著上升Eh显著下降的原因,可能是由于土壤中COOH- 被微生物降解需要消耗氧气,导致土壤氧化还原电位降低(Fay and Shi, 2012).氧化还原电位降低进一步影响土壤pH,因为土壤中的H+会参加氧化还原反应.与CMA不同,CH3COO-对土壤pH有很强的缓冲作用,而CHOO-的酸度系数pKa为3.73显著低于土壤pH,因此CHOO-对土壤pH的缓冲作用不明显(Rasa et al., 2006).
Pb和Cu是城市土壤环境中常见的重金属污染物.本试验研究表明KCOOH对城市街道绿化土壤中Pb和Cu的释放量远低于NaCl处理.0.1 mol · L-1 KCOOH处理下土壤对Pb的释放量为土壤Pb全量的2.62%,而同浓度NaCl处理土壤对Pb的释放量为土壤Pb全量的6.63%;0.1 mol · L-1 KCOOH处理下土壤对Cu的释放量为土壤Cu全量的10.72%,而同浓度NaCl处理土壤对Cu的释放量为土壤Cu全量的15.48%.同浓度NaCl和KCOOH处理下土壤对Cu的释放量均高于对Pb的释放量,证实了Pb在土壤中的高稳定性(Bäckström et al., 2004; Norrström,2005).Harrison等(1981)的研究也得到了相似的结论,在1.0 mol · L-1 MgCl2的交换作用下,街道绿化土壤和灰尘中Pb的迁移量低于1.5%.在天然的多孔介质中(如土壤和地下蓄水层),胶体为载体的运移方式是Pb和Cu淋溶浸出的主要途径之一(Grolimund and Borkovec, 2005; Um and Papelis, 2002; Tang and Weisbrod, 2009).因此,胶体必须先从固体基质中被释放,在悬浮液中达到足够的数量,并保持足够长的时间.这个最重要的过程发生时,首先需要保证土壤被一价阳离子所饱和.土柱淋溶试验中融雪剂含有的高盐离子和低电解质水改变了土壤的离子强度,为胶体迁移提供了前提(Norrström and Bergstedt, 2001; Nelson et al., 2009).
本试验中NaCl处理下土壤对Pb和Cu的释放量与254 nm吸光度值的相关性分析表明,NaCl处理下土壤对Pb、Cu释放量和254 nm吸光度值之间具有极显著的相关性(rPb=0.823,p<0.01;rCu=0.903,p<0.01).NaCl处理下土壤可溶性有机质淋溶特征的试验结果表明,土壤中高浓度的Na+导致土壤pM(金属离子浓度的负对数)值升高而引起土壤粘土颗粒的弥散,从而影响土壤团聚体的稳定性和土壤渗透性(李小刚等,2004; 余海英等,2009).
Norrström和Jacks(1998)研究表明公路旁土壤Pb多呈氧化物形态而Cu多以胶体吸附形态存在.高Na和低离子强度是土壤胶体扩散的主要原因,从而导致与土壤胶体紧密吸附的金属得以释放(Amrhein et al., 1992).Amrhein 等(1992)的研究也表明,实验中Cr、Pb、Ni、Fe和Cu的释放量与土壤中吸附一价阳离子的含量显著相关.KCOOH处理对土壤有机质的释放规律与NaCl一致,然而KCOOH处理对土壤胶体扩散的作用更小.同时,与NaCl处理不同,从土壤对Pb和Cu的淋溶释放动态变化情况看(图 2和图 4),KCOOH处理下Pb和Cu的淋溶高峰值出现在L/S=0.6~1.0,即第一次低离子强度水淋洗作用下.分析淋溶后期KCOOH对Pb和Cu释放量降低的原因,可能为COOH-被微生物降解,土壤pH升高,重金属易通过与氧化物、超氧化物和碳酸盐的协同沉淀作用降低金属迁移性(Amrhein and Strong, 1990).Ostendorf等(1997)的研究也指出CMA可与土壤中的Zn和Pb形成碳酸盐沉淀,从而降低Zn和Pb的迁移性.
本研究中重金属的迁移是一个总计值,即融雪剂使用直接或间接所造成的金属迁移的趋势和水平.KCOOH对土壤中Pb和Cu的释放量均低于NaCl.有研究表明,与NaCl相比CMA可能通过Ca2+和Mg2+的离子交换作用增加土壤溶液中重金属Cd和Zn的浓度(Amrhein and Strong, 1990; Schwab et al., 2008),因此,与NaCl和CMA的环境效应相比,KCOOH可能是更好的选择,但KCOOH对其他金属元素的释放及在其他环境介质中的生态效应有待进一步研究.
5 结论(Conclusions)1)随NaCl和KCOOH处理浓度的增加,土壤对Pb、Cu的释放量均增大.同浓度NaCl和KCOOH处理土壤对Cu的释放量均高于对Pb的释放量.0.1 mol · L-1 KCOOH处理下土壤对Pb和Cu的释放量为土壤Pb和Cu全量的2.62%和10.72%,而同浓度NaCl处理土壤对Pb和Cu的释放量为土壤Pb和Cu全量的6.63%和15.48%.
2)两种处理下土壤对Pb、Cu释放量与土壤可溶性有机质含量显著相关,表明胶体运移是NaCl和KCOOH处理下重金属Pb、Cu迁移的主要方式.NaCl处理下土壤对Pb、Cu释放量与土壤可溶性有机质含量之间具有极显著的相关性(p<0.01),相关系数r分别为0.823和0.903;KCOOH处理下土壤对Pb释放量与土壤可溶性有机质含量的相关性显著(r = 0.421,p<0.05),Cu释放量与土壤可溶性有机质含量的相关性极显著(r=0.436,p<0.01).
3)KCOOH对土壤中Pb和Cu的释放量均低于NaCl.KCOOH对土壤胶体扩散的作用较NaCl更小,以及KCOOH处理下土壤氧化还原电位降低、pH升高是土壤中Pb、Cu易于固定的主要原因.
| [1] | Akbar K F, Headley A D, Hale W H G, et al. 2006. A comparative study of de-icing salts (sodium chloride and calcium magnesium acetate) on the growth of some roadside plants of England [J]. Journal of Applied Sciences and Environmental Management, 10(1): 67-71 |
| [2] | Allert A L, Cole-Neal L C, Fairchild J F. 2012. Toxicity of chloride under winter low-flow conditions in an urban watershed in central Missouri, USA [J]. Bulletin of Environmental Contamination and Toxicology, 89(2): 296-301 |
| [3] | Amrhein C, Strong J E. 1990. The effect of deicing salts on trace metal mobility in roadside soils [J]. Journal of Environmental Quality, 19(4): 765-772 |
| [4] | Amrhein C, Strong J E, Mosher P A. 1992. Effect of deicing salts on metal and organic matter mobilization in roadside soils [J]. Environmental Science and Technology, 26(4): 703-709 |
| [5] | Bäckström M, Karlsson S, Bäckman L, et al. 2004. Mobilisation of heavy metals by deicing salts in a roadside environment [J]. Water Research, 38(3): 720-732 |
| [6] | Brenner M V, Horner R R. 1992. Effects of calcium magnesium acetate (CMA) on dissolved oxygen innatural waters [J]. Resources, Conservation and Recycling, 7(1/3): 239-265 |
| [7] | Bryson G M, Barker A V. 2002. Sodium accumulation in soils and plants along Massachusetts roadsides [J]. Communications in Soil Science and Plant Analysis, 33(1/2): 67-78 |
| [8] | Czerniawska-Kusza I, Kusza G, Du yński M. 2004. Effect of deicing salts on urban soils and health status of roadside trees in the Opole region [J]. Environmental Toxicology, 19(4): 296-301 |
| [9] | Fay L, Shi X M. 2012. Environmental impacts of chemicals for snow and ice control: state of the knowledge [J]. Water, Air, and Soil Pollution, 223(5): 2751-2770 |
| [10] | Findlay S E G, Kelly V R. 2011. Emerging indirect and long-term road salt effects on ecosystems [J]. Annals of the New York Academy of Sciences, 1223: 58-68 |
| [11] | Fischel M. 2001. Evaluation of selected deicers based on a review of the literature . http://bibvir2.uqac.ca/archivage/17775044.pdf |
| [12] | Grolimund D, Borkovec M. 2005. Colloid-facilitated transport of strongly sorbing contaminants in natural porous media: mathematical modeling and laboratory column experiments [J]. Environmental Science and Technology, 39(17): 6378-6386 |
| [13] | Harrison R M, Laxen D P H, Wilson S J. 1981. Chemical association of lead, cadmium, copper, and zinc in street dusts and roadside soils [J]. Environmental Science and Technology, 15(11): 1378-1383 |
| [14] | Hellstén P P, Salminen J M, Jrgensen K S, et al. 2005. Use of potassium formate in road winter deicing can reduce groundwater deterioration [J]. Environmental Science Technology, 39(13): 5095-5100 |
| [15] | 蒋新元, 李阁男, 赵梦婕. 2012. 竹醋基有机酸钙对建兰生长及土壤性质的影响 [J]. 中南林业科技大学学报, 32(1): 207-210 |
| [16] | Kim S Y, Koretsky C. 2013. Effects of road salt deicers on sediment biogeochemistry [J]. Biogeochemistry, 112(1/3): 343-358 |
| [17] | Li F Y, Fan Z P, Xiao P F, et al. 2009. Contamination, chemical speciation and vertical distribution of heavy metals in soils of an old and large industrial zone in Northeast China [J]. Environmental Geology, 57(8): 1815-1823 |
| [18] | Li F Y, Zhang Y, Fan Z P, et al. 2011. Accumulation of deicing salts and heavy metals in urban roadside soils in Northeast China . Annual Congress of Envrionmental Science. Japan. 97 |
| [19] | 李小刚, 曹靖, 李凤民. 2004. 盐化及钠质化对土壤物理性质的影响 [J]. 土壤通报, 35(1): 64-72 |
| [20] | 罗雪梅, 陈新之, 王侃, 等. 2004. 沈阳市蔬菜生产基地重金属污染及评价[J]. 环境保护科学, 29(4): 43-45 |
| [21] | Nelson S S, Yonge D R, Barber M E. 2009. Effects of road salts on heavy metal mobility in two Eastern Washington soils [J]. Journal of Environmental Engineering, 135(7): 505-510 |
| [22] | Norrström A C, Jacks G. 1998. Concentration and fractionation of heavy metals in roadside soils receiving de-icing salts [J]. The Science of the Total Environment, 218(2/3): 161-174 |
| [23] | Norrström A C, Bergstedt E. 2001. The impact of road de-icing salts (NaCl) on colloid dispersion and base cation pools in roadside soils [J]. Water, Air, and Soil Pollution, 127(1/4): 281-299 |
| [24] | Norrström A C. 2005. Metal mobility by de-icing salt from an infiltration trench for highway runoff [J]. Applied Geochemistry, 20(10): 1907-1919 |
| [25] | Ostendorf D W, DeGroot D J, Pollock S J, et al. 1997. Aerobic degradation potential assessment from oxygen and carbon dioxide soil gas concentrations in roadside soil [J]. Journal of Environmental Quality, 26(2): 445-453 |
| [26] | 彭丽成, 黄占斌, 石宇, 等. 2011. 不同环境材料对Pb、Cd污染土壤的淋溶效应 [J]. 环境科学学报, 31(5): 1033-1038 |
| [27] | Ramakrishna D M, Viraraghavan T. 2005. Environmental impact of chemical deicers-a review [J]. Water, Air, and Soil Pollution, 166(1/4): 49-63 |
| [28] | Rasa K, Peltovuori T, Hartikainen H. 2006. Effects of de-icing chemicals sodium chloride and potassium formate on cadmium solubility in a coarse mineral soil [J]. Science of the Total Environment, 366(2/3): 819-825 |
| [29] | Robidoux P Y, Delisle C E. 2001. Ecotoxicological evaluation of three deicers (NaCl, NaFo, CMA)—Effect on terrestrial organisms [J]. Ecotoxicology and Environmental Safety, 48(2): 128-139 |
| [30] | Schwab A P, Zhu D S, Banks M K. 2008. Influence of organic acids on the transport of heavy metals in soil [J]. Chemosphere, 72(6): 986-994 |
| [31] | Tang X Y, Weisbrod N. 2009. Colloid-facilitated transport of lead in natural discrete fractures [J]. Environmental Pollution, 157(8/9): 2266-2274 |
| [32] | Um W, Papelis C. 2002. Geochemical effects on colloid-facilitated metal transport through zeolitized tuffs from the Nevada Test Site [J]. Environmental Geology, 43(1/2): 209-218 |
| [33] | Wahlström M. 1996. Nordic recommendation for leaching tests for granular waste material [J]. Science of the Total Environment, 178(1/3): 95-102 |
| [34] | 余海英, 孔亚平, 张科利, 等. 2009. 融雪剂在路域土壤中的累积、扩散及其对土壤性质的影响 [J]. 水土保持学报, 23(6): 182-214 |
| [35] | 张营, 李法云, 严霞, 等. 2012. 外源K+和水杨酸在缓解融雪剂对油松幼苗生长抑制中的效应与机理 [J]. 生态学报, 32(14): 4300-4308 |
| [36] | 赵菲. 2012. 醋酸钙镁融雪剂对土壤中重金属形态和地表水中溶解氧含量的影响 . 吉林: 吉林大学. 10-48 |
 2015, Vol. 35
2015, Vol. 35


