人们对土壤与环境的保护及农业可持续发展已成为当今世界人类面临的重要课题(何振立,1998),其中,土壤重金属污染已成为环境体系中尤为突出的问题之一.重金属离子在土壤中的积累、迁移和转化受制于土壤体系中的多种物理化学和生物过程,而其在土壤固/液界面上的行为却决定于土壤固相对重金属离子的吸附/解吸特性(凌婉婷等,2002).
土壤中重金属的吸附特征及其影响因素已经进行了大量的研究,并取得了许多重要的进展(虞锁富,1991;张磊等,2005;景丽洁等,2008;Sprynskyy et al., 2011;Jiang et al., 2012).在所有影响因素中,土壤表面电化学性质制约着重金属离子在土壤胶体表面的扩散、吸附和解吸行为,是影响土壤吸附/解吸重金属最根本的原因之一(熊毅等,1990).然而,在土壤中重金属离子交换的动力学规律研究中,大多集中在离子类型、离子强度和环境条件等因素对重金属离子吸附/解吸的影响(张磊等,2005;孟昭福等,2011;Bouzidi et al., 2010;Chalghaf et al., 2013;Komy et al., 2014),而并未考虑土壤表面电场对重金属离子吸附/解吸的影响,也并未对重金属离子吸附/解吸动力学的机理做出理论分析.
按照Gouy-Chapman理论,当本体溶液为10-4 mol · L-1的NaCl,且土壤颗粒表面电位为-300 mV 时,在298 K时表面电场高达2.88×106 V · cm-1,在距离土壤颗粒表面30 nm处的溶液中的电场强度达1.57×105 V · cm-1,即使是在距离土壤颗粒表面100 nm 处的电场强度仍达1.18×103 V · cm-1.可见,在研究土壤颗粒表面离子的交换动力学过程中,电场力是一个不能忽略的重要推动力(李睿等,2010).
目前,李航等研究发现,离子交换吸附和离子扩散完全是同一个过程,即扩散双电层中的离子交换过程的本质是各种离子在外电场中由活度梯度(包含浓度梯度和电位梯度)推动下的“混合”过程(Li et al., 2007;2010).同时,李睿等提出了考虑土壤电场作用下的离子扩散与吸附的新动力学理论,并且发现离子交换平衡的一些重要参数完全可以用建立起来的动力学新理论做出定量计算(Li et al., 2011a;2011b).本文将在此基础上对黄壤中不同金属离子的吸附/解吸动力学过程进行研究,以期为进一步揭示土壤中重金属离子吸附/解吸机理提供依据.
2 材料与方法(Materials and methods) 2.1 实验试剂与仪器硝酸锌、硝酸铜和硝酸钾均为分析纯;AXLB实验室超纯水机,FA2004A电子天平,DBS-100电脑全自动部分收集器及BT-200B数显恒流泵,日立Z-5000原子吸收分光光度计.
2.2 实验方法 2.2.1 实验样品的制备供试土壤为重庆市北碚区鸡公山黄壤(矿子黄泥).根据Low(1980)的方法测得黄壤pH为5.12时的阳离子交换量为6.38 cmol · kg-1,比表面积为35000 m2 · kg-1.取一份50 g黄壤样品加入0.1 mol · L-1的KNO3溶液1000 mL,并于三角瓶中恒温振荡24 h,离心去掉上清液,反复处理3次,使黄壤颗粒表面负电荷全部被K+吸附饱和.然后将离子吸附饱和后的样品用超纯水洗去本体溶液中多余的K+,将所得样品70 ℃烘干后磨细过0.25 mm筛备用.
2.2.2 固/液界面的离子吸附/解吸实验离子吸附实验采用静态恒流法(Li et al., 2009),实验装置如图 1所示.称取黄壤K+饱和样0.5 g左右(实验完成后,烘干样品再精确称得样品的实际质量),平铺在铺有滤纸的交换柱上.为尽可能消除离子扩散受纵向浓度梯度的影响,样品层应尽可能薄.本实验设计的样品层厚度约为0.2~0.3 mm,样品面积约为15 cm2.然后在298 K的恒温条件下分别与给定浓度(5×10-5 mol · L-1、1×10-4 mol · L-1)的交换液(Cu(NO3)2和Zn(NO3)2)以1 mL · min-1的恒定流速通过交换柱上的待交换样品,用自动部分收集器按10 min的设定时间间隔收集从实验装置中流出的流动液,用原子吸收分光光度计分别测定流出液中Cu2+/Zn2+的浓度及原液Cu2+/Zn2+浓度,分别称取实验前后试管各自的质量,计算出Cu2+/Zn2+的吸附量.
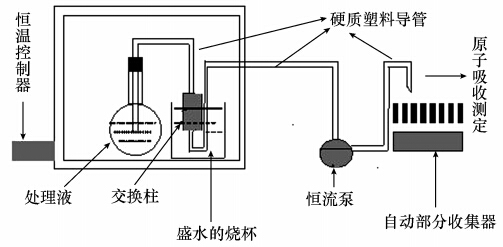 |
| 图 1 实验装置示意图 Fig. 1 Schematic diagram of experimental devices |
同样地,在解吸实验中,在298 K 的恒温条件下用1×10-2 mol · L-1的交换液(Cu(NO3)2/Zn(NO3)2)以1 mL · min-1的恒定流速通过交换柱上的待交换样品,使样品达到Cu2+/Zn2+饱和;然后再与给定浓度(5×10-5 mol · L-1、1×10-4 mol · L-1)的KNO3溶液以1 mL · min-1的恒定流速通过交换柱上的样品,用自动部分收集器按10 min的设定时间间隔收集从实验装置中流出的流动液,用原子吸收分光光度计分别测定流出液中Cu2+/Zn2+的浓度,分别称取实验前后试管各自的质量,计算出Cu2+/Zn2+的解吸量.
3 结果与讨论(Results and discussion) 3.1 黄壤表面电场下Cu2+和Zn2+的吸附动力学过程李航等(1996)研究发现,如果土壤固体颗粒表面对离子存在快速的强作用力吸附,则吸附过程中可能存在零级动力学特征,其动力学方程为:
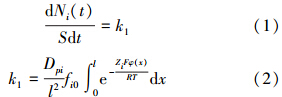
式中,Ni(t)为离子在t时的吸附量(mmol · kg-1),S为 比表面积(m2 · kg-1),k1为速率常数(mmol · min-1 · m-2),fi0为离子i的初始浓度(mol · L-1),l为扩散距离(m),φ(x)为表面电位(mV),Zi为离子i的电荷数量,F为Faraday常数(96485.34 C · mol-1),R为气体常数(8.314 J · mol-1 · K-1),T为绝对温度(K),Dpi为离子i的扩散系数,通常Dpi=θ(l/le)2Dir(Kemper et al., 1966),θ是体积含水量,(l/le)2是弯曲因子,Di是离子的扩散系数,r是考虑离子相互作用的系数.
当表面上的强静电力吸附作用已达到饱和,体系将在较弱的静电力作用下继续进行,此时离子扩散距离将由0-l缩短至0-l′,离子的吸附动力学将表现为一级动力学特征,吸附的速率方程可以表达为(Li et al., 2011b):
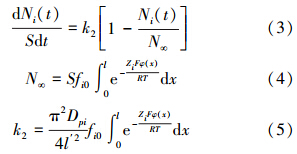
式中,N∞为平衡吸附量(mmol · kg-1),k2为速率常数(mmol · min-1 · m-2).为了直接利用实验数据,将式(1)、(3)表达成差分形式则更加方便:
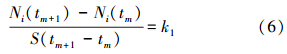
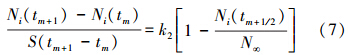
式中,m=0,1,2,3,……;Ni(tm+1/2)=Ni(tm)+0.5[Ni(tm+1)-Ni(tm)]
据前面分析,如果体系同时存在零级和一级速率过程,则所得实验数据通过[Ni(tm+1)-Ni(tm)]/S(tm+1-tm)对Ni(tm+1/2)作图应得两条直线,即先出现一条截距等于k1且平行于横轴的直线,然后转为一条截距等于k2且斜率等于π2Dpi/4l′2S的直线.这两条直线的转折点出现的时间应代表体系由强吸附作用转为弱吸附作用的时间.由于l′<l,所以k2>k1,因此,如果体系同时存在强吸附和弱吸附作用,则实验结果可能得到如图 2所示的两条直线.
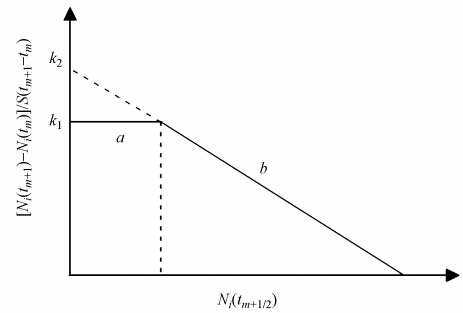 |
| 图 2 同时存在强吸附和弱吸附的吸附速率曲线(a:强吸附;b:弱吸附;Ni:离子吸附量;tm:吸附时间;k1:强吸附速率常数;k2:弱吸附速率常数) Fig. 2 Adsorption rate curves containing both strong and weak force adsorptions |
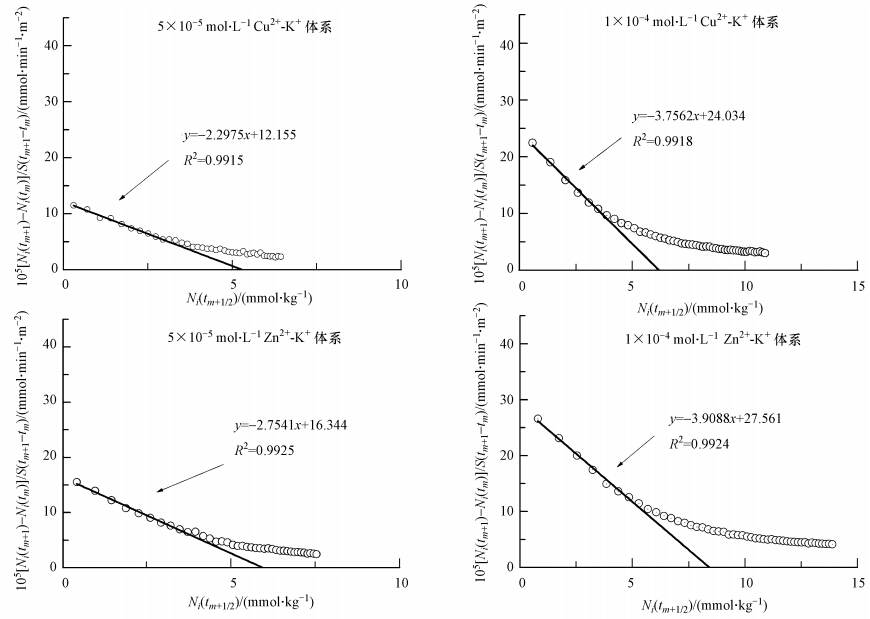
直接利用恒流实验中得到的动力学实验数据,用[Ni(tm+1)-Ni(tm)]/S(tm+1-tm)对Ni(tm+1/2)作图,所得结果列于图 3.由图 3可知:①观察到的零级和一级动力学过程与图 2的理论预期一致;②不同浓度的Cu2+和Zn2+的吸附实验在初期都出现了零级速率特征,说明黄壤颗粒表面对Cu2+和Zn2+的吸附都存在强吸附作用,且随着电解质浓度的降低,零级速率过程持续时间越长;③实验进行到一定时间后,表现出一级速率特征,且在相同浓度下,Cu2+-K+体系中的直线斜率低于Zn2+-K+体系中对应的直线斜率;④在Cu2+-K+体系中,零级吸附速率值(k1)和一级吸附速率值(k2)均大于Zn2+-K+体系中对应的吸附速率值,说明Cu2+-K+体系中,Cu2+的吸附速率快于Zn2+-K+体系中Zn2+的吸附速率;⑤在吸附实验中,电解质浓度为1×10-4 mol · L-1和5×10-5 mol · L-1时,Cu2+、Zn2+的吸附动力学从零级向一级的转折点的出现时间分别为40、110 min和30、80 min,可见Cu2+-K+交换体系的零级与一级过程持续时间更久;⑥在图 3中,所得曲线与横轴相交处所对应的值均是Cu2+-K+体系大于Zn2+-K+体系,说明黄壤胶体表面对Cu2+的吸附量大于对Zn2+的吸附量,对Cu2+的吸附力能力更强.
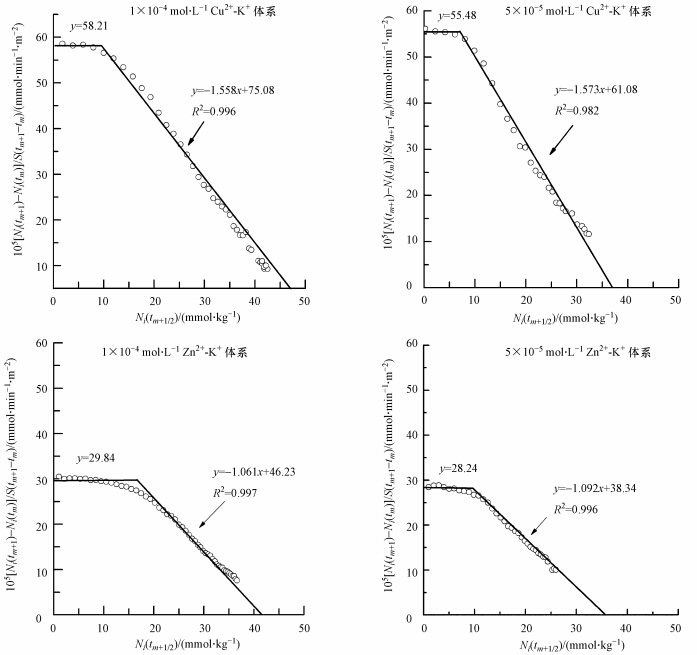 |
| 图 3 Cu2+和Zn2+扩散/吸附动力学实验结果 Fig. 3 Experimental results of Cu2+ and Zn2+ diffusion/adsorption kinetics |
根据式(7),利用实验得到一级速率方程的直线斜率和截距值,就可以通过式(8)精确地计算出离子交换平衡时Cu2+、Zn2+的平衡吸附量N∞的值;同时,利用实验(s)得到的k1和k2值,可以通过式(9)进一步得到l′/l的值.根据图 3中的实验结果,结合式(8)、(9),就可以得出速率方程中的各参数值,所得结果列于表 1.
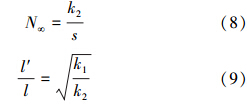
由表 1可以看出:①由于弱静电力吸附阶段的扩散距离缩小(l′<l),导致该阶段的吸附速率明显快于强吸附力阶段(k2>k1);②分析不同浓度下的π2Dpi/4l′2S值,浓度越高,π2Dpi/4l′2S值越大,原因在于电解质浓度越高,单位时间内进入扩散双电层的离子数量增加,致使下一单位时间内进入扩散双电层的离子实际扩散路径(l′)缩短,导致π2Dpi/4l′2S变大;③比较不同电解质的k1值发现,相同浓度的Cu2+-K+体系中Cu2+的吸附速率值比Zn2+-K+体系中Zn2+的吸附速率值大4%~6%,说明在强吸附阶段,黄壤颗粒表面对Cu2+的吸附作用更强;④在弱静电力吸附阶段,相同浓度的Cu2+-K+体系中Cu2+的吸附速率k2值比Zn2+-K+体系中Zn2+的吸附速率值高13%~14%,其主要原因是,在弱静电力吸附阶段,Cu2+-K+体系中l′减小,Cu2+的扩散距离缩小,导致该体系中Cu2+的吸附速率明显加快;⑤Zn2+-K+体系中l′/l值均大于Cu2+-K+体系,可见Cu2+-K+体系中Cu2+的扩散距离(l′)更小,与前文的分析相吻合;并且黄壤颗粒表面对Cu2+的吸附作用更强,因此,Cu2+-K+体系的平衡吸附量N∞大于Zn2+-K+体系的平衡吸附量,在相同浓度条件下,Cu2+-K+体系的平衡吸附量N∞比Zn2+-K+体系的平衡吸附量大25%~28%.
| 表 1 利用动力学实验数据得到的离子吸附速率方程中的有关参数 Table 1 Parameters in adsorption rate equations obtained by the kinetics experimental data |
前面的分析表明,在相同浓度的电解质体系下,Cu2+的吸附速率值和平衡吸附量N∞均大于Zn2+的吸附速率值和平衡吸附量N∞,黄壤颗粒表面对Cu2+的吸附作用强于对Zn2+的吸附作用.那么是什么原因造成这种情况的出现呢?首先,根据静电场理论,Cu2+和Zn2+同属于二价离子,在电解质浓度相同的情况下,黄壤胶体表面电场对Cu2+和Zn2+的静电作用力应该相等,因此,如果只考虑黄壤胶体表面电场这一单一因素并不能解释Cu2+和Zn2+的吸附动力学产生差异的原因;其次,Cu2+和Zn2+虽然同属于二价离子,但由于Cu2+和Zn2+的电子构型分别为[Ar]3d9和[Ar]3d10,Zn2+的d轨道电子全部充满,原子半径大于Cu2+的原子半径,因此,Zn2+的核外电子受到原子核的束缚力更弱,同时Zn2+的核外电子在黄壤胶体表面电场中更易发生极化,使Zn2+产生更强的极化电荷电场,因而黄壤胶体表面电场会与Zn2+的极化电荷电场发生耦合作用,其耦合作用的结果是,在外电场中Zn2+将受到比Cu2+更弱的引力(Liu et al., 2014).因此,与Zn2+比较,这种耦合作用使得Cu2+更为紧密地吸附于黄壤胶体表面,并且会使得黄壤胶体表面电场的强弱发生变化.
基于李航等的研究(Li et al., 2004),可利用表 1中的参数计算出该体系的表面电化学参数并列于表 2.从表 2可以看出:①虽然样品的表面电荷密度不高,但其表面电场强度可以高达108 V · m-1的数量级,也就证明整个固液界面交换体系都在黄壤颗粒表面电场的控制之下,交换体系中的离子交换动力学过程强烈地受到黄壤颗粒表面电场的作用;②在Cu2+-K+体系中,黄壤胶体表面电场与Zn2+-K+体系中的黄壤胶体表面电场并不相等,因此,Cu2+和Zn2+的吸附动力学差异并不是黄壤胶体表面电场这一单一因素造成的,而是黄壤胶体表面电场与离子外层极化电荷电场的耦合作用的结果;③Cu2+-K+体系的表面电化学参数φ0、σ0、E0均大于Zn2+-K+体系中的对应值,说明黄壤颗粒表面对Cu2+的吸附作用强于Zn2+,与上文的实验现象相吻合.
| 表 2 吸附实验各交换体系中的表面电化学参数 Table 2 Surface electrochemical parameters in different adsorption systems |
Cu2+、Zn2+在黄壤表面的吸附作用是金属离子与黄壤表面功能团之间化学键吸附与静电吸附综合作用的结果,因此,在实验上如何区分这两种吸附作用仍然是一个难题.根据李睿等的研究(Li et al., 2011b),在不存在专性吸附或专性吸附可以忽略的情况下,电场作用下的离子解吸过程可以用一级动力学过程来表达,其速率方程为:
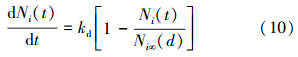
式中,kd为解吸过程的速率常数(mmol · min-1 · m-2);Ni∞为平衡时的解吸量(mmol · kg-1),且:
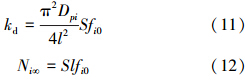
方程(10)表明,对于解吸过程而言,fi0越高,则解吸速率就越快.将实验数据通过[Ni(tm+1)-Ni(tm)]/S(tm+1-tm)对Ni(tm+1/2)作图只会得到一条直线,此直线截距为kd,斜率为π2Dpi/4l2S,所以实验结果可能是如图 4所示的一条直线.因此,如果Cu2+、Zn2+在黄壤表面的解吸作用是在静电力作用下发生的解吸作用,那么,所得实验数据通过[Ni(tm+1)-Ni(tm)]/S(tm+1-tm)对Ni(tm+1/2)作图,应为如图 4所示的直线.
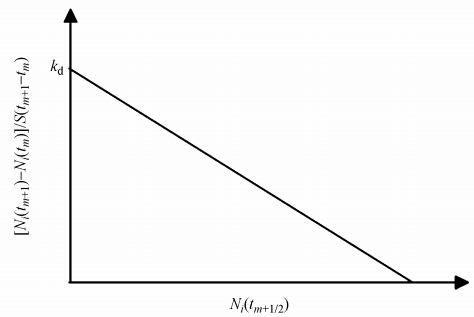 |
| 图 4 静电作用下的解吸附速率曲线(Ni:离子解吸量;tm:解吸时间;kd:解吸速率) Fig. 4 Desorption rate curves under electric field force |
直接利用恒流实验中得到的动力学实验数据,用[Ni(tm+1)-Ni(tm)]/S(tm+1-tm)对Ni(tm+1/2)作图,所得不同浓度不同离子的结果列于图 5.从图 5所示的实验结果可看出:①不同浓度K+解吸Cu2+、Zn2+的实验结果与图 4的理论预期有差别,原因是黄壤是一种可变电荷土壤,Cu2+、Zn2+在黄壤胶体表面的吸附方式除了静电吸附外还存在专性吸附,因而以静电力吸附在黄壤胶体表面的离子可以通过解吸进入到土壤溶液中,而另一部分以专性吸附的离子很难被解吸,从而使得实验结果与图 4所示的静电力作用下的解吸过程有差别;②不同浓度K+解 吸Cu2+、Zn2+前期都出现了一级速率特征,说明Cu2+、Zn2+解吸动力学过程前期为一个弱扩散/吸附过程;③在解吸过程进行一定时间之后,速率明显降低,亦不再呈现一级动力学特征;这是由于在解吸初期离子活度高,本身交换能力较弱的K+能将通过静电吸附在黄壤胶体表面的Cu2+、Zn2+解吸下来,当通过静电吸附在黄壤胶体表面的Cu2+、Zn2+完全解吸进入土壤溶液中之后,即使K+浓度不变,也很难将以专性吸附的Cu2+、Zn2+解吸下来;④图 5中,所得直线与横轴相交处所对应的值即是静电作用下达到解吸平衡时的解吸量,K+浓度相同时,Zn2+-K+体系均大于Cu2+-K+体系,说明K+对黄壤颗粒表面吸附的Zn2+的解吸量大于对Cu2+的解吸量,即黄壤颗粒表面对Cu2+的吸附作用更强;⑤不同K+浓度下,Cu2+、Zn2+的解吸量随着K+浓度的升高而增加.
 |
| 图 5 K+扩散/解吸Cu2+和Zn2+动力学实验结果 Fig. 5 Experimental results of Cu2+ and Zn2+ diffusion/desorption kinetics |
根据图 5中的实验结果,结合式(8),就可以得出静电作用下解吸速率方程中的各参数值,所得结果列于表 3.由表 3可以看出:①分析不同浓度的π2Dpi/4l2S值,浓度越大,π2Dpi/4l2S值越大,原因在于电解质浓度越大,单位时间内进入扩散双电层的离子数量增加,致使下一单位时间内进入扩散双电层的离子实际扩散路径(l)缩短,导致π2Dpi/4l2S变大;②比较不同离子的解吸速率常数kd,Zn2+-K+体系的解吸速率kd比Cu2+-K+体系快15%~34%,这是由于在吸附过程中,黄壤颗粒表面对Cu2+的吸附能力明显比对Zn2+的吸附能力强,故当相同浓度K+去解吸时,Cu2+比Zn2+更难解吸下来,所以Cu2+-K+体系的解吸速率kd值比Zn2+-K+体系小;③比较不同离子的平衡解吸量,Zn2+-K+体系的平衡解吸量N∞比Cu2+-K+体系大10%~12%,原因也是由于黄壤颗粒表面对Cu2+的吸附能力明显比对Zn2+的吸附能力强,因此,Cu2+-K+体系的平衡解吸量N∞小于Zn2+-K+体系的平衡吸附量.
| 表 3 利用动力学实验数据得到的离子解吸速率方程中的有关参数 Table 3 Parameters in desorption rate equations obtained by the kinetics experimental data |
同样地,基于李航等的研究(Li et al., 2004),利用表 3中的参数计算出静电作用下该体系的表面电化学参数并列于表 4.从表 4可以看出:①尽管样品的表面电荷密度很小,但其表面电场强度却高达107 V · m-1数量级,也就证明整个固液界面交换体系都在黄壤表面电场的控制之下,交换体系中的离子解吸动力学过程强烈地受到黄壤表面电场的作用;②Zn2+-K+体系的表面电化学参数φ0、σ0、E0均大于Cu2+-K+体系中的对应值,说明黄壤颗粒表面对Zn2+-K+体系中K+的吸附作用强于Cu2+-K+体系中的K+,也就证明K+对Zn2+的解吸作用强于对Cu2+的解吸作用,即黄壤表面Zn2+的平衡解吸量大于Cu2+的平衡解吸量,与上文的实验现象相吻合;③对比表 2和表 4,不难发现吸附和解吸实验中,各交换体系的表面电场存在较大差异,吸附实验中的表面电场(108 V · m-1)比解吸实验的表面电场(107 V · m-1)多出1个数量级,证明了吸附实验是在更强的表面电场作用下进行的,并且表面电场强烈影响了其交换速率和平衡交换量.
| 表 4 解吸实验各交换体系中的表面电化学参数 Table 4 Surface electrochemical parameters in different desorption systems |
从上面的分析可知黄壤胶体表面带有大量电荷,因此,必须考虑黄壤胶体表面电场对重金属离子产生的静电吸附;同时,重金属离子在黄壤胶体表面易于发生专性吸附而表现出重金属离子解吸不完全的现象.实际上,在任何实验条件下所得到的离子解吸动力学数据均是离子在溶液中受到的各种作用力(包括静电力作用和专性吸附作用)的总体效应.通过我们的研究,可以计算出静电作用下的重金属离子的平衡解吸量,因此,提供了一种区分交换平衡中的物理交换和化学交换的方法.
4 结论(Conclusions)1)在考虑黄壤表面电场作用下,Cu2+-K+、Zn2+-K+交换/吸附体系中,实验初期阶段是强吸附作用下零级动力学过程和一定反应时间后的弱吸附作用下的一级动力学过程,且零级速率过程和一级速率过程之间存在明显的转折点.电解质浓度为1×10-4 mol · L-1和5×10-5 mol · L-1时,Cu2+、Zn2+的吸附动力学从零级向一级的转折点的出现时间分别为40、110 min和30、80 min,Cu2+-K+交换体系的零级与一级过程持续时间更长.
2)当电解质浓度相同时,不同电解质的交换体系中,其吸附动力学结果并不相同.在零级动力学过程和一级动力学过程中,由于Zn2+极化作用强于Cu2+,并与黄壤表面电场发生耦合作用,更多地减弱了表面电场,以致Zn2+将受到比Cu2+更弱的引力,导致Cu2+-K+体系中Cu2+的吸附速率值、平衡吸附量N∞和表面电化学参数都比Zn2+-K+体系中Zn2+对应的值大,从而证明了黄壤颗粒表面对Cu2+的吸附作用强于Zn2+.
3)在考虑黄壤表面电场作用下,Cu2+-K+、Zn2+-K+交换/解吸体系中,只在实验前期出现一级动力学过程,与理论模型存在差异,原因在于专性吸附于黄壤表面的离子很难被解吸下来,以致于后期速率明显降低;且当电解质浓度相同时,不同电解质的交换体系中,其解吸动力学结果并不相同;Zn2+-K+体系的解吸速率比Cu2+-K+体系快,且Zn2+-K+体系的平衡解吸量N∞和表面电化学参数都比Cu2+-K+体系大,证明Zn2+-K+体系中Zn2+的解吸作用比Cu2+-K+体系中的Cu2+解吸作用强.
4)在黄壤表面发生的离子交换过程都受到其表面电场的强烈影响,利用解吸动力学数据和静电作用下的平衡解吸量,可能提供一种区分交换平衡中的物理交换和化学交换的方法.
| [1] | Bouzidi A,Souahi F,Hanini S.2010.Sorption behavior of cesium on Ain Oussera soil under different physicochemical conditions[J].Journal of Hazardous Materials,184(1/3): 640-646 |
| [2] | Chalghaf R,Oueslati W,Ammar M,et al.2013.Effect of temperature and pH value on cation exchange performance of a natural clay for selective (Cu2+,Co2+) removal: Equilibrium,sorption and kinetics[J].Progress in Natural Science-Materials International,23(1): 23-35 |
| [3] | 何振立.1998.污染及有益元素的土壤化学平衡[M].北京:中国环境科学出版社 |
| [4] | Jiang T,Jiang J,Xu R,et al.2012.Adsorption of Pb(II) on variable charge soils amended with rice-straw derived biochar[J].Chemosphere,89(3): 249-256 |
| [5] | 景丽洁,王敏.2008.不同类型土壤对重金属的吸附特性[J].生态环境,17(1): 245-248 |
| [6] | Kemper W D,Van Schaik J C.1966.Diffusion of salts in clay-water systems[J].Soil Science Society of America Journal,30(5): 534-540 |
| [7] | Komy Z R,Shaker A M,Heggy S E M,et al.2014.Kinetic study for copper adsorption onto soil minerals in the absence and presence of humic acid[J].Chemosphere,99: 117-124 |
| [8] | 李航,薛家骅.1996.土壤中离子扩散的动力学研究[J].土壤学报,33(4): 327-336 |
| [9] | Li H,Qing C L,Wei S Q,et al.2004.An approach to the method for determination of surface potential on solid/liquid interface: Theory [J].Journal of Colloid and Interface Science,275(1): 172-176 |
| [10] | Li H,Wu L S.2007.A new approach to estimate ion distribution between the exchanger and solution phases[J].Soil Science Society of America Journal,71(6): 1694-1698 |
| [11] | Li H,Wu L S,Zhu H L,et al.2009.Ion diffusion in the time-dependent potential of the dynamic electric double layer[J].The Journal of Physical Chemistry C,113(30): 13241-13248 |
| [12] | Li H,Li R,Zhu H L,et al.2010.Influence of electrostatic field from soil particle surfaces on ion adsorption-diffusion[J].Soil Science Society of America Journal,74(4): 1129-1138 |
| [13] | 李睿,李航.2010.土壤颗粒表面电场作用下固-液界面Mg2+-K+与Ca2+-K+交换动力学的比较研究[J].物理化学学报,26(3): 552-560 |
| [14] | Li R,Li H,Zhu H L,et al.2011a.Kinetics of cation adsorption on charged soil mineral as strong electrostatic force presence or absence[J].Journal of Soils and Sediments,11(1): 53-61 |
| [15] | Li R,Li H,Xu C Y,et al.2011b.Analytical models for describing cation adsorption/desorption kinetics as considering the electrostatic field from surface charges of particles[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects,392(1): 55-66 |
| [16] | 凌婉婷,李学垣,贺纪正,等.2002.土壤表面电荷特征与重金属吸附-解吸的相互关系[J].土壤通报,33(6): 456-460 |
| [17] | Liu X M,Li H,Li R,et al.2014.Strong non-classical induction forces in ion-surface interactions: General origin of Hofmeister effects [J].Scientific Reports,4: 5047 |
| [18] | Low P F.1980.The swelling of clay: II.Montmorillonites[J].Soil Science Society of America Journal,44(4): 667-676 |
| [19] | 孟昭福,万丹,邓晶,等.2011.Cu2+、Zn2+复合条件下Cd2+在陕西5种土壤中的吸附[J].农业环境科学学报,30(1): 71-77 |
| [20] | Sprynskyy M,Kowalkowski T,Tutu H,et al.2011.The adsorption properties of agricultural and forest soils towards heavy metal ions (Ni,Cu,Zn,and Cd)[J].Soil & Sediment Contamination,20: 12-29 |
| [21] | 佟雪娇,李九玉,姜军,等.2011.添加农作物秸秆炭对红壤吸附Cu(Ⅱ)的影响[J].生态与农村环境学报,27(5): 37-41 |
| [22] | 熊毅,陈家坊.1990.土壤胶体-第三册-土壤胶体的性质[M].北京: 科学出版社 |
| [23] | 虞锁富.1991.土壤对重金属离子的竞争吸附[J].土壤学报,28(1): 50-57 |
| [24] | 张磊,宋凤斌.2005.土壤吸附重金属的影响因素研究现状及展望[J].土壤通报,36(4): 628-631 |
 2015, Vol. 35
2015, Vol. 35


