2. 同济大学生物膜技术研究所, 污染控制与资源化研究国家重点实验室, 上海 200092
2. Institute of Biofilm Technology, Tongji University, State Key Laboratory of Pollution Control and Resource Reuse, Shanghai 200092
高浓度氨氮废水采用生化方法处理时,需要较高的供氧量和生物量,因而成为生化处理含氮污染物的难题之一.传统的生物脱氮工艺(即硝化-反硝化工艺)普遍存在着占地面积大、能耗高、外加碳源需求量大及脱氮效率低等不足.部分亚硝化和厌氧氨氧化联合技术是新型的废水生物脱氮方法,与传统的生物脱氮方法相比,该方法能够节省64%的能量需求和100%的外加碳源及减少80%~90%的污泥量(Henze,2008),特别是在高氨氮废水的治理方面存在很大的优势.膜曝气生物膜反应器(Membrane-aerated biofilm reactor,MABR)是利用透气膜进行曝气供氧的一种污水生物处理工艺,溶解氧通过气体透过性膜扩散进入生物膜进而氧化污染物,同时气体透过性膜也可作为生物膜生长的载体(Casey et al., 1999).传统的多孔或者微孔曝气装置氧的利用效率不高,膜曝气生物膜反应器由于采用无泡曝气的方式,氧气的传递效率可以接近100%(Wang et al., 2009;Ahmed et al., 2004).高效的氧传质速率、较高的生物膜表面积和内外分层的特殊生物膜结构,使得MABR工艺在高浓度废水的处理中具有明显的优势(Terada et al., 2003).
MABR特殊的生物膜分层结构能够实现在同一系统中同时发生氧化和还原作用,通过调整供氧压力来控制氧气的传递(Terada et al., 2004),氧气能够直接透过曝气膜被硝化菌利用(Satoh et al., 2004),为氨氧化菌的生长提供了良好的生存环境.有研究在MABR小试中实现了部分亚硝化(Wang et al., 2009;Lackner et al., 2010;Terada et al., 2006;Park et al., 2010;Nisola et al., 2013).但是,目前对于MABR中试系统中部分亚硝化的稳定运行的抑制条件(如生物膜厚、氨氮负荷等)及微生物机理方面的研究尚鲜有报道.
本文正是针对该问题,通过中试来考察MABR实现部分亚硝化的技术关键,重点分析在不同的氨氮负荷下,MABR工艺的部分亚硝化性能.从处理效果和生物膜特性两个层面上分析MABR部分亚硝化工艺作为厌氧氨氧化前处理单元的可行性和适用性,以期为MABR用于高浓度氨氮废水的工程应用提供技术支持.
2 材料与方法(Materials and methods) 2.1 试验装置试验装置如图 1所示,中试MABR的高度和直径分别为1000 mm和150 mm,反应器包括循环段在内有效容积共计16.7 L.反应器内部膜组件由48根致密无孔硅橡胶膜平行排列组成,总表面积0.37 m2,膜组件比表面积为22.16 m2 · m-3,系统采用贯通式曝气方式,进水通过蠕动泵打入反应器,上部空间溢流出水.
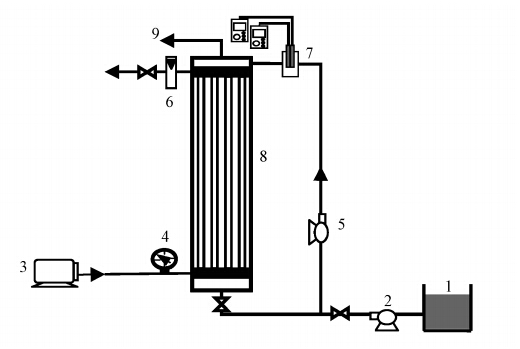 |
| 图 1 膜曝气生物膜反应器流程图(1.进水箱;2.进水泵;3.鼓风机;4.压力表;5.循环泵;6.流量计;7.pH和溶解氧电极;8.膜组件;9.出水) Fig. 1 Schematic diagram of the membrane-aerated biofilm reactor(MABR) |
反应器设置循环段进行水力混合,内部流速约为1.25 cm · s-1,利用NaCl为示踪剂进行水力停留时间分布(RTD)实验,结果表明,RTD曲线分布接近N=1时完全混合反应器,因此,可以假定MABR反应器内部处于完全混合状态.氧通量实验测定气体氧表面负荷,采用最大氧通量近似计算,在气体氧分压为20 kPa,循环流速为800 L · h-1条件下得到反应器最大氧传质系数KO2=0.81 m · d-1,本试验MABR最大氧通量由式(1)(Pellicer-Nàcher et al., 2010)计算.
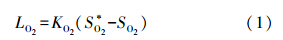
试验用水采用人工配制的模拟高浓度氨氮废水,不添加有机碳源,以碳酸氢铵作为氮源,碳酸氢钠为无机碳源和pH调节剂,每升配水中加入28 mg KH2PO4、224 mg MgSO4·7H2O、84.5 mg CaCl2·2H2O、 1 mL微量元素(Pynaert et al., 2004),NH4+-N浓度见表 1.
| 表1 MABR中试各阶段的运行条件 Table 1 Operational conditions of pilot-scale MABR at different stages |
试验过程采用温控装置保证水温在25~30 ℃,添加碳酸氢钠调节碱度,控制pH在7.5~8.3之间,供氧通过膜氧分压控制,稳定运行阶段,逐步提高进水氨氮浓度,同时调控HRT,控制反应器进水氨氮负荷.
由于中试装置膜组件设立膜丝数量较少,膜比表面积相对较小,后续研究中已证实成倍增加膜组件膜丝数量时,生物膜对污染物表面去除负荷相近,容积去除负荷成倍增加,因此,本研究中氨氮去除负荷采用生物膜表面去除负荷来表征,列出的容积负荷仅供参考.
2.3 水质分析方法pH和温度测定采用HACH HQ 系列便携式测定仪(HQ40d18,HACH,美国),DO测定采用在线溶解氧测定仪(JPB-607,上海雷磁),电导率测定采用在线电导率测定仪(DDSJ-308A,上海雷磁).水质指标NH4+-N、NO2--N和NO3--N测定参照国家环保总局发布的标准方法(国家环保总局,2002).
2.4 生物膜厚度测定采集完整生物膜样品,采用冷冻切片机(MEV,SLEE,德国)将生物膜沿曝气膜丝的径向切成50 μm厚的切片,切片置于载玻片上,通过配有测量装置的光学摄影显微镜(BA-310,中国Motic公司)测量生物膜的厚度,每片生物膜在不同位置测定3次,取平均值表征生物膜厚度.
2.5 亚硝化率计算方法亚硝化率(NAR)计算公式如下:
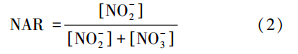
取1根完整曝气膜刮取生物膜,超声5 min后用磁力搅拌器打散使之均匀悬浮,去离子水清洗3次后,8000 r · min-1离心10 min,去掉上清液,投入内装搅拌子的测定瓶中待测.
氨氧化细菌、亚硝酸盐氧化菌和好氧异养菌的活性采用单位质量微生物的氧利用速率(Specific oxygen uptake rate,SOUR)来表征,分别以SOURAOB 、SOURNOB、SOURH表示(王建龙等,1999).根据悬浮微生物总量(MLSS),测定时间和溶解氧变化情况(溶解氧消耗曲线斜率),求得生物膜微生物比氧利用速率SOUR.
2.7 生物膜DNA提取和实时定量PCR用无菌剃刀从反应器曝气膜上刮取部分生物膜,立即提取DNA或者短期保存于-20 ℃冰箱中后提取DNA.DNA提取采用MB公司的Fast DNASpin Kit for Soil 试剂盒,提取后的DNA存放于-20 ℃冰箱中保存备用.采用Nanodrop 2000(美国,Thermo Scientific)纳米荧光定量仪检测DNA原始样本浓度.
采用美国ABI7500型实时荧光定量PCR系统对反应器中生物膜中的16S rRNA AOB(CTO)、16S rRNA Nitrospira sp.(NSR)进行荧光定量研究,分别用来表征生物膜中氨氧化细菌和亚硝酸盐氧化菌的含量.CTO前引物序列为CCGGAGGAAAG TAGGGGATCG,后引物序列为CTAGCYTTGTAGTTTCAAACGC(Rotthauwe et al., 1997),NSR前引物序列为CCTGCTTTCAGTT GCTACCG,后引物序列为GTTTGCAGCGCTTTG TACCG(Dionisi et al., 2002).每反应体系20 μL,包括10 μL SYBR Green mix,前引物和后引物各0.4 μL,0.4 μL ROX,6.8 μL无菌水,2 μL DNA模板,每个样品均重复3次,并添加HPLC级高纯水作为阴性对照组,数据采用3次平均值.
2.8 生物膜挂膜与中试系统启动接种污泥取自运行良好的上海某污水处理厂好氧段活性污泥.本试验启动采用循环挂膜法,将污泥和营养液按一定配比打入反应器,反应器内部循环水力混合,序批式运行,2 d后停止循环,更换营养液,继续循环运行2 d,排出未挂膜剩余污泥,之后连续进水.以连续进水的第1 d记为连续运行第1 d.
启动阶段,定期清洗反应器内部器壁,防止生物膜在非曝气膜载体上生长,一段时间后可观察到肉眼可见的生物膜结构,之后连续运行过程中由于渗透进入反应器液相中的溶解氧浓度受到限制,不用对反应器内部进行清洗.
3 结果与讨论(Results and discussion) 3.1 生物膜生长过程分析取MABR稳定运行时期的生物膜,认为此时生物膜结构和组成不再发生显著变化并处于相对稳定状态,生物膜厚度此时达到稳定,结果见表 2.从表 2中可以看出,MABR运行至第38、47、60、78 d的生物膜厚度分别为(76.6±8.4)、(117.7±11.5)、(173.7±16.3)和(255.7±25.0)μm.在MABR运行过程中,生物膜在不断的生长增厚,在运行初期生物膜增长较慢,在0~38 d仅增长至(76.6±8.4)μm,但从60~78 d的18 d过程中,生物膜增长了约82.0 μm.生物膜的增厚相对于活性污泥系统中污泥量的增加,运行后期生物膜增长较快,这与系统中底物浓度NH4+-N的增加密切相关,与活性污泥系统相同,生物膜的厚度存在最优值,生物膜过厚,底物的传质受到限制,在短程亚硝化系统中表现为对亚硝化性能的影响.
| 表2 MABR中试各阶段的生物膜厚度 Table 2 Biofilm thickness of pilot-scale MABR at different stages |
中试MABR连续运行过程中氮素的转化情况如图 2所示.启动阶段反应器出水氨氮浓度逐渐下 降,出水亚硝氮浓度逐渐上升,硝酸盐氮浓度基本维持不变;反应器初始阶段就出现亚硝酸盐的积累现象,初始自由氨(Free ammonium,FA)浓度约为1.29 mg · L-1,当FA浓度大于1 mg · L-1时会对NOB产生抑制,造成了亚硝酸盐的积累,而自由亚硝酸(Free nitrous acid,FNA)的积累(当FNA浓度大于0.22 mg · L-1(Anthonisen et al., 1976))反过来又会对NOB产生抑制作用.同时从图 2溶解氧变化曲线可以看出,在第0~14 d的启动运行阶段,溶解氧浓度迅速从5.3 mg · L-1下降到0.25 mg · L-1.AOB的氧饱和常数一般为0.2~0.4 mg · L-1,而NOB的为1.2~1.5 mg · L-1,低溶解氧首先会对NOB的活性造成抑制,AOB成为优势种群,出水中的亚硝态氮浓度逐渐升高,发生亚硝酸盐积累.阶段Ⅰ,液相中的溶解氧浓度浓度进一步下降,基本维持在0.5 mg · L-1以下,至阶段Ⅱ、Ⅲ、Ⅳ,溶解氧浓度几乎都在0.1 mg · L-1以下,反应器中供氧不足,液相中的溶解氧浓度几乎为零.因此,当生物膜开始在膜丝上形成后,液相中溶解氧的浓度就开始急剧降低至零.
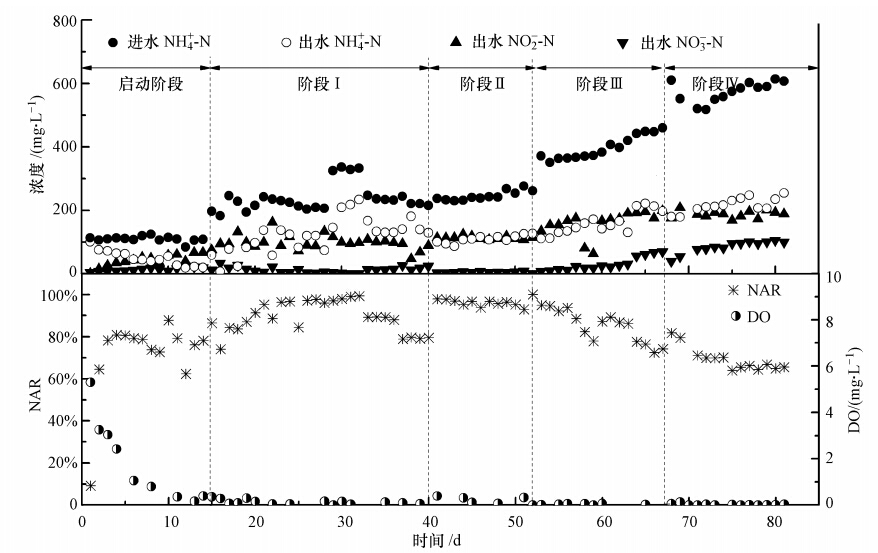 |
| 图 2 连续运行阶段氮素转化情况及亚硝化率和DO变化情况 Fig. 2 Change of nitrogen conversion,nitritation rate and DO in MABR under different conditions |
在系统运行的前61 d内,出水硝酸盐浓度很低,仅有亚硝酸盐的积累,亚硝化率(NAR)基本维持在80%以上,系统亚硝化效果较好,MABR系统可以达到稳定的亚硝化;但61d后,也就是运行的第III阶段后期和第IV阶段,出水硝酸盐浓度有逐渐上升的趋势,亚硝化率最终降至65%.这可能是因为前期生物膜较薄,系统运行至第38 d的生物膜厚度仅为(76.6±8.4)μm,生物量较低,第47 d的生物膜厚度为(117.7±11.5)μm,高负荷条件下,液相中高浓度的FA和FNA能够扩散至生物膜内部,对生物膜亚硝酸盐氧化菌(NOB)造成了抑制.后期,随着生物膜的生长增厚,至运行第60 d时,生物膜增厚至(173.7±16.3)μm,过厚的生物膜开始对FA和FNA的传质造成限制,接近曝气膜生长的NOB不受抑制,且氧基质充足,导致部分亚硝酸盐被氧化成硝酸盐,同时亚硝化率出现下降.并且随着运行时间的延长,生物膜进一步增厚,第78 d已增厚至(255.7±25.0)μm,且亚硝化率降至65%;同时,参考Schramm等(2000)和Terada等(2007)报道的利用微电极测定的成熟硝化生物膜中各物质的浓度梯度变化,远离膜表面的亚硝酸盐的减少趋势大于硝酸盐,导致亚硝酸盐反硝化得到强化,进而出水亚硝酸盐浓度降低.因此,在本研究中,生物膜的厚度应控制在大约110~170 μm之间,可以实现稳定的MABR部分亚硝化.关于如何控制生物膜厚度,在具体实践中硝化生物膜可以采用定期空气喷射的方式来进行清洗,对处理效率的影响较小(Stricker et al., 2011).
3.3 氨氮去除负荷由于本试验的目标是处理高氨氮废水,因此,本试验在同时提高氨氮浓度的情况下调整反应器的HRT,以进水氨氮负荷为控制因素.不同工况下MABR对氨氮去除负荷的变化情况如图 3所示.启动阶段进水氨氮负荷较低,仅为(4.9±0.4)g · m-2 · d-1,氨氮去除负荷逐渐上升并稳定在(3.4±0.5)g · m-2 · d-1,控制HRT,将进水氨氮浓度提高1倍,氨氮负荷升至(10.0±0.8)g · m-2 · d-1,初始前3 d由于高氨氮浓度的刺激作用,氨氮去除率和去除负荷一直处于上升趋势,且最大氨氮去除负荷达到9.3 g · m-2 · d-1.但随着运行时间的延长,总体的氨氮去除负荷和去除率波动较大并出现下降趋势,由于持续高负荷进水、高FA和不充足的氧通量(DO<0.1 mg · L-1),结果造成AOB和NOB的共同抑制.30 d时增加进水氨氮负荷至(14.9±0.2)g · m-2 · d-1考察氨氮的冲击负荷对去除效果的影响,冲击负荷期间,氨氮去除负荷和去除率逐渐下降,恢复进水氨氮负荷至冲击前水平,去除负荷很快恢复到(4.0±0.9)g · m-2 · d-1,说明膜曝气生物膜反应器有很好的对抗冲击负荷能力.
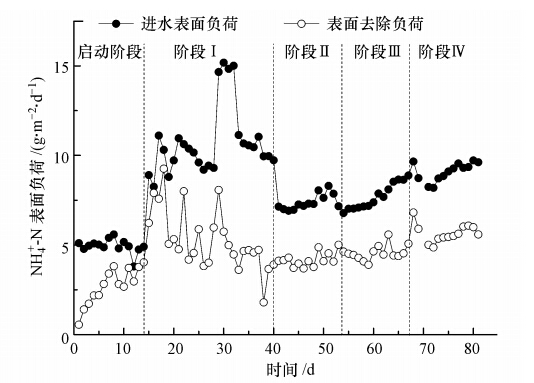 |
| 图 3 不同进水负荷下MABR对氨氮去除负荷变化情况 Fig. 3 Changes of ammonia removal loading in MABR under different influent surface loading |
工况Ⅱ、Ⅲ将进水氨氮负荷分别降至(7.4±0.5)g · m-2 · d-1、(7.7±0.7)g · m-2 · d-1,但进水氨氮浓度仍继续增加,分别增加至(246.2±15.1)mg · L-1和(368.1±9.9)mg · L-1,氨氮去除负荷较工况Ⅰ有些许增加,分别为(4.1±0.4)g · m-2 · d-1和(4.6±0.2)g · m-2 · d-1,反应器仍然处于限氧条件.由于溶解氧基质的限制作用限制了氨氮去除负荷的增加,根据清水实验条件下得到的最大氧通量8.5 g · m-2 · d-1,按完全亚硝化计算最大氨氮去除负荷为2.48 g · m-2 · d-1,按完全硝化计算最大氨氮去除负荷为1.86 g · m-2 · d-1. 氨氮去除负荷超过根据清水实验计算的氨氮最大去除负荷近两倍,说明生物膜的存在会显著促进氧传递速率的增加.其他研究(Lackner et al., 2010; Gilmore et al., 2009; Downing et al., 2008)也发现类似结果,曝气膜表面生物膜的生长会显著促进透过膜的氧传质通量,生长有生物膜的MABR中氧传质通量比清水实验中不生长生物膜的MABR高出几倍.Pellicer-Nàcher等(2013)研究也发现,亚硝化MABR系统的运行中,生长生物膜的MABR系统氧传质速率是清水实验条件下的6倍,生物膜的存在对氧传递速率的影响是双重的,一方面会显著改变膜/液界面的氧分配系数,另一方面生物膜的活性也会影响氧的传质性.
工况Ⅳ进水氨氮浓度增加至约575 mg · L-1,进水氨氮负荷增加至(9.1±0.5)g · m-2 · d-1.根据Pellicer-Nàcher等(2013)有关氨氮表面负荷对氧传递速率的影响试验,高负荷条件下的氧传质速率比低负荷条件下高4倍之多,在高氨氮负荷和限氧双重条件下运行的MABR 硝化生物膜会显著地促进内部生物膜的氧摄取速率.因此,工况Ⅳ中虽然溶解氧受到限制,但氨氮去除负荷还有所提高并稳定在(5.7±0.5)g · m-2 · d-1.总体说明在逐步增加进水氨氮浓度的基础上调整进水氨氮负荷,驯化MABR微生物能够达到对高氨氮废水良好的处理性能.
3.4 不同氨氮负荷下部分亚硝化效果图 4为不同进水氨氮负荷下MABR系统中氮素转化物料平衡.从图 4可以看出,4个工况下进水氨氮负荷分别为10.0、7.4、7.7和9.1 g · m-2 · d-1.由于第Ⅰ阶段氨氮负荷过高导致处理效果不稳定,并且生物膜厚度较薄,因此,参考Terada等(2010)的曝气硅胶膜硝化特性研究,溶解氧的穿透深度在100~150 μm;在本实验第Ⅱ阶段之后,溶解氧已无法完全穿透生物膜,生物膜结构基本相同.对第Ⅱ、Ⅲ、Ⅳ阶段的出水部分亚硝化效果进行对比分析,结果发现,3个阶段出水NO2--N负荷分别为3.40、3.08、2.96 g · m-2 · d-1,且亚硝化率持续下降,由96.3%降至69.1%.从保持高的亚硝酸盐积累量和部分亚硝化效果考虑,本试验MABR最适宜的进水氨氮负荷为7.4 g · m-2 · d-1.同时发现,随着生物膜的增厚,生物膜中出现内层好氧外层缺氧的分层结构,反硝化脱氮量也逐渐增加,由最初的0.2 g · m-2 · d-1增加到1.4 g · m-2 · d-1.
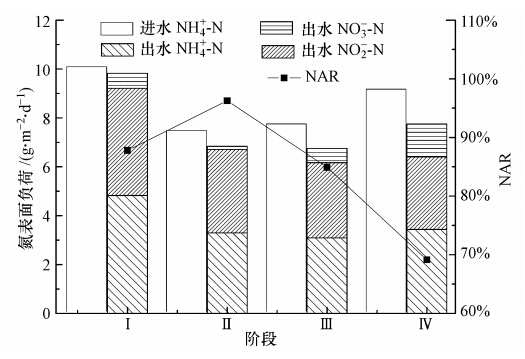 |
| 图 4 不同氨氮负荷下MABR内的氮素转化物料衡算 Fig. 4 Nitrogen mass balance analysis in MABR under different ammonium loading |
比氧利用速率(以SOUR表征)是评价微生物代谢活性的重要指标,图 5为不同运行阶段MABR生物膜活性(SOUR)的变化情况.从图 5可以看出,在运行至38 d时,相较接种前污泥,MABR中生物膜AOB、NOB的SOUR活性都有较大程度的提高,分别为(133.9±31.1)和(12.1±3.1)mg · g-1 · h-1(以每g SS利用的O2量(mg)计),AOB活性增加明显.主要是因为MABR中特殊的生物膜分层结构及进水高氨氮浓度等环境有助于AOB的积累和活性的表达,这也与反应器中出现亚硝酸盐的大量积累相符.虽然进水中没有有机底物但仍然有异养菌的存在,生物膜中的异氧菌以微生物分泌的胞外聚合物(EPS)为基质进行代谢和生长繁殖.与Liu等(2010)研究的MABR生物膜SOURAOB为52.0 mg · g-1 · h-1相比,本研究的AOB活性要高.在78 d时,由于高氨氮负荷下氧传质速率的增加,AOB和NOB活性也有所增高,但AOB活性仅升高至(134.8±20.6)mg · g-1 · h-1,而NOB活性由于外部基质的抑制减弱从(12.1±3.1)mg · g-1 · h-1升高到(30.6±7.1)mg · g-1 · h-1.这也与运行第Ⅳ阶段出水硝酸盐氮浓度的增加对应,也从微观上说明了过厚的生物膜由于传质的限制,难于保持对NOB的持续抑制和亚硝化的稳定实现,表明生物膜厚度控制对实现MABR亚硝化稳定运行的重要性.
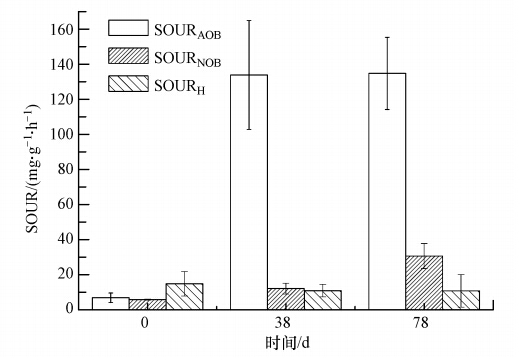 |
| 图 5 不同运行阶段MABR生物膜的比氧利用速率(SOUR)比较 Fig. 5 Specific oxygen uptake rate(SOUR)of biofilm in MABR at different stages |
采用实时定量PCR分析接种前后污泥和生物膜中功能基因的含量.采用AOB的16S rRNA(CTO)定量表征氨氧化菌的丰度变化,以NOB的16S rRNA(NSR)表征亚硝酸盐氧化菌的丰度变化.图 6为反应器接种前污泥和接种后生物膜中功能基因含量对比图,接种前污泥的CTO和NSR含量分别为2.56×103和1.62×104 copies · μg-1(以DNA计).采集反应器稳定运行至38 d时亚硝化阶段的生物膜,得到系统微生物CTO和NSR含量分别为1.53×106和7.91×105 copies · μg-1.相比于活性污泥系统,生物膜系统微生物丰度都有2~3个数量级的提高.AOB和NOB功能基因的比例也由接种前的0.16提高到1.94,说明MABR中AOB逐步成为优势菌群,同时单位生物量AOB微生物丰度值也比普通活性污泥高.
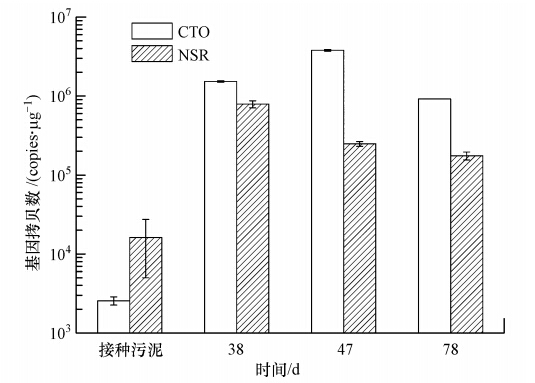 |
| 图 6 不同运行时间MABR生物膜中AOB和NOB功能基因拷贝数 Fig. 6 AOB and NOB gene numbers of biofilm in MABR at different stages |
运行至47 d时,AOB功能基因的含量增至3.80×106 copies · μg-1,NOB功能基因的含量降至2.49×105 copies · μg-1,这也与此阶段运行数据中亚硝化率最高的实验结果相一致.78 d时,由于生物膜生长过厚而出现缺氧反硝化层,同时由于外层基质的扩散限制,单位DNA的AOB、NOB功能基因量有所下降,分别降至9.20×105和1.75×105 copies · μg-1,同时存在内层NOB的竞争抑制,AOB功能基因含量下降较多.综合整个MABR运行期间,AOB始终作为优势菌群存在于生物膜中,这从微生物生态学角度解释了MABR具有较高的氨氧化速率和亚硝酸盐积累性能变化的内在原因.
4 结论(Conclusions)1)MABR的异向传质结构有利于实现亚硝化,但稳定部分亚硝化的实现需要有效控制生物膜的厚度,最佳生物膜厚度需控制在110~170 μm之间,能够有效实现对NOB的抑制和亚硝酸盐的积累.
2)在进水氨氮负荷从(4.9±0.4)g · m-2 · d-1升至(9.1±0.5)g · m-2 · d-1的过程中,进水氨氮浓度由(109.0±9.0)mg · L-1升至(574.6±32.7)mg · L-1,MABR氨氮表面去除负荷可以达到(5.7±0.5)g · m-2 · d-1,MABR对高氨氮废水具有良好的处理性能,本试验MABR 进水氨氮负荷为7.4 g · m-2 · d-1时,部分亚硝化效果最佳.
3)生物膜特性分析表明,维持适宜的生物膜厚度,膜曝气生物膜内AOB的活性SOURAOB可以达到133.9 mg · g-1 · h-1.针对于氨氧化功能基因的实时定量PCR结果表明,MABR生物膜中AOB为优势菌群,且其丰度比普通接种污泥高出3个数量级,这些结果从微生物机理上说明了MABR实现部分亚硝化的内在原因.
| [1] | Ahmed T, Semmens M J, Voss M A. 2004. Oxygen transfer characteristics of hollow-fiber, composite membranes[J]. Advances in Environmental Research, 8(3/4): 637-646 |
| [2] | Anthonisen A C, Loehr R C, Prakasam T B, et al. 1976. Inhibition of nitrification by ammonia and nitrous acid[J]. Water Pollution Control Federation, 48(5): 835-852 |
| [3] | Casey E, Glennon B, Hamer G. 1999. Review of membrane aerated biofilm reactors[J]. Resources Conservation and Recycling, 27(1/2): 203-215 |
| [4] | Dionisi H M, Layton A C, Harms G, et al. 2002. Quantification of Nitrosomonas oligotropha-like ammonia-oxidizing bacteria and Nitrospira spp. from full-scale wastewater treatment plants by competitive PCR[J]. Applied and Environmental Microbiology, 68(1): 245-253 |
| [5] | Downing L S, Nerenberg R. 2008. Effect of oxygen gradients on the activity and microbial community structure of a nitrifying, membrane-aerated biofilm[J]. Biotechnology and Bioengineering, 101(6): 1193-1204 |
| [6] | Gilmore K R, Little J C, Smets B F, et al. 2009. Oxygen transfer model for a flow-through hollow-fiber membrane biofilm reactor[J]. Journal of Environmental Engineering, 135(9): 806-814 |
| [7] | 国家环保总局. 2002. 水和废水监测分析方法 (第4版)[M]. 北京: 中国环境科学出版社 |
| [8] | Henze M. 2008. Biological Wastewater Treatment-Principles, Modelling and Design[M]. London: IWA Publishing. 139-154 |
| [9] | Lackner S, Terada A, Horn H, et al. 2010. Nitritation performance in membrane-aerated biofilm reactors differs from conventional biofilm systems[J]. Water Research, 44(20): 6073-6084 |
| [10] | Liu H J, Yang F L, Shi S Y, et al. 2010. Effect of substrate COD/N ratio on performance and microbial community structure of a membrane aerated biofilm reactor[J]. Journal of Environmental Sciences, 22(4): 540-546 |
| [11] | Nisola G M, Orata-Flor J, Oh S, et al. 2013. Partial nitrification in a membrane-aerated biofilm reactor with composite PEBA/PVDF hollow fibers[J]. Desalination and Water Treatment, 51(25/27): 5275-5282 |
| [12] | Park S, Bae W, Rittmann B E. 2010. Operational boundaries for nitrite accumulation in nitrification based on minimum/maximum substrate concentrations that include effects of oxygen limitation, pH, and free ammonia and free nitrous acid inhibition[J]. Environmental Science & Technology, 44(1): 335-342 |
| [13] | Pellicer-Nàcher C, Sun S P, Lackner S, et al. 2010. Sequential aeration of membrane-aerated biofilm reactors for high-rate autotrophic nitrogen removal: experimental demonstration[J]. Environmental Science & Technology, 44(19): 7628-7634 |
| [14] | Pellicer-Nàcher C, Domingo-Félez C, Lackner S, et al. 2013. Microbial activity catalyzes oxygen transfer in membrane-aerated nitritating biofilm reactors[J]. Journal of Membrane Science, 446: 465-471 |
| [15] | Pynaert K, Smets B F, Beheydt D, et al. 2004. Start-up of autotrophic nitrogen removal reactors via sequential biocatalyst addition[J]. Environmental Science & Technology, 38(4): 1228-1235 |
| [16] | Rotthauwe J H, Witzel K P, Liesack W. 1997. The ammonia monooxygenase structural gene amoA as a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied and Environmental Microbiology, 63(12): 4704-4712 |
| [17] | Satoh H, Ono H, Rulin B, et al. 2004. Macroscale and microscale analyses of nitrification and denitrification in biofilms attached on membrane aerated biofilm reactors[J]. Water Research, 38(6): 1633-1641 |
| [18] | Schramm A, De Beer D, Gieseke A, et al. 2000. Microenvironments and distribution of nitrifying bacteria in a membrane-bound biofilm[J]. Environmental Microbiology, 2(6): 680-686 |
| [19] | Stricker A E, Lossing H, Gibson J H, et al. 2011. Pilot scale testing of a new configuration of the membrane aerated biofilm reactor (MABR) to treat high-strength industrial sewage[J]. Water Environment Research, 83(1): 3-14 |
| [20] | Terada A, Hibiya K, Nagai J, et al. 2003. Nitrogen removal characteristics and biofilm analysis of a membrane-aerated biofilm reactor applicable to high-strength nitrogenous wastewater treatment[J]. Journal of Bioscience and Bioengineering, 95(2): 170-178 |
| [21] | Terada A, Yamamoto T, Hibiya K, et al. 2004. Enhancement of biofilm formation onto surface-modified hollow-fiber membranes and its application to a membrane-aerated biofilm reactor[J]. Water Science and Technology, 49(11/12): 263-268 |
| [22] | Terada A, Yamamoto T, Igarashi R, et al. 2006. Feasibility of a membrane-aerated biofilm reactor to achieve controllable nitrification[J]. Biochemical Engineering Journal, 28(2): 123-130 |
| [23] | Terada A, Lackner S, Tsuneda S, et al. 2007. Redox-stratification controlled biofilm (ReSCoBi) for completely autotrophic nitrogen removal: The effect of co- versus counter-diffusion on reactor performance[J]. Biotechnology and Bioengineering, 97(1): 40-51 |
| [24] | Terada A, Lackner S, Kristensen K, et al. 2010. Inoculum effects on community composition and nitritation performance of autotrophic nitrifying biofilm reactors with counter-diffusion geometry[J]. Environmental Microbiology, 12(10): 2858-2872 |
| [25] | 王建龙, 吴立波, 齐星, 等. 1999. 用氧吸收速率 (OUR) 表征活性污泥硝化活性的研究[J]. 环境科学学报, 19(3): 225-229 |
| [26] | Wang R C, Terada A, Lackner S, et al. 2009. Nitritation performance and biofilm development of co- and counter-diffusion biofilm reactors: Modeling and experimental comparison[J]. Water Research, 43(10): 2699-2709 |
 2015, Vol. 35
2015, Vol. 35


