纳米光催化技术是应用在染料废水治理领域的一种新型技术,具有能耗低、无二次污染、氧化能力强等特点,而TiO2是纳米光催化技术中被广泛采用的光催化剂之一,它具有化学性质比较稳定、催化性强,在近紫外光区吸光系数大、催化高效持久等优点(Nagaveni et al., 2004; Kamat et al., 2002).因此,近年来关于TiO2光催化降解染料废水中污染物的研究得到了较多关注(Aarthi et al., 2007; Erdemoğlu et al., 2008; Sansiviero et al., 2011; Shirsath et al., 2013).然而,TiO2在光催化降解污染物的过程中普遍存在着失活现象,这给光催化技术的实际应用带来障碍.目前 TiO2失活的研究多局限于反应产物对催化剂的影响.如Cao等(2000)研究TiO2光催化降解甲苯时,TiO2失活主要是由于光催化降解过程中苯甲醛和苯甲酸积累在催化剂表面的活性点上,导致催化剂失活. Kaewgun和Lee(2010)在光催化降解甲基橙的反应中也发现了类似结论,TiO2失活是由于甲基橙的分解产物及含碳化合物沉积在催化剂表面. Gandhi等(2012)在光催化降解邻苯二甲酸的研究中发现,TiO2失活是由于降解产物(羧酸类化合物)通过静电作用与催化剂表面进行络合吸附,这些吸附有机物的存在影响了催化剂的表面特性和催化性能.然而,这些研究工作仅对光降解过程中失活TiO2表面的有害物质进行了探讨,并没有系统的从失活催化剂本身的表面形态、光学特性、晶体结构等物化特性方面做考察.
本文通过在紫外光条件下,以TiO2为光催化剂光催化降解刚果红的过程为研究对象,研究光催化剂的活性,同时对失活光催化剂进行系统的物化特性分析,并对其再生温度进行研究,以期得到催化剂失活机制及最适再生温度,为光催化技术的实际应用提供参考依据.
2 材料与方法(Materials and methods) 2.1 实验材料电子分析天平(AUY220);紫外灯(ZW10S15W-Z331);磁力搅拌器(IKA C-MAG HS4);紫外可见分光光度计(SP-1900);离心机(KDC-140HR);干燥箱(GZX-9240MBE).光催化反应装置为自制,反应器直径95 mm,高115 mm,有效体积为500 mL.实验中所用药品均为分析纯. 光催化剂为德固赛P25二氧化钛,平均粒径为20~50 nm.
2.2 催化剂的表征与分析用S-3400N-II扫描电子显微镜(SEM)(日本株式会社日立高新技术公司)观测催化剂的颗粒形貌;用D8-AdvanceX射线衍射(XRD)仪(德国Bruker公司)分析催化剂的结构,实验条件:Cu Kα射线,λ=0.15418 nm,管电压40 kV,管电流40 mA,扫描角度范围2θ=20°~90°,扫描步长0.02度,扫描速度0.1 s · 步-1;用SDT-296差热-热重分析(DSC-TGA)仪(美国TA仪器公司)对失活催化剂进行热重分析,实验条件:空气气氛,升温速率 10 ℃ · min-1,实验温度 40 ℃~700 ℃;用TU-1901双光束紫外可见分光光度计(北京普析通用仪器公司)测定紫外-可见漫反射光谱(UV-vis DRS);用VERTEX-70傅立叶变换红外光谱仪(德国Bruker)测定红外光谱.
2.3 TiO2活性及失活实验以刚果红降解脱色反应为模型,紫外光为光源,将0.2 g光催化剂投加到200 mL(50 mg · L-1)的刚果红水溶液中,反应器在实验过程中一直置于磁力搅拌器上以保证反应液浓度均一;每隔10 min取一次样于离心管中,离心分离20 min,取上清液在498 nm的波长下测定其吸光度At;刚果红脱色率计算公式为:
ω=(A0-At)/A0
式中,A0为起始时刚果红溶液的吸光度;At为t时刻刚果红溶液的吸光度.降解反应结束后,将反应液离心分离20 min,回收其中的TiO2,并充分干燥后进行重复使用.在同样实验条件下,准确称量使用过的TiO2,重复上述实验过程,考察使用次数对TiO2光催化活性的影响,直至光催化反应脱色率下降至不再有明显变化为止,得到失活的光催化剂.
2.4 失活TiO2再生实验目前常采用的光催化剂再生方法有清洗(物理或化学)再生(井立强等,2003)、紫外光再生(Vorontsov et al., 2003)、焙烧再生(Cao et al., 2000; 于秀娟等,2006).焙烧再生相比较于前两种方法,其效率高,耗时短,再生催化剂易回收,而且有机物焙烧后的产物多为CO2和H2O,较为环保.因此选择在马弗炉中分别以250 ℃、350 ℃、450 ℃、550 ℃对失活TiO2有氧焙烧处理1 h进行焙烧再生,并对处理后的光催化剂进行光催化活性实验,以考察光催化剂的再生效果.
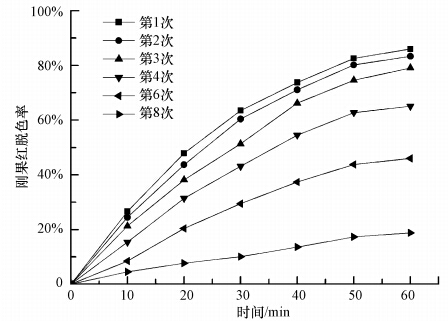
3 结果与讨论(Results and discussion) 3.1 循环使用次数对光催化剂活性影响TiO2循环使用不同次数后,对其光催化活性及每次使用后其表面吸附物的质量分数进行了测定,结果见图 1和图 2.
 |
| 图 1 循环使用次数对TiO2光催化活性的影响 Fig. 1 Effects of Recycling times on the photocatalytic activity of TiO2 |
 |
| 图 2 每次使用后TiO2表面吸附物的质量分数 Fig. 2 Mass fraction of adsorbate on the surface of TiO2 after each use |
从图 1结果可见,TiO2在第1次使用时活性最高,其对刚果红的脱色率达到了86%,第2、3次使用后,活性基本不变,脱色率只下降了6.9%;第4次使用后,脱色率明显降至65.1%;第6、8次使用后,脱色率分别降低至46.0%和18.8%.从图 2中可以看到,TiO2前3次使用后,其表面积累的反应副产物极少,第3次使用后仅有0.19%(质量分数,下同);当TiO2第4、5、6次使用后,催化剂表面反应副产物的量急剧增加,分别增至0.44%、0.85%、1.22%;第7、8次使用后,催化剂表面反应副产物基本不再增加,分别为1.29%和1.31%.以上数据表明,TiO2连续使用3次其活性基本维持不变,随后催化剂活性加速降低的这一实验结果,与催化剂表面吸附的反应副产物的量有着密切联系.反应初始阶段,催化剂表面尽管有反应副产物的积累,但积累量不多的情况下,会很快被TiO2光催化氧化而降解,因此在前3次光催化反应过程中,催化剂的活性基本维持不变.但随着TiO2循环使用次数的增多,反应副产物大量积累,并占据了催化剂表面的多数活性位,反应物得不到有效降解,从而表现出TiO2光催化脱色率快速下降,当催化剂被第7、8次使用后,其表面积累的反应副产物趋于饱和,催化剂接近失活.
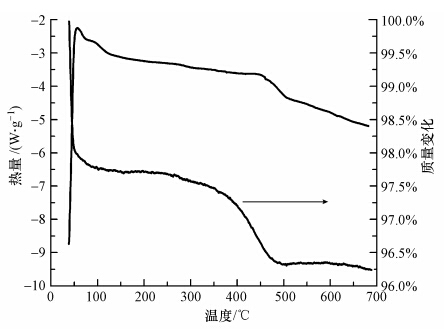
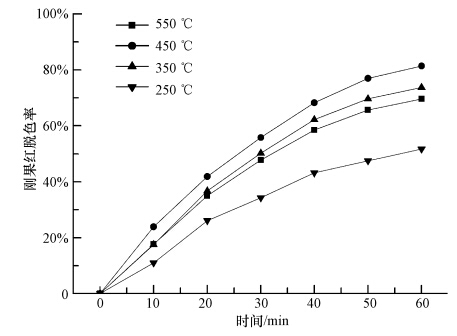
3.2 失活TiO2的再生焙烧再生的温度对于再生TiO2的活性有重要影响.温度太低,反应副产物不能氧化分解;温度太高,催化剂会被烧结(Madaan et al., 2011). 因此,适当的焙烧温度非常重要.本实验通过DSC-TGA分析来确定一个合理的焙烧温度区间,并探讨不同再生温度对再生TiO2活性的影响,结果见图 3和图 4.
 |
| 图 3 失活TiO2的DSC-TGA曲线 Fig. 3 DSC-TGA curves of the deactivated TiO2 |
 |
| 图 4 再生TiO2光催化活性实验结果 Fig. 4 Results of the photocatalytic activity of regeneration TiO2 |
图 3 为失活TiO2的DSC-TGA曲线,从图中可以看到,50~100 ℃有一明显的吸热峰,该峰为失活TiO2吸附的物理结合水脱附,相应温度的TG曲线上出现了失重现象,失重约为2.3%;而390~500 ℃出现的吸热峰为失活TiO2表面刚果红降解的中间产物分解,同时相应温度的TG曲线上也有较大失重现象,失重约为1.3%.500 ℃以后无明显的失重现象,且热流量也逐渐下降,这说明失活TiO2表面刚果红降解的中间产物已完全分解.因此,选择250 ℃、350 ℃、450 ℃、550 ℃作为失活光催化剂的再生温度.
图 4为失活TiO2经250 ℃、350 ℃、450 ℃、550 ℃焙烧再生后,TiO2光催化活性的实验结果.由图可见,失活TiO2在马弗炉中分别经250 ℃、350 ℃、450 ℃、550 ℃有氧焙烧处理1 h后,其光催化活性都有一定程度的恢复,其中经450 ℃再生的TiO2光催化活性最高,1 h降解反应后脱色率达81.4%,与相同条件下新鲜TiO2的脱色率相比,其脱色率只下降了4.6%,而250 ℃、350 ℃及550 ℃再生的TiO2脱色率分别降低了34.3%、12.3%、16.4%. 由此可知,通过焙烧再生,TiO2表面刚果红降解产生的中间产物因高温分解而得到不同程度的去除,光催化活性也相应得到了一定程度恢复.其中250 ℃、350 ℃焙烧条件下,再生TiO2脱色率下降是由于焙烧温度较低,刚果红降解的中间产物不能完全氧化分解所致;550 ℃虽已超过刚果红降解中间产物的氧化分解温度,但由于温度过高,对催化剂造成了烧结;相比较之下,450 ℃的再生效果最好,这是因为该温度既可以有效地将刚果红降解中间产物氧化分解掉,又可以保证催化剂不被烧结,该温度也正好与图 3中450 ℃左右出现吸热峰的实验结果相吻合,但450 ℃再生的TiO2其光催化活性没有得到完全恢复.这表明:一方面焙烧再生对于失活TiO2的再生是有效的,另一方面催化剂失活不仅与其表面积累的降解中间产物有关,还可能与其他因素有关.
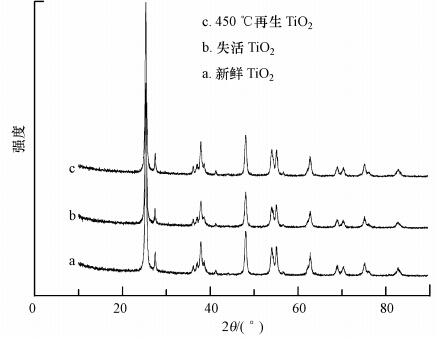
3.3 SEM表征及XRD分析为了观察TiO2的表面形貌、活性组分颗粒的大小与分布,以及了解催化剂晶型的变化,实验对不同状态的TiO2进行了SEM表征和XRD分析,结果分别如图 5、图 6所示.从图 5中可以看到,图 5a中TiO2的颗粒大小比较均一,多为球形颗粒,直径分布在20~50 nm;图b中TiO2团聚比较严重,颗粒几乎 都聚集在一起成块状,直径已不在纳米级范围内; 图 5c中经450 ℃焙烧再生后的TiO2颗粒有轻微的烧结但无团聚,颗粒分布也较均匀,直径有所增加,多分布在50~100 nm.以上结果表明,失活后TiO2的粒径比新鲜TiO2增大了许多,这恰恰造成了光催化剂的比表面积急剧下降,从而降低反应物在催化剂表面的吸附量,以及减少光催化剂所接收的光照量,最终使得光催化剂的光催化活性降低.可见,TiO2失活的原因之一是:TiO2颗粒发生严重的团聚.焙烧处理能有效的解决失活TiO2的团聚现象,但在一定程度上造成了TiO2颗粒的烧结,使得颗粒直径变大,最终导致TiO2的光催化活性降低,这也很好的解释了TiO2再生后其活性没有完全恢复的原因.
 |
| 图 5 分别为新鲜(a)、失活(b)及450 ℃(c)再生后的TiO2光催化剂的SEM图片 Fig. 5 SEM images of TiO2 fresh(a),deactivation(b), and 450 ℃(c)regeneration |
图 6显示,TiO2在失活前后及焙烧再生后在25.3°、37.8°、47.9°、53.9°、55.1°、62.7°等位置都出现了衍射峰,并且失活及再生后TiO2特征峰的强度和半峰宽也几乎与新鲜TiO2一样,这与文献(Pan et al., 2013)相似.以上结果表明,TiO2的晶体结构及结晶度在光催化反应前后及450 ℃再生后都没有发生变化,因此TiO2失活并不是TiO2内部结构变化引起的.
 |
| 图 6 分别为新鲜、失活、450 ℃再生的TiO2的XRD谱图 Fig. 6 XRD patterns of fresh,deactivation, and 450 ℃ regeneration TiO2 |
图 7为不同状态TiO2的可见漫反射光谱.图 7中a谱图只在紫外光区有很强的吸收,而在大于400 nm波长的范围内几乎没有吸收,图 7c不仅在紫外光区有很强的吸收,而且在400~800 nm波长范围内有很强的吸收,这刚好与实验过程中TiO2催化剂的颜色由白色变为暗红色相吻合,此外失活TiO2在可见光范围内并没有出现明显的光吸收峰.图 7b与图 7a光吸收范围完全一致,吸光度相近.以上结果表明,失活TiO2表面的确存在着刚果红降解产生的反应副产物,也正是这些反应副产物的存在才使得失活TiO2在可见光区有很强的吸收,但这些反应副产物的存在并没有使TiO2的带隙发生改变.由此可以肯定,TiO2失活并非由于其带隙发生改变而引起,而是其表面存在的反应副产物造成的.450 ℃再生后的TiO2与新鲜TiO2光吸收范围完全一致,吸光度相近,也表明了450 ℃焙烧再生对于失活TiO2再生是有效的.
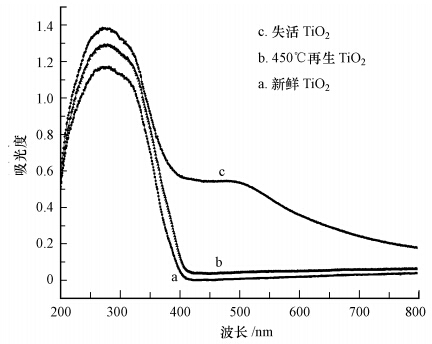 |
| 图 7 分别为新鲜、失活及450 ℃再生后TiO2的 UV-Vis谱图 Fig. 7 UV-vis diffuse reflectance spectra of fresh,deactivation, and 450 ℃ regeneration TiO2 |
为了进一步确定催化剂表面反应副产物的组份,实验又对不同状态的TiO2做了FTIR对比分析,结果见图 8.从图中可以看见,TiO2失活前后及450 ℃再生后的谱图在900~400 cm-1区间都出现了强的宽化吸收峰,此为TiO2光催化剂的吸收峰. 图 8a的FTIR谱图比较平滑,在官能团区及指纹区均无明显的吸收峰.然而从图 8c的谱图中可以看到,在1612 cm-1处有明显的峰,此为芳香环骨架C C振动吸收峰,同时在1121及1049 cm-1处有微弱的峰,它们可归属为硫酸盐(SO-4)的不对称伸缩振动峰(刘洋和尚静,2005),1384 cm-1处有很微弱峰,根据文献(周忠华等,2010),此吸收峰属于NO-3基团的N-O伸缩振动吸收峰.通过以上分析可以发现,失活TiO2表面的反应副产物中有硫酸盐、硝酸盐及含碳化合物,因此,可以推断TiO2失活的另一原因是:刚果红降解的中间产物如硫酸盐、硝酸盐及含碳化合物吸附积累在TiO2表面,导致光催化剂的表面活性点被占据,或是阻碍了光催化剂产生电子与空穴,最终导致催化剂活性降低至失活.图 8b谱图是经450 ℃再生后的TiO2,与图 8c相比,图 8b并没有出现任何明显的特征峰,且谱图形状大致与新鲜TiO2的谱图相同.由此可以再次肯定,450 ℃焙烧对于去除失活TiO2表面积累的刚果红降解的中间产物是有效的.
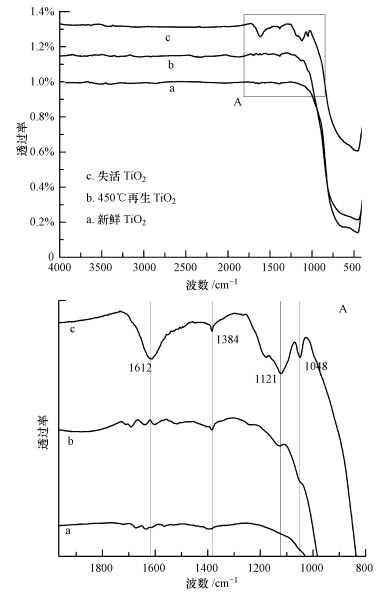 |
| 图 8 新鲜、失活及450 ℃再生后TiO2的红外光谱图 Fig. 8 FTIR spectra of fresh,deactivation, and 450 ℃ regeneration TiO2 |
1)TiO2在前3次使用中其活性基本保持不变,第4次使用后活性逐渐大幅度降低,当使用8次后活性基本丧失.
2)经SEM、XRD、UV-vis、FTIR对失活前后及再生TiO2进行对比测试分析可知,TiO2失活的主要原因有:一是TiO2颗粒的严重团聚;二是刚果红降解的中间产物,如硫酸盐,硝酸盐及含碳化合物累积在TiO2表面占据催化剂的活性位,或是阻碍了光催化剂产生电子与空穴最终使TiO2光催化活性下降.
3)采用250 ℃、350 ℃、450 ℃、550 ℃对失活TiO2进行焙烧再生,450 ℃的再生效果最好.
| [1] | Aarthi T, Narahari P, Madras G. 2007. Photocatalytic degradation of Azure and Sudan dyes using nano TiO2[J]. Journal of Hazardous Materials, 149(3): 725-734 |
| [2] | Cao L X, Gao Z, Suib S L, et al. 2000. Photocatalytic oxidation of toluene on nanoscale TiO2 catalysts: studies of deactivation and regeneration[J]. Journal of Catalysis, 196(2): 253-261 |
| [3] | Erdemoğlu S, Aksu S K, Saylkan F, et al. 2008. Photocatalytic degradation of Congo Red by hydrothermally synthesized nanocrystalline TiO2 and identification of degradation products by LC–MS[J]. Journal of Hazardous Materials, 155(3): 469-476 |
| [4] | Gandhi V G, Mishra M K, Joshi P A. 2012. A study on deactivation and regeneration of titanium dioxide during photocatalytic degradation of phthalic acid[J]. Journal of Industrial and Engineering Chemistry, 18(6): 1902-1907 |
| [5] | 井立强, 徐自力, 孙晓君, 等. 2003. ZnO和TiO2粒子的光催化活性及其失活与再生[J]. 催化学报, 24(3): 175-180 |
| [6] | Kaewgun S, Lee B I. 2010. Deactivation and regeneration of visible light active brookite titania in photocatalytic degradation of organic dye[J]. Journal of Photochemistry and Photobiology A: Chemistry, 210(2/3): 162-167 |
| [7] | Kamat P V, Huehn R, Nicolaescu R. 2002. A "sense and shoot" approach for photocatalytic degradation of organic contaminants in water[J]. The Journal of Physical Chemistry B, 106(4): 788-794 |
| [8] | 刘洋, 尚静. 2005. SO2的气相光催化氧化及催化剂的失活和再生研究[J]. 环境污染治理技术与设备, 6(11): 28-31 |
| [9] | Madaan N, Gatla S, Kalevaru V N, et al. 2011. Deactivation and regeneration studies of a PdSb/TiO2 catalyst used in the gas-phase acetoxylation of toluene[J]. Journal of Catalysis, 282(1): 103-111 |
| [10] | Nagaveni K, Sivalingam G, Hegde M S, et al. 2004. Photocatalytic degradation of organic compounds over combustion-synthesized nano-TiO2[J]. Environmental Science & Technology, 38(5): 1600-1604 |
| [11] | Pan X Y, Zhang N, Fu X Z, et al. 2013. Selective oxidation of benzyl alcohol over TiO2 nanosheets with exposed {001} facets: Catalyst deactivation and regeneration[J]. Applied Catalysis A: General, 453: 181-187 |
| [12] | Sansiviero M T C, Dos Santos D S, Job A E, et al. 2011. Layer by layer TiO2 thin films and photodegradation of Congo red[J]. Journal of Photochemistry and Photobiology A: Chemistry, 220(1): 20-24 |
| [13] | Shirsath S R, Pinjari D V, Gogate P R, et al. 2013. Ultrasound assisted synthesis of doped TiO2 nano-particles: Characterization and comparison of effectiveness for photocatalytic oxidation of dyestuff effluent[J]. Ultrasonics Sonochemistry, 20(1): 277-286 |
| [14] | Vorontsov A V, Savinov E N, Lion C, et al. 2003. TiO2 reactivation in photocatalytic destruction of gaseous diethyl sulfide in a coil reactor[J]. Applied Catalysis B: Environmental, 44(1): 25-40 |
| [15] | 于秀娟, 王永强, 李朝林, 等. 2006. 光催化氧化苯甲酸时TiO2中毒机理及再生方法的研究[J]. 环境科学学报, 26(3): 433-437 |
| [16] | 周忠华, 黄悦, 孟彦超, 等. 2010. TiO2光催化失活复活特性与表面NO3-浓度的关系[J]. 无机化学学报, 26(2): 211-216 |
 2015, Vol. 35
2015, Vol. 35


