2. 新型肥料湖北省工程实验室, 武汉 430070;
3. 湖北省土壤肥料工作站, 武汉 430070
2. Hubei Provincial Engineering Laboratory for New-Type Fertilizer, Wuhan 430070;
3. Hubei Soil and Fertilizer Station, Wuhan 430070
硒是人和动物必需的微量元素,而在世界范围内大概有5~10亿人缺硒(Combs,2001).硒的营养功能由含有硒代半胱氨酸的25种硒蛋白在它们的活性中心实现(Rayman,2012).许多硒蛋白是重要的酶,它在抵抗疾病和减少死亡风险等方面对人类健康所起的重要作用主要是由硒蛋白基因中的单核苷酸多态性(SNPs)实现(Rayman,2012).每天摄入200 μg硒具有预防多种疾病和延缓衰老的作用(Wang et al., 2013).中国72%的土壤含硒量小于国际公布的正常临界值0.1 mg · kg-1,导致了成人每天的硒摄入平均变幅只有26~32 μg(Chen et al., 2002),所以近年来,硒肥的应用以及富硒地区农作物的开发越来越受到广泛关注.但是人体缺硒和硒中毒范围相对较窄,日摄入量大于400 μg即会产生硒中毒风险(Fordyce,2007),而我国硒资源分布极不均匀,恩施等地土壤含硒量可高达27.50 mg · kg-1(Huang et al., 2013),加之当地矿物和煤炭的开采,导致水溶态硒向周围土壤中释放(Zhu et al., 2008),这些高含量水溶态无机硒将通过地表径流或下渗对灌溉水和地下水产生了进一步的危害(Dhillon and Dhillon, 2009),已有报道当地居民因硒中毒而出现脱发、掉指甲和浑身乏力等症状(Zhu et al., 2009).因此,明确硒的吸收和转运规律以及影响它们的关键因素,对于强化缺硒地区作物硒营养,合理开发利用高硒地区硒资源,保证富硒农产品的安全生产具有重要意义.
硒在环境中主要以4种形态存在:Se6+(硒酸盐)、Se4+(亚硒酸盐)、Se0(元素态硒)和Se2-(硒化物)(Fellowes et al., 2013),其中硒酸盐和亚硒酸盐是植物吸收利用的主要形态(Bañuelos and Lin, 2005; Ellis and Salt, 2003; 吴雄平等,2009).由于硒酸盐和硫酸盐运输途径相同,高亲和的硫酸盐转运子会在根皮层、根尖和横向根中高度表达,导致了硫酸盐和硒酸盐都能大量被根系吸收(Shibagaki et al., 2002).硫酸盐转运子的表达会根据植物种类和硫酸盐水平发生变化,作物对硫酸盐的亲和力通常大于硒酸盐(White et al., 2004),所以当溶液中硫酸根离子过多时,会显著抑制根系对硒酸盐的吸收.Li 等(2008)通过水培研究表明,相比不施硫,施硫使小麦对硒酸盐的吸收降低了90.5%.不论土壤中自然存在还是外源施用硫肥,都会显著影响植物组织中硒的累积与分配(Shinmachi et al., 2010),土壤中硒的有效性较低被认为主要是由于硫肥的施用引起(Premarathna et al., 2012).硒酸盐施入土壤后主要以可溶态硒形式存在,移动性较大(王松山等,2010),容易被淋洗,环境风险相对较高(黄青青等,2013).目前关于植物对亚硒酸盐的吸收机制还不是很清楚,Li等(2008)认为亚硒酸盐是通过磷酸盐运输途径进入植物体内,但是盆栽试验表明施用磷肥是通过作物生长引起的稀释效应降低了植物体硒含量,似乎并没有减少硒的累积量(Mora et al., 2008; 赵文龙等,2013).陈思杨等(2011)通过水培试验也表明施磷并没有降低水稻对硒的吸收.亚硒酸盐在土壤中易被吸附固定,限制了其在土壤中迁移,从而使其生物有效性显著降低(Chilimba et al., 2012; Premarathna et al., 2012),但同时可作为长期的补硒潜在资源(Mora et al., 2008).作物对亚硒酸盐的吸收已被证明是一个主动过程(Li et al., 2008),其转移率很低,代谢产物容易在根中积累,只有少量运往地上部,这也是多项研究表明作物对亚硒酸盐的吸收效率显著小于硒酸盐的主要原因.亚硒酸盐处理下作物体内的硒易转化为对人体有益的有机硒(Keskinen et al., 2010),因此多被作为硒肥肥源.已有研究表明硫酸盐并不会影响作物对亚硒酸盐的吸收(Li et al., 2008; Zhang et al., 2006),但无论盆栽还是大田试验,在人为添加亚硒酸盐的土壤上施用硫肥,都可以显著的降低苜蓿、麦草和水稻等作物对硒的吸收(Mackowiak and Amacher, 2008; Dhillon and Dhillon, 2000).所以有必要进一步了解作物对亚硒酸盐与硫酸盐的吸收关系.
小麦是中国居民重要主粮之一,也是谷类中富硒能力最强的粮食作物(Lee et al., 2011).小麦籽粒中硒主要以可以被人体高效利用的硒代蛋氨酸形式存在,占总硒的56% ~83%(Whanger,2002).因此,明确硫酸盐影响小麦吸收硒酸盐的同时能否改变硒在小麦体内的转移能力,小麦经亚硒酸盐处理后聚集在根部大量的硒能否继续向地上部转运,这种转运是否需要硫酸盐的参与,对于合理施用硫肥、正确选择硒肥类型、有效开发硒资源以及减少环境污染具有重要意义,而目前关于这方面的研究相对缺乏.本文以此为切入点,旨在通过不同硫硒浓度的吸收效率试验和转运试验,阐述两种硒形态处理下,小麦的硒吸收和转运规律及其与硫酸盐的关系.
2 材料与方法(Materials and methods) 2.1 植物生长背景供试小麦品种为郑麦9023(Triticum aestivum L.),小麦籽粒先经0.5%的次氯酸钠(NaClO)消毒15 min,然后用去离子水洗涤5次,每次10 min,冲洗干净的种子在25 ℃的黑暗环境中用去离子水浸泡24 h催芽,露白后再在纱布上用0.5 mmol · L-1的CaCl2溶液育苗,待根长为3~4 cm时移栽至盛有10 L营养液的聚乙烯盆中培养,各株幼苗随机排列种植.植物生长在一个受控的室内环境中,条件如下:光子流量密度(PFD)为240 μmol · m-2 · s-1,光照周期14 h · d-1,温度为22 ℃/16 ℃(昼/夜)和65%~75%的相对湿度.营养液采用1/5 Hogl and -Arnon配方,构成为:1.01 mmol · L-1 KNO3,1.00 mmol · L-1 Ca(NO3)2 · 4H2O,0.40 mmol · L-1 MgSO4 · 4H2O,0.21 mmol · L-1 KH2PO4,1.83 μmol · L-1 MnCl2 · 4H2O,9.25 μmol · L-1 H3BO3,0.08 μmol · L-1 H2MoO4 · 4H2O,0.15 μmol · L-1 ZnSO4 · 7H2O,0.06 μmol · L-1 CuSO4 · 5H2O和50.00 μmol · L-1 Fe(III)-EDTA.该溶液pH值在2 mmol · L-1 MES缓冲液中用 KOH调整到6.0.营养液每天通气2次,每3 d更换1次,培养3周后,选取生长一致的幼苗开始饥饿处理(先缺硫培养24 h,缺硫处理中MgSO4,ZnSO4和CuSO4被相应的氯盐取代,再用0.5 mmol · L-1 CaCl2处理12 h).
2.2 试验设计 2.2.1 硫酸盐对亚硒酸盐和硒酸盐处理下小麦硒吸收和转运的影响吸收液硫浓度设为0和0.1 mmol · L-1两个水平,亚硒酸盐和硒酸盐浓度均设为1、5、10、20、50和100 μmol · L-1 6个水平,以0. 5 mmol · L-1的CaCl2为支持电解液,然后将硫与硒各水平进行完全交互形成系列吸收液.将经过饥饿处理的幼苗4株1组,用吸水纸吸干根系表面水分,然后将根系全部浸入装有200 mL系列吸收液的聚乙烯小黑瓶中,每组4次重复.硒和硫分别以亚硒酸钠(Na2SeO3)、硒酸钠(Na2SeO4 · 10H2O)和硫酸镁(MgSO4 · 7H2O)的形式供应给植物,采用(MgCl2 · 6H2O)来保证Mg2+浓度的一致(下同).吸收2 h后将幼苗转移到解吸溶液中(1 mmol · L-1 CaCl2,2 mmol · L-1 MES,pH值6.0)浸泡15 min.然后分离地上部和根并吸干根部水分.
2.2.2 硫酸盐对亚硒酸盐和硒酸盐处理后小麦体内硒转运的影响将经过饥饿处理的小麦幼苗先分别移入亚硒酸盐和硒酸盐-浓度均为50 μmol · L-1的10 L聚乙烯盆吸收2 h,然后再将幼苗分别移入硫浓度为0和0.1 mmol · L-1的溶液中进行转运试验,以0.5 mmol · L-1的CaCl2为支持电解液,每组4次重复.分别于处理后0 h、1 h、4 h、7 h、11 h和21 h取样.取样后处理步骤同2.2.1节.
2.3 样品分析测定将小麦幼苗根和地上部于105 ℃杀青30 min,60 ℃烘干,称重,磨碎存于密闭自封袋中用于测定硒浓度.采用 HNO3-HClO4(4 ∶ 1)消解,消解过程温度始终控制在180 ℃左右,消解液在6 mol · L-1 HCl介质中进行还原,冷却后,定容过滤,氢化物发生原子荧光光谱法(HG-AFS-820)测定硒(GB/T 2008),整个测定过程中采用灌木枝叶(GBW07602-GSV-1)和空白样品加标回收进行分析质量控制.
2.4 数据分析吸收动力学数据使用Sigmaplot软件拟合米氏方程[Michaelis-Menten equation:V=Vmax · c/(Km+c)]曲线.式中V表示根系吸收离子的速率(nmol · g-1 · h-1),Vmax表示载体饱和时的最大吸收速率(nmol · g-1 · h-1),米氏常数Km表示载体对所吸收离子亲和力常数的倒数(μmol · L-1),c表示吸收液的离子浓度(μmol · L-1).
硒转移系数(TF值)=地上部硒含量/根硒含量(Renkema et al., 2012).
试验数据取4次重复的平均值和标准误差,采用SPSS17.0软件进行方差分析(多重比较采用Duncan法),Excel 2013和Sigmaplot进行制表绘图.
3 结果(Results) 3.1 硫酸盐对两种硒形态处理下小麦硒吸收和转运影响 3.1.1 硫酸盐对两种形态硒吸收动力学的影响小麦对亚硒酸盐的吸收动力学曲线受硫酸盐的影响不显著,而硫酸盐显著影响了小麦对硒酸盐的吸收动力学曲线,表现为硫酸盐显著(p<0.05)抑制了根系对硒酸盐的吸收(图 1).无硫时,小麦根系对硒酸盐的吸收能力为亚硒酸盐的9. 0~24.1倍,而当硫酸盐浓度为0.1 mmol · L-1时,小麦根系对硒酸盐的吸收能力为亚硒酸盐的1.9~3.5倍(图 1).
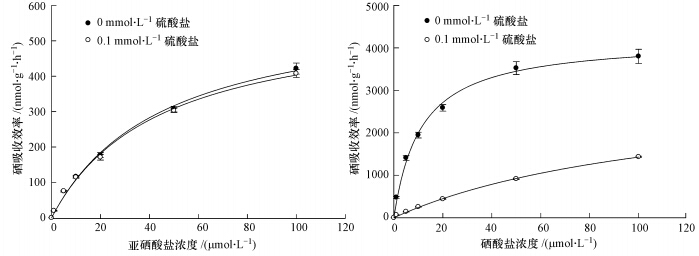 |
| 图 1 硫酸盐对亚硒酸盐和硒酸盐处理下小麦硒吸收动力学曲线的影响 Fig. 1 Effects of sulfate on the kinetics of selenite and selenate influx to roots of wheat seedlings |
为了更加准确的衡量小麦对两种形态硒吸收能力差异以及硫酸盐对其影响,本试验对吸收动力学参数Vmax和Km等重要指标进行了计算.由表 1可以看出,不同硫酸盐处理对小麦根系(干重)吸收亚硒酸盐的Vmax和Km均无显著影响,却显著(p<0.05)影响了小麦根系吸收硒酸盐的Vmax和Km值.相比无硫处理,0.1 mmol · L-1硫使小麦对硒酸盐的吸收潜力(Vmax值)降低了25.7%,使小麦对硒酸盐的亲和力(1/Km值)降低了90.8%.小麦根系对硒酸盐的吸收潜力和亲和力均显著(p<0.05)大于亚硒酸盐,表现为无硫时,小麦对硒酸盐的吸收潜力是亚硒酸盐的7.1倍,小麦对硒酸盐的亲和力是亚硒酸盐的4.0倍;当溶液中硫酸盐浓度为0.1 mmol · L-1时,小麦对硒酸盐的吸收潜力是亚硒酸盐的5.3倍,小麦对硒酸盐的亲和力仅为亚硒酸盐的37.0%.可见,硫酸盐对小麦根系与硒酸盐亲和力的影响显著大于对小麦根系吸收硒酸盐潜力的影响.
| 表 1 硫酸盐对亚硒酸盐和硒酸盐处理下小麦硒吸收动力学参数的影响 Table 1 Effects of sulfate on selenite and selenate absorption kinetics parameters to roots of wheat seedlings |
硒转移系数(TF值)代表植物吸收硒后转移到地上部能力的强弱.硫酸盐对亚硒酸盐处理下小麦的TF值影响不显著,但小麦的TF值却随着溶液中亚硒酸盐浓度升高而显著(p<0.05)下降,由0.017降至0.011(图 2),降幅达35.3%.硫酸盐对硒酸盐处理下小麦的TF值影响表现为,无硫处理时,TF值随硒酸盐浓度的升高而显著(p<0.05)上升,由0.13升至0.20,增幅达53.8%,说明小麦根系对硒酸盐的容忍力小于地上部;而当溶液中硫酸盐浓度为0.1 mmol · L-1时,TF值却随着硒酸盐浓度的增加而显著(p<0.05)下降,由0.34降至0.21,但均显著(p<0.05)高于无硫处理下的TF值,说明硫酸盐促进了硒酸盐由根向地上部运输,但这种促进作用随溶液中硒酸盐浓度的增加而降低.
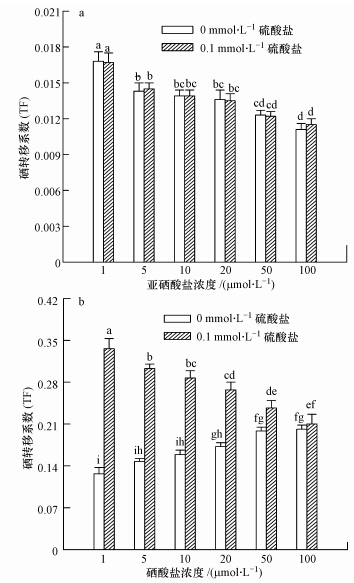 |
| 图 2 硫酸盐对亚硒酸盐和硒酸盐处理下小麦硒转移系数的影响(a. 地上部,b. 根部)(注:不同字母代表p<0.05下差异显著,下同) Fig. 2 Effects of sulfate on the translocation factors(TF)of selenite and selenate in wheat seedlings(a. shoots,b. roots) |
硒酸盐处理下小麦的TF值显著(p<0.05)高于亚硒酸盐处理,具体表现为无硫处理时,TF值为亚硒酸盐处理的7.5~18.1倍,当溶液中硫酸盐浓度为0.1 mmol · L-1时,TF值为亚硒酸盐处理的18.3~20.1倍.
3.2 硫酸盐对两种硒形态处理后小麦硒转运能力影响从图 2的转移系数明确了硫酸盐对两种硒形态处理下硒转运的影响,对于停止供硒后,根部累积的硒能否继续向地上部转运,在这个过程中,硫酸盐会不会继续参与硒的转运,也是调控作物硒营养所必须关注的重点.
3.3 硫酸盐对亚硒酸盐处理后硒转运的影响小麦经亚硒酸盐处理2 h后,也就是转运0 h时,小麦地上部和根中硒含量分别为0.84和56.3 μg · g-1,表明经过亚硒酸盐短时间处理,小麦吸收的硒大部分聚集根部而只有少量被运往地上部.之后将小麦分别移入无硫和0.1 mmol · L-1硫酸盐溶液中,发现随着培养时间的延长,根部硒含量显著(p<0.05)下降,最低可降至26.0 μg · g-1,降幅为53.8%;地上部硒含量显著(p<0.05)上升,最高为2.79 μg · g-1,增幅达232.5%,不同硫处理下小麦体内硒的转运无显著差异.由此说明小麦经亚硒酸盐处理后,硒在其体内的分配并未达到平衡,在短时间内会不断的由根向地上部转运,而硫酸盐对这种转运无显著影响(图 3).
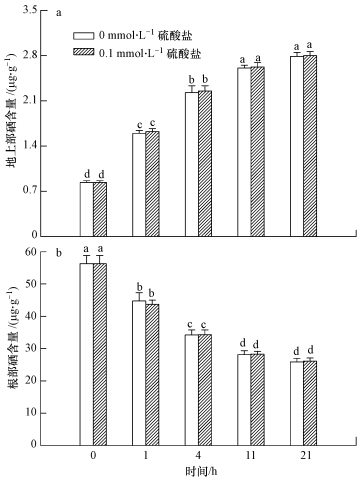 |
| 图 3 硫酸盐对亚硒酸盐处理后小麦地上部和根中硒含量的影响(a. 地上部,b. 根部) Fig. 3 Effects of sulfate on the Se content in shoots and roots of wheat seedlings after selenite treatment(a. shoots,b. roots) |
小麦经硒酸盐处理2 h后,也就是转运0 h时,小麦地上部和根中硒含量分别为195.8和610.0 μg · g-1,表明经过硒酸盐短时间处理,小麦吸收的硒会快速由根部运往地上部.之后将小麦分别移入无硫和0.1 mmol · L-1硫酸盐溶液中,发现无硫时,地上部和根部硒含量虽然会随培养时间的延长有下降趋势,但均未达到显著差异,也就表明小麦经硒酸盐处理后,硒在其体内的分配迅速达到平衡;当溶液中硫酸盐浓度为0.1 mmol · L-1时,随着培养时间的延长,根部硒含量显著(p<0.05)下降,最低可降至365.7 μg · g-1,降幅达40.0%,地上部硒含量显著(p<0.05)上升,最高可达268.2 μg · g-1,增幅达36.9%,这就表明硫酸盐参与并显著(p<0.05)促进了硒由根向地上部的转运(图 4).
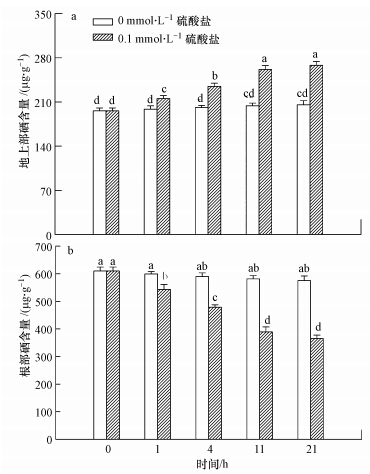 |
| 图 4 硫酸盐对硒酸盐处理后小麦地上部和根中硒含量的影响(a. 地上部,b. 根部) Fig. 4 Effects of sulfate on the Se content in shoots and roots of wheat seedlings after selenate treatment(a. shoots,b. roots) |
小麦对硒酸盐的吸收能力显著大于亚硒酸盐.具体表现为无硫时,小麦地上部和根中硒含量分别为亚硒酸盐处理的121.6倍和11.6倍;当溶液中硫酸盐浓度为0.1 mmol · L-1时,小麦地上部和根中硒含量分别为亚硒酸盐处理的30.0倍和1.7倍.Renkema等(2012)通过对油菜苗期溶液培养发现,无论施硫与否,油菜对硒酸盐的吸收能力均显著大于亚硒酸盐.Sharma等(2010)通过苗期土培试验发现,硒酸盐处理下油菜地上部和根中硒的累积量分别为亚硒酸盐处理的75~160和2~18倍,这些结果与本研究相一致.
本研究发现,相比无硫处理,0.1 mmol · L-1硫使硒酸盐处理下小麦地上部和根中硒含量分别降低了80%和90%左右,这主要是由于硒酸盐与硫酸盐运输途径相同,缺硫处理诱导了根系硫酸盐转运蛋白的增加,能够加大其对硒酸盐的吸收(Sors et al., 2005).硫酸盐充足会在转录水平上抑制硫酸盐转运蛋白表达(Koralewska et al., 2009; Rouached et al., 2009),从而降低硒酸盐的吸收.笔者同时发现硫酸盐并不影响小麦对亚硒酸盐的吸收,Zhang等(2006)的研究结果也证实了这个结论.虽然Cartes等(2006)通过土培试验得出,施用100 mg · kg-1硫肥可使2 mg · kg-1亚硒酸盐处理下黑麦草地上部硒含量至少降低33.0%,但刘新伟等(2014)认为这主要是硫肥使土壤理化性质发生了变化从而影响了亚硒酸盐在土壤中的赋存形态和价态的转化,因此降低了作物对硒的吸收,而硫酸盐并没有通过竞争吸附降低小麦对亚硒酸盐的吸收.
Vmax表示离子吸收所能达到的最大速率,其值越大,离子吸收的内在潜力越大,而该值的大小决定于细胞膜上相应离子转运载体蛋白的数量.Km的倒数表示根系吸收位点(转运载体)与所吸收离子间的亲和力大小,Km值越小,亲和力越大.王松山等(2010)通过土培试验发现,小白菜根系对硒酸盐的吸收潜力(Vmax值)和亲和力(1/Km值)均显著大于亚硒酸盐,本研究在小麦上也证实了这个结论.同时,笔者发现0.1 mmol · L-1硫处理使小麦根系对硒酸盐的吸收潜力和亲和力分别降低了25.7%和90.8%,由此说明硫酸盐主要的是通过降低小麦根系对硒酸盐的亲和力来缩小其对两种形态硒的吸收差异.
4.2 小麦对两种硒形态的转运差异及其与硫酸盐的关系陈思杨等(2011)研究表明水稻幼苗经不同形态硒处理24 h后,硒酸盐处理下的硒转移能力为亚硒酸盐10.1倍.本研究也发现,无硫时,硒酸盐处理下的小麦硒转移能力为亚硒酸盐的7.5~18.1倍.同时,笔者发现随着溶液中亚硒酸盐浓度的升高,硒的转移能力显著下降,降幅可达35.3%,主要原因可能是短时间内小麦根系聚集大量的亚硒酸盐无法快速有效的运往地上部,亚硒酸盐的主动吸收致使越来越多的硒累积在根部;随着溶液中硒酸盐浓度的增加,小麦的硒转移能力显著上升,增幅可达53.8%,主要原因可能是小麦根系因短时间内聚集大量硒酸盐,其反应越来越敏感,小麦自身为了降低伤害,通过一系列内在代谢将根部吸收过多的硒运往容忍力更强的地上部来缓解这种胁迫.当硫酸盐浓度为0.1 mmol · L-1时,硒酸盐处理下的小麦硒转移能力为亚硒酸盐处理的18.3~20.1倍,表明硫酸盐显著促进了硒酸盐的转运,Renkema等(2012)通过苗期溶液培养发现油菜经亚硒酸盐、硒酸盐不加硫酸盐和硒酸盐加硫酸盐3个处理后吸收的硒分别有10.0%、50.0%和80.0%的硒从根部转移到了地上部,其认为硒酸盐由根向地上部转移过程中硫酸盐的刺激作用大于竞争作用.Ríos等(2008)发现,溶液中硒酸盐浓度小于20 μmol · L-1时,可以显著提高生菜叶片的ATP硫酸化酶活性,从而增加了根系中硒酸盐向叶片中的运输,本研究虽然存在高浓度硒酸盐处理,但由于硫酸盐的竞争吸附,使小麦根系吸收的硒酸盐显著降低,这也是造成硒转移能力上升的原因.
小麦经50 μmol · L-1亚硒酸盐处理2 h后,大量的硒聚集在根部,短时间内无法完全进行有机化,所以继续培养,根系自由空间和其它一些细胞组织中聚集的结合程度较低的硒会不断向上运输,这也印证了Li等(2008)认为小麦对亚硒酸盐的吸收是一个主动过程,但是这种转运并不需要硫酸盐的参与.硒酸盐由于是通过高亲和的硫酸盐转运蛋白进入根系,所以会迅速转运至地上部,在小麦体内很快达到平衡,其根系中虽聚集有大量的硒,但基本都较为稳定的存在于根系组织中;而一旦转入含有硫酸盐的溶液中培养,由于植物体存在高亲和和低亲和的硫酸盐转运途径,它们以不同的浓度存在于植物体根和地上部的细胞膜中,从而参与硫的吸收(Terry et al., 2000),通常根系对硫酸盐的亲和性要大于地上部,根系从溶液中获得大量的硫酸根离子会取代硒酸根,从而促使了硒酸根向地上部的转运,但其深层机理有待于在分子水平和生理代谢层次上进一步的试验研究.
生产实践上,缺硒地区可以通过土施或喷施少量硒酸盐来快速提高作物硒含量,或者种植一些块茎类作物以提高对土壤中亚硒酸盐的有效利用.在中国一些富硒区域(恩施和紫阳等地)可以通过施用硫肥来降低当季作物(特别是根系)对硒的奢侈吸收,并促进硒向地上部等可食部位的转移,从而保证富硒食品的安全开发和土壤硒资源的长效利用.
5 结论(Conclusions)1﹚小麦根系对硒酸盐的吸收潜力和亲和力均显著大于亚硒酸盐,硫酸盐主要是通过降低小麦根系对硒酸盐的亲和力来缩小其对两种形态硒的吸收差异.
2﹚小麦的硒转移能力随溶液中亚硒酸盐浓度的升高而显著下降,硫酸盐对其无显著影响;小麦的硒转移能力随着溶液中硒酸盐浓度的升高而显著上升,硫酸盐可显著促进这种转运.
3﹚经亚硒酸盐处理后,小麦根部聚集的硒会随着培养时间的延长显著运往向地上部,硫酸盐对其无显著影响;而经硒酸盐处理后,在无硫溶液中继续培养,小麦体内的硒随培养时间的延长未发生显著变化,但当溶液中存在硫酸盐时,其根部聚集的硒会随着培养时间的延长而显著的运往地上部.
| [1] | Bañuelos G S, Lin Z Q. 2005. Phytoremediation management of selenium-laden drainage sediments in the San Luis Drain: a greenhouse feasibility study [J]. Ecotoxicology and Environmental Safety, 62(3): 309-316 |
| [2] | Cartes P, Shene C, Mora M L. 2006. Selenium distribution in ryegrass and its antioxidant role as affected by sulfur fertilization [J]. Plant and Soil, 285(1/2): 187-195 |
| [3] | Chen L C, Yang F M, Xu J, et al. 2002. Determination of selenium concentration of rice in China and effect of fertilization of selenite and selenate on selenium content of rice [J]. Journal of Agricultural and Food Chemistry, 50: 5128-5130 |
| [4] | 陈思杨, 江荣风, 李花粉. 2011. 苗期小麦和水稻对硒酸盐/亚硒酸盐的吸收及转运机制[J]. 环境科学, 32(1): 284-289 |
| [5] | Chilimba A D C, Young S D, Black C R, et al. 2012. Assessing residual availability of selenium applied to maize crops in Malawi [J]. Field Crops Research, 134: 11-18 |
| [6] | Combs G F. 2001. Selenium in global food systems [J]. British Journal of Nutrition, 85(5): 517-547 |
| [7] | Dhillon S K, Dhillon K S. 2000. Selenium accumulation by sequentially grown wheat and rice as influenced by gypsum application in a seleniferous soil [J]. Plant and Soil, 227(1/2): 243-248 |
| [8] | Dhillon S K, Dhillon K S. 2009. Phytoremediation of selenium-contaminated soils: the efficiency of different cropping systems [J]. Soil Use and Management, 25(4): 441-453 |
| [9] | Ellis D R, Salt D E. 2003. Plants, selenium and human health [J]. Current Opinion in Plant Biology, 6(3): 273-279 |
| [10] | Fellowes J W, Pattrick R A D, Boothman C, et al. 2013. Microbial selenium transformations in seleniferous soils [J]. European Journal of Soil Science, 64(5): 629-638 |
| [11] | Fordyce F. 2007. Selenium geochemistry and health[J]. AMBIO: A Journal of the Human Environment, 36(1): 94-97 |
| [12] | Huang Y, Wang Q X, Gao J, et al. 2013. Daily dietary selenium intake in a high selenium area of Enshi, China [J]. Nutrients, 5(3): 700-710 |
| [13] | 黄青青, 杜威, 王琪, 等. 2013. 水稻对不同土壤中硒酸盐/亚硒酸盐的吸收和富集[J]. 环境科学学报, 33(5): 1423-1429 |
| [14] | Keskinen R, Turakainen M, Hartikainen H. 2010. Plant availability of soil selenate additions and selenium distribution within wheat and ryegrass [J]. Plant and Soil, 333(1/2): 301-313 |
| [15] | Koralewska A, Buchner P, Stuiver C E E, et al. 2009. Expression and activity of sulfate transporters and APS reductase in curly kale in response to sulfate deprivation and re-supply [J]. Journal of Plant Physiology, 166(2): 168-179 |
| [16] | Lee S, Woodard H J, Doolittle J J. 2011. Effect of phosphate and sulfate fertilizers on selenium uptake by wheat (Triticum aestivum) [J]. Soil Science and Plant Nutrition, 57(5): 696-704 |
| [17] | Li H F, McGrath S P, Zhao F J. 2008. Selenium uptake, translocation and speciation in wheat supplied with selenate or selenite [J]. New Phytologist, 178(1): 92-102 |
| [18] | 刘新伟, 段碧辉, 夏全杰, 等. 2014. 硫对土壤中硒形态变化及油菜硒吸收的影响[J]. 环境科学, 35(9): 3564-3571 |
| [19] | Mackowiak C L, Amacher M C. 2008. Soil sulfur amendments suppress selenium uptake by alfalfa and Western wheatgrass [J]. Journal of Environmental Quality, 37(3): 772-779 |
| [20] | Mora M L, Pinilla L, Rosas A, et al. 2008. Selenium uptake and its influence on the antioxidative system of white clover as affected by lime and phosphorus fertilization [J]. Plant and Soil, 303(1/2): 139-149 |
| [21] | Premarathna H M P L, McLaughlin M J, Kirby J K, et al. 2012. Influence of submergence and subsequent drainage on the partitioning and lability of added selenium fertilizers in a sulphur-containing Fluvisol [J]. European Journal of Soil Science, 63(4): 514-522 |
| [22] | Ríos J J, Blasco B, Cervilla L M, et al. 2008. Regulation of sulphur assimilation in lettuce plants in the presence of selenium [J]. Plant Growth Regulation, 56(1): 43-51 |
| [23] | Rayman M P. 2012. Selenium and human health [J]. The Lancet, 379(9822): 1256-1268 |
| [24] | Renkema H, Koopmans A, Kersbergen L, et al. 2012. The effect of transpiration on selenium uptake and mobility in durum wheat and spring canola [J]. Plant and Soil, 354(1/2): 239-250 |
| [25] | Rouached H, Secco D, Arpat A B. 2009. Getting the most sulfate from soil: Regulation of sulfate uptake transporters in Arabidopsis [J]. Journal of Plant Physiology, 166(9): 893-902 |
| [26] | Sharma S, Bansal A, Dhillon S K, et al. 2010. Comparative effects of selenate and selenite on growth and biochemical composition of rapeseed (Brassica napus L.) [J]. Plant and Soil, 329(1/2): 339-348 |
| [27] | Shibagaki N, Rose A, McDermott J P, et al. 2002. Selenate-resistant mutants of Arabidopsis thaliana identify Sultr1; 2, a sulfate transporter required for efficient transport of sulfate into roots [J]. The Plant Journal, 29(4): 475-486 |
| [28] | Shinmachi F, Buchner P, Stroud J L, et al. 2010. Influence of sulfur deficiency on the expression of specific sulfate transporters and the distribution of sulfur, selenium, and molybdenum in wheat [J]. Plant Physiology, 153(1): 327-336 |
| [29] | Sors T G, Ellis D R, Salt D E. 2005. Selenium uptake, translocation, assimilation and metabolic fate in plants [J]. Photosynthesis Research, 86(3): 373-389 |
| [30] | Terry N, Zayed A M, de Souza M P, et al. 2000. Selenium in higher plants [J]. Annual Review of Plant Biology, 51: 401-432 |
| [31] | 王松山, 吴雄平, 梁东丽, 等. 2010. 不同价态外源硒在石灰性土壤中的形态转化及其生物有效性[J]. 环境科学学报, 30(12): 2499-2505 |
| [32] | Wang Y D, Wang X, Ngai S M, et al. 2013. Comparative proteomics analysis of selenium responses in selenium-enriched rice grains [J]. Journal of Proteome Research, 12(2): 808-820 |
| [33] | Whanger P D. 2002. Selenocompounds in plants and animals and their biological significance [J]. Journal of the American College of Nutrition, 21(3): 223-232 |
| [34] | White P J, Bowen H C, Parmaguru P, et al. 2004. Interactions between selenium and sulphur nutrition in Arabidopsis thaliana [J]. Journal of Experimental Botany, 55(404): 1927-1937 |
| [35] | 吴雄平, 梁东丽, 鲍俊丹, 等. 2009. Se(Ⅳ)和Se(Ⅵ)对小白菜生长及生理效应的影响[J]. 环境科学学报, 29(10): 2163-2171 |
| [36] | Zhang L H, Shi W M, Wang X C. 2006. Difference in selenite absorption between high- and low-selenium rice cultivars and its mechanism [J]. Plant and Soil, 282(1/2): 183-193 |
| [37] | 赵文龙, 胡斌, 王嘉薇, 等. 2013. 磷与四价硒的共存对小白菜磷、硒吸收及转运的影响[J]. 环境科学学报, 33(7): 2020-2026 |
| [38] | Zhu J M, Wang N, Li S H, et al. 2008. Distribution and transport of selenium in Yutangba, China: impact of human activities [J]. Science of the Total Environment, 392(2/3): 252-261 |
| [39] | Zhu Y G, Pilon-Smits E A H, Zhao F J, et al. 2009. Selenium in higher plants: understanding mechanisms for biofortification and phytoremediation [J]. Trends in Plant Science, 14(8): 436-442 |
 2015, Vol. 35
2015, Vol. 35


