2. 贵州省黔东南州农业科学院, 凯里 556000;
3. 贵州警官职业技术学院, 贵阳 550005;
4. 贵州省山地环境信息系统和生态环境保护重点实验室, 贵阳 550001
2. Academy of Agricultural Sciences of South-Eest National of Guizhou Province, Kaili 556000;
3. Guizhou Police Officer Vocational College, Guiyang 550005;
4. Key Laboratory for Information System of Mountainous Area and Protection of Ecological Environment of Guizhou Province, Guiyang 550001
污染环境的植物修复技术核心是超富集植物,植物对污染物的生物富集能力与忍耐能力,是修复效率的基本保障.目前对于植物修复工作开展除了在重金属尾矿区进行广泛野外调查发现新的超富集植物,还利用现代生物技术方法,如组织培养、基因工程等手段改良或改进现有的一些已知超富集植物.利用发根农杆菌(Agrobacterium rhizogenes)诱导植物组织产生的毛状根(Hairy root),具有生长迅速,遗传稳定,易于扩大培养和不受季节地域限制等优点被广泛用于药用植物上面(Guillon et al., 2006).同时,与自然根比较,毛状根具有生长快,侧根分支多与污染源接触表面积大等优点(Eapen et al., 2003; Suza et al., 2008),而成为环境污染新的植物修复材料被应用于环境污染清理工作(Han et al., 2004; Suresh et al., 2005).因为毛状根是由植物组织诱导产生,除了具有质粒介导的外源基因外,还具有原植物的全部基因组,是一种处于未分化状态的植物外植体,只具有根结构形态,无茎、叶的分化,对于重金属离子的吸收不存在向植物茎、叶等地上部转运,这对研究植物对重金属或污染物的吸收与积累机制研究,毛状根无疑是一种理想材料(Banerjee et al., 2002).因为毛状根具有原植物全部遗传信息,在污染环境中,毛状根也能像植株自然根一样分泌根际物质,收集毛状根培养物可以作为环境污染修复缓解剂(Gujarathi et al., 2005; Doty,2008).利用毛状根进行对重金属与有机污染的修复方面研究,主要集中在国外,利用毛状根对重金属Ni、Cd和Cu污染修复,利用毛状根对有机污染物苯酚、氯苯、DDT、TNT、RDX和铀等污染的修复(Majumder and Jha, 2012),我国这方面的工作起步较晚,工作开展较少.从已有的研究可知,三叶鬼针草植株对Cd有很强的富集能力(魏树和等,2008; Sun et al., 2009),其毛状根对Cd、Pb富集如何?关于这方面研究,国内外未见报道.本文诱导出三叶鬼针草毛状根并展开其对重金属Cd、Pb富集,这对于利用三叶鬼针草毛状根修复重金属污染环境提供参考.
2 材料与方法(Materials and methods) 2.1 三叶鬼针草毛状根诱导剪下三叶鬼针草无菌苗幼嫩叶片,用细针在其表面刺许多小创伤,剪去叶缘,浸入C58C1的悬浮液中,200 r · min-1,27 ℃振荡25 min后,用无菌滤纸吸干叶片表面的菌液,接种于附加100 μmol · L-1乙酰丁香酮(Acetosyringone)的MS固体培养基中,27 ℃下黑暗培养6 d,取出叶片无菌水洗涤3~4次,吸干水分后接种于含有500 mg · L-1的头孢噻肟钠(CefotaximeSodium)的1/2 MS固体培养基中黑暗培养,每4 d更换1次培养基,直至毛状根长出.
2.2 毛状根的除菌与扩繁剪下从叶片长出的毛状根尖端部分接种于含有500 mg · L-1的头孢噻肟钠的1/2MS固体培养基上继代培养除菌.选取生长快的毛状根进行继代培养除菌5次后,剪下一定毛状根接种到盛有200 mL的1/2MS的液体培养基三角瓶中进行扩繁,大量繁殖为下面实验准备充足材料.
2.3 毛状根PCR鉴定以发根农杆菌C58C1为阳性对照,野生型三叶鬼针草根系为阴性对照,分别选取三叶鬼针草毛状根的9个株系进行PCR验证,以验证C58C1携带的基因rolB是否转入.rolB特异性引物为frolB:5′GCTCTTGCAGTGCTAGATTT3′; rrolB:5′GAAGGTG CAAGCTACCTCTC3′.依次加入GoTaq Green Master Mix 5.5 μL;正向引物和反向引物各0.25 μL;Nuclease-Free Water 3.5 μL;DNA模板0.5 μL.PCR条件:以发根农杆菌C58C1为阳性对照,对菌体进行10 min煮沸处理,然后同时进行以下程序,94 ℃预变性3 min;94 ℃变性45 s;55 ℃(rolB)退火45 s;72 ℃延伸45 s;30 个循环后72 ℃延伸10 min.扩增产物于120 V,90 mA下进行0.1%琼脂糖凝胶电泳后于凝胶成像系统中拍照保存.
2.4 重金属Cd、Pb胁迫下,毛状根对重金属的富集选取生长一致的三叶鬼针草毛状根以0.45~0.55 g的量接种于300 mL的以1/2MS+C母液的按单一Cd、Pb浓度为:25、50、100、200和400;复合Cd-Pb浓度为:25~0、25~25、25~100、25~200和200~0、200~25、200~100、200~200,单位均为μmol · L-1,未加重金属为对照CK.本实验设5个重复.重金属的培养瓶中,于25 ℃,110转全温控制大摇床中培养30 d,测定生物量和重金属含量.生物量测定:每种处理取5瓶毛状根于3%的EDTA-Na2溶液清洗3次,然后蒸馏水清洗1次,于60 ℃下烘干至恒重,称重,取均数为生物量.测定生物量后取1.000 g左右进行重金属蓄积量测定,方法参照“土壤质量-重金属测定王水回流消解原子吸收法”(NY/T 1613-2008)进行(农业部环境保护科研监测所,2008).
3 结果分析(Results and analysis) 3.1 三叶鬼针草毛状根诱导鉴定按照上方法利用农杆菌C58C1浸染三叶鬼针草后,经过3~5 d的暗培养,在叶脉处长出白色毛状根.随着毛状根的生长,剪下根尖部分在加有抗生素的1/2MS固体脱菌,如此重复3~5次后,外观确认毛状根表已经无C58C1菌体后,转移至1/2MS的液体培养基中进行大量扩繁,整个过程实验图片如图 1所示.并抽取毛状根进行鉴定.
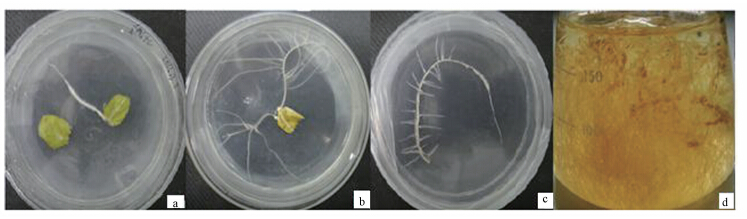 |
| 图 1 三叶鬼针草毛状根诱导及扩繁(a. 毛状根刚长出;b. 毛状根生长伸长;c. 毛状根在选择性培养基上继代培养;d. 毛状根在1/2MS培养基大量生长) Fig.1 Hairy root induction and exp and breeding of B. pilosa(A. Hairy roots germination; B. Hairy roots growth; C. Hairy roots grow in Successive transfer culture medium; D. Hairy roots grows in 1/2MS liquid medium) |
图1为三叶鬼针草叶片诱导毛状根比较有代表性的过程(a:被发根农杆菌C58C1浸染的叶片、叶脉部长出毛状根;b:叶脉长出的毛状根进一步生长,对侧叶缘也长出毛状根;c:毛状根不断生长,长至一定长度时,剪下尖端部分,接种于除菌继代培养基上;d:继代培养5次后剪下,把除菌后的毛状根剪成5cm左右,接种于1/2MS液体培养基中大量扩繁)
以三叶鬼针草自然根系为阴性对照,C58C1为阳性对照,对诱导出的毛状根进行PCR鉴定.从PCR凝胶成像结果可知,阴性对照“-”野生三叶鬼针草根系没有检测到rolB基因,阳性对照“+”C58C1与三叶鬼针草毛状根的6个被测株系均能检测到rolB基因,因此证明该毛状根为C58C1诱导含有rolB基因三叶鬼针草毛状根,凝胶图片见图 2.
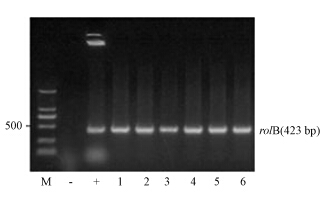 |
| 图 2 三叶鬼针草毛状根PCR的验证 Fig.2 PCR detection of hairy root of B. pilosa |
三叶鬼针草毛状根在单一Cd处理下,具有很强的忍耐力,能在50 μmol · L-1浓度中正常生长,生物量对照没有差异.当Cd处理浓度超过100 μmol · L-1时,毛状根的生长出现明显的抑制,并随处理浓度增加抑制程度加剧,生物量明显低于对照,见图 3a.在单一Pb处理下,处理浓度低于25 μmol · L-1,毛状根能正常生长,毛状根生物量与对照无差异.随浓度增加,毛状根生产受到明显抑制,生物量明显低于对照,见图 3b.图 3c所示,Cd-Pb复合处理时,低浓度Cd(μmol · L-1)与Pb复合处理,随Pb浓度增加(25、100、200 μmol · L-1)三叶鬼针草毛状根生物量逐渐减少,表明受到抑制效应随Pb增加而加剧;高浓度Cd(μmol · L-1)与Pb复合处理,随Pb浓度增加(25、100、200 μmol · L-1)三叶鬼针草毛状根生物量逐渐减少,表明受到抑制效应随Pb增加而加剧.高浓度Cd与Pb复合处理,毛状根生长受到抑制更严重.重金属总摩尔浓度相等时,如25-200和200-25胁迫组,鬼针草生物量没有差异,与单一Cd处理组2000相比,200-25组受到抑制更明显.
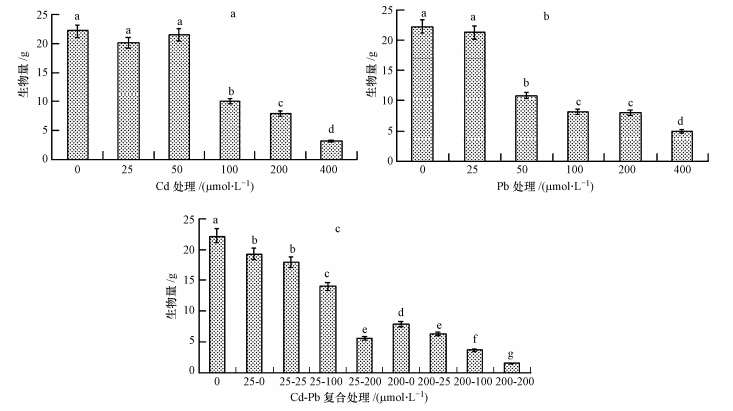 |
| 图 3 重金属Cd,Pb和Cd-Pb处理下三叶鬼针草毛状根生物量积累 Fig.3 Biomass of hairy root of B. pilosa with Cd,Pb and Cd-Pb processing |
单一Cd处理下,三叶鬼针草毛状根(以干重为计)体内的Cd含量在处理浓度≤50 μmol · L-1的低浓度处理下,表现为随浓度增加,蓄积量增加的趋势,在处理浓度为50 μmol · L-1时出现最大Cd蓄积值1736 mg · kg-1.当处理浓度≥100 μmol · L-1的中、高处理水平时,毛状根体内的Cd蓄积量并没有随处理浓度的增加而增加.低浓度处理更利于毛状根对Cd的蓄积,随着处理浓度增高毛状根对重金属蓄积减少,如图 4a.在单一Pb处理下,中、低浓度(≤100 μmol · L-1)时,三叶鬼针草毛状根对Pb蓄积,随浓度增加有微弱降低,但差异不明显.在高浓度Pb(≥200 μmol · L-1)处理下,Pb蓄积随处理浓度增加显著减少,如图 4b所示.
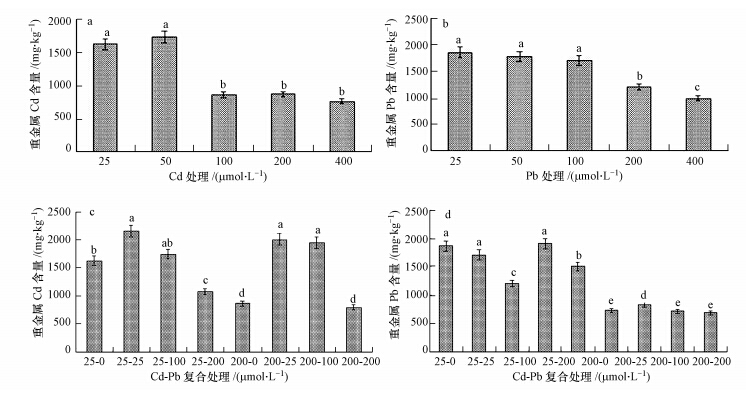 |
| 图 4 重金属Cd、Pb和Cd-Pb处理下三叶鬼针草毛状根生物体内重金属的蓄积 Fig.4 Accumulation of Cd and Pb in hairy root of B. pilosa with Cd,Pb and Cd-Pb processing |
Cd-Pb复合处理下,低浓度Pb(25 μmol · L-1)能显著促进三叶鬼针草毛状根对Cd的蓄积,如25-25和200-25处理组.中浓度下(100 μmol · L-1)也能微弱促进毛状根对Cd蓄积,如25-100和200-100处理组.高浓度Pb复合处理组没有明显促进毛状根对Cd的蓄积,如200-0和200-200处理组.Cd-Pb复合处理,毛状根对Cd蓄积主要抑制因子是Cd的中、高浓度本身,Pb对Cd在毛状根中蓄积有一定的促进作用,如图 4c所示.
低浓度Cd(25 μmol · L-1)非常微弱促进低浓度Pb复合处理的三叶鬼针草毛状根对Pb的蓄积,但不显著,如0-25和25-25处理组.高浓度Cd(200 μmol · L-1)显著抑制低、中、高浓度Pb复合处理的毛状根对Pb蓄积.Cd-Pb复合处理,影响毛状根对Pb蓄积主要因子是Pb本身,随着Pb处理浓度增加,蓄积量减少显著,如图 4d所示.
4 讨论(Discussion)三叶鬼针草自然植株在土壤中Cd浓度从8 mg · kg-1增加至100 mg · kg-1时,其根部的Cd蓄积量也由(31.3±6.0)mg · kg-1增加到(201.1±60.1)mg · kg-1(Sun et al., 2009),同时在与紫茉莉(Mirabilis Jalapa)(Cd的富集植物,(吴双桃,2006))、中华景天(Sedum polytrichoides)两种植物对Cd污染农田土壤比较实验中,三叶鬼针草对12.0 mg · kg-1的高污染和1.2 mg · kg-1的低污染农田土壤均表现最佳的修复优势(韩少华等,2012).而本文诱导出的三叶鬼针草对Cd处理浓度为50 μmol · L-1时达到最大蓄积值1736 mg · kg-1,可见三叶鬼针草毛状根对Cd修复潜能是非常强大的.目前对于重金属超富集植物标准,主要沿用Baker等研究的指标,包括蓄积量(metal accumulation)、提取率(metal extraction ratio)、富集系数(bioaccumulation factor,BF)和转移系数(translocation factor,TF)等(孙约兵,2009),对于植物培养物,如毛状根对重金属污染修复能力尚无具体标准报道,仅见Wu等的“重金属忍耐力强,富集能力也比较强植物修复材料可作为植物修复材料的模糊而笼统的概述(Wu et al., 2001)”.所以本文对于三叶鬼针草毛状根对重金属忍耐和蓄积也只能与不同种类植物的毛状根进行类比.施和平等(施和平等,2010)利用Cd处理褐脉少花龙葵(Solanum nigrum L. var pauciflorum)毛状根,在Cd处理浓度为50 μmol · L-1时毛状根没有表现出生长抑制或毒害症状,相反的有微弱的促进生物量增加的效应,在毛状根培养15 d后,生物量约比CK增高12.8%,说明褐脉少花龙葵毛状根与自然植株一样具有较强的Cd耐受能力,这与本研究三叶鬼针草毛状根在Cd≤50 μmol · L-1的与Pb≤25 μmol · L-1处理时,生物量比对照没有显著的减少,表明三叶鬼针草在也有较强的对重金属Cd、Pb胁迫的耐受性一致.王云灵(2010)研究发现南美蟛蜞菊(Wedelia trilobata)在Cd胁迫浓度为50 μmol · L-1时促进生物量积累,毛状根最大吸收Cd不是最大胁迫浓度300 μmol · L-1,而是出现在100 μmol · L-1的中胁迫浓度时,本研究中三叶鬼针草毛状根Cd胁迫的响应也与南美蟛蜞菊毛状根表现一致,但本实验设定最低浓度时Cd没有促进三叶鬼针草毛状根生物量的积累,Cd的最大吸收量不是出现在最大Cd胁迫浓度400 μmol · L-1,而是出现在Cd胁迫浓度为25 μmol · L-1的胁迫组.结合其他研究者对Cd超富集植物遏蓝菜(Thlaspi caerulscens)和重金属Ni超富集植物野葱(Alyssum bertolonii)诱导的毛状根对也与自然植株一样均表现出对Cd、Ni的富集(Nedelkoska and Doran, 2000; Boominathan and Doran, 2002).其机制是因为毛状根也与自然植株一样能以细胞壁固定和液泡区室化等措施隔离重金属,降低重金属在细胞器内去迁移性,避免毒害生物活性强的细胞器(Nedelkoska and Doran, 2001; Boominathan and Doran, 2003).三叶鬼针草毛状根对重金属Cd的耐受机制是否也与此一致?利用植物全息性,利用毛状根再生转入rolB基因的根系得到加强转基因植株,其对重金属Cd、Pb的植物吸收能力是否得到加强?这些都是下一步深入开展工作的方向.毛状根多用于持续性有机物污染中较多,对于重金属污染研究较少,根据毛状根与重金属或者有机污染物相互作用的信息,包括特定基因的表达和酶类的合成以及这些酶在环境修复过程中的作用机制(Ku c ˇ erová et al., 2000),通过现代生物技术手段,调节培养基中植物激素配比把处于未分化的毛状根诱导成植株应用于环境污染的植物修复领域将是植物修复未来发展的新方向(Maestria and Marmirolia, 2011).
5 结论(Conclusions)以发根脓杆菌C5831诱导Cd超富集植物三叶鬼针草产生的毛状根,在单一Cd、Pb胁迫下,相同的摩尔浓度处理下对Cd的耐受比Pb强.在Cd≤50 μmol · L-1和Pb≤25 μmol · L-1时,毛状根能正常生长,生物量积累与对照无明显差异,表现较强的重金属耐受性.
1)单一Cd处理下,Cd≤50 μmol · L-1时,表现随浓度增加,蓄积量增加的趋势,在处理浓度为50 μmol · L-1时出现最大Cd蓄积值1736 mg · kg-1.低浓度处理更利于毛状根对Cd的蓄积.
2)在单一Pb处理下,中、低浓度(≤100 μmol · L-1)时,三叶鬼针草毛状根对Pb蓄积,随浓度增加有微弱降低,但差异不明显.在高浓度Pb(≥200 μmol · L-1)处理下,Pb蓄积随处理浓度增加显著减少.
3)Cd-Pb复合处理相对于单一Cd处理,Pb加入加强了毛状根生物量积累的抑制效应,这种抑制效应并随Pb浓度增加而加剧;Cd-Pb复合处理,低浓度Pb能显著增加毛状根对Cd的蓄积,随浓度增加这种促进效应逐渐变为抑制效应;低浓度Pb能微弱增加毛状根对Cd的蓄积,但不明显,随Pb浓度增加,这种微弱抑制效应转变为较强的抑制效应.
利用发根农杆菌C58C1诱导的三叶鬼针草毛状根具有生长快、生物量大的特点,能对Cd、Pb胁迫有很强的耐受性与生物富集能力,可作为一种潜在的重金属Cd、Pb污染修复新材料.
| [1] | Bane rjee S, Shang T Q, Wilson A M, et al. 2002. Expression of functional mammalian P450 2E1 in hairy root cultures [J]. Biotechnology and Bioengineering, 77(4): 462-466 |
| [2] | Boominathan R, Doran P M. 2002. Ni-induced oxidative stress in roots of the Ni hyperaccumulator, Alyssum bertolonii [J]. New Phytologist, 156(2): 205-215 |
| [3] | Boominathan R, Doran P M. 2003. Organic acid complexation, heavy metal distribution and the effect of ATPase inhibition in hairy roots of hyperaccumulator plant species [J]. Journal of Biotechnology, 101(2): 131-146 |
| [4] | Doty S L. 2008. Enhancing phytoremediation through the use of transgenics and endophytes [J]. New Phytologist, 179(2): 318-333 |
| [5] | Eapen S, Suseelan K N, Tivarekar S, et al. 2003. Potential for rhizofiltration of uranium using hairy root cultures of Brassica juncea and Chenopodium amaranticolor [J]. Environmental Research, 91(2): 127-133 |
| [6] | Guillon S, Trémouillaux-Guiller J, Pati P K, et al. 2006. Hairy root research: recent scenario and exciting prospects [J]. Current Opinion in Plant Biology, 9(3): 341-346 |
| [7] | Gujarathi N P, Linden J C. 2005. Oxytetracycline inactivation by putative reactive oxygen species released to nutrient medium of Helianthus annuus hairy root cultures [J]. Biotechnology and Bioengineering, 92(4): 393-402 |
| [8] | Han B B, Linden J C, Gujarathi N P, et al. 2004. Population balance approach to modeling hairy root growth [J]. Biotechnology Progress, 20(3): 872-879 |
| [9] | 韩少华, 黄沈发, 唐浩, 等. 2012. 3种植物对Cd污染农田土壤的修复效果比较试验研究 [J]. 环境污染与防治, 34(12): 22-30 |
| [10] | Kučerová P, Macková M, Chromá L, et al. 2000. Metabolism of polychlorinated biphenyls by Solanum nigrum hairy root clone SNC-9O and analysis of transformation products [J]. Plant and Soil, 225(1/2): 109-115 |
| [11] | Maestria E, Marmirolia N. 2011. Transgenic plants for phytoremediation [J]. International Journal of Phytoremediation, 13(1): 264-279 |
| [12] | Majumder A, Jha S. 2012. Hairy roots: a promising tool for phytoremediation // Satyanarayana T, Johri B N, Prakash A. Microorganisms in Environmental Management: Microbes and Environment[M]. Netherlands: Springer. 607-629 |
| [13] | Nedelkoska T V, Doran P M. 2000. Hyperaccumulation of cadmium by hairy roots of Thlaspi caerulescens [J]. Biotechnology and Bioengineering, 67(5): 607-615 |
| [14] | Nedelkoska T V, Doran P M. 2001. Hyperaccumulation of nickel by hairy roots of Alyssum species: comparison with whole regenerated plants [J]. Biotechnology Progress, 17(4): 752-759 |
| [15] | 农业部环境保护科研监测所. 2008. NY/T 1613—2008 土壤质量-重金属测定 王水回流消解原子吸收法 [S]. 北京: 中国农业出版社 |
| [16] | 施和平, 曾宝强, 王云灵, 等. 2010. 镉及其与钙组合对褐脉少花龙葵毛状根生长、抗氧化酶活性和吸收镉的影响 [J]. 生物工程学报, 26(2): 147-158 |
| [17] | Sun Y B, Zhou Q X, Wang L, et al. 2009. Cadmium tolerance and accumulation characteristics of Bidens pilosa L. as a potential Cd-hyperaccumulator [J]. Journal of Hazardous Materials, 161(2/3): 808-814 |
| [18] | 孙约兵, 周启星, 王林, 等. 2009. 三叶鬼针草幼苗对镉污染的耐性及其吸收积累特征研究 [J]. 环境科学, 30(10): 3028-3035 |
| [19] | Suresh B, Sherkhane P D, Kale S, et al. 2005. Uptake and degradation of DDT by hairy root cultures of Cichorium intybus and Brassica juncea [J]. Chemosphere, 61(9): 1288-1292 |
| [20] | Suza W, Harris R S, Lorence A. 2008. Hairy roots: from high-value metabolite production to phytoremediation [J]. Electronic Journal of Integrative Biosciences, 3(1): 57-65 |
| [21] | 王云灵. 2010. 镉对南美蟛蜞菊毛状根生长、镉吸收及细胞毒性的影响以及钙的缓解效应 . 广州:华南师范大学 |
| [22] | 魏树和, 杨传杰, 周启星. 2008. 三叶鬼针草等7种常见菊科杂草植物对重金属的超富集特征 [J]. 环境科学, 29(10): 2912-2918 |
| [23] | 吴双桃. 2006. 紫茉莉修复镉污染土壤的研究 [J]. 污染防治技术, 19(4): 17-18 |
| [24] | Wu S X, Zu Y G, Wu M L. 2001. Cadmium response of the hairy root culture of the endangered species Adenophora lobophylla [J]. Plant Science, 160(3): 551-562 |
 2015, Vol. 35
2015, Vol. 35


