2. 广东省环境污染控制与修复技术重点实验室(中山大学), 广州 510275
2. Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology(Sun Yat-sen University), Guangzhou 510275
过去30多年的研究成果认为红树林湿地生态系统能有效地去除污水中的氮、磷营养盐从而使水质得到净化(林鹏,1997),但近些年也有研究显示,红树林内为氮、磷的库,红树林内底栖微藻和浮游生物(浮游动物和浮游藻类)密度普遍较高,有林内富营养化现象(Betrones and Castrejón,1999; 陈长平等,2002; 王雨等,2007;Huang et al.,2012).因而,红树林的大面积推广种植对沿海富营养化的影响尚不明确.
生长在潮间带的红树植物生长环境特殊,根区多为厌氧生境,根系十分发达,对根际微环境中的底栖生物群落包括细菌、真菌、微藻等微生物均有影响(曹启民等,2008;Liu et al.,2013),应该与其根系微域中的物质密切相关,特别是有机类物质.目前对此方面的研究甚少,特别是在原位情景下,红树植物根际环境中有机类物质的浓度和成分是一个值得深入探讨的问题.
溶解性有机物(dissolved organic matter,简称DOM)通常被定义为能通过0.45 μm滤膜的具有不同结构和分子量的有机物的连续体(Kalbitz et al.,2000).土壤中的DOM在碳、氮和磷的生物地球化学作用、成土作用和污染物运输中都起到重要的作用,主要来源于植物碎屑、土壤腐殖质、微生物或根分泌物.水环境中的DOM主要来源于陆源植物和土壤或水生植物、藻类及微生物等的排泄和死亡分解(Kalbitz et al.,2000).相关研究显示,土壤、水体和植物浸提液中的DOM组成特性差别较大(谢理等,2013).
对DOM组成结构的研究大多使用紫外-可见光谱、荧光光谱、傅里叶红外光谱、核磁共振等多种光谱技术(Anu et al.,2011).荧光光谱法,特别是三维荧光光谱法(excitation emission matrices,简称EEMs)是水环境有机物研究中一种灵活的工具,具有广泛应用的可能,如应用荧光光谱法追踪海洋中的合成溶解性有机物、海洋和河口水体中DOM的研究.目前,EEMs比较普遍地是用于海洋有机物来源、特征和相互作用的研究中(Naomi et al.,2007).但对红树林中DOM组成结构的应用研究目前仍未见报道.
本研究于2013年9月对广东省湛江市红树林国家级自然保护区5种主要红树植物建群种进行原位采样调查,采用总有机碳分析仪(TOC仪)和三维荧光分析法分别测定与分析红树植物根际土及非根际土孔隙水中的DOM浓度和成分组成特性,以了解红树植物根际环境中DOM的来源及构成特点,通过对比分析,能更进一步了解原位情景下红树植物对根际微域微生物的影响及其机理,有利于深入理解红树植物的生态功能与作用,以期为红树植物的推广种植及管理提供科学理论依据.
2 材料与方法(Materials and methods) 2.1 研究区域概况及采样点定位广东省湛江市廉江红树林国家级自然保护区是我国现存连片面积最大的一个自然保护区,高桥镇红树林是其主要核心区域之一,保护区内有红树植物14科28种(引进4种),其中真红树8种,引种红树4种.于2013年9月7—9日在湛江高桥红树林保护区内进行采样.选择该保护区内的5种面积较大的主要建群红树林群落:红海榄(Rhizophora stylosa,Rs)、秋茄(K and elia c and el,Kc)、木榄(Bruguiera gymnorrhiza,Bg)、无瓣海桑(Sonneratia apetala,Sa)、桐花树(Aegiceras corniculatum,Ac)、低潮带桐花树(简称Ac-L),每种红树林内设3个采样点(即选择3株植株高度相近之植物),采集其根际土以及非根际土.由于采样面积较大,每个样点和每株红树植物均用经纬度仪确定位置,范围大致在N21°32′35.06″,E109°46′09.01″间.
2.2 土样(根际土和非根际土)采集以抖落法采集根际土用于孔隙水组分分析(王珍珍等,2011),挖出根系,去掉附着于根系的大量土壤,留包裹根系的土壤,即根表面0~5 mm,抖落根际土作为根际土(rhizosphere soil,rs)样品,由于红树林内土壤较为黏重,对于粘附在根系上无法抖落的土则将其刮下.并在远离根系处(10 cm以外)去除表层土后挖取同等深度的土作为非根际土(bulk soil,bs)样品.将采集的土样装入密封袋内冷冻保存带回.
2.3 室内样品预处理将冻干根样研磨成粉,过100目筛后密封冷藏保存.将冻干土样中肉眼可见的根碎屑等杂物去除,研磨成粉,过40目筛后密封冷藏保存.用于土样孔隙水DOM组分分析的样品于 4 ℃下冷藏保存,并尽快进行测定.
2.4 根际土及非根际土孔隙水DOM浓度测定孔隙水的收集(傅平青等,2004):孔隙水通过室内使用冷冻离心机对采集的根际土及非根际土样品离心分离30 min得到,转速为8000 r · min-1,倾出水立即用0.45 μm玻璃纤维滤膜(预先于450 ℃灼烧5 h)过滤,装入棕色玻璃瓶内保存在4 ℃冰箱里待测.通常以溶解性有机碳(dissolved organic carton,简称DOC)的含量来表征DOM的浓度.取1 mL母液加高纯水稀释至20 mL,使用TOC仪(日本岛津TOC-VCPH)测定根际土孔隙水和非根际土孔隙水中DOC含量,表述为rs-DOC和bs-DOC,每一样品均测定3个平行样.
2.5 DOM荧光法组分分析海洋DOM中,含有类蛋白和类腐殖质荧光等不同的荧光基团,且不同来源的DOM具有不同的荧光基团,荧光峰的位置和荧光强度也有所差异.由于不同的荧光物质或荧光基团存在特定的激发(激发波长:excitation wavelength,简称Ex)和发射(发射波长:emission wavelength,简称Em)最大波长,根据激发和发射最大波长的位置可以确定荧光物质或荧光基团的存在,从而获得DOM中含有的荧光基团的信息.DOM的荧光基团主要分为类腐殖质和类蛋白两大类,其中类腐殖质中又可分出紫外光区类腐殖质(A峰)和可见光区类腐殖质(C峰);类蛋白分为长波处类蛋白(B峰)和短波处类蛋白(D峰)(Hudson et al.,2007),见图 1.通常认为A峰和C峰反映的是外源(陆源)输入的腐殖酸和富里酸形成的荧光峰,B峰和D峰代表的是内源生物降解来源的类酪氨酸和类色氨酸形成的荧光峰(陈小锋等,2012).其中,A峰的成分主要为腐殖酸,C峰的成分主要为富里酸,腐殖酸的芳香性较富里酸高.因此,可以利用内源性的B峰或D峰与外源性的A峰或C峰的峰值比值,如B峰与C峰的比值r(B,C)来探究水体DOM的来源,比值越大,即代表DOM的内源性越强,反之,值越小则代表外源性越强(刘明亮等,2009).
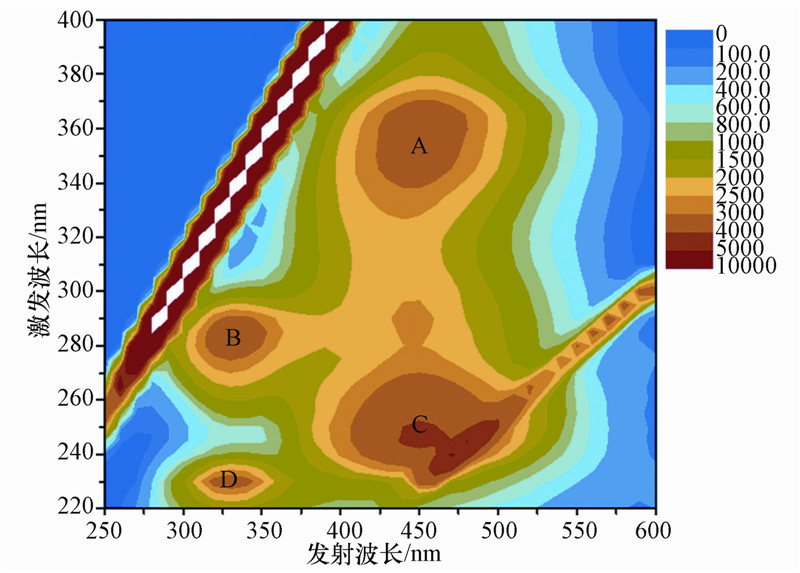 |
| 图 1 DOM中主要的荧光物质及对应的荧光峰位置(A.紫外光区类腐殖质; B.长波处类蛋白; C.可见光区类腐殖质; D.短波处类蛋白) Fig. 1 Main fluorescence matter and corresponding peaks position of DOM(A. humic-like matter in ultraviolet region; B. protein-like matter at long wave;C. humic-like matter in visible light region; D. protein-like matter at short wave) |
此外,也可用荧光指数(fluoresence index,简称FI)来判断DOM的来源.FI是指Ex为370 nm时,荧光发射光谱强度(fluoresence emission intensity,FEI)在450 nm与500 nm处的比值(FI=FEI450/FEI500).McKnight等通过对有陆源有机物输入的溪流和无陆源输入仅靠水体中微生物产生有机物的湖泊之间荧光指数的对比,发现FI在两者之间具有明显区别,可以用于区分DOM的来源,其中陆源富里酸的FI为~1.4,内源富里酸的FI为~1.9,陆源即代表外来的陆源有机物,内源则指微生物、藻类等产生的有机物(McKnight et al.,2001).
由于根际土及非根际土中化学组分尤其是有机物组成非常复杂,不可能对每种组分都进行分离鉴定与含量测定,因此,利用三维荧光分析法,通过荧光峰比例r(B,C)、荧光指数(FI)等指标来对根际土孔隙水中的DOM组分(rs-DOM)和非根际土孔隙水中的DOM组分(bs-DOM)进行大类分析测定应为较好选择(陆松柳等,2009).待确定主要成分后,可以进行后续的更进一步的细致分析.
采用荧光光谱仪(日本日立F-4500)进行分析,光源为150 W氙弧灯,电压700 V.激发波长Ex间隔5 nm,发射波长Em间隔10 nm,扫描区域为:Ex=220~400 nm,Em=250~600 nm.
2.6 数据统计与处理方法综合使用Excel(2007)、SPSS(17.0)、OriginPro(8)对数据进行分析、制作三维荧光图、计算各组分峰值比例r(B,C)和荧光指数(FI).
3 结果和讨论(Results and discussion) 3.1 根际土及非根际土孔隙水DOC含量分析图 2对比了5种红树植物rs-DOC和bs-DOC含量,结果显示18组样点中14组样点表现出rs-DOC>bs-DOC的规律,以桐花树规律最为明显且DOC含量差值较大且较稳定,Ac的rs-DOC为193.53 mg · L-1,bs-DOC为89.69 mg · L-1;Ac-L的rs-DOC为351.37 mg · L-1,bs-DOC为135.90 mg · L-1.红海榄差异幅度最小,rs-DOC为184.00 mg · L-1,bs-DOC为150.67 mg · L-1.其它3种红树植物差异幅度较大且均只有2个样点是rs-DOC>bs-DOC.rs-DOC的总平均值为207.87 mg · L-1;bs-DOC的总平均值为144.51 mg · L-1.大约78%的红树植物呈现出rs-DOC>bs-DOC的规律.
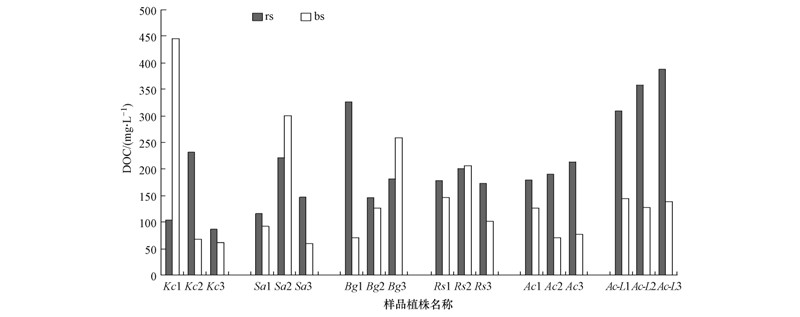 |
| 图 2 5种红树植物根际土与非根际土孔隙水DOC含量 Fig. 2 DOC concentration in pore waters in rhizosphere soil and bulk soil of five mangrove plants |
一般认为,土壤DOM可能有4种不同的来源:植物凋落物、腐殖化的有机质、根系分泌物和微生物生物量(Kalbitz et al.,2000).红树林一方面自身新陈代谢快,林内动植物丰富,另一方面对外源有机污染物具有截留作用,林内孔隙水中的有机物有可能来源于红树植物凋落物分解、大量陆源有机质的输入、红树林内底栖动物或藻类及微生物等的新陈代谢等.叶彬彬等研究发现秋茄幼苗生长的土壤中,相比于非根际土层,根际土层中DOM浓度较高,推测是根际环境中靠近植物根系的土层中DOM很大一部分来自于根际微环境中微生物新陈代谢的产物以及根系分泌物或降解产物组成(叶彬彬和严重玲,2008).而红树植物根系来源的有机物有相当一部分为单宁,难以被降解,再加上厌氧环境,最终导致红树植物根系环境中DOM含量较高(杨秀虹等,2013).
3.2 根际土及非根际土孔隙水DOM三维荧光光谱特征对36个样品均测试其三维荧光光谱图,图 3仅代表性地展示其中12个样品的rs-DOM、bs-DOM的三维荧光图(每种红树植物选择一个样点且对应展示其根际土和非根际土的状况).从图 2可看出,大部分样品均存在包括2个类腐殖酸荧光峰和2个类蛋白荧光峰;根际土样品(a),(c),(e),(g),(i),(k)的4个主要的荧光峰均较非根际土样品(b),(d),(f),(h),(j),(l)的4个主要的荧光峰明显,说明所有的样品根际土中的有机物浓度及成分均大于非根际土中.特别是在(g)样品,说明无瓣海桑3较其他几种红树植物中根际土中含有更多的有机物质.
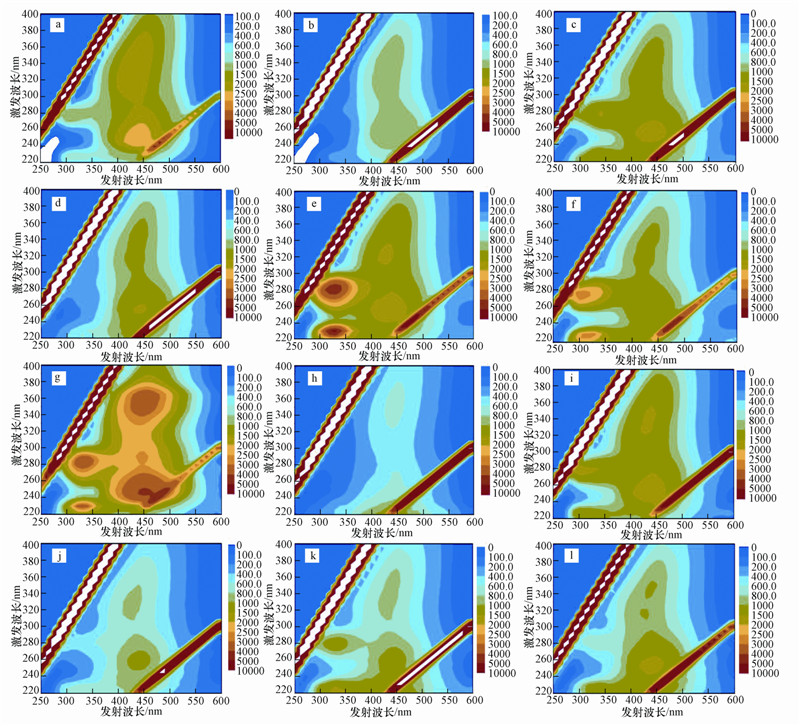 |
| 图 3 红树植物根际土及非根际土孔隙水的DOM三维荧光光谱图(根际土:(a),(c),(e),(g),(i),(k); 非根际土:(b),(d),(f),(h),(j),(l).(a)、(b).桐花树3;(c)、(d).秋茄2;(e)、(f).木榄3;(g)、(h).无瓣海桑3;(i)、(j).桐花树-L2;(k)、(l).红海榄1.) Fig. 3 3-D fluorescent contours of DOM in pore water in rhizosphere soil and bulk soil of five mangrove plants rs:(a),(c),(e),(g),(i),(k); bs:(b),(d),(f),(h),(j),(l)(a)、(b). Ac3;(c)、(d). Kc2;(e)、(f). Bg3;(g)、(h). Sa3;(i)、(j). Ac-L2;(k)、(l). Rs1) |
本次采集的36个孔隙水样品DOM的 r(B,C)值除5个缺乏B峰(即r(B,C)值为0)外,其它的值在0.253 ~8.128之间(见表 1),且rs-DOM的r(B,C)值多数大于bs-DOM中(18对中有12对),可见根际土孔隙水中溶解性有机物的内源性较非根际土强.
| 表 1 5种红树植物根际土与非根际土孔隙水r(B,C)值 Table 1 r(B,C)of DOM in pore water in rhizosphere soil and bulk soil of five mangrove plants |
对36个孔隙水样品DOM的 r(A,C)值进行分析,除2个缺乏A峰(即r(A,C)值为0)外,其它的值只有2个小于1,而有32个数值均为大于1(见表 2),说明紫外光区类腐殖质(A峰)大多数大于可见光区类腐殖质(C峰),也即在外源输入情况下,输入的腐殖酸量大于富里酸量.
一般认为,土壤中提取的DOM主要由碳水化合物组成,芳香族物质少,烷基链烃含量少且支链短,分子结构也较简单.而湖泊水体中DOM主要有类腐殖质和类蛋白质物质,结构复杂,分子量大,苯环多,腐殖化程度较高(Parlanti et al.,2000).红树植物更类似于后者,外源输入的腐殖酸量大于富里酸量,芳香族物质较多.
| 表 2 5种红树植物根际土与非根际土孔隙水r(A,C)值 Table 2 r(A,C)of DOM in pore water in rhizosphere soil and bulk soil of five mangrove plants |
表 3是红树植物根际土与非根际土孔隙水中溶解性有机物的荧光指数,数值在1.60~1.87,FI整体上较高,接近于内源富里酸FI的~1.9,说明红树林内rs-DOM和bs-DOM均主要来源于内源,即土壤中的微生物、藻类、红树植物根系等新陈代谢产生.另一方面,除了Ac,FI的平均值为rs-DOM>bs-DOM外,其他均为rs-DOM>bs-DOM,即荧光指数在根际土孔隙水中的值大多大于非根际中,与r(B,C)值的对比结果相同,因此,rs-DOM较bs-DOM更多地由内源产生,故推测根际土孔隙水中的溶解性有机物主要可能来源于根际微生物或红树植物根系分解产物和分泌物.另外,从整体上看,FI值在各个红树植物中均无显著性差异,说明整体上该保护区的红树植物有机物来源是以内源产生为主,陆源有机物来源的相对较低,一定程度上也可反映红树植物根系分泌物含量较高及根际微生物的活性较强.
| 表 3 5种红树植物根际土与非根际土孔隙水DOM荧光指数(FI) Table 3 Fluorescent index of DOM in pore water in rhizosphere soil and bulk soil of five mangrove plants |
从表 3可见,5种红树植物中,桐花树-L由于处于低潮带,受陆源污染较小,根际土和非根际土孔隙水DOM显示出较强的内源性.而木榄和红海榄根际土孔隙水DOM的内源性较其他红树植物强,推测这两种红树植物的根际环境生物作用较强,微生物和红树植物根系产生的水溶性有机物较多.
研究表明,红树植物是强大的第一生产者,能以凋落物的形式提供大量的营养物质;红树植物交织的支柱根及气生根能减缓水体流速,滞留汇集污染物的效果明显,即使是凋落物产生的营养物质也较难被带出到红树林之外;红树植物根系死亡或腐烂、根表皮在土壤中分解的过程中可能会向土壤中释放氮磷等营养物质及多酚类等化感物质,红树植物根系含有大量的单宁酸(Ayoub and Yankov,1985; Pillinger et al.,1994);根际微环境的形成与根系分泌物密切相关,红树植物根泌物中除酚类物质外,可能还存在其他化感物质(Kimura and Wada,1989; 李玫等,2004; 李春强等,2009);红树根系丰富的根际微生物群落如各种固氮菌和溶磷菌会产生营养(Anjan and Chaudhuri,1991; Vazquez et al.,2000;曹启民等,2008;李春强等,2009);根际底栖动物对底质的搅动作用(Taylor et al.,1986),使得红树林内营养物质丰富.因此,进一步分析红树植物根际环境中各类物质的来源和贡献率将会是较大的挑战.
4 结论(Conclusions)1)红树植物根际土孔隙水DOC含量的总平均值为207.87 mg · L-1;非根际土孔隙水DOC含量总平均值为144.51 mg · L-1.
2)大约78%的红树植物呈现出根际土孔隙水DOC含量高于非根际土中的规律,其中以桐花树规律最为明显.
3)从三维荧光光谱图判断,根际土中有机物浓度及成分均大于非根际土中,特别是无瓣海桑较其它几种红树植物根际土比非根际土中含有更多的有机物质.
4)从孔隙水样品DOM的荧光特征值r(B,C)、r(A,C)和荧光指数FI判断,红树植物根际土孔隙水中溶解性有机物的内源性较非根际土强,外源输入的腐殖酸量大于富里酸量,芳香族物质较多.
5)总体说明在根区环境中,红树植物根系分解产物、根系分泌物及根际微生物的活动对根际土中的水溶性有机物贡献较大.
| [1] | Anjan S, Chaudhuri S. 1991. Ecology of heterotrophic dinitrogen fixation in the rhizosphere of mangrove plant community at the Ganges river estuary in India[J]. Oecologia, 87(4): 560-564 |
| [2] | Anu M, Gjessing E T, Lahtinen T, et al. 2011. An overview of the methods used in the characterisation of natural organic matter (NOM) in relation to drinking water treatment[J]. Chemosphere, 83(11): 1431-1442 |
| [3] | Ayoub S M H, Yankov L K. 1985. Algicidal properties of tannins[J]. Fitoterapia, 6(4): 227-229 |
| [4] | Betrones D A S, Castrejón E S. 1999. Structure of benthic diatom assemblages from a mangrove environment in a Mexican subtropical lagoon1[J]. Biotropica, 31(1): 48-70 |
| [5] | 陈小锋, 揣小明, 刘涛, 等. 2012. 江苏省西部湖泊溶解性有机物光谱学特征和来源解析[J]. 湖泊科学, 24(2): 259-266 |
| [6] | 陈长平, 高亚辉, 林鹏. 2002. 红树林区硅藻研究进展[J]. 海洋科学, 26(3): 17-19 |
| [7] | 曹启民, 郑康振, 陈耿, 等. 2008. 红树林生态系统微生物学研究进展[J]. 生态环境, 17(2): 839-845 |
| [8] | 傅平青, 刘丛强, 吴丰昌, 等. 2004. 洱海沉积物孔隙水中溶解有机质的三维荧光光谱特征[J]. 第四纪研究, 24(6): 695-700 |
| [9] | Huang Q X, Liu Y, Zheng X W, et al. 2012. Phytoplankton community and the purification effect of mangrove in the mangrove plantation-aquaculture coupling systems in the Pearl River Estuary[J]. Procedia Environmental Sciences, 15: 12-21 |
| [10] | Hudson N, Baker A, Reynoles D. 2007. Fluorescence analysis of dissolved organic matter in natural, waste and polluted waters—a review[J]. River Research and Applications, 23(6): 631-649 |
| [11] | Kalbitz K, Solinger S, Park J H, et al. 2000. Controls on the dynamics of dissolved organic matter in soils: a review[J]. Soil Science, 165(4): 277-304 |
| [12] | Kimura K, Wada H. 1989. Tannins in mangrove tree roots and their role in the root environment[J]. Soil Science and Plant Nutrition, 35(1): 101-108 |
| [13] | 李春强, 刘志昕, 黎娟华, 等. 2009. 红树植物化感作用对中肋骨条藻生长的影响[J]. 热带作物学报, 30(6): 862-867 |
| [14] | 李玫, 廖宝文, 郑松发, 等. 2004. 无瓣海桑对乡土红树植物的化感作用[J]. 林业科学研究, 17(5): 641-645 |
| [15] | 林鹏. 1997. 中国红树林生态系[M]. 北京: 科学出版社 |
| [16] | 刘明亮, 张运林, 秦伯强. 2009. 太湖入湖河口和开敞区 CDOM 吸收和三维荧光特征[J]. 湖泊科学, 21(2): 234-241 |
| [17] | Liu Y, Li F, Huang Q X. 2013. Allelopathic effects of gallic acid from Aegiceras corniculatum on Cyclotella caspia [J]. Journal of Environmental Sciences, 25(4): 776-784 |
| [18] | 陆松柳, 胡洪营, 孙迎雪, 等. 2009. 3 种湿地植物在水培条件下的生长状况及根系分泌物研究[J]. 环境科学, 30(7): 1901-1905 |
| [19] | McKnight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 46(1): 38-48 |
| [20] | Parlanti E, Wörz K, Geoffroy L, et al. 2000. Dissolved organic matter fluorescence spectroscopy as a tool to estimate biological activity in a coastal zone submitted to anthropogenic inputs[J]. Organic Geochemistry, 31(12): 1765-1781 |
| [21] | Pillinger J M, Cooper J A, Ridge I. 1994. Role of phenolic compounds in the antialgal activity of barley straw[J]. Journal of Chemical Ecology, 20(7): 1557-1569 |
| [22] | Taylor P R, Littler M M, Littler D S. 1986. Escapes from herbivory in relation to the structure of mangrove island macroalgal communities[J]. Oecologia, 69(4): 481-490 |
| [23] | Vazquez P, Holguin G, Puente M E, et al. 2000. Phosphate-solubilizing microorganisms associated with the rhizosphere of mangroves in a semiarid coastal lagoon[J]. Biology and Fertility of Soils, 30(5/6): 460-468 |
| [24] | 王珍珍, 刘晓艳, 张新颖, 等. 2011. 长江口油污湿地植物根际微生态环境特征[J]. 环境科学学报, 31(5): 1026-1032 |
| [25] | 王雨, 卢昌义, 谭凤仪, 等. 2007. 深圳红树林区浮游植物时空变化与水质要素的关系[J]. 生态科学, 26(6): 505-512 |
| [26] | 谢理, 杨浩, 渠晓霞, 等. 2013. 滇池典型陆生和水生植物溶解性有机质组分的光谱分析[J]. 环境科学研究, 26(1): 72-79 |
| [27] | 杨秀虹, 彭琳婧, 李适宇, 等. 2013. 红树植物凋落叶分解对土壤可溶性有机质的影响[J]. 生态环境学报, (6): 924-930 |
| [28] | 叶彬彬, 严重玲. 2008. 镉胁迫下红树林沉积物中水溶性有机物的变化[J]. 应用与环境生物学报, 14(2): 198-201 |
 2015, Vol. 35
2015, Vol. 35


