2. 福建师范大学亚热带湿地研究中心, 福州 350007;
3. 湿润亚热带生态-地理过程教育部重点实验室, 福州 350007
2. Research Center of Wetlands in Subtropical Region, Fujian Normal University, Fuzhou 350007;
3. Key Laboratory of Humid Sub-tropical Eco-geographical Process of Ministry of Education, Fuzhou 350007
甲烷(CH4)、二氧化碳(CO2)和氧化亚氮(NO2)是主要的温室气体,当今全球大气中的CH4浓度是工业革命前的2.5倍(IPCC,2013).CH4的单分子增温潜势是CO2的25倍,全球大气中CH4浓度的微量变化将引起气候的深刻变化(Bridgham et al., 2013),因而受到国际社会的高度关注.厌氧生境是CH4产生与排放的主要源地,其中,天然湿地对全球CH4排放通量的贡献率约为15%~40%(Bridgham et al., 2006).湿地土壤是大气中甲烷的“源”或“汇”,取决于产甲烷菌(Methanogenus)的CH4产生潜力和甲烷氧化菌(Methanotrophs)的CH4氧化潜力二者之间的平衡,并受外源物质输入的影响(Eriksson et al., 2010).目前,关于外源物质输入对湿地CH4产生的影响研究已较多,一些学者研究发现,醋酸(CH3COOH)、甲醇(CH3OH)、甲胺(CH3NH2)和三甲胺(C3H9N)等底物均能促进甲烷产生(Lyimo et al., 2002;Kaku et al., 2005;仝川等,2011);硝酸根(NO3-)、亚硝酸根(NO2-)、硫酸根(SO2-4)、三价铁离子(Fe3+)和四价锰离子(Mn4+)等电子受体主要表现为抑制甲烷的产生(Chidthaisong et al., 2000; Raghoebarsing et al., 2006; 曾从盛等,2008; Beal et al., 2009; Lipson et al., 2013); 铵根(NH4+)的输入主要抑制CH4产生潜力,但原位观测表明其会促进CH4排放通量(姜欢欢等,2012;葛瑞娟等,2010;牟晓杰等,2012; Andrews et al., 2013).CH4氧化是影响CH4排放的一个重要环节,但关于CH4氧化对外源物质输入的响应机制目前尚不清楚.系统性的研究CH4产生与氧化对外源物质输入的响应具有重要意义.
河口湿地处于海洋和陆地相互作用地带,承接着来自陆地人类活动带来的外源物质,是响应全球变化和人类活动较为敏感的生态系统之一(孙志高等,2009).除地质作用和生物作用之外,外源物质还通过水文作用(河流、海水和地下水)和大气物质沉降(氮沉降和酸沉降)沉积到河口湿地(Sutula et al., 2001).近些年,随着流域内工农业的发展、城市化的推进及近岸水域水产养殖的增加,大量外源物质沉积到河口湿地.在此背景下,外源物质的输入对河口CH4产生和氧化有何影响?CH4产生和氧化的综合效应如何?这些都值得探讨.闽江河口湿地是中国东南沿海典型的开放式潮汐河口湿地.闽江流经38个县市,其流域占福建全省一半以上的陆域.2013年中国海洋环境状况公报(国家海洋局,2013)统计公布数据表明,闽江携带入海的污染物质(COD 117×104 t,氨氮 10337 t,硝酸盐 26685 t,亚硝酸盐 1288 t,总磷 6423 t,石油类 571 t)仅次于长江和珠江,这给闽江河口湿地的生态环境带来了巨大压力.因此,本研究选取闽江河口鳝鱼滩芦苇(Phragmites australis)湿地,通过多种外源物质(包括底物、电子受体和营养物质)的添加实验,探讨其对河口湿地沉积物CH4产生和氧化潜力的影响,以期为河口湿地的环境保护及温室气体减排提供基础参考依据.
2 材料与方法(Materials and methods) 2.1 研究区概况鳝鱼滩湿地(119°34′12″~119°40′40″E,26°00′36″~26°03′42″N)位于闽江入海口,地处南亚热带与中亚热带的过渡地带,是闽江河口面积最大(约3120 hm2)的天然潮滩湿地.区内气候暖热湿润,降水丰沛,年均降水日数为153 d,年均降水量为1346 mm(仝川等,2012).芦苇是闽江河口湿地优势大型挺水植物之一,芦苇植株在夏季达到最高(1.6~1.8 m),地上生物量也达到峰值((1524.8±78.9)g · m-2)(曾从盛等,2012).本研究样地中的芦苇湿地属于河口半咸水沼泽湿地(Brackish-water marshes)(仝川等,2012).
2.2 样品采集及测定方法 2.2.1 样品采集2011年8月,在芦苇长势良好的样地选取160 cm×160 cm的样方,其中设置5个小样方,分别为4个角和中心点,每个样点间距5 cm,设3个重复.用直径5 cm的土壤采样器采集0~15 cm的沉积物样品,样品采集后装入自封袋带回实验室.所有样品自然风干后研磨,过20目筛备用.
2.2.2 沉积物性质测定pH值和电导率分别使用酸度计(奥利龙818型)和电导仪(DDS-307型)测定,水土比为5 ∶ 1.沉积物样品用去离子水浸提后,用TOC-VCPH仪器测定DOC.在SKALAR连续流动分析仪测定沉积物中的NH4+、NO3-、NO2-、SO2-4和PO3-4.采用离子色谱仪(美国戴安DIONEX ICS3000)测定CH3COOH浓度.研究区沉积物的理化性质如表 1所示.
| 表1 闽江口滩芦苇湿地沼泽沉积物理化性质 Table 1 Soil properties of Phragmites australis marsh in the Min River estuary |
实验使用的外源物质添加物为A.R级化合物,包括FeCl3、FeCl2、MnCl2、NH4Cl、Na2SO4、NaNO3、NaNO2、Na3PO4、CH3COOH、CH3OH和C3H9N.实验剂量参照闽江口滩芦苇湿地沼泽沉积物理化性质(表 1)中部分待添加物(CH3COOH、NO3-、NO2-、SO2-4 NH4+和PO3-4)指标,最大添加量约为各项指标平均值的5倍,梯度为5、50和500 mg · kg-1(以干土质量计算)的剂量处理供试土样.每个处理做3个重复.
2.3.2 CH4产生潜力的培养实验CH4产生潜力的培养实验采用厌氧培养法(高君颖,2012),具体操作如下:①称取10 g风干土壤样品,装入150 mL的培养瓶中,加入蒸馏水,调节培养瓶中土壤的含水量,得到含水量为150%的土壤,加入1 mL不同浓度的化合物溶液,然后在旋涡混合器上混合15 min;②用氮气(N2)以300 mL · min-1的流速冲洗(N2用末端连接玻璃管的胶管导入培养瓶)培养瓶,持续5 min,以形成厌氧环境;③将处理好的土壤样品放入恒温培养箱中,在30 ℃条件下连续培养10 d,用微型注射器抽取2 mL气体,用以测量培养瓶内CH4气体浓度;④每次抽取CH4气体后,用N2冲洗(方法同上),以形成厌氧环境.
2.3.3 CH4氧化潜力的培养实验CH4氧化潜力的培养实验采用好氧培养法(高君颖,2012),具体操作如下:①处理同2.3.2节步骤①,但培养瓶中土壤的含水量设定为30%;②用异丁基橡胶塞密封,再用微型注射器注入0.5 mL纯CH4;③除了将恒温培养箱的温度设为25 ℃外,其他处理如2.3.2节步骤③;④每次抽取CH4气体后,向培养瓶中注入2 mL高纯合成空气,以保持培养瓶内外压力平衡.
以上实验每批样品均设置不添加物质对照,每个培养样品做3个重复.
2.4 CH4测定气体样品采用气相色谱仪(日本岛津GC-2010)分析.CH4检测器为氢焰离子化检测器(FID),载气为N2(流速30 mL · min-1),H2为燃气(流速30 mL · min-1),空气为助燃气(流速400 mL · min-1),检测器温度为120 ℃,分离柱温度为60 ℃.
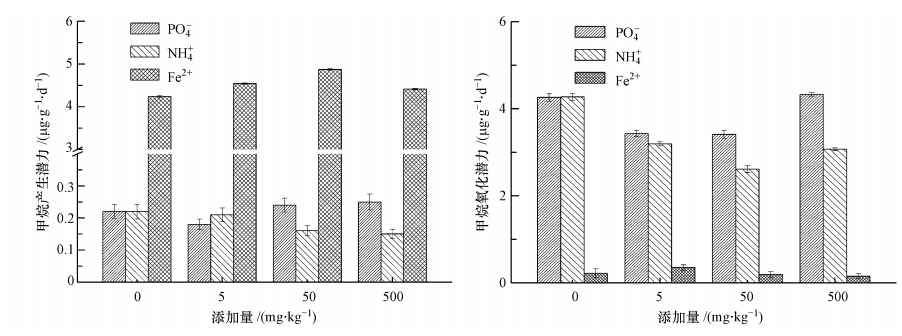
2.5 数据处理与计算利用SPSS 17.0的单因素方差分析(One-way ANOVA)比较不同处理CH4产生与氧化潜力的差异;采用Origin 8.0进行绘图.CH4产生潜力和氧化潜力计算公式如下(Wassmann et al., 1998):
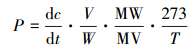
不同底物对CH4产生与氧化的影响如图 1所示.沉积物CH4产生潜力随CH3OH和C3H9N添加量的增加呈指数上升趋势,在添加量不高于50 mg · kg-1时对CH4产生潜力的影响差异不显著(p>0.05),而添加量达到500 mg · kg-1时,促进作用达到极显著水平(p<0.01),表现为:C3H9N(35.79 μg · g-1 · d-1)>CH3OH(10.70 μg · g-1 · d-1).不同添加量(5~500 mg · kg-1)CH3COOH对CH4产生潜力影响不显著(p>0.05).
3种底物在不同含量条件下对沉积物CH4氧化潜力均有显著抑制作用(p<0.05).CH4氧化潜力随添加量增加呈“U”字型变化趋势,其中,CH3OH和CH3COOH在50 mg · kg-1时抑制CH4氧化潜力的作用最明显,其氧化潜力分别为2.17和2.70 μg · g-1 · d-1,比对照减少50%和37%;C3H9N在5 mg · kg-1时抑制作用最强,CH4氧化潜力为2.68 μg · g-1 · d-1,比对照减少41%.
 |
| 图 1 添加不同底物的沉积物CH4产生与氧化潜力 Fig. 1 Methane production and oxidation potential with addition of various substrates of marsh soil |
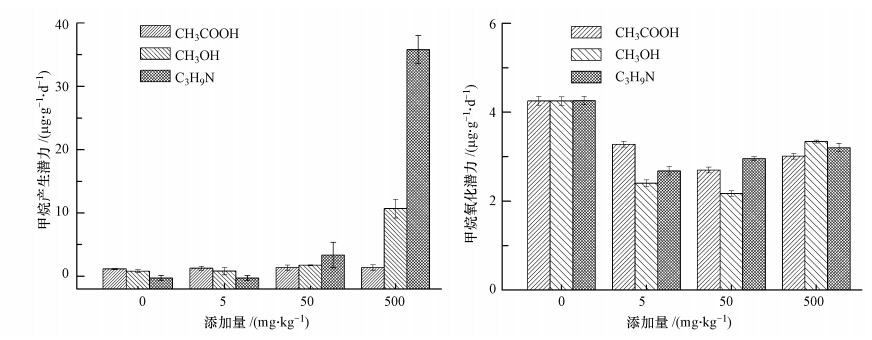
由图 2可知,NO3-和NO2-均表现为抑制CH4产生潜力,抑制作用随添加量的增大而增强.当添加量达到500 mg · kg-1时,CH4产生潜力分别为0.10和0.04 μg · g-1 · d-1,比对照分别减少87%和89%.Fe3+在50 mg · kg-1时抑制CH4产生潜力的作用最显著,比对照减少40%;其他添加量之间没有显著差异(p>0.05).添加量为0~500 mg · kg-1的SO2-4和Mn4+对CH4产生潜力的影响没有显著差异(p>0.05).
 |
| 图 2 添加各种电子受体的沉积物CH4产生与氧化潜力 Fig. 2 Methane production and oxidation potential with addition of various electron acceptors of marsh soil |
5种电子受体各剂量处理土样的CH4氧化潜力均与对照组之间差异显著(p<0.05)(图 2).NO3-和NO2-的添加均抑制CH4氧化潜力,分别在5 mg · kg-1和50 mg · kg-1时抑制作用最强,CH4氧化潜力分别为2.57 μg · g-1 · d-1(比对照组减少40%)和1.70 μg · g-1 · d-1(比对照组减少60%);随添加量的增加,其抑制作用减弱.SO2-4随添加量增加,CH4氧化潜力减小,当SO2-4添加量达到500 mg · kg-1时,CH4氧化潜力比对照组减少38%.Fe3+和Mn4+的添加均促进CH4氧化潜力,其中,Fe3+随添加量增大,促进CH4氧化潜力的作用越强,最大促进作用较对照组增加31%;Mn4+的添加也会促进CH4氧化潜力,但各添加量(5~500 mg · kg-1)实验组的CH4氧化潜力之间没有显著性差异(p>0.05).
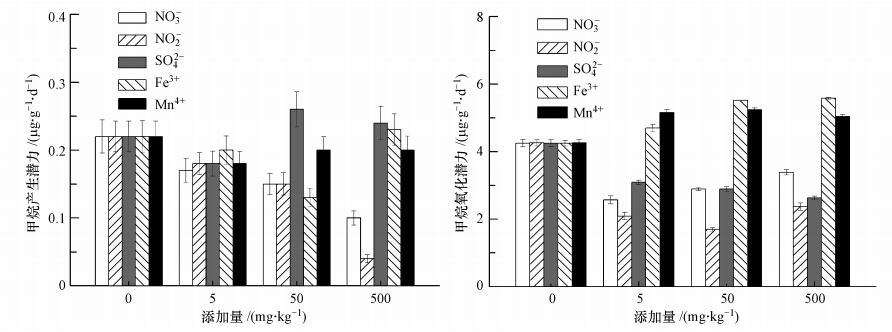
3.3 PO3-4、NH4+和Fe2+对沉积物CH4产生与氧化潜力的影响整个培养期内,PO3-4和低含量NH4+(≤5 mg · kg-1)组的CH4产生潜力与对照组差异不显著(p>0.05)(图 3).较高含量NH4+(50~500 mg · kg-1)对CH4产生潜力具有显著的抑制作用.Fe2+在添加量范围内对CH4产生潜力起促进作用,但变化较小,其CH4产生潜力平均为4.61 μg · g-1 · d-1,平均比对照组增加8%.
 |
| 图 3 添加营养物质的沉积物CH4产生与氧化潜力 Fig. 3 Methane production and oxidation potential with addition of various nutrient elements of marsh soil |
整个培养期内,PO3-4和NH4+不同含量水平处理下CH4氧化潜力与对照差异显著(p<0.05),而不同含量Fe2+水平下CH4氧化潜力没有显著差异(p>0.05).低含量PO3-4(≤50 mg · kg-1)对CH4氧化潜力起抑制作用,最多可抑制20%的CH4氧化潜力;当PO3-4含量达到500 mg · kg-1时,CH4氧化潜力与对照组差异不显著(p>0.05).NH4+的添加会抑制CH4氧化潜力,随NH4+添加量的增加,CH4氧化潜力呈“U”字型变化趋势,在50 mg · kg-1时抑制作用最明显,比对照组减少39%.
3.4 CH4产生与氧化潜力对外源物质添加的响应对比闽江口半咸水芦苇沼泽湿地沉积物CH4产生和氧化潜力对外源物质添加的响应如表 2所示.CH4产生和氧化潜力二者的综合作用对CH4排放通量的可能影响有2种:①产生或氧化潜力作用不显著,但促进CH4产生潜力或抑制CH4氧化潜力显著(如CH3COOH、SO2-4、NH4+、Fe2+和PO3-4)、促进CH4产生潜力并抑制其氧化潜力(如CH3OH和C3H9N)、抑制CH4氧化潜力的作用大于抑制其产生潜力(如NO3-和NO2-),将会增加CH4排放通量;②抑制CH4产生潜力或促进CH4氧化潜力显著(如Fe3+和Mn4+),将会减少CH4排放通量.
| 表2 不同添加物对湿地沉积物CH4产生和氧化潜力的影响 Table 2 Influence of additives on CH4 production and oxidation potential on the marsh soil |
本研究表明,CH4产生潜力对CH3COOH(0~500 mg · kg-1)、CH3OH(0~50 mg · kg-1)和C3H9N(0~50 mg · kg-1)添加的响应不显著(图 1),这一现象可能与闽江口芦苇湿地沉积物中的产甲烷菌有关.佘晨兴等(2012)的研究发现,闽江口芦苇湿地表层(0~30 cm)沉积物中产甲烷菌的优势类群为Methanolinea和Methanoregula,其营养类型为H2/CO2(Sakai et al., 2012).因此,闽江河口芦苇沼泽湿地CH4生成途径主要为H2/CO2途径,而非乙酸途径和甲基途径.本研究还表明,较高剂量(500 mg · kg-1)的CH3OH和C3H9N对CH4产生潜力具有显著的促进作用,这与Lyimo等(2002)和Kaku等(2005)对河口湿地沉积物的研究结果相似.CH3OH和C3H9N属于非竞争性甲烷产生基质(non-competitive substrates),可以被产甲烷菌利用进而生成CH4(仝川等,2011).
本研究表明,CH3OH、C3H9N和CH3COOH这3种底物在实验剂量内(0~500 mg · kg-1)对CH4氧化潜力均表现为抑制作用(图 1).其中,CH3OH对CH4氧化的抑制作用在黄河口潮滩湿地也有类似现象(孙万龙等,2014).一方面,CH3OH是CH4氧化代谢途径的中间产物,对甲烷单加氧酶产生反馈抑制,即CH3OH在CH4氧化菌的代谢过程中抑制其新陈代谢;另一方面,尽管培养条件为好氧环境,但供试土壤质地较为粘重时,内部仍然存在厌氧微环境,造成CH4氧化的同时也有部分CH4产生,进而促使培养瓶内CH4的浓度上升,表现为抑制氧化(孙万龙等,2014).事实上,是否还存在另一种CH3OH、C3H9N和CH3COOH对甲烷氧化菌的抑制机制?好氧甲烷氧化菌属于甲基营养细菌的一个分支,可分为TypeⅠ型和TypeⅡ型,较多研究表明,TypeⅡ型甲烷氧化菌是酸性泥炭地中的优势类群(Hanson et al., 1996;佘晨兴等,2011;贠娟莉等,2013).闽江河口湿地土壤为酸性(pH=5.59),这暗示着其甲烷氧化菌优势类群可能为TypeⅡ型.甲基营养细菌能利用CH3OH和C3H9N这类甲基物质进行生长,而且Jeongdae等(2011)发现,TypeⅡ型甲烷氧化菌能利用CH3COOH进行生长.依据这一理论,CH3OH、C3H9N和CH3COOH这3种底物应该能促进甲烷氧化菌的生长,但本研究并没有得出类似结论,这个问题还有待进一步探索.
4.2 电子受体对沉积物CH4产生与氧化潜力的影响闽江河口湿地受到河流与海洋周期性水文波动的影响,电子受体(包括NO3-、NO2-、SO2-4、Fe3+、Mn4+和腐殖酸等(Lovley et al., 1996)较丰富.本研究表明,5种电子受体均能抑制CH4产生潜力,即电子受体的还原能力强于CH4产生菌的竞争力.电子受体的还原过程抑制CH4产生菌的活性(Raghoebarsing et al., 2006; Beal et al., 2009).NO3-和NO2-抑制CH4产生潜力的同时也抑制其氧化潜力,且对氧化的抑制作用较强(图 2).Chidthaisong等(2000)认为NO3-除了通过产生NO2-、NO和N2O毒害CH4产生菌,还会通过减少CH3COOH和葡萄糖的产生来抑制CH4产生.研究发现,SO2-4的添加对CH4产生潜力没有显著影响,但会抑制CH4氧化潜力.曾从盛等(2008)研究表明,SO2-4的添加是减缓而非阻止CH4产生,抑制的程度取决于SO2-4浓度.柳铮铮(2009)通过原位模拟酸沉降对闽江河口短叶茳芏湿地CH4排放的影响发现,增加SO2-4对CH4排放的影响不显著;其室内培养实验表明,闽江口鳝鱼滩湿地沉积物中的SO2-4浓度已经超过饱和浓度,再增加SO2-4并不会增加其还原的速率,与本研究结果一致.本研究中的半咸水芦苇沼泽湿地沉积物的SO2-4浓度(456.56 mg · kg-1,表 1)介于Segarra等(2013)研究河口盐-淡水湿地沉积物中咸水湿地(709.1 mg · kg-1)和淡水湿地(38.5 mg · kg-1)沉积物SO2-4浓度之间,但本研究的CH4氧化潜力(4.25 μg · g-1 · d-1)比咸水湿地(6.5 μg · g-1 · d-1)和淡水湿地(17.2 μg · g-1 · d-1)的CH4氧化潜力要低.CH4氧化对SO2-4响应的差异可能还与沉积物中的NO3-、Fe3+和Mn4+等耦合作用有关(Segarra et al., 2013).本研究表明,Fe3+的添加会抑制CH4产生并促进CH4氧化,其结果可能会减少CH4排放通量(表 2),这与Lipson等(2013)对高纬度的沼泽湿地的研究结果相似.王维奇等(2013)通过对水稻田施加铁炉渣的实验表明,铁炉渣的施加可降低CH4产生和排放通量,提高CH4氧化量,其作用机制主要包括:Fe3+将底物的浓度降低到产甲烷菌不能利用的程度,Fe3+将氧化还原电位提高到了超过产甲烷菌的适应范围,Fe3+对产甲烷菌的毒害作用,以及Fe3+的还原菌组群与产甲烷菌竞争CH3COOH和电子供体.此外,Fe3+较高的环境易于形成较高的胡敏酸(Lipson et al., 2013)和较低Eh环境( Le Mer et al., 2001),进而影响微生物和土壤酶的活性.本研究还发现,Mn4+的添加与Fe3+相似,均促进CH4氧化潜力,但Mn4+的添加对CH4产生潜力没有显著影响(表 2).当Mn4+的添加量达到5 mg · kg-1时,已经显著促进CH4氧化潜力;但随着添加量的增加,CH4氧化潜力并没有显著性差异.Beal等(2009)的研究认为,CH4氧化过程利用Mn4+和Fe3+作为电子受体,即CH4氧化分别耦联Mn4+和Fe3+的还原.此外,可能Mn4+刺激了甲烷氧化菌的活性,但甲烷氧化菌其本身对Mn4+并没有偏好性.
4.3 营养物质对沉积物CH4产生与氧化潜力的影响河口湿地是一个高效的营养物汇集场所(Odum et al., 2009),NH4+、PO3-4和Fe2+对CH4产生和氧化的影响相对于底物与电子受体更为复杂,它们对CH4产生和氧化二者综合结果会促进CH4排放通量(表 2).NH4+输入对闽江口湿地沉积物的CH4产生潜力表现为抑制作用,这与姜欢欢等(2012)对黄河口潮滩湿地沉积物CH4产生潜力的研究结果不同.受外源营养物质过量输入的影响,本研究沉积物中固有的NH4+含量(182.28 mg · kg-1)较高,会抑制产甲烷菌活性.而黄河口碱蓬(Suaeda salsa)盐沼和光滩的沉积物中固有的NH4+(碱蓬盐沼:4.74 mg · kg-1,光滩:3.12 mg · kg-1)不能完全满足产甲烷菌的需要,NH4+的输入为产甲烷菌提供了生长所必需的氮源,故促进了CH4产生潜力.葛瑞娟等(2010)通过对三江平原小叶章(Deyeuxia angustifolia)的盆栽施N试验和牟晓杰等(2012)通过对闽江口湿地短叶茳芏原位施N试验发现,适量的NH4+在短时间内可促进土壤CH4排放.本研究表明,NH4+输入对闽江河口湿地CH4排放通量的影响主要通过抑制CH4氧化的途径,最终达到促进CH4排放.酸性土壤的甲烷氧化效率远低于pH为6.5~8.5的土壤环境(Syväsalo et al., 2006; Weslien et al., 2009),NH4+的输入会抑制TypeⅡ型甲烷氧化菌(Yang et al., 2011),因此,NH4+输入会抑制以TypeⅡ型甲烷氧化菌为主的闽江口的CH4氧化潜力.此外,NH4+抑制CH4氧化的机制还包括:通过增加硝化细菌的数量而抑制甲烷氧化菌的生长及活性;NH4+氧化过程中代谢产物(NO2-)对CH4营养菌产生毒害作用;盐效应引起甲烷氧化菌生理缺水;土壤NH4+-N周转作用(丁维新等,2001; 牟晓杰等,2012).此外,闽江口湿地沉积物的CH4产生潜力对PO3-4输入的响应不显著,可能是因为产甲烷菌对PO3-4(5~50 mg · kg-1)不敏感.低含量的PO3-4对CH4氧化潜力起抑制作用,可能源于其盐效应抑制甲烷氧化菌的机制.Fe2+的输入对CH4产生潜力起微弱的促进作用,促进作用随添加量的变化不大,而对CH4氧化潜力没有显著影响.可能是因为Fe2+的添加能刺激产甲烷菌的活性,促进CH4产生,但产甲烷菌及甲烷氧化菌对Fe2+并没有偏好性.此外,在野外环境中,NH4+、PO3-4和Fe2+的输入将会促进植物的生长,对植物生物量、根系物质的泌氧和增加底物等,以及对CH4的产生、氧化、传输和排放起重要影响.
为了探究某一种外源物质对CH4产生和氧化的影响,本研究只做了单一物质添加的实验,并没有进行多种物质交互添加的实验.事实上,野外中各种外源物质都同时存在,共同影响着河口湿地CH4的产生和氧化.如Segarra等(2013)的研究表明,SO2-4能耦合NO3-、Fe3+和Mn4+进行硫酸盐还原,其耦合还原能力大于其他电子受体和可选择底物之间的耦合还原作用.在今后的研究中应重点开展多种物质交互添加对河口湿地CH4产生和氧化潜力的影响.
5 结论(Conclusions)闽江口半咸水芦苇沼泽湿地沉积物CH4产生和氧化潜力对多种外源物质添加的响应实验结果表明:大部分外源物质(除Fe3+、Mn4+和Fe2+外)的输入均会抑制河口湿地沉积物的CH4氧化.CH3OH、C3H9N和Fe2+的添加对CH4产生起促进作用,NO3-、NO2-、Fe3+和NH4+的添加作用与之相反,CH3COOH、SO2-4、Mn4+和PO3-4对CH4产生的影响不显著.CH4产生和氧化对CH3COOH、CH3OH、C3H9N、NO3-、NO2-、SO2-4、NH4+、PO3-4和Fe2+输入的综合响应结果是增加CH4排放通量,Fe3+和Mn4+输入的综合作用会减少CH4排放通量.
致谢(Acknowledgement): 本研究在野外采样过程中得到了福建师范大学亚热带湿地研究中心杨平、贾宜、林德华和赵娜等的帮助,在室内气样分析过程得到湿润亚热带生态-地理过程教育部重点实验室杨柳明的帮助,在文章写作过程中得到了福建师范大学地理研究所仝川教授的帮助,在此一并表示感谢.
| [1] | Andrews S,Schultz R,Frey S,et al.2013.Plant community structure mediates potential methane production and potential iron reduction in wetland mesocosms [J].Ecosphere,4(4),doi: 10.1890/ES12-00314.1 |
| [2] | Beal E J,House C H,Orphan V J.2009.Manganese-and iron-dependent marine methane oxidation [J].Science,325(5937): 184-187 |
| [3] | Bridgham S D,Megonigal J P,Keller J K,et al.2006.The carbon balance of North American wetlands [J].Wetlands,26(4): 889-916 |
| [4] | Bridgham S D,Cadillo-Quiroz H,Keller J K,et al.2013.Methane emissions from wetlands: biogeochemical,microbial,and modeling perspectives from local to global scales [J].Global Change Biology,19(5): 1325-1346 |
| [5] | Chidthaisong A,Conrad R.2000.Turnover of glucose and acetate coupled to reduction of nitrate,ferric iron and sulfate and to methanogenesis in anoxic rice field soil [J].FEMS Microbiology Ecology,31(1): 73-86 |
| [6] | 丁维新,蔡祖聪.2001.氮肥对土壤氧化大气甲烷影响的机制[J].农村生态环境,17(3): 30-34 |
| [7] | Eriksson T,Öquist M G,Nilsson M B.2010.Production and oxidation of methane in a boreal mire after a decade of increased temperature and nitrogen and sulfur deposition [J].Global Change Biology,16(7): 2130-2144 |
| [8] | 高君颖.2012.闽江河口芦苇湿地土壤甲烷产生与氧化潜力研究.福州: 福建师范大学.13-14 |
| [9] | 葛瑞娟,宋长春,杨桂生,等.2010.氮输入对三江湿地小叶章不同生长阶段土壤产生CH4能力的影响[J].环境科学学报,30(10): 2070-2077 |
| [10] | 国家海洋局.2013.2013年中国海洋环境状况公报.http://www.soa.gov.cn/zwgk/hygb/zghyhjzlgb/201403/ t20140324_31065.html |
| [11] | Hanson R S,Hanson T E.1996.Methanotrophic bacteria[J].Microbiological Reviews,60(2): 439-471 |
| [12] | Im J,Lee S W,Yoon S,et al.2011.Characterization of a novel facultative Methylocystis species capable of growth on methane,acetate and ethanol [J].Environmental Microbiology Reports,3(2): 174-181 |
| [13] | IPCC.2013.Climate Change 2013: The Physical Science Basis.Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change.TS17.Cambridge,United Kingdom+New York,NY,USA: Cambridge University Press |
| [14] | 姜欢欢,孙志高,王玲玲,等.2012.黄河口潮滩湿地土壤甲烷产生潜力及其对有机物和氮输入响应的初步研究[J].湿地科学,10(4): 451-458 |
| [15] | Kaku N,Ueki A,Ueki K,et al.2005.Methanogenesis as an important terminal electron accepting process in estuarine sediment at the mouth of Orikasa River [J].Microbes and Environments,20(1): 41-52 |
| [16] | Le Mer J,Roger P.2001.Production,oxidation,emission and consumption of methane by soils: A review[J].European Journal of Soil Biology,37(1): 25-50 |
| [17] | Lipson D,Miller K,Lai C.2013.Methane Suppression: The Impacts of Fe (III) and Humic Acids on Net Methane Flux from Arctic Tundra Wetlands in Alaska and Finland.B32C-02.San Diego,CA,USA: American Geophysical Union |
| [18] | 柳铮铮.2009.酸沉降对闽江河口湿地CH4产生排放和碳输出的影响.福州:福建师范大学.31-36 |
| [19] | Lovley D R,Coates J D,Blunt-Harris E L,et al.1996.Humic substances as electron acceptors for microbial respiration [J].Nature,382(6590): 445-448 |
| [20] | Lyimo T J,Pol A,Op Den Camp H J M.2002.Sulfate reduction and methanogenesis in sediments of Mtoni mangrove forest,Tanzania[J].AMBIO: A Journal of the Human Environment,31(7): 614-616 |
| [21] | 牟晓杰,刘兴土,仝川,等.2012.闽江河口短叶茳芏湿地CH4和N2O排放对氮输入的短期响应[J].环境科学,33(7): 2482-2489 |
| [22] | Odum E P, Barrett G W.2009.生态学基础(第5版)[M].陆健健,王伟,王天慧,等译.北京: 高等教育出版社.377 |
| [23] | Raghoebarsing A A,Pol A,Van De Pas-Schoonen K T,et al.2006.A microbial consortium couples anaerobic methane oxidation to denitrification [J].Nature,440(7086): 918-921 |
| [24] | Sakai S,Ehara M,Tseng I C,et al.2012.Methanolinea mesophila sp.nov.,a hydrogenotrophic methanogen isolated from rice field soil,and proposal of the archaeal family Methanoregulaceae fam.nov.within the order Methanomicrobiales [J].International Journal of Systematic and Evolutionary Microbiology,62(Pt 6): 1389-1395 |
| [25] | Segarra K E,Comerford C,Slaughter J,et al.2013.Impact of electron acceptor availability on the anaerobic oxidation of methane in coastal freshwater and brackish wetland sediments [J].Geochimica et Cosmochimica Acta,115: 15-30 |
| [26] | 孙万龙,孙志高,孙文广,等.2014.黄河口潮滩湿地土壤CH4氧化潜力及其对有机物输入的响应[J].草业学报,23(1): 104-112 |
| [27] | 孙志高,牟晓杰,王玲玲.2009.滨海湿地生态系统 N2O 排放研究进展[J].海洋环境科学,29(1): 159-164 |
| [28] | 佘晨兴,仝川.2011.自然湿地土壤产甲烷菌和甲烷氧化菌多样性的分子检测[J].生态学报,31(14): 4126-4135 |
| [29] | 佘晨兴,仝川.2012.闽江口芦苇沼泽湿地土壤产甲烷菌群落结构的垂直分布[J].生态学报,32(17): 5299-5308Sutula M,Day J,Cable J,et al.2001.Hydrological and nutrient budgets of freshwater and estuarine wetlands of Taylor Slough in Southern Everglades,Florida (U.S.A) [J].Biogeochemistry,56(3): 287-310 |
| [30] | Syväsalo E,Regina K,Turtola E,et al.2006.Fluxes of nitrous oxide and methane,and nitrogen leaching from organically and conventionally cultivated sandy soil in western Finland [J].Agriculture,Ecosystems & Environment,113(1/4): 342-348 |
| [31] | 仝川,陈重安,黄佳芳.2011.河口沼泽土壤醋酸发酵途径产生的甲烷及基质添加对甲烷产生的刺激作用[J].湿地科学,9(4): 305-313 |
| [32] | 仝川,黄佳芳,王维奇,等.2012.闽江口半咸水芦苇潮汐沼泽湿地甲烷动态[J].地理学报,67(9): 1165-1180 |
| [33] | 王维奇,李鹏飞,曾从盛,等.2013.铁炉渣施加对稻田甲烷产生、氧化与排放的影响[J].生态学报,33(5): 1578-1583 |
| [34] | Wassmann R,Neue H U,Bueno C,et al.1998.Methane production capacities of different rice soils derived from inherent and exogenous substrates [J].Plant and Soil,203(2): 227-237 |
| [35] | Weslien P,Kasimir Klemedtsson,Börjesson G,et al.2009.Strong pH influence on N2O and CH4 fluxes from forested organic soils [J].European Journal of Soil Science,60(3): 311-320 |
| [36] | Yang N,Lü F,He P J,et al.2011.Response of methanotrophs and methane oxidation on ammonium application in landfill soils[J].Applied Microbiology and Biotechnology,92(5): 1073-1082 |
| [37] | 贠娟莉,王艳芬,张洪勋.2013.好氧甲烷氧化菌生态学研究进展[J].生态学报,33(21): 6774-6785曾从盛,王维奇,仝川.2008.不同电子受体及盐分输入对河口湿地土壤甲烷产生潜力的影响[J].地理研究,27(6): 1321-1330 |
| [38] | 曾从盛,张林海,王天鹅,等.2012.闽江河口湿地植物枯落物立枯和倒伏分解主要元素动态[J].生态学报,32(20): 6289-6299 |
| [39] | 曾从盛,王维奇,仝川.2008. 不同电子受体及盐分输入对河口湿地土壤甲烷产生潜力的影响[J]. 地理研究, 27(6): 1321-1330 |
 2015, Vol. 35
2015, Vol. 35


