2. 湖南大学环境生物与控制教育部重点实验室, 长沙 410082
2. Key Laboratory of Environmental Biology and Pollution Control, Ministry of Education, Hunan University, Changsha 410082
近年来,水体中磷过剩导致富营养化问题日益严重,去除水体中过量的磷引起了极大关注.强化生物除磷(Enhanced biological phosphorus removal,EBPR)是一种有效的除磷途径(Chen et al., 2004).聚磷菌(Polyphosphate accumulating organisms,PAOs)在厌氧段吸收挥发性脂肪酸(Volatile fatty acids,VFAs)合成聚羟基烷基脂酸(Polyhydroxyalkanoates,PHAs),同时降解细胞体内聚磷酸盐和糖原来提供能量和还原物质,并在随后的好氧段水解PHAs供能过量吸磷,最后通过排出富磷剩余污泥实现磷的去除(Oehmen et al., 2007; Wang et al., 2012a).
Wang等(2008)提出了好氧/延长闲置(Oxic/Extended-idle,O/EI)序批式反应器.O/EI反应器省略了传统除磷理论认为必需的厌氧段,进水后直接进行曝气,随后设置延长闲置段,系统仍能维持良好的除磷效果(除磷率90%以上).PAOs在好氧条件下吸收VFAs,利用糖原分解和三羧酸循环(Tricarboxylic acid cycle,TCA)为合成PHAs提供三磷酸腺苷(Adenosine triphosphate,ATP)和还原力NADH,通过分解好氧前期合成的PHAs为聚磷酸盐(Polyphosphate,poly-P)的合成提供能量,实现好氧吸磷.研究表明(王冬波,2011),诱导O/EI系统中微生物发生过量摄磷的根本原因在于反应过程中内外基质贫乏的闲置期的设置,Wang等(2012b)研究了O/EI系统闲置期分别设置为1.5、3.5、5.5、7.5和9.5 h时系统的除磷性能,其研究表明对于生活污水而言,闲置期设置为3.5 h较适宜.以往研究考察了不同碳源种类及浓度(王冬波等,2009)、pH(丁艳等,2010)等控制条件对O/EI系统除磷效果的影响,探究了O/EI系统除磷机理(王冬波,2011)以及处理实际污水的应用效果(陈洪波等,2012).然而,其他控制条件如污泥停留时间(Sludge retention time,SRT)、溶解氧(Dissolved oxygen,DO)浓度等对O/EI系统除磷性能的影响尚不清楚,为该工艺的推广与应用,进一步深入研究十分必要.
DO浓度可影响PAOs摄磷速率及PAOs与聚糖菌(Glycogen accumulating organisms,GAOs)间的微生物竞争,是生物除磷的重要影响因素之一(Oehmen et al., 2007).研究表明,当DO浓度为4.5~5.0 mg · L-1时,系统中GAOs数量较多,除磷效果较差;而当DO浓度为2.5~3.0 mg · L-1时,系统富集较多PAOs,磷的去除率较高(Griffiths et al., 2002).彭赵旭等(2011)研究了好氧阶段不同DO(5.5~7.0 mg · L-1和0.5~1.5 mg · L-1)对长期运行EBPR除磷的变化,结果表明高DO下不利于系统除磷效果.此外,有研究报道,为保证较高的生物除磷性能,好氧段DO浓度应维持在2 mg · L-1以上(方茜等,2004).
传统厌氧/好氧(Anaerobic/Oxic,A/O)模式中,释磷发生在厌氧段,而摄磷在好氧段进行,而O/EI系统磷的释放和摄入均发生在好氧段.因此,DO对O/EI反应器中PAOs释磷和摄磷的影响较传统A/O模式是否一致尚不明确.此外,以往研究表明O/EI系统中微生物代谢途径与传统模式有所不同(Wang et al., 2012a).因此,DO对O/EI系统除磷性能的影响与传统模式也将有较大区别.
本文旨在考察不同DO浓度对O/EI系统除磷性能的影响,并通过分析磷元素的变化及微生物体内储能物质的积累/转化情况,探究DO浓度影响O/EI系统除磷性能的机理,以期为工艺控制条件的优化和日后的工程设计提供理论参考.
2 材料与方法(Materials and methods) 2.1 污泥驯化活性污泥取自长沙市第一污水处理厂回流池,污泥驯化在一个有效容积为8 L的有机玻璃反应器中进行.每天运行3个周期,每周期运行8 h,具体运行方式为:瞬时进水→曝气(4 h)→沉淀和出水(0.5 h)→闲置(3.5 h).每周期开始时加入5 L人工合成废水(成分见2.3节),出水时排出5 L上清液,污泥驯化期间不排泥.
2.2 实验装置及运行方法研究在4个有效容积为1.8 L的有机玻璃反应器(分别标记为R1、R2、R3和R4)中进行.各反应器分别接种驯化污泥800 mL,各反应器中初始污泥浓度约为4000 mg · L-1.运行方法与驯化时相同,在每周期开始时加入1 L合成废水,出水时排出1 L上清液,水力停留时间约为14 h.每天在好氧末排出泥水混合物120 mL,维持SRT在15 d左右.好氧段采用鼓风曝气,并通过磁力搅拌确保泥水混合均匀.各反应器中DO浓度通过自动控制系统分别维持约1、2、3和4 mg · L-1.温度为20±1 ℃.
2.3 合成废水进水采用人工合成废水,乙酸钠(15 mmol · L-1,以C计,理论COD为480 mg · L-1)为单一碳源,磷酸盐采用磷酸二氢钾(15 mg · L-1,以PO3-4-P计),氨氮采用氯化铵(30 mg · L-1;以NH+4-N计),硫酸镁和氯化钙浓度均为5 mg · L-1,微量元素(1.0 mL · L-1)主要成分及浓度见参考文献(Wang et al., 2008).各反应器进水成分及浓度一致.
2.4 分析方法糖原测定采用苯酚-硫酸法(Wang et al., 2008);PHAs采用气相色谱法(Takabatake et al., 2002;Wang et al., 2008),色谱分析仪型号为安捷伦6890N.DO采用便携式溶解氧仪测定,pH采用玻璃电极法,溶解性磷酸盐(SOP)采用钼锑抗分光光度法,混合液悬浮固体浓度(MLSS)与混合液挥发性悬浮固体浓度(MLVSS)采用重量法,化学需氧量(COD)采用重铬酸钾法,具体方法参照文献(魏复盛,2002).
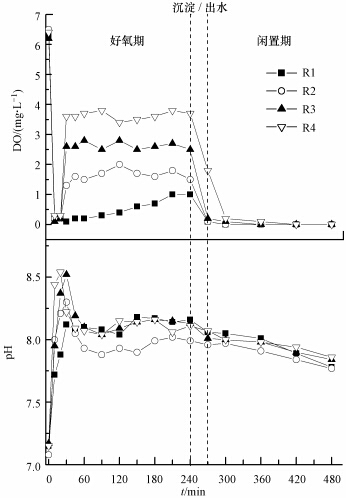
3 结果与讨论(Results and discussion) 3.1 典型周期内DO及pH变化各反应器典型周期内DO变化情况如图 1所示.由图 1可见,各反应器在好氧前30 min内DO均较低(≤0.5 mg · L-1),这与 和Ugurlu(2005)和Wang等(2013)观察到的现象一致.
和Ugurlu(2005)和Wang等(2013)观察到的现象一致. 和Ugurlu(2005)发现在厌氧-缺氧-好氧工艺中的好氧阶段开始的1~1.5 h内有一个明显的DO≤0.5 mg · L-1阶段. O/EI系统闲置期内DO几乎为零,且该阶段外碳源已被消耗完全,微生物处于饥饿状态,当开始进水曝气,系统中的氧很快被微生物利用,系统DO上升速度缓慢,因而出现短暂的低DO阶段.
和Ugurlu(2005)发现在厌氧-缺氧-好氧工艺中的好氧阶段开始的1~1.5 h内有一个明显的DO≤0.5 mg · L-1阶段. O/EI系统闲置期内DO几乎为零,且该阶段外碳源已被消耗完全,微生物处于饥饿状态,当开始进水曝气,系统中的氧很快被微生物利用,系统DO上升速度缓慢,因而出现短暂的低DO阶段.
 |
| 图 1 DO和pH周期变化图 Fig. 1 Variations of DO and pH during one cycle |
研究表明,pH值是生物除磷效果的重要影响因素之一(Oehmen et al., 2007).因此,笔者对各反应器典型周期内pH的变化进行了监测,结果如图 1所示.好氧初期,PAOs吸收废水中的VFAs合成PHAs,因而各反应器中pH值较快上升(Wang et al., 2012a).而在随后的好氧段和延长闲置段,外碳源已被完全利用,系统依靠水解PHAs为微生物提供能量,因而pH值逐渐下降,这与Wang等(2013)的研究一致.图中各反应器中pH值相差不大,且变化趋势大体一致,表明DO浓度对O/EI系统pH变化无显著影响.
3.2 各反应器中MLSS和MLVSS稳定运行阶段各反应器中MLSS及MLVSS如表 1所示.本研究中各反应器初始MLSS值约为4000 mg · L-1,MLVSS在2000 mg · L-1左右.稳定运行阶段,各反应器中DO浓度越大则MLSS越小,而MLVSS相差不大,R1到R4中MLVSS/MLSS值由0.58增大至0.69.Oehmen等(2005)研究表明MLVSS/MLSS值能反映微生物中聚磷的相对含量,MLVSS/MLSS越小,细胞内聚磷含量越高,系统的除磷效果越好.因此,低DO浓度条件下较小的MLVSS/MLSS值表明反应器中可能含有较多的聚磷.
| 表 1 稳定运行阶段各反应器中MLSS和MLVSS Table 1 MLSS and MLVSS in the SBRs during the stable operation |
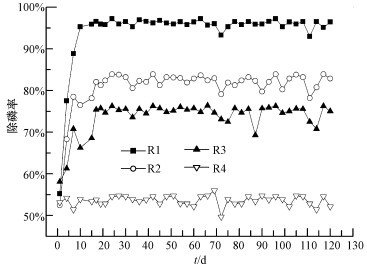
长期运行过程中各反应器内磷的去除率如图 2所示.由图 2可知,污泥驯化阶段,各反应器除磷率逐渐上升.稳定运行以后,各反应器中磷的去除效果具有较大差别,DO浓度越大,反应器中磷的去除效果越差.王晓莲等(2005)也报道了A2O工艺好氧区在高DO浓度下运行,出水磷浓度会急剧增加,而随后降低曝气量,磷出水浓度则逐渐好转.可见,高DO条件对生物除磷过程不利.
 |
| 图 2 长期运行下各反应器的除磷率 Fig. 2 Phosphorus removal rate during the long-term operation in the reactors |
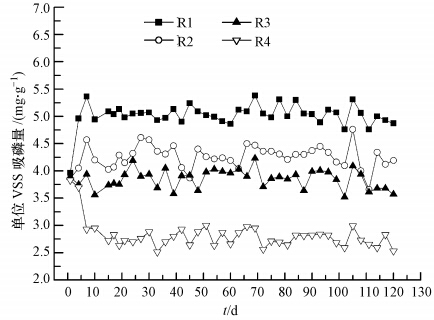
为更准确的表达各反应器的除磷性能,图 3给出了长期运行下单位VSS的除磷量的变化.由图 3可见,不同DO浓度条件下各反应器单位VSS除磷量亦有较大差异.污泥驯化阶段,R1、R2和R3中单位VSS磷的去除量逐渐增大,而R4中单位VSS磷的去除量逐渐减小.稳定运行后,随着DO增大,各反应器中单位VSS除磷量依次减少.
 |
| 图 3 各反应器单位VSS除磷量 Fig. 3 Phosphorus removal amount per g VSS in the reactors |
长期运行过程中各反应器除磷性能的比较如表 2所示.由表 2可知,R1、R2、R3和R4中磷的去除率和单位VSS除磷量均依次减小.R1除磷效果 最佳,除磷率高达96%,单位VSS磷的去除量为5.02 mg · g-1,出水磷浓度仅为0.6 mg · L-1.而R4中出水磷含量高达6.71 mg · L-1,除磷率降至53%,单位VSS磷的去除量仅为2.81 mg · g-1.以上结果表明,低DO浓度有利于O/EI反应器除磷性能,当DO浓度由1 mg · L-1增至4 mg · L-1,系统除磷性能逐渐减弱.
| 表 2 各反应器长期除磷性能比较 Table 2 Comparisons of phosphorus removal during the long-term operation in the reactors |
Wang等(2012b)设置DO浓度为3 mg · L-1时,得出O/EI系统除磷率为54%左右,单位VSS除磷量为2.49左右,与本研究结果相近.传统EBPR为保证出水磷浓度小于1 mg · L-1,好氧段DO必须维持在2 mg · L-1以上(方茜等,2004).本研究中O/EI系统在较低DO浓度(1 mg · L-1)条件下表现出最佳除磷效果,这表明O/EI反应器具有比传统EBPR更低的溶解氧需求,因而降低了运行成本.低DO条件下,O/EI系统中单位VSS除磷量高得多,可能是由于低DO系统污泥中PAOs比高DO下多.当DO浓度较高时,由于曝气量大,氧能较快穿透菌胶团,破坏菌胶团内部厌氧环境,不利于微生物释磷,从而减少微生物吸磷量,此外,高曝气量可能会将活性污泥中较大的菌胶团冲散,使菌胶团结构被破坏,使系统的生物除磷性能降低.为明确DO浓度对O/EI反应器除磷性能的影响机理,进一步深入研究意义重大.
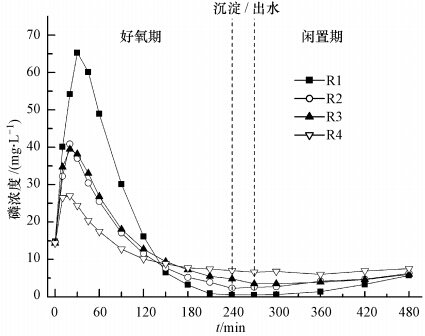
3.4 典型周期内SOP、COD、糖原和PHA的变化各反应器中典型周期内磷的去除情况如图 4所示.由图 4可见,好氧段前30 min各反应器中均出现明显释磷现象.其中,R1释磷量较大,而R4释磷量较小.此外,R1闲置期释磷量(1.81 mg · g-1)也明显高于其他反应器,而R4闲置期基本无释磷.研究表明厌氧段释磷量可影响系统的除磷效果,厌氧释磷越多,系统除磷效果越好(方茜等,2004).以上结果表明,DO浓度可影响系统好氧初期释磷量、好氧吸磷量以及闲置期释磷量,低DO条件有利于PAOs释磷和吸磷,从而提升系统除磷效率.
 |
| 图 4 各反应器SOP周期变化 Fig. 4 Variations of SOP during one cycle in the reactors |
各反应器中典型周期内COD、糖原和PHAs的变化情况如图 5所示.由图 5中可见,曝气开始后,各反应器中COD急剧下降,前30 min内已被消耗完全,各反应器COD去除率均达90%以上.糖原作为除磷过程中的一种重要的胞内聚合物,它能为合成PHAs提供还原力,同时可作为碳源和能量储存物质.从图 5可知R2~R4中糖原变化趋势基本一致,在好氧前期糖原降解为PAOs吸收VFAs提供能量,VFAs经过TCA循环与糖原降解共同为合成PHAs提供所需的还原力,随后PHAs被氧化分解,提供PAOs吸磷所需的能量,同时糖原得到补充.而R1中糖原含量在整个周期内变化不大,在好氧前期并没有分解糖原,即R1中仅TCA循环为PHAs合成提供还原物质.由图 5还可看出,R1中好氧段PHAs合成量明显大于其他3个反应器,约为4 mmol · g-1.以上结果表明,R1中主要储能物质为PHAs,而在其他反应器主要依靠PHAs和糖原供能.Mino(1998)提出外碳源和电子受体(O2)同时存在时,外碳源被优先用于合成PHAs,只有当外碳源耗尽,吸磷才会发生.本研究中好氧前期微生物处于一种局部缺氧环境,微生物在细胞内储存PHAs.PHAs极易被氧化分解,PHAs合成阶段的氧气供应越充足,PHAs的积累量则越低,表明氧在PHAs合成中不利,且氧气存在利于PHAs好氧分解.
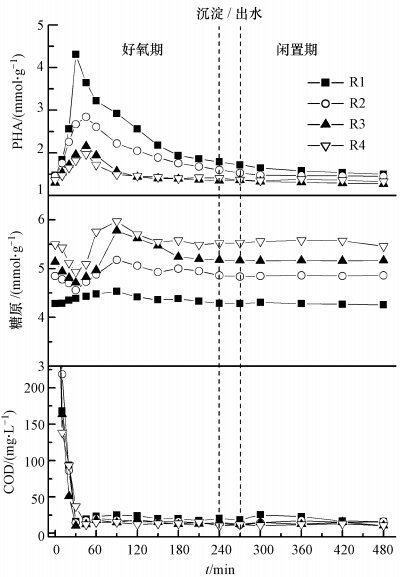 |
| 图 5 各反应器中COD、糖原和PHA周期变化 Fig. 5 Variations of COD,glycogen and PHA concentrations during one cycle in different reactors |
各反应器中摄入单位VFAs的PHAs合成量以及PHAs各组分所占百分比如表 3所示.由表 3可知,R1中PHAs合成量/VFAs明显高于其他反应器,表明在R1中微生物将所吸收的VFAs大部分用于合成PHAs,为随后的好氧吸磷提供更多的能量.此外,随着DO浓度的增大,PHB所占百分比逐渐减小.Randall和Liu(2002)研究得出PHAs组成可能是好氧吸磷的一个关键因素,且PHB为主要形式时更有利于好氧吸磷.随着DO升高PHAs累积量明显下降是由于在溶解氧不足时,微生物的代谢处于相对缓慢的状态,代谢过程中可供利用的能量也相对较少,因而所吸收的VFAs转化为PHAs储存能量和还原物质,供外在碳源不足时利用;而在高DO下,微生物具有更高的代谢速率,产生更多的ATP,将吸收的VFAs更多的被用作微生物细胞生长.因此,低DO下PAOs趋向于储存更多的PHAs,这与Third等(2003)的结论一致.DO浓度越高,系统中糖原累积量越大,这可能是由于系统中占优势地位的微生物种群不同造成的.
| 表 3 各反应器中PHAs成分比较(以乙酸钠为碳源) Table 3 Comparisons of percentages of PHB,PHV and PH2MV in PHAs(acetate as carbon source) |
由图 5可知,与其他反应器不同,R1中糖原在好氧阶段前期并没有被分解,这表明此时O/EI系统是通过三羧酸循环为PHAs合成提供NADH.这可能是因为R1中DO较低,系统中的氧首先供微生物吸收进行好氧呼吸,通过TCA循环用于吸收和转化VFAs,从而没有多余的氧供糖原分解.在其他反应器中,糖原分解和TCA循环共同为PHAs合成提供NADH,然后通过PHAs分解补充糖原.好氧条件下PAOs分解PHAs产生的ATP,一部分供聚磷菌生长,另一部分ATP由磷酸激酶转化成聚磷,将能量储存在聚磷酸盐的高能磷酸键中,实现PAOs好氧吸磷(Smolders et al., 1995).当系统DO较高时,微生物吸收的VFAs大部分用于细胞生长,储能物质PHAs合成量少,微生物吸磷量少,除磷性能差.而低DO条件下,微生物细胞生长速率较慢,有利于微生物储存较多的PHAs(图 5),当外碳源消耗完时,PHAs能为吸磷提供足够的能量.
综上所述,R1具有最佳除磷效果,其除磷性能明显高于其他反应器,这是由于R1中好氧前期由于氧气不足,微生物能释放出较多的聚磷,并将吸收的VFAs大部分用于合成储能物质PHAs,为好氧吸磷提高能量,而R4则由于氧气供应充足,系统内DO升高较快,微生物释磷量少,微生物吸收VFAs主要用于细胞的生长和生成糖原,PHAs合成量较少.由此可见,DO是通过影响O/EI系统的释磷和吸磷过程以及PHAs合成量,从而影响系统的除磷性能.
4 结论(Conclusions)1)低DO浓度(1 mg · L-1)有利于O/EI反应器除磷性能,除磷率高达96%,DO浓度升高至4 mg · L-1时,系统除磷性能逐渐减弱.可见DO浓度对O/EI系统除磷性能影响显著.
2)与R4相比,R1系统中微生物能吸收更多的磷,合成较多的PHAs,但对糖原的合成和利用较少.因此,DO浓度可影响微生物体内PHAs和糖原合成量,好氧初期和闲置期释磷量以及好氧吸磷量,进而影响系统的除磷性能.
| [1] | Akn B S, Ugurlu A. 2005. Monitoring and control of biological nutrient removal in a Sequencing Batch Reactor [J]. Process Biochemistry, 40(8): 2873-2878 |
| [2] | 陈洪波, 王冬波, 李小明, 等. 2012. 单级好氧生物除磷工艺处理生活污水 [J]. 中国环境科学, 32(7): 1203-1209 |
| [3] | Chen Y G, Randall A A, McCue T. 2004. The efficiency of enhanced biological phosphorus removal from real wastewater affected by different ratios of acetic to propionic acid [J]. Water Research, 38(1): 27-36 |
| [4] | 陈滢, 彭永臻, 杨向平, 等. 2004. 低溶解氧SBR除磷工艺研究 [J]. 中国给水排水, 20(8): 40-42 |
| [5] | 丁艳, 王冬波, 李小明, 等. 2010. pH值对SBR单级好氧生物除磷的影响 [J]. 中国环境科学, 30(3): 333-338 |
| [6] | 方茜, 张可方, 张朝升, 等. 2004. SBR法处理低碳城市污水的除磷规律 [J]. 中国给水排水, 20(8): 43-46 |
| [7] | Griffiths P C, Stratton H M, Seviour R J. 2002. Environmental factors contributing to the "G bacteria" population in full-scale EBPR plants[J]. Water Science & Technology, 46(4/5): 185-192 |
| [8] | 胡玉琴. 2007. 低溶解氧环境A/O工艺和SBR工艺生物脱氮除磷试验研究. 重庆: 重庆大学 |
| [9] | Mino T, van Loosdrecht M C M, Heijnen J J. 1998. Microbiology and biochemistry of the enhanced biological phosphate removal process[J]. Water Research, 32(11): 3193-3207 |
| [10] | Oehmen A, Teresa Vives M, Lu H B, et al. 2005. The effect of pH on the competition between polyphosphate-accumulating organisms and glycogen-accumulating organisms [J]. Water Research, 39(15): 3727-3737 |
| [11] | Oehmen A, Lemos P C, Carvalho G, et al. 2007. Advances in enhanced biological phosphorus removal: From micro to macro scale [J]. Water Research, 41(11): 2271-2300 |
| [12] | 彭赵旭, 霍明昕, 彭永臻, 等. 2011. DO对除磷过程的长期影响 [J]. 哈尔滨工业大学学报, 43(4): 42-46 |
| [13] | Pijuan M, Casas C, Baeza J A. 2009. Polyhydroxyalkanoate synthesis using different carbon sources by two enhanced biological phosphorus removal microbial communities [J]. Process Biochemistry, 44(1): 97-105 |
| [14] | Randall A A, Liu Y H. 2002. Polyhydroxyalkanoates form potentially a key aspect of aerobic phosphorus uptake in enhanced biological phosphorus removal [J]. Water Research, 36(14): 3473-3478 |
| [15] | Smolders G J F, Van der Meij J, Van Loosdrecht M C M, et al. 1994. Model of the anaerobic metabolism of the biological phosphorus removal process: stoichiometry and pH influence [J]. Biotechnology and Bioengineering, 43(6): 461-470 |
| [16] | Smolders G J F, Van der Meij J, Van Loosdrecht M C M, et al. 1995. A structured metabolic model for anaerobic and aerobic stoichiometry and kinetics of the biological phosphorus removal process [J]. Biotechnology and Bioengineering, 47(3): 277-287 |
| [17] | Takabatake H, Satoh H, Mino T, et al. 2002. PHA (polyhydroxyalkanoate) production potential of activated sludge treating wastewater [J]. Water Science & Technology, 45(12): 119-126 |
| [18] | Third K A, Newland M, Cord-Ruwisch R. 2003. The effect of dissolved oxygen on PHB accumulation in activated sludge cultures [J]. Biotechnology and Bioengineering, 82(2): 238-250 |
| [19] | Tong J, Chen Y G. 2007. Enhanced biological phosphorus removal driven by short-chain fatty acids produced from waste activated sludge alkaline fermentation [J]. Environmental Science & Technology, 41(20): 7126-7130 |
| [20] | Wang D B, Li X M, Yang Q, et al. 2008. Biological phosphorus removal in sequencing batch reactor with single-stage oxic process [J]. Bioresource Technology, 99(13): 5466-5473 |
| [21] | 王冬波, 李小明, 杨麒, 等. 2009. 碳源对SBR单级好氧工艺中微生物摄磷能力的影响及其机理研究 [J]. 中国科学B 辑: 化学, 39(6): 560-568 |
| [22] | 王冬波. 2011. SBR单级好氧生物除磷机理研究. 长沙: 湖南大学 |
| [23] | Wang D B, Li X M, Yang Q, et al. 2012a. Improved biological phosphorus removal performance driven by the aerobic/extended-idle regime with propionate as the sole carbon source [J]. Water Research, 46(12): 3868-3878 |
| [24] | Wang D B, Yang G J, Li X M, et al. 2012b. Inducing mechanism of biological phosphorus removal driven by the aerobic/extended-idle regime [J]. Biotechnology and Bioengineering, 109(11): 2798-2807 |
| [25] | Wang D B, Zheng W, Liao D X, et al. 2013. Effect of initial pH control on biological phosphorus removal induced by the aerobic/extended-idle regime [J]. Chemosphere, 90(8): 2279-2287 |
| [26] | 王晓莲, 王淑莹, 马勇, 等. 2005. A2O工艺中反硝化除磷及过量曝气对生物除磷的影响 [J]. 化工学报, 56(8): 1565-1570 |
| [27] | 魏复盛. 2002. 水和废水监测分析方法(第4版) [M]. 北京: 中国环境科学出版社 |
| [28] | Winkler M, Coats E R, Brinkman C K. 2011. Advancing post-anoxic denitrification for biological nutrient removal [J]. Water Research, 45(18): 6119-6130 |
 2015, Vol. 35
2015, Vol. 35


