2. 四川省水利科学研究院, 成都 610072
2. Sichuan Provincial Water Conservancy Research Institute, Chengdu 610072
过氧化氢,其水溶液称为双氧水,通常被用作漂白剂和氧化剂,在环保、化工、造纸和食品等各个工业领域几乎都有应用(刘洋等,2011).H2O2在环保方面主要应用于废气和废水的除臭和解毒,其最突出的优点是H2O2参与反应之后的产物只有纯水和氧气,是一种重要的绿色化学试剂(Sheldon,2005).同时,H2O2也是一种活性氧(ROS)物质,而活性氧不仅会影响植物的光合作用(Uzilday et al., 2014),还会使某些基因的表达发生紊乱(Mehterov et al., 2012),并且也会使生物体细胞发生膜脂过氧化作用,对细胞产生损伤,从而影响生物体的正常生长和繁殖(杨晴等,2012).
H2O2能够有效杀灭藻细胞,是一种潜在的除藻剂,这在国内外的相关研究中都已被证实(Freese et al., 1999; Kay et al., 1982; Hea et al., 2013;李今等,2011).但目前有关H2O2的除藻机理及对藻细胞的损伤效应的研究却鲜有报道.铜绿微囊藻(Microcystis aeruginosa)在我国富营养化水体中占据一定优势,是引起蓝藻“水华”的特征藻种.因此,本文以铜绿微囊藻为实验材料,研究不同浓度的H2O2处理对藻细胞数量和生理生化指标的影响,以探讨H2O2对藻细胞生长及氧化损伤效应的影响,为H2O2除藻的机理研究提供一定的理论参考.同时,对培养基中H2O2含量变化的分析可在一定程度上为实际应用H2O2除藻的环境安全性和可行性提供依据.
2 材料与方法(Materials and methods) 2.1 实验材料供试藻种:铜绿微囊藻(Microcystis aeruginosa)FACHB912,该株系购自中国科学院水生生物研究所藻种库,是从太湖中分离、纯化后获得的.铜绿微囊藻属于蓝藻门、色球藻科、色球藻目、微囊藻属,广泛分布于有机质丰富的湖泊、池塘等水体中,是引起富营养化水体形成蓝藻水华的一种优势藻类.
供试药品:H2O2溶液由成都市科龙化工试剂厂生产.
2.2 藻种培养严格按照无菌操作的要求,在超净台上将藻种从试管转入已高压蒸汽灭菌的小三角瓶中(20~50 mL),转接2/3藻种,转接时藻液与BG11培养基比例为1 ∶ 2.然后放置到光照培养箱中培养,温度为25 ℃,光照强度为2000~2500 lx,周期为12 h(昼)/12 h(夜),每天定时摇瓶3次.培养2周后观察,如生长较好,再进行转接,使藻液与BG11培养基比例为1 ∶ 5~1 ∶ 6,并将剩余藻种转接进行扩大培养,反复接种,以培养实验所需的藻种.
2.3 实验设计根据文献(Hea et al., 2013;李今等,2011)和预实验的结果,设置过氧化氢的浓度梯度为0、25、50、75和100 mg · L-1,并以浓度为0 mg · L-1的实验组为对照.把处于对数生长期的铜绿微囊藻藻液于4500 r · min-1下离心10 min,弃去上清液,用无菌水悬浮洗涤两次以除去附着在藻种表面的培养基,再用适量的无菌水悬浮后,等量接种到灭菌过后、pH为7.5的BG11培养基中,使藻细胞的初始密度为5×106 个· mL-1左右.然后分别向藻液中加入H2O2溶液,调节藻液中初始H2O2浓度分别为0、25、50、75和100 mg · L-1.把藻液放入温度为25 ℃、光照为2500 lx的光照培养箱中进行培养实验,每个处理设置3个重复.
2.4 测定项目及分析方法每隔24 h取样测藻细胞数、叶绿素a、类胡萝卜素和蛋白质含量、藻细胞藻的总抗氧化能力(T-AOC)、丙二醛(MDA)含量及培养基中H2O2的含量.藻细胞数的测定:参照文献(黄秀梨等,2008)提供的方法在650 nm处采用光密度方法进行测定;叶绿素a和类胡萝卜素含量的测定:采用丙酮萃取法进行测定(吴忠兴,2006);藻细胞组织液的提取:参照文献(吴清莲等,2013)的方法,藻细胞反复冻融,使其充分破碎,即可得到藻细胞提取液,用于蛋白质含量、T-AOC和MDA的测定;藻细胞蛋白质含量的测定:考马斯亮蓝法(陈芝兰,2005);藻细胞T-AOC的测定:比色法;MDA含量的测定:TBA法(向丽,2010);H2O2含量的测定:可见光分光光度法.其中,蛋白质、T-AOC、MDA和H2O2均采用南京建成生物工程研究所提供的试剂盒进行测定.实验数据用Excel2003与DPS v7.05软件进行统计分析.
3 结果与分析(Results and analysis) 3.1 铜绿微囊藻藻细胞数的变化每个处理的初始藻细胞数均为5×106个· mL-1,不同浓度H2O2在3 d内随时间变化对铜绿微囊藻藻细胞数及去除率的影响如表 1所示.由表 1可以看出,H2O2能够杀死铜绿微囊藻藻细胞,对藻细胞的生长及去除有显著的影响,在相同时间内,H2O2浓度越大,藻细胞数越少,去除率越大.空白对照组(0 mg · L-1)的藻细胞数随着时间的增加而显著增加(p<0.05),72 h后,藻细胞数比初始值增加了152%.而经H2O2处理的实验组,24 h后,藻细胞的去除率均达到65%以上;随着处理时间的增加,藻细胞数逐渐减少,48 h后,75 mg · L-1和100 mg · L-1实验组的藻细胞数之间差异不显著(p>0.05),50 mg · L-1实验组的藻细胞数与这两个实验组之间存在显著差异,但去除率均达到90%以上;72 h之后,藻细胞的去除量明显减少,25 mg · L-1实验组的藻细胞数变化不显著,去除率为81%,而其他3个H2O2处理实验组之间的藻细胞数均显著低于48 h时,且3个实验组之间差异不显著(p>0.05).
| 表 1 H2O2对铜绿微囊藻生长及去除率的影响 Table 1 Effects of H2O2 on the growth and removal rate of Microcystis aeruginosa |
每个处理的初始叶绿素a含量为25.546 mg · m-3,初始类胡萝卜素含量为11.445 mg · m-3.一般认为,水体富营养化时,表征藻类生物量的叶绿素a含量大于10 mg · m-3.不同浓度的H2O2在3 d之内随时间变化对铜绿微囊藻藻叶绿素a和类胡萝卜素含量的影响如表 2和表 3所示.
| 表 2 H2O2对铜绿微囊藻叶绿素a含量的影响 Table 2 Effects of H2O2 on the contents of chlorophyll a of Microcystis aeruginosa |
| 表 3 H2O2对铜绿微囊藻类胡萝卜素含量的影响 Table 3 Effects of H2O2 on the contents of carotenoids of Microcystis aeruginosa |
从表 2可以看出,H2O2对铜绿微囊藻叶绿素a含量影响的变化趋势和藻细胞数变化趋势基本一致.在藻液中加入H2O2,叶绿素a含量会随着时间的增加而明显减少,并且H2O2浓度越大,叶绿素a的去除率越大,中高浓度(50、75、100 mg · L-1)实验组之间叶绿素a含量差异不显著(p>0.05);在24 h后,叶绿素a含量大大降低,去除率达到80%以上;随着时间的增加,100 mg · L-1实验组叶绿素a含量变化不显著(p>0.05),75 mg · L-1实验组在48 h时叶绿素a含量显著降低,而50 mg · L-1实验组叶绿素a含量一直显著减少(p<0.05),72 h后叶绿素a的去除率与75 mg · L-1实验组一致,达到了98%.低浓度(25 mg · L-1)实验组在相同时间内,叶绿素a含量显著低于空白对照组,但显著高于中高浓度实验组.未经H2O2处理的实验组,藻细胞能够正常生长,叶绿素a含量在72 h内随着时间的增加而快速增多.向藻液中投加H2O2能够有效地减少叶绿素a的含量.
类胡萝卜素是生物体内抗氧化防御体系的非酶促体系中的一种重要物质,可对氧气的激活状态进行有效的灭活,防止生物体受氧化损伤.由表 3可以看出,H2O2对铜绿微囊藻类胡萝卜素含量影响的变化趋势与叶绿素a含量变化趋势基本一致.未经H2O2处理的实验组,类胡萝卜素含量随着时间的增加有所增长,但差异变化不显著(p>0.05).而经H2O2处理的实验组,24 h后,低浓度(25 mg · L-1)实验组类胡萝卜素含量显著高于其他H2O2处理实验组(p<0.05),其减少率仅为60%;而中高浓度(50、75、100 mg · L-1)实验组在相同的时间内,类胡萝卜素含量差异不显著(p>0.05),随着处理时间的增加,类胡萝卜素含量逐渐降低,在48 h时,减少率就达到了96%以上.
3.3 铜绿微囊藻蛋白质含量的变化不同浓度H2O2随时间变化对铜绿微囊藻蛋白质含量的影响如图 1所示.由图 1可知,每个处理的初始铜绿微囊藻蛋白质含量为28.654×10-7 μg · cells-1,在实验的72 h内,空白对照组(0 mg · L-1)的铜绿微囊藻蛋白质含量都显著高于其他H2O2处理实验组(p<0.05),并且随着时间的增加呈上升趋势;而经过H2O2处理的实验组,蛋白质含量的变化与空白组正好相反,都随着时间的增加而显著减少(p<0.05);在相同的时间内,H2O2浓度越大,蛋白质的减少量就越大,但这种差异随着时间的增加而减小.
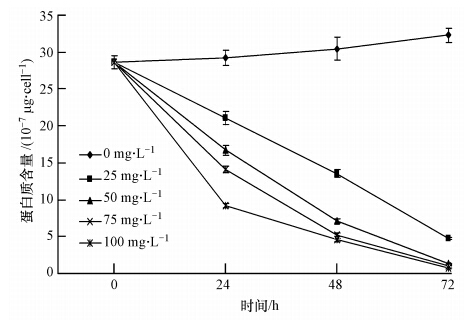 |
| 图 1 H2O2对铜绿微囊藻蛋白质含量的影响 Fig. 1 Effects of H2O2 on the contents of protein of Microcystis aeruginosa |
不同浓度的H2O2在72 h内随时间变化对铜绿微囊藻总抗氧化能力的影响如图 2所示.藻细胞总抗氧化能力(T-AOC)的强弱与细胞活性存在着密切的联系.从图中可以看出,空白组(0 mg · L-1)和25 mg · L-1H2O2处理组在相同时间内T-AOC差异不显著(p>0.05),但却明显高于其他3个实验组;同时,这两个实验组的T-AOC随着时间的增加变化不明显,25 mg · L-1 H2O2处理实验组的T-AOC在24 h时比初始值略有增加,但随着时间的增加,呈现一种下降的趋势,72 h之后仅比初始值降低5%.50、75和100 mg · L-1 3个H2O2处理实验组的T-AOC变化趋势完全一致,都是随着时间的增加T-AOC一直在减小;24 h时,3个实验组之间的T-AOC存在显著差异(p<0.05),分别为3.105、2.567和2.104 U(在37 ℃时,每分钟每107个藻细胞提取液使反应体系的吸光度(OD)值每增加0.01时,定义为一个总抗氧化能力单位,用U表示),仅比初始值减少了17%、34%和44%;但48 h之后,3个实验组之间的T-AOC差异不显著(p>0.05),72 h时,T-AOC较初始值分别减少了86%、97%和98%.这说明低浓度的H2O2在短时间内可能会促进铜绿微囊藻的T-AOC,当H2O2浓度达到一定的值时,会对铜绿微囊藻的总抗氧化能力产生严重的影响.
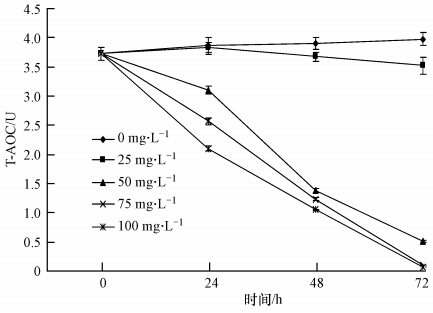 |
| 图 2 H2O2对铜绿微囊藻总抗氧化能力(T-AOC)的影响 Fig. 2 Effects of H2O2 on the total antioxidant capacity(T-AOC)of Microcystis aeruginosa |
不同浓度H2O2在72 h内随时间变化对铜绿微囊藻丙二醛(MDA)含量的影响如图 3所示.当生物体的器官发生衰老或受到一些外界逆环境影响时,细胞的脂质会发生过氧化作用,破坏细胞膜的结构,而丙二醛(MDA)就是细胞质膜过氧化的最终产物之一,其含量的大小对于衡量细胞受损伤的程度有重要意义.从图 3可以看出,空白对照组MDA含量在72 h内无明显变化,且显著低于其他实验组(p<0.05).而经H2O2处理的实验组,铜绿微囊藻MDA含量随着时间的增加而显著增大(p<0.05);并且在相同的时间内,H2O2浓度越大,MDA含量也越大.最终,在72 h时,25、50、75、100 mg · L-1 H2O2处理实验组的MDA含量分别比初始值(0.936×107 nmol · cells-1)增加了75%、92%、163%和270%.可 见,在一定的时间内,H2O2可使藻细胞受到严重损伤,从而使MDA含量增加.
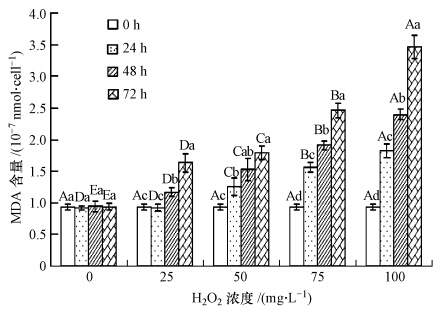 |
| 图 3 H2O2对铜绿微囊藻丙二醛(MDA)含量的影响 Fig. 3 Effects of H2O2 on the contents of malondialdehyde(MDA)of Microcystis aeruginosa |
不同浓度的H2O2处理藻液之后,培养基中H2O2含量在72 h内的变化如表 4所示.H2O2处理藻液之后,由于其自身对藻细胞发生作用及H2O2在水体中的自身分解,培养基中的H2O2含量会逐渐减少.由表 4可以看出,空白对照组培养基中的H2O2含量一直最低,随着时间的增加,H2O2含量显著增加,72 h后,培养基中的H2O2含量增加了34%,为0.343 mg · L-1.经H2O2处理的实验组,培养基中的H2O2含量随着时间的增加而显著降低(p<0.05).其中,H2O2浓度越大的实验组,培养基中H2O2的残留量也就越大;但H2O2浓度越小的实验组,在相同时间内,H2O2减少量却越大;24 h时,25 mg · L-1实验组培养基中的H2O2减少量达到了81%,而50、75、100 mg · L-1实验组培养基中的H2O2减少量依次为69%、65%和62%;最终72 h之后,培养基中的H2O2的减少量都达到了90%以上.其中,50 mg · L-1实验组的H2O2残留量为0.975 mg · L-1,显著高于75 mg · L-1和100 mg · L-1实验组(p<0.05),但与25 mg · L-1实验组之间的差异不显著(p>0.05),H2O2的减少量也都达到了98%.其中,100 mg · L-1 H2O2处理的实验组,72 h后培养基中H2O2的减少量虽然达到了90%,但培养基中的H2O2残留量仍然比较高,为10.014 mg · L-1.
| 表 4 培养基中的H2O2含量 Table 4 Contents of H2O2 in medium |
本研究发现,H2O2处理藻液之后,会对铜绿微囊藻藻细胞产生严重的损伤效应,从而对它的生长产生抑制作用,因此,可以应用H2O2来杀灭铜绿微囊藻,是一种潜在的除藻剂.不同浓度的H2O2处理藻液后,会对藻细胞产生不同程度的毒害作用.这是由于H2O2本身是一种ROS物质,当藻细胞受到氧化胁迫时,脂质会发生过氧化作用而受到损伤,导致膜脂变性和功能的改变,破坏细胞膜结构,从而对藻细胞产生毒害作用,当藻液中H2O2浓度越大时,其损害作用就越大(尹希等,2010).李今等(2011)的研究结果显示,H2O2对铜绿微囊藻抑制的效应随着H2O2浓度的增加而增强,他建议在实际应用中,要在一定时间内达到有效抑制藻类的效果,H2O2的质量分数应为0.004‰以上.本文研究结果也发现,H2O2对铜绿微囊藻的去除效率与H2O2的浓度呈正比,并且H2O2浓度为50 mg · L-1时,能够有效地去除铜绿微囊藻,同时72 h之后,培养基中的H2O2残留量也会很低,这与Burson等(2014)的研究成果相类似.
4.2 H2O2对藻细胞的损伤效应H2O2对铜绿微囊藻的损伤效应还表现在对藻细胞的生理指标及抗氧化防御系统的影响方面.目前,关于H2O2对藻细胞损伤效应的研究报道较少.叶绿素a是叶绿素的基本组成部分,可以吸收和传递光能,是光能的吸收体和载体,其含量的大小直接影响光合作用的强弱.有研究发现,H2O2可以通过影响光合电子的转移来影响蓝藻的光合作用,从而对蓝藻细胞造成伤害(Drábková et al., 2007).蛋白质是生物的物质基础,参与生物体结构的构建和生物体的各种生存代谢,同时,酶类蛋白质对生物体的各种代谢活动影响很大.本研究发现,H2O2处理藻液24 h后,铜绿微囊藻藻细胞数、叶绿素a含量、类胡萝卜素含量、蛋白质含量及T-AOC都迅速减小,而MDA含量显著增加,同时培养基中的H2O2含量也快速降低;随着处理时间的增加,毒害作用一直延续,培养基中的H2O2也逐渐被消耗和分解;72 h之后,藻细胞各指标的数值降得很低,同时MDA含量也增加到最大,藻细胞的损伤效应也达到最大.这可能是H2O2作用于藻细胞之后,细胞膜发生膜脂过氧化作用,藻细胞的生理功能发生紊乱,叶绿素a的合成受到影响,从而影响了藻细胞的光合作用和呼吸作用.类胡萝卜素是机体内抗氧化防御体系的非酶促体系中的一种重要物质,当藻细胞受到氧化损伤时,一定程度上会刺激藻细胞产生类胡萝卜素来抑制氧化损伤;但当H2O2对藻细胞的损伤作用过大时,藻细胞各种功能代谢减弱,藻体本身大量死亡,会严重影响藻细胞类胡萝卜素含量的产生.因此,在本研究中,H2O2处理藻细胞后,藻细胞数和叶绿素a含量都快速降低,对藻细胞产生了严重的伤害,类胡萝卜素的含量也快速下降,并且H2O2浓度越大,对藻细胞的损伤效应越大,藻细胞产生类胡萝卜素的量也就越小.藻细胞蛋白质也是以光合作用的直接产物为基础(刘春光等,2006),H2O2对藻细胞光合作用的影响也间接影响蛋白质的含量;H2O2是一种氧化剂,会使氨基酸的一些结合位点被氧化,从而阻碍蛋白质的合成(Stadman,1993).H2O2浓度越大,毒害作用就越大.
机体防御体系的总抗氧化能力(T-AOC)的强弱与健康程度存在着密切的联系,该防御体系有酶促和非酶促两个体系组成.T-AOC的大小可以充分反映H2O2对藻细胞抗氧化系统的影响程度,以及藻细胞遭到H2O2作用之后抗氧化能力的变化.酶促体系主要是SOD、POD和CAT等一些酶类物质,非酶促体系主要是维生素、氨基酸和金属蛋白质等一些生命大分子.其中,SOD是生物体内天然存在的超氧阴离子自由基(· O-2)的清除因子,可以把· O-2转化为H2O2,然后机体内的POD和CAT会立即把有害的H2O2分解为完全无害的水,从而对细胞起到保护作用.类胡萝卜素也是生物体抗氧化系统的非酶促体系中的一种物质,可以对氧气的激活状态进行有效的灭活,以保护生物体免受自由基的氧化损伤.在一般的正常生长情况下,机体细胞内有防御活性氧、去除自由基毒害的保护机制,活性氧的产生和清除处于一个动态平衡状态,不会对机体细胞造成伤害(李信书等,2007).而当铜绿微囊藻受到H2O2逆环境胁迫时,会刺激藻细胞内活性氧的大量产生和累积.同时,培养基中的H2O2也是一种活性氧物质,铜绿微囊藻在同时受到藻细胞内外过量ROS损伤的情况下,藻细胞本身对活性氧的产生和清除平衡被打破,过量的ROS使藻细胞遭到严重的损伤,细胞内各种抗氧化酶的活性逐渐减弱,总抗氧化能力也因此而减弱,类胡萝卜素含量也逐渐降低,最终藻细胞的结构和功能都受到破坏.丙二醛(MDA)是一种生物体内自由基作用于脂质发生过氧化反应的氧化产物,具有细胞毒性.它能与蛋白质、核酸等生命大分子交联螯合修饰其特性,或抑制蛋白质的合成,还可以与酶发生反应,使酶的活性丧失,甚至成为一种催化错误代谢的分子,最终干扰细胞内的正常生命活动(Taylor et al., 2003).因此,MDA含量的高低可以直接体现细胞膜脂过氧化水平的强弱.本实验中,H2O2处理藻液之后,藻细胞发生膜脂过氧化作用,体内MDA含量一直显著增加,此时,蛋白质的合成受到阻碍,其含量逐渐降低,T-AOC也一直在减弱.
4.3 H2O2除藻的环境安全性H2O2是一种特殊的化学试剂,在应用它除藻的同时,可能会对其他水生生物产生影响.但有研究发现,把低剂量的过氧化氢添加到养殖水体中有助于改善水质,能够抑制自养型生物的生长,尤其是对蓝藻的抑制效应超过了其他浮游藻类,并且对养殖的鱼类不产生负面影响,可作为养殖水体中的一种有效除藻剂(黄锦雄等,2012).同时,H2O2由于自身的化学特性,在一定条件下,本身会分解成水和氧气.当它作用于藻细胞时,会被消耗利用,再加上自身的分解作用,50 mg · L-1 H2O2处理藻液72 h后,培养基中H2O2的含量减少了95%,而随着时间的推移,培养基中的H2O2肯定还会继续分解,这体现了应用H2O2除藻的一个优势:添加的化学试剂在自然状态下会自身分解,同时分解的产物无毒无害.在实际应用时,还应该考虑50 mg · L-1H2O2刚加入到水体中时对其他生物产生的影响,随着时间的推移,24 h之后,水体中的H2O2大量减少,对其他生物的影响也会显著降低.应用过氧化氢除藻的关键就是控制好H2O2的投加量,既要保证对铜绿微囊藻有较高的去除率,也要力求对其他生物的影响较小.
5 结论(Conclusions)不同浓度的H2O2处理藻液,会对藻细胞产生不同程度的毒害作用,H2O2浓度越大,毒害作用越大.24 h之后,铜绿微囊藻藻细胞数、叶绿素a含量、类胡萝卜素含量、蛋白质含量及T-AOC都显著减小,而MDA含量显著增加,同时培养基中的H2O2含量也迅速降低;随着处理时间的增加,毒害作用一直延续,培养基中H2O2也逐渐被消耗和分解,72 h之后,藻细胞各指标的数值降得很低,同时MDA含量也增加到最大,藻细胞的损伤效应也达到最大.其中,H2O2浓度为50 mg · L-1时,能够有效地去除藻细胞,并且对藻细胞的生理指标及抗氧化能力都有很强的损伤效应;同时,72 h之后,培养基中H2O2的含量减少了98%,残留量很低.因此,H2O2是一种潜在的除藻剂,本身分解也只产生水和氧气,可以用H2O2来杀灭水体中的铜绿微囊藻,并且以50 mg · L-1作为H2O2除藻的最佳浓度,这对于蓝藻“水华”的治理意义重大.
| [1] | Burson A,Matthijs H C P,de Bruijne W,et al.2014.Termination of a toxic Alexandrium bloom with hydrogen peroxide[J].Harmful Algae,31: 125-135 |
| [2] | 陈芝兰.2005.凤眼莲根对赤潮藻生长的抑制作用及其机理研究.广州:暨南大学 |
| [3] | Drábková M,Matthijs H C P,Admiraal W,et al.2007.Selective effects of H2O2 on cyanobacterial photosynthesis[J]. Photosynthetica,45(3): 363-369 |
| [4] | Freese S D,Nozaic D,Pryor M J,et al.1999.Comparison of ozone and hydrogen peroxide/ozone for the treatment of eutrophic water[J].Water Science and Technology,39(10/11): 325-328 |
| [5] | Hea X X,Cruz A A,Dionysiou D D.2013.Destruction of cyanobacterial toxin cylindrospermopsin by hydroxyl radicals and sulfate radicals using UV-254 nm activation of hydrogen peroxide,persulfate and peroxymonosulfate[J].Journal of Photochemistry and Photobiology A: Chemistry,251: 160-166 |
| [6] | 黄锦雄,杨宇晴,张海发,等.2012,过氧化氢在循环水养殖系统中的应用[J].渔业现代化,39(1):72-73 |
| [7] | 黄秀梨,辛明秀.2008.微生物学实验指导(第2版)[M].北京: 高等教育出版社 |
| [8] | Kay S H,Quimby P C,Quzts J D.1982.Hydrogen peroxide: A potential algicide for aquaculture. Proceedings of the 35th Annual Meeting of the Southern Weeding Science Society.Atlanta,GA: 275-289 |
| [9] | 李今,华江环.2011.几种除藻剂对铜绿微囊藻生长的毒性效应[J].沈阳师范大学学报(自然科学版),29(3): 444-448 |
| [10] | 李信书,唐学玺.2007.亚心形扁藻超氧化物歧化酶活性对镉和铜的应答[J].海洋湖沼通报,(3): 75-80 |
| [11] | 刘春光,孙红文,张楠,等.2006.二价铜离子对川蔓藻(Ruppia maritima)的毒害作用研究[J].环境科学学报,26(11): 1870-1874 |
| [12] | 刘洋,曾庆乐,唐艳红,等.2011.绿色化学试剂过氧化氢在有机合成中的应用研究进展[J].有机化学,31(7): 986-996 |
| [13] | Mehterov N,Balazadeh S,Hille J,et al.2012.Oxidative stress provokes distinct transcriptional responses in the stress-tolerant atr7 and stress-sensitive loh2 Arabidopsis thaliana mutants as revealed by multi-parallel quantitative real-time PCR analysis of ROS marker and antioxidant genes[J].Plant Physiology and Biochemistry,59: 20-29 |
| [14] | Sheldon R A.2005.Green solvents for sustainable organic synthesis: state of the art[J].Green Chemistry,7(5): 267-278 |
| [15] | Stadman E R.1993.Oxidation of free amino acids and acid residues in proteins by radiolysis and metal catalyzed reactions[J].Annual Review of Biochemistry,62: 797-821 |
| [16] | Taylor E R,Hurrel F,Shannon R J.2003. Reversible glutatmonylation of complex I increases mitoehondrial superoxide formation[J]. J Bio Chem,278 (22):19603-19610 |
| [17] | Uzilday B,Turkan I,Ozgur R,et al.2014.Strategies of ROS regulation and antioxidant defense during transition from C3 to C4 photosynthesis in the genus Flaveria under PEG-induced osmotic stress[J].Journal of Plant Physiology,171(1): 65-75 |
| [18] | 吴清莲,王应军,杜宇,等.2013.钇对铅胁迫下铜绿微囊藻抗氧化能力及藻毒素释放的影响[J].农业环境科学学报,32(6): 1128-1133 |
| [19] | 吴忠兴.2006.我国微囊藻多样性分析及其种群优势的生理学机制研究.武汉:中国科学院水生生物研究所 |
| [20] | 向丽.2010.稻麦秸秆对铜绿微囊藻生长的抑制作用及其机理研究.无锡:江南大学 |
| [21] | 杨晴,杨晓玲,秦玲.2012.植物生理学[M].北京:中国农业科学技术出版社.354-363 |
| [22] | 尹希,陈填烽,杨芳,等.2010.硒对H2O2胁迫钝顶螺旋藻的保护作用及其机制[J].西北植物学报,30(4): 733-740 |
 2015, Vol. 35
2015, Vol. 35


