2. 四川省高校特种废水处理重点试验室, 成都 610066
2. Key Laboratory of Treatment for Special Wastewater of Sichuan Province Higher Education System, Chengdu 610066
氟广泛被用于电镀\,电子\,农药\,太阳能电池等工业.在氟化物的加工\,生产和应用过程会产生大量的高浓度含氟废水,若不经处理排向环境会带来严重的污染,对人体健康和动植物生长势必将造成威胁(Mahramanlioglu et al., 2002).为保护生态环境和人体健康,我国规定工业废水中氟的最高允许排放浓度为10 mg · L-1(张超杰和周琪,2002).为达到此排放标准,许多含氟工业废水采用吸附作为深度处理单元.
吸附剂的选择是吸附法应用效果好坏的关键.根据使用的原料,除氟吸附剂可分为稀土材料,含铝吸附剂,天然高分子吸附剂及其它材料(徐传海,2009;Zhou et al., 2004).其中,天然有机高分子吸附剂因来源广泛,比表面积大,环境友好正受到越来越多的关注,但其机械强度低,对氟的选择性较差.将天然有机高分子和无机金属化合物以某种方式聚合可形成有机-无机复合材料,这种复合材料兼备两种材料的双重优良特性,从而具有较高的氟吸附效能.如将Al3+\,La3+\,Zr4+等负载于海藻酸钠\,壳聚糖\,明胶等天然有机高分子上所获得的吸附剂具有较高的吸附容量(姚瑞华等,2009;Huo et al., 2011).但是上述天然高分子材料的来源有限,提取方法复杂且价格较高,大面积推广利用较困难.
腐殖酸是土壤和水底沉积物的主要有机成分,自然界的腐殖酸只需用酸碱试剂在温和的条件下就能提取,提取方法简单.它是一种亲水性可逆胶体,具有疏松的“海绵状”结构,使其产生巨大的表面积和表面能.腐殖酸分子中含有羟基\,羧基等活性基团,可与水中金属发生离子交换\,络合反应及表面吸附作用(刘咏等,2013).利用腐殖酸独特的物理化学性质,空间结构以及与金属离子的反应特性,可使腐殖酸与无机金属化合物复合,所形成的复合物将赋予腐殖酸新的功能,从而可以根据不同需要制备成各种特殊功能的复合材料.
鉴于此,本文以腐殖酸钠(NaA)作为原料,通过凝胶聚合法制备La-腐殖酸/Al2O3凝胶复合物(简称LHAGC),将此复合物作为吸附剂,对模拟含氟废水进行吸附试验,研究该复合物的氟吸附性能,为含氟工业废水的吸附处理提供一种新材料和新方法.
2 材料与方法(Materials and methods) 2.1 材料 2.1.1 主要试剂腐殖酸钠AR级,氯化铝AR级,硝酸镧AR级,氟化钠AR级.
2.1.2 主要仪器氟离子选择性电极(PF-1-01,上海仪电科学仪器股份有限公司);pH计(PHS-3C+,成都世纪方舟科技有限公司);磁力搅拌器(DF-101B,巩义市予华仪器有限责任公司);电子天平(TE124S,赛多利斯科仪器有限公司);调速多用振荡器(SNAA-C,江苏金坛市金城国胜试验仪器厂);离心机(LD4-2A,北京雷勃尔离心机有限公司).
2.1.3 水样模拟废水由氟化钠和蒸馏水配制而成,其中F-质量浓度为10~250 mg · L-1.
2.2 吸附剂的制备与表征 2.2.1 LHAGC的制备将3 g氯化铝溶解于70 mL蒸馏水中,加入60 mL浓度为50 g · L-1的硝酸镧溶液,加热至60 ℃,在剧烈搅拌下加入浓度为30 g · L-1的腐殖酸钠溶液100 mL,用氢氧化钠和盐酸调节溶液的pH值为7,用电动搅拌器缓慢搅拌60 min,离心分离(离心速率为4000 r · min-1),将固体用蒸馏水进行洗涤后在69 ℃的烘箱中干燥24 h即获得LHAGC除氟吸附剂.
2.2.2 LHAGC的表征用N2吸附/解吸方法(Micromeritics TriStar Surface Area and Pority Analyzer,氮吸收装置,美国)对吸附剂的比表面积和孔径分布进行分析;通过扫描电子显微镜(SEM,JSM.5900LV,Hitech,日本),傅立叶红外光谱仪(FTIR,VERTEX 70,德国)和X射线衍射(XRD,XD-2型,中国)对LHAGC和NaA吸附剂进行表征.
2.3 静态吸附试验将LHAGC以一定的投加量处理一定浓度的F-模拟废水,在25 ℃的恒温振荡器上振荡6 h,固液分离后取上清液用F-选择电极法测定废水中残余F-浓度(国家环保局《水和废水监测分析方法》编委会,1998),根据公式(1)、(2)分别计算F-的吸附量和吸附率:
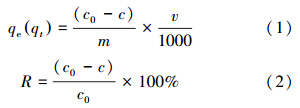
采用逐级稀释法制备浓度分别为10-1,10-2,10-3,10-4 g · L-1 的 NaF标准溶液,逐级稀释时添加适当的TISAB溶液,用氟离子选择性电极法测定溶液的电位.结果表明,在所测定范围内F-浓度与电位之间有良好的线性关系,线性方程:y = 59.700x-76.98,且可决系数R2=0.9999.
3 结果与讨论(Results and discussion) 3.1 LHAGC的表征 3.1.1 N2吸附-脱附曲线通过BET法计算结果得出LHAGC和NaA的比表面积、平均孔容、平均孔径分别为3.770×10 m2 · g-1、7.281×10-2 m3 · g-1、3.862 nm和6.319 m2 · g-1、1.228×10-2 m3 · g-1、3.887 nm. LHAGC的N2吸附-脱附曲线如图 1所示.
 |
| 图 1 LHAGC的N2吸附-脱附曲线 Fig. 1 N2 adsorption-desorption isotherms of LHAGC sample |
由图 1可以看出LHAGC的N2吸附-脱附曲线属于Ⅳ型,在P/P0为0.30~0.99出现滞后环.说明LHAGC具有有序结构,产生滞后环可能是由胶体粒子之间的堆积而产生的毛细凝结现象引起.
3.1.2 LHAGC成分分析将2.2.1节中制得的LHAGC进行称重并对其中铝和镧的质量用ICP分析,结果表明,所获得的LHAGC共有4 g,样品中铝和镧的质量分数分别为15.23%和24.08%,原料中铝和镧的转化率分别为99.99%和91.97%.
3.1.3 XRD分析LHAGC和NaA的XRD谱图如图 2所示. 由图 2可以看出,NaA和LHAGC谱图中大多数是模糊宽化的弥散峰,表明NaA和LHAGC中含有部分非晶体结构.在LHAGC谱图中,2θ为22.10°、24.94°、31.77°、45.00°处的衍射峰,与LaCl3 · 7H2O 标准谱图(PDF00-003-0069)位置和强度基本吻合,由此说明部分镧是以LaCl3 · 7H2O晶态结构存在.谱图中没有发现铝化合物的衍射峰,可能是因为铝化合物以无定型形态存在于样品中.
 |
| 图 2 NaA和LHAGC的XRD图谱 Fig. 2 XRD patterns of NaA and LHAGC |
图 3为LHAGC与NaA的扫描电镜图.图 3a显示的LHAGC表面呈现凹凸不平,疏松多孔.而图 3b NaA表面紧密,光滑,孔隙率不高.这说明凝胶聚合作用能改变腐殖酸钠的形貌,使凝胶复合物疏松多孔,同时比表面积得到进一步的扩大.
 |
| 图 3 NaA和LHAGC的SEM图(×5000) Fig. 3 SEM images of LHAGC and NaA(×5000) |
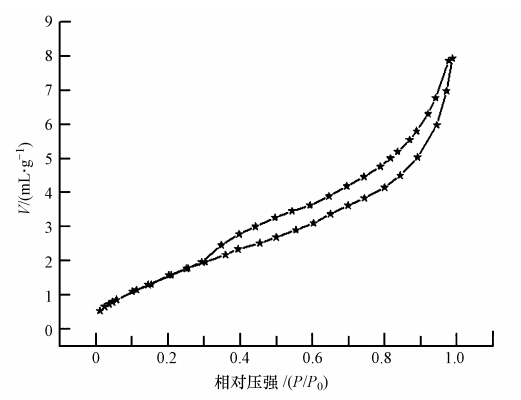
图 4示出了3种原料组成NaA,NaA+AlCl3,NaA+AlCl3+La(NO3)3(LHAGC)分别制得的吸附剂的FTIR谱图.从图 4可知,NaA和NaA+AlCl3为原料的吸附剂的谱图没有明显的变化,Al3+与NaA之间没有共价键和配位键的作用.在LHAGC的红外光谱图中,3675 cm-1(O—H伸缩振动峰)处的特征峰消失,表明La3+与NaA上的O—H发生了络合反应;在1424 cm-1(羧酸盐的对称伸缩振动峰)和1610 cm-1(羧酸盐反对称伸缩振动峰)处的特征峰强度减弱,可能是因为发生离子交换所致;在1012 cm-1(C—OH伸缩振动峰)和872 cm-1(苯环取代吸收峰)处的特征峰强度增强,可能是因为La3+与NaA形成了配位键引起的.
 |
| 图 4 LHAGC与NaA的FTIR光谱 Fig. 4 FTIR spectrums of NaA and LHAGC |
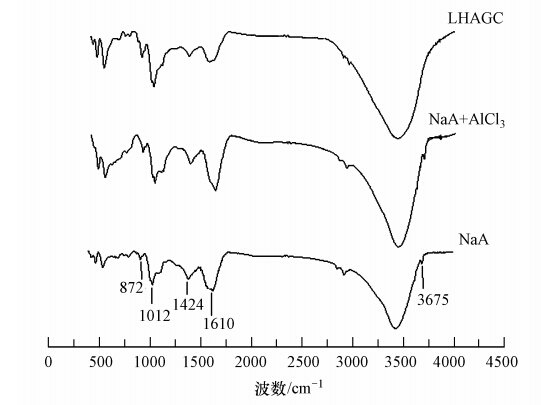
在温度为25 ℃的条件下,LHAGC以10 g · L-1的投加量分别处理不同质量浓度的F-模拟废水(12~250 mg · L-1)进行吸附试验,所得的吸附等温线如图 5所示,将试验数据用Langmuir和Freundlich等温吸附模型进行处理,所得的结果如表 1所示.
 |
| 图 5 LHAGC对F-的吸附等温线 Fig. 5 FTIR spectrums of NaA and LHAGC |
由表 1中可以看出,在试验质量浓度范围内,Langmuir等温吸附模型和Freundlich等温吸附模型均能较好地拟合LHAGC对F-的吸附行为,其中Langmuir等温吸附模型拟合效果更好.用Langmuir等温吸附方程计算出的Q0值为219.30 mg · g-1,远远高出目前文献所报道的一些氟吸附剂的饱和吸附容量.此外,Freundlich常数1/n为0.94<1,说明吸附过程为优惠型吸附,吸附反应较易进行(贾旭等,2011;McKay et al., 1998).这是因为LHAGC不仅可以对F-进行表面吸附,又可以利用羟基、羧基对F-进行氢键吸附.此外,LHAGC含有大量的铝和镧,可对水中F-进行化学吸附,从而突显出LHAGC对F-吸附的竞争优势.
| 表1 LHAGC对F-吸附等温线模型参数 Table 1 Isotherm model parameters for the adsorption of fluoride on LHAGC sample |
为研究吸附剂对F-的吸附行为,在温度为25 ℃的条件下,LHAGC以10 g · L-1的投加量处理初始质量浓度为20 mg · L-1的F-模拟废水,对其吸附过程的动力学进行了测定,结果如图 6所示.
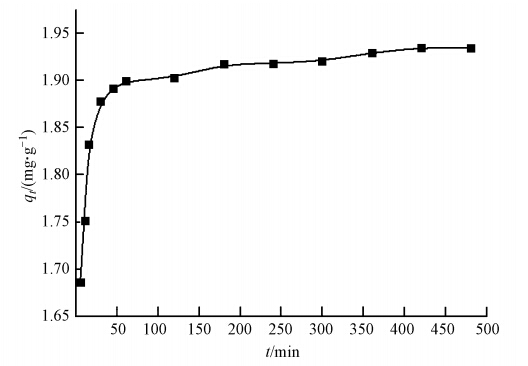 |
| 图 6 吸附时间对F-吸附容量的影响 Fig. 6 Influence of contact time on fluoride adsorption by LHAGC |
由图 6可以看出,前50 min LHAGC 对F-的吸附速率急剧增加,此时的吸附量能达饱和吸附量97%.当趋于平衡点时,吸附速率减慢.出现这种现象是因为在吸附的初始阶段溶液中的F-浓度高,且LHAGC具有大量的活性吸附位点,吸附推动力大,导致吸附速率快.随着溶液中F-浓度降低,同时LHAGC的活性吸附位点被占据,吸附推动力减小,因而吸附速率减慢(赵梦华等,2012).
为更进一步了解LHAGC对F-的吸附速率控制步骤,将试验数据进行准一级动力学方程,准二级动力学方程和颗粒内扩散方程拟合.
准一级动力学方程和准二级动力学方程表达式为(Ho,2004;Ho and McKay, 1999):
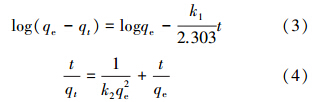
颗粒扩散速率方程:

准一级动力学方程与准二级动力学方程的拟合参数见表 2.从表 2中可以看出拟合的准二级动力方程的R2达到0.9999,准一级动力学方程的R2仅0.9026.这说明,准二级动力学方程能更好地描述整个吸附过程.而影响准二级动力学的主要因素是化学键的形成(Gupota and Bhattacharyya,2011;Bai et al., 2011),由此说明LHAGC对F-吸附是以化学吸附为主.
| 表2 LHAGC吸附F-的吸附动力学模型参数 Table 2 Kinetic models parameters for the adsorpion of fluoride on LHAGC sample |
用qt对t0.5作图,如果能得到一条通过原点的直线,则说明颗粒内扩散是控制吸附速率的唯一步骤.颗粒扩散速率方程对吸附数据拟合的结果如图 7.由图 7可知,LHAGC吸附剂的颗粒内扩散曲线并没有通过原点,说明颗粒内扩散不是吸附速率控制的唯一步骤,即吸附速率受吸附和扩散等多方面的影响(Ayoob et al., 2008).
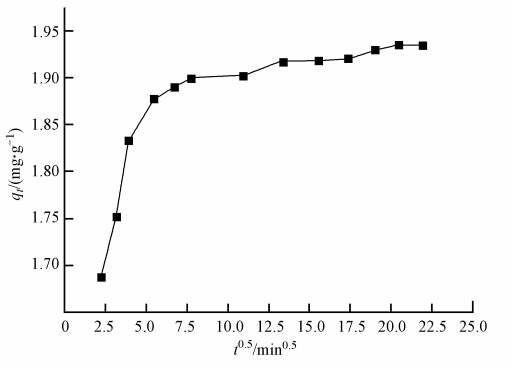 |
| 图 7 LHAGC吸附速率的内扩散模型拟合 Fig. 7 Fitting cure of intra-particle diffusion modeling for LHAGC adsorption ratio |
在不同pH条件下,将LHAGC以10 g · L-1投加量对初始浓度为20 mg · L-1的F-模拟废水进行吸附试验,同时为了进一步探讨LHAGC对F-的吸附作用机理,对吸附前后的F-溶液pH值进行了测定,结果如图 8所示.如图 8可见,在不同pH条件下,LHAGC对F-的吸附率呈现出不同的变化.当pH由1增大到5,F-吸附率由63.87%增加到93.03%;当pH由11增加到13,吸附率从84.73%下降到14.49%;造成这种现象可能是因为:在较低的pH的条件下金属离子溶出,或是pH过低,水中的F-倾向于与氢离子生成氟化氢,导致F-不能彻底从水中被去除.随着pH的升高,游离的OH-增多,与F-争夺吸附剂表面的吸附位点而导致吸附率降低;或是pH升高致使吸附剂表面带上了负电荷,对F-的静电吸附作用减弱.当pH在5~11范围内,吸附率都高于93%,最高能达到96.69%.表明LHAGC吸附剂适应的pH的范围宽泛,体现出潜在的应用价值.
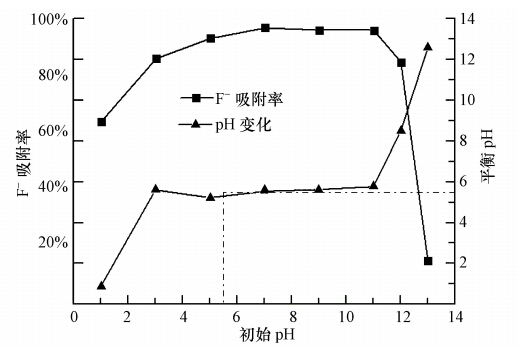 |
| 图 8 pH对吸附率的影响以及吸附前后的pH变化 Fig. 8 Effect of pH on fluoride adsorption efficiency and the variation of pH value of the F-solution before and after adsorption |
从图 8观察吸附前后pH的变化可知,吸附前F-模拟废水pH=1,吸附后pH基本没变化;吸附前F-模拟废水pH=3~11,吸附后pH基本维持到5.5左右,吸附率也相对较高;吸附前F-模拟废水pH大于11时,吸附后pH略有降低.这说明,在pH达到5.5时,LHAGC对H+或OH-几乎没有吸附能力.此时,吸附剂稳定层与扩散层的电位也几乎为0,吸附剂接近pH的zeta零电位点.表明,LHAGC的zeta零电位点pH为5.5,低于传统吸附剂γ-Al2O3的零电位点9.2,zeta零电位pH的降低,有利于提高吸附剂对阴离子的吸附能力,增加吸附容量.这也可推测,当体系pH低于5.5时,LHAGC对F-的吸附以静电吸附或氢键吸附为主,当体系pH高于9时 LHAGC主要是表面吸附和化学吸附为主.
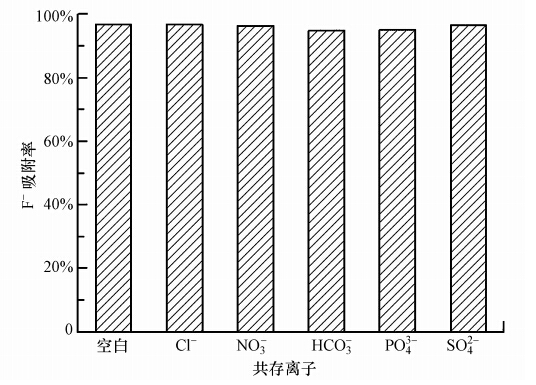
3.3.2 共存离子在工业含氟废水中,往往含有很多其他阴离子,比如: Cl-、NO3-、HCO3-、PO3-4和SO42-.这些共存离子可能会对吸附剂的吸附除氟性能产生影响.在F-初始浓度为20 mg · L-1,上述阴离子浓度都为300 mg · L-1的条件下,LHAGC的吸附除氟效果结果如图 9所示.从图 9可以看出,在试验的浓度范围内,Cl-的存在对F-吸附率没有影响.其他共存离子NO3-,HCO3-,PO3-4和SO42-的存在使得对F-吸附率略有下降.其中NO3-,SO42-的存在使吸附率下降不到1%,可以认为对F-的吸附率影响很小; HCO3-和PO3-4的存在使吸附率下降了2%,对F-的吸附率产生了一定的负作用.造成这种差异可能是因为共存离子PO3-4与铝具有一定的亲和力,它会与F-竞争结合HLAGC吸附剂表面的吸附位点; HCO3-3的加入可促使水中OH-增加,OH-与F-发生了竞争吸附.即使如此,HCO3- 或PO3-4以F-质量浓度的15倍存在时,F-吸附率仍能达到94%以上,从而表明LHAGC抗干扰能力强,在处理含氟废水中的应用具有非常乐观的应用前景.
 |
| 图 9 共存离子对吸附率的影响 Fig. 9 Effect of co-existing anions on fluoride adsorption efficiency |
一种具有竞争力的吸附剂除了吸附容量高外,还应具有重复利用性.分别取1 g吸附有F-的LHAGC固体(吸附量为201.5 mg · g-1),分别用不同浓度的NaOH再生溶液50 mL浸泡6 h,分别测定再生溶液中F-浓度,计算脱氟率结果如表 3所示.
| 表3 再生剂对LHAGC脱氟效果的影响 Table 3 Effects of desorption reagent on desorption of F- from LHAGC |
由表 3可以看出,用浓度为10-1 mol · L-1的NaOH溶液作为脱氟试剂,脱附效果最好,当NaOH溶液浓度超过10-1 mol · L-1时,会有腐殖酸钠析出,此时溶液呈黄棕色,不利于吸附剂的回收利用.因此,选择浓度为10-1 mol · L-1的NaOH溶液作为脱氟试剂.试验时发现,若用经过10-1 mol · L-1 NaOH溶液浸泡脱氟后的LHAGC重新除氟,几乎没有除氟效果,原因在于脱氟后的LHAGC表面残留有大量OH-,重新除氟时,虽然部分OH-返回溶液中,但大部分都存留于吸附剂表面,阻碍了F-的重新吸附.因此,吸附剂表面pH成为再生是否有效的关键.笔者用AlCl3作为pH调节剂,将脱氟后的吸附剂表面pH值调节到合适的数值,保证再生后吸附剂的除氟能力.
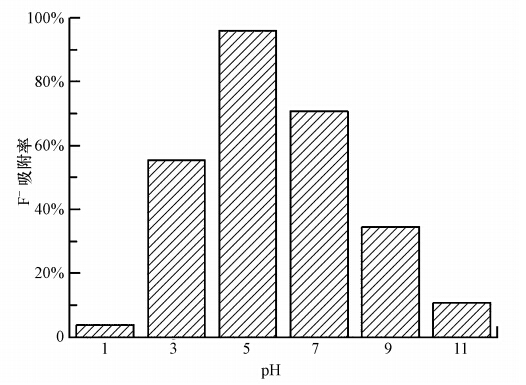
取6 g吸附饱和的LHAGC湿颗粒,于100 mL 10-1 mol · L-1 NaOH水溶液浸泡6 h,滤出颗粒,投加到100 mL蒸馏水中,用AlCl3调节水中的pH,当水中pH分别稳定为1、3、5、7、9、11时,滤出颗粒,烘干后进行除氟试验,试验结果见图 10.从图 10可以看出,当再生液的pH为5时,再生吸附剂对初始浓度为25 mg · L-1的含氟废水F-吸附率为96.08%,而pH过低或过高时,再生吸附剂的除氟能力都急剧降低.原因在于,当再生吸附剂表面pH过低(<5),重新除氟时,再生吸附剂上的金属离子会溶出,导致除氟效果降低;而当pH过高(>5)时,再生吸附剂表面被大量OH-占据,F-与OH-竞争位点而导致除氟效果变差;当再生吸附剂表面pH为5时,一方面AlCl3中的铝易水解沉积在再生吸附剂表面,增加了除氟能力;另一方面,在此种情况下,再生吸附剂表面的OH-含量不高,对F-的竞争力不强,F-易于从水中扩散到再生吸附剂表面进行吸附,产生了较好的除氟效果.由此可以得出,吸附饱和的LHAGC经浓度为10-1 mol · L-1的NaOH溶液脱氟后,重新置于蒸馏水中,用AlCl3稳定混合液pH到5,过滤,烘干后可以得到较好的再生效果.
 |
| 图 10 再生过程中pH对LHAGC再生除氟效果的影响 Fig. 10 Effect of pH on the fluoride adsorption efficiency of LHAGC during the regeneration process |
为探讨再生过程中吸附剂的损失和耐用性,设计了如下试验.取10 g LHAGC干颗粒,放入含氟模拟废水中吸附至饱和后,将湿颗粒于200 mL 10-1 mol · L-1 NaOH水溶液浸泡6 h,滤出颗粒,将滤出颗粒平均分为两份,其中1份直接烘干后称重,另1 份颗粒投加到100 mL蒸馏水中,用AlCl3调节水中的pH为5,滤出,烘干后称重.经计算,其损失率分别为10%和6%.可以看出,再生过程中经AlCl3调节pH后的吸附剂损失率较低,是因为部分铝发生水解并附着在吸附剂的表面,增加了吸附剂的质量.
将吸附饱和的LHAGC颗粒按上面的再生方法再生后对初始浓度为25 mg · L-1 F-模拟废水进行吸附试验,重复使用5次,其F-吸附率分别为96.08%\,92.98%\,88.14%\,73.97%\,68.50%.由此可以得出,LHAGC在重复使用5次后,仍能将初始浓度为25 mg · L-1的含氟废水降至10 mg · L-1以下,表明LHAGC吸附F-的效果稳定.
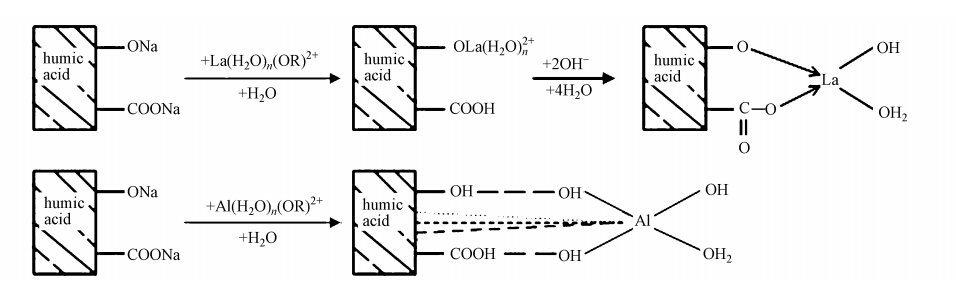
3.5 LHAGC吸附剂的形成机理初步分析前面对LHAGC通过IR\,XRD及SEM表征结果可以初步推测出LHAGC吸附剂的形成机理.原理示意图见图 11.
 |
| 图 11 La-腐殖酸/Al2O3凝胶复合物形成的化学原理示意图 Fig. 11 Chemical mechanism about the formation of La-Humic Acid / Al2O3 gels complex |
腐殖酸钠溶液是一种亲水性的胶体,当加入到pH较低的Al3+\,La3+溶液中时,一方面La3+通过腐殖酸上的羧基,羟基形成配位键而交联,让腐殖酸产生胶凝而聚集;另一方面,溶液中的Al3+不断发生水解,缩聚反应,Al3+水解时产生的质子不断与腐殖酸分子上的羧基、羟基结合,促进铝盐水解聚合,同时也加剧了腐殖酸的胶凝,铝盐的水解缩聚产物与胶凝的腐殖酸共同聚集,在一定的条件下生成La-腐殖酸/Al2O3凝胶复合体.如图所示.由前面IR图可知,La3+主要通过形成配位键与腐殖酸钠结合,而Al3+与腐殖酸钠之间看不出共价键和配位键的作用,可能是通过分子间的氢键作用,π-π堆积作用,给体-受体相互作用,疏水作用等结合的,虽然单个非共价键的键能较小,结合常数较低,但是这些分子间弱相互作用力可在一定条件下发生加合与协同作用,形成有一定方向性和选择性的强作用力(沈家胞和孙俊奇,2004),足以使得腐殖酸与Al2O3之间结合很牢固,这使得LHAGC具有较高的水稳定性.
4 结论(Conclusions)1)相对于NaA而言,所制备的LHAGC具有更高的孔隙率,更大的比表面积. LHAGC中铝主要以无定型的形态存在,在胶体聚合时La3+不仅与NaA形成了配位键分子和离子交换,还与NaA中的—OH发生了络合反应.
2)所制备的LHAGC对水中F-的吸附过程可用Langmuir等温方程和准二级动力学方程描述,用Langmuir等温方程计算出的最大吸附量为219.30 mg · g-1,F-在LHAGC上的吸附主要体现出化学吸附行为,LHAGC对F-的吸附过程复杂,颗粒内扩散可以控制吸附速率,但内扩散并非唯一的控制步骤,LHAGC对F-吸附过程还会受其它动力学过程的影响.
3)所制备的LHAGC用于水中F-的吸附处理时,其适宜的pH值为5~11,水溶液中SO42-、NO3-和Cl- 对 F-的去除没有影响,而HCO3-或PO3-4 的存在使得F-的吸附率略微下降.
4)吸附饱和的LHAGC在用10-1 mol · L-1 NaOH水溶液脱氟后,重新置于蒸馏水中,用AlCl3稳定混合液pH到5,过滤.烘干后可以得到较好的再生效果.重复使用5次后,仍能将浓度为25 mg · L-1 F-模拟废水降至10 mg · L-1以下,突显出LHAGC稳定的吸附F-效果.
| [1] | Ayoob S, Gupta A K, Bhakat P B, et al. 2008. Investigations on the kinetics and mechanisms of sorptive removal of fluoride from water using alumina cement granules [J]. Chemical Engineering Journal, 14(1/3): 6-14 |
| [2] | Bai J R, Wang Q, Qin H, et al. 2011. Kinetics and thermodynamics of adsorption of heavy metal ions onto fly ash from oil shale[J]. Journal of Fuel Chemistry and Technology, 39(5): 378-384 |
| [3] | 国家环保局《水和废水监测分析方法》编委会. 1998. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社. 296-300 |
| [4] | Gupta S S, Bhattacharyya K G. 2011. Kinetics of adsorption of metal ions on inorganic materials: a review[J]. Advances in Colloid and Interface Science, 162(1/2): 39-58 |
| [5] | Ho Y S, McKay G. 1999. Pseudo-second order model for sorption processes[J]. Process Biochemistry, 34(5): 451-465 |
| [6] | Ho Y S. 2004. Citation review of Lagergren kinetic rate equation on adsorption reactions [J]. Scientometrics, 59(1): 171-177 |
| [7] | Huo Y K, Ding W M, Huang X, et al. 2011. Fluoride removal by lanthanum alginate bead: adsorbent characterization and adsorption mechanism[J]. Chinese Journal of Chemical Engineering, 19(3): 360-370 |
| [8] | 贾旭, 彭新晶, 张凤君, 等. 2011. 改性黏土除氟剂的吸附作用及其动力学研究[J]. 中南大学学报(自然科学版), 42(5): 1482-1488 |
| [9] | 刘咏, 刘娅, 洪利, 等. 2013. 金属离子-腐殖酸复合凝胶的制备及其对氟吸附研究[J]. 四川大学学报(工程科学版), 45(6): 188-195 |
| [10] | Mahramanlioglu M, Kizilcikli I, Bicer I O. 2002. Adsorption of fluoride from aqueous solution by acid treated spent bleaching earth [J]. Journal of Fluorine Chemistry, 115(1): 41-47 |
| [11] | McKay G, Blair H S. Gardner J R. 1982. Adsorption of dyes on chitin. Ⅰ. Equilibrium studies[J]. Journal of Applied Polymer Science, 27(8): 3043-3057 |
| [12] | 沈家胞, 孙俊奇. 2004. 超分子科学研究进展[J]. 中国科学院院刊, 19(6): 420-424 |
| [13] | Sit A D. 2001. Factors affecting sorption of organic compounds in natural sorbent /water systems and sorption coefficients for selected pollutants. A review[J]. Journal of Physical Chemical Reference Data, 30(1): 187-439 |
| [14] | 徐传海. 2009. 含氟废水治理技术研究进展[J]. 石化技术, 16(2): 57-60 |
| [15] | 姚瑞华, 孟范平, 张龙军, 等. 2009. 负载金属镧的壳聚糖对氟离子的吸附动力学[J]. 离子交换与吸附, 25(4): 319-326 |
| [16] | 张超杰, 周琪. 2002. 含氟水治理研究进展[J]. 给水排水, 28(12): 26-29 |
| [17] | 赵梦华, 霍亚坤, 丁文明, 等. 2012. 铁-镧复合氧化物颗粒吸附剂除氟特性的研究[J]. 北京化工大学学报(自然科学版), 39(6): 90-94 |
| [18] | Zhou Y M, Yu C X, Shan Y. 2004. Adsorption of fluoride from aqueous solution on La3+-impregnated cross-linked gelatin[J]. Separation and Purification Technology, 36(2): 89-94 |
 2015, Vol. 35
2015, Vol. 35


