随着生物处理技术在全世界污水处理厂的广泛应用,剩余污泥大量产生,其处理处置费用也越来越高,剩余污泥的处理与处置问题已成为污水处理厂所面临的日益严峻的挑战.目前,国内外污泥减量技术包括(Ratsak et al., 2006):强化微型动物捕食污泥的污泥减量技术、基于微生物代谢解偶联的污泥减量技术、污泥溶胞技术及其他利用生物的污泥减量技术.投加解偶联剂和在高浓度溶解氧下的解偶联污泥减量技术存在成本大、能耗高、运输成本大的缺点;污泥溶胞技术采用超声波、微波热解和臭氧氧化使细胞破碎,内含物被微生物利用,从而使系统的污泥得到减量,但此技术成本高,会使出水水质变差,特别是出水中N、P含量高.
研究发现,环节动物门寡毛纲颤蚓科环节蠕虫(俗称水蚯蚓)能大量摄食污泥,其通过摄食活性污泥中的细菌和污泥,在体内矿化从而减少系统中的剩余污泥产量(Zhao et al., 2012).该技术由于其能耗低,不产生二次污染,作为一种生态工程技术近年来受到人们的关注,并已在城镇污水处理厂中成功应用(Ratsak,2001; Lou et al., 2011a).剩余污泥中不可避免的会含有各种重金属,尤其是工业废水处理系统的剩余污泥中,重金属含量高、种类多,给剩余污泥的处理增加了难度.生物吸附法因具有成本低、效率高等特点,近年来已成为处理重金属的一种重要方法(Horsfall et al., 2003),常见的生物吸附剂包括藻类、真菌和细菌等(Fan et al., 2008; Kratochvil et al., 1998; Göksungur et al., 2005; Sağ et al., 2000).有研究表明(申为宝等,2008),土壤中的蚯蚓也可以通过吸附对重金属生物有效性产生影响.是否可将水蚯蚓应用于这些含重金属的剩余污泥的减量,以及水蚯蚓是否可以通过吸收并将重金属持留在体内而使废水中的重金属浓度降低值得我们探索.在众多重金属中,铬及其化合物因具有高毒性而被列为中国水环境优先污染物黑名单(周文敏等,1991),且在制革、电镀和染料的制造等过程中均会排放含铬废水.Cr在自然界中主要以Cr(Ⅵ)和Cr(Ⅲ)两种形态存在,其中,Cr(Ⅲ)不容易迁移且毒性很低,而Cr(Ⅵ)在环境中易溶于水、迁移能力强且毒性为Cr(Ⅲ)的100倍以上.当水蚯蚓存在于含铬的废水处理系统中时,如能通过吸持铬使水中铬浓度降低,这无疑将有利于水蚯蚓在污水处理中的应用.
因此,本文以水蚯蚓为研究对象,分别考察主要运行参数包括水中六价铬初始浓度(C)、水蚯蚓投加量(M)、pH和温度(T)对水蚯蚓吸持水中六价铬性能的影响,以期探明最佳运行工艺参数,为水蚯蚓在含铬废水处理系统中的应用提供理论基础.
2 试验材料与方法(Materials and methods) 2.1 水蚯蚓试验所用水蚯蚓捕捞自上海黄浦江,经鉴定为霍甫水丝蚓(Limnodrilus hoffmeisteri)和正颤蚓(Tubifex tubifex)的混合种颤蚓科蠕虫,比例为2 ∶ 1.
2.2 试剂重铬酸钾用于配制铬液,氢氧化钠、盐酸用于调节pH值,所用试剂均为分析纯.
2.3 试验仪器与设备pH采用FE20K精密pH计测定;水蚯蚓湿重和干重采用EL104电子天平称量;DO采用Tengine-EDO溶解氧仪测定;水温用WNG-01温度计测量;六价铬浓度用ICE3300原子吸收分光光度计及XSeries II电感耦合等离子体质谱仪(ICP-MS)测定.
2.4 试验方法 2.4.1 水蚯蚓干湿比的测定试验过程中投加的水蚯蚓以湿重计,试验结果以干重进行表达,因此,需测定水蚯蚓的干湿比.挑取适量颜色鲜红、活性强的水蚯蚓,用清水反复冲去表面污泥后,放于带有小孔的铝箔纸上,铝箔纸下面放置吸水纸巾吸去水蚯蚓表面的水分,吸干后称量,计为湿重.然后,将水蚯蚓于烘箱内103~105 ℃条件下烘至衡重,称量,计为干重.作干重-湿重关系图,并对数据进行线性拟合,其拟合方程的斜率即为干湿重比.
2.4.2 初始铬浓度对水蚯蚓吸持六价铬的影响为保证水蚯蚓在试验过程中存活,先进行急性毒性试验,根据急性毒性试验结果,六价铬浓度设置6个梯度,分别为0(对照组)、SC(安全浓度)、96 h LC50、72 h LC50、48 h LC50、24 h LC50,即0、0.1、0.5、1.0、2.5、8.0 mg · L-1.其他试验条件为:M=4.0 g(湿重),pH=7.0±0.1,T=(22±1)℃.
2.4.3 pH对水蚯蚓吸持六价铬的影响为保证水蚯蚓的正常生命活动,不使pH对水蚯蚓造成胁迫,根据本试验组前期研究结果(Lou et al., 2011b;楼菊青等,2013),试验pH范围设为6.0~8.0,试验设置5个梯度,即6.0±0.1、6.5±0.1、7.0±0.1、7.5±0.1、8.0±0.1.其他试验条件为:C0=1.0 mg · L-1,M=4.0 g(湿重),T=(22±1)℃.
2.4.4 水蚯蚓投加量对其吸持六价铬的影响设置5个梯度,即水蚯蚓投加量分别为1.0、2.0、3.0、4.0、5.0 g(湿重),其他试验条件为:C0=1.0 mg · L-1,pH=7.0±0.1,T=(22±1)℃.
2.4.5 温度对水蚯蚓吸持六价铬的影响温度设置为(10±1)、(15±1)、(20±1)、(25±1)、(30±1)℃,其他试验条件为:C0=1.0 mg · L-1,M=4.0 g(湿重),pH=7.0±0.1.
以上试验均在200 mL烧杯中进行,试验溶液为100 mL,每个浓度设3个平行,每隔4 h取样1次.对照组试验条件:试验溶液为蒸馏水,即C0=0 mg · L-1,pH=7.0±0.1,M=4.0 g(湿重),T=(22±1)℃.试验期间若对照组水蚯蚓死亡数超过10%,则试验结果不能采用.
2.4.6 各指标计算方法吸持速率、吸持率、单位质量吸持量分别按以下公式计算:
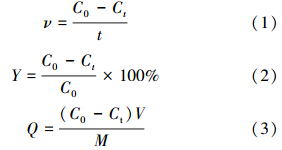
式中,ν为吸持速率(μg · h-1 · L-1);t为反应时间(h);Y为金属离子吸持率;C0为金属离子初始浓度(mg · L-1);Ct为反应后溶液中金属离子浓度(mg · L-1);Q为单位质量吸持量,即吸持容量(mg · kg-1),指单位质量的生物吸持的金属离子质量;V为溶液体积(L);M为投加的生物量(g).
3 试验结果与讨论(Results and discussion) 3.1 水蚯蚓干湿比本试验测得水蚯蚓的干湿比为15.6%.曾有报道(Egeler et al., 1997),颤蚓的干湿比为0.161±0.015,与本试验所测值略有差别.Elissen(2007)曾提到,不用种类的水蚯蚓干湿比不同,颤蚓和夹杂带丝蚓的干湿比分别为17%和13%,和本试验略有不同,原因可能是所选试验对象在体长、直径和生物体积上存在差异(Elissen,2007;Lafont,1987).
3.2 初始铬浓度对水蚯蚓吸持六价铬的影响不同初始浓度Cr6+被水蚯蚓吸持后随时间的变化如图 1所示,在30 h试验时间里,水中六价铬浓度呈现良好的线性下降趋势.如表 1所示,除了0.5 mg · L-1浓度组外,其余各组R2均大于0.95.从表 1还可以看出,水蚯蚓对六价铬的吸持速率与初始浓度有关,Cr6+浓度越大,水蚯蚓对其吸持速率就越快,当浓度从0.1 mg · L-1增加到8.0 mg · L-1时,吸持速率从3.0 μg · h-1 · L-1增大到72.5 μg · h-1 · L-1.图 1中只给出了前30 h的Cr6+浓度变化值,在试验中,30 h后六价铬下降趋势均逐渐趋于平缓,这表明水蚯蚓对六价铬的吸持已经达到平衡.但从六价铬的吸持率来看(图 2),其变化趋势却与吸持速率相反,当六价铬浓度为0.1 mg · L-1时,吸持率最大,达89.16%,而当六价铬浓度为8.0 mg · L-1时,吸持率最低,仅为27.35%;在低浓度条件下,大部分六价铬能与水蚯蚓表面的吸持位点相结合,因而吸持率较高,但当初始浓度增大到一定值后,由于吸持位点饱和导致吸持率降低;而且高浓度重金属离子对细胞具有毒害作用,水蚯蚓自身会通过自我防护机制的调节来抑制吸收,从而导致吸持率降低,这与王家强(2010)的研究结论一致.从图中还可得知,随着Cr6+浓度的增加,水蚯蚓对六价铬的单位吸持量逐渐增大,初始Cr6+浓度对吸持容量影响很大,Cr6+初始浓度从0.1 mg · L-1增大到8.0 mg · L-1,单位质量吸持量从14.4 mg · kg -1(以干重计)增加到312.7 mg · kg -1.这是因为当Cr6+浓度增大时,导致液相和固相之间的浓度梯度增大,使吸持驱动力增加,从而使单位质量吸持量增加(King et al., 2008).
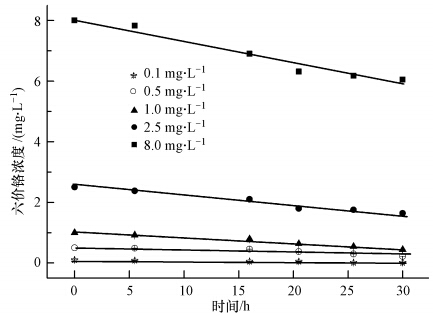 |
| 图 1 不同Cr6+初始浓度下水蚯蚓对六价铬的吸持(数据为3个平行的平均值±标准差) Fig. 1 Adsorption of Cr(Ⅵ)by worms in different initial Cr6+ concentrations |
| 表 1 不同Cr6+初始浓度下水蚯蚓对六价铬的吸持速率 Table 1 Adsorption rate of Cr(Ⅵ)by worms in different initial Cr6+concentrations |
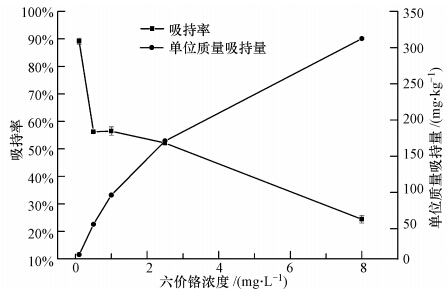 |
| 图 2 不同Cr6+初始浓度下水蚯蚓对六价铬的吸持率及单位质量吸持量 Fig. 2 Adsorption efficiency and amount at different initial Cr6+ concentrations |
pH会影响溶液中金属离子的溶解性和溶液中质子的浓度,因此,pH是影响溶液中重金属吸持的一个重要因素(Fan et al., 2008; Gong et al., 2005).pH对水蚯蚓吸持六价铬的影响如图 3所示,随着试验时间的增加,水中六价铬浓度均下降,并在20 h之后下降趋势趋于平缓.当pH从6.0增加到8.0,水蚯蚓对六价铬的吸持速率随pH的上升而提高(表 2).造成此现象的主要原因是金属离子吸持与不同pH条件下的电荷有关.孙卫玲等(2001)证实,生物膜上金属氧化物和有机质等具有一定数量的电荷,低pH时电荷为正,不利于吸持金属离子,反之,则有利于吸持.因此,当pH升高时,水蚯蚓对六价铬的吸持速率加快.
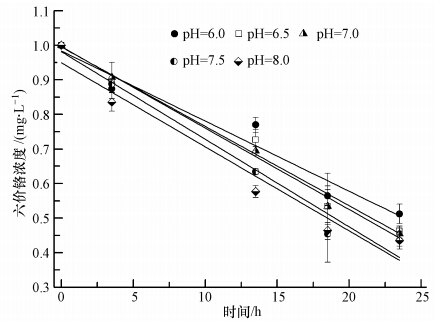 |
| 图 3 不同pH条件下水蚯蚓对六价铬的吸持 Fig. 3 Adsorption of Cr(Ⅵ)by worms in different pHs |
| 表 2 不同pH条件下水蚯蚓对六价铬的吸持速率 Table 2 Adsorption rate of Cr(Ⅵ)by worms in different pHs |
图 4揭示了水蚯蚓对六价铬的吸持率和单位质量吸持量随pH的变化规律.从图中可看出,二者随pH的变化趋势一致,当pH从6.0增加到7.5时,吸持率和单位质量吸持量均随pH值的上升而增大,当pH值大于7.5时,二者均不再上升,吸持达到平衡.梁郁强等(2004)研究发现,当pH在2~7时,随着pH升高,活性污泥对六价铬的吸持率随之增大,但pH在7~11范围内,随着pH增大反而降低.这是由于重金属离子在碱性环境下易水解生成相应的氢氧化物,在弱碱性环境下这些新生成的沉淀物以极小的微粒形式沉积在细胞表面,从而阻碍了水蚯蚓对重金属的吸持(程永清等,2009).
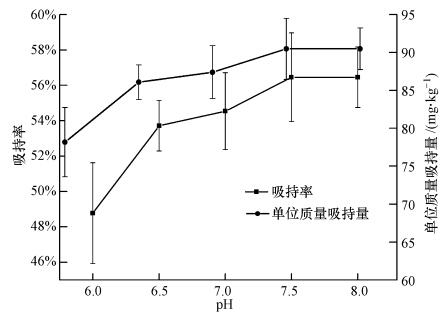 |
| 图 4 不同pH条件下水蚯蚓对六价铬的吸持率及单位质量吸持量 Fig. 4 Adsorption efficiency and amount of Cr(Ⅵ)for worms at different pH values |
不同投加量的水蚯蚓对六价铬的吸持情况如图 5所示.当质量分别为1.0、2.0、3.0、4.0、5.0 g(湿重)的水蚯蚓暴露于浓度为1.0 mg · L-1的六价铬溶液中时,随着水蚯蚓质量的增加,水中六价铬浓度的下降速率逐渐加快,且浓度呈良好的线性下降趋势(R2=0.9870~0.9961);且从表 3中可看出,随着水蚯蚓质量的增加,对六价铬的吸持速率逐渐增大.从图 6可以发现,随着水蚯蚓投加量的增加,水蚯蚓对六价铬的吸持率也增大.这是因为水蚯蚓增多,使吸持总表面积增大,吸持位点增多,从而使吸持率升高(King et al., 2008).但图 6也显示,单位质量水蚯蚓对六价铬的吸持量随着投加量的增加反而减 少,水蚯蚓投加量从1.0 g增加到5.0 g,单位质量吸持量从61.1 mg · kg-1下降到23.6 mg · kg-1.这显然与以活性污泥作为生物吸附剂的研究结果不同(Utkiger et al., 2000),这是因为水蚯蚓不同于活性污泥,水蚯蚓在投加量较大且受到外界刺激时会抱团,质量越大抱的团越大,从而使吸持剂的有效表面积增加有限(王开峰等,2010),单位质量参与吸持的面积反而降低;另外,过量水蚯蚓间参与吸持的相邻活性基团彼此干扰对方的吸持(张德敏等,2008).可见,在实际应用中水蚯蚓的投加量并不是越多越好.
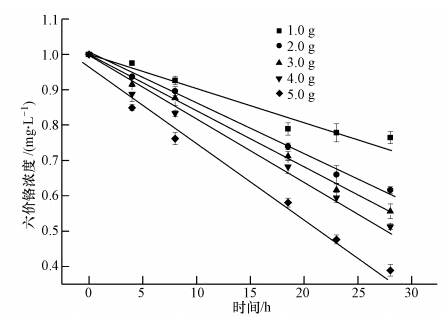 |
| 图 5 不同质量的水蚯蚓对六价铬的吸持 Fig. 5 Adsorption of Cr(Ⅵ)for different quantities of worms |
| 表 3 不同质量下水蚯蚓对六价铬的吸持速率 Table 3 Adsorption rate of Cr(Ⅵ)for different quantities of worms |
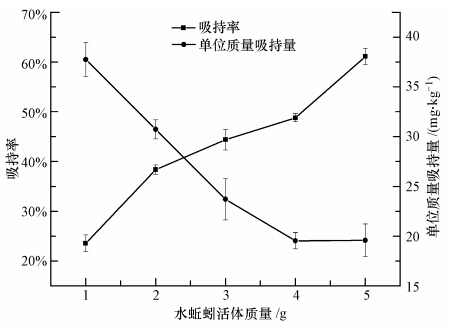 |
| 图 6 不同投加量的水蚯蚓对六价铬的吸持率及单位质量吸持量 Fig. 6 Adsorption efficiency and amount of Cr(Ⅵ)for different quantities of worms |
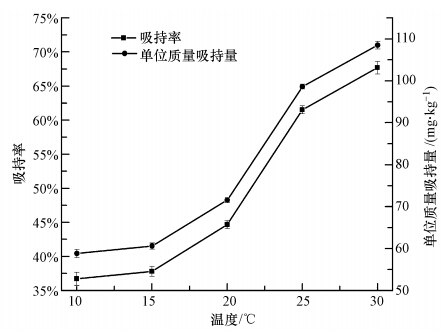
水蚯蚓吸持六价铬与水蚯蚓的活性及代谢有关,而温度是影响水蚯蚓活性及代谢的关键因素之一.温度对水蚯蚓吸持六价铬的影响如图 7所示,各温度对应的吸持速率见表 4.当把4.0 g水蚯蚓暴露于1.0 mg · L-1的六价铬液中,水中六价铬浓度的变化因温度的不同而有不同的趋势.当温度在10~20 ℃范围内时,水蚯蚓的新陈代谢较慢,此温度范围内水蚯蚓的呼吸速率较低,活性也相应较低(楼菊青等,2013),此时,水蚯蚓对六价铬的吸持速率较为缓慢;而当温度从20 ℃升高到25 ℃时,吸持速率明显加快,25 ℃时的吸持速率分别为10 ℃与15 ℃时吸持速率的2.24、1.81倍,当温度从10 ℃上升到30 ℃,吸持速率从11.8 μg · h-1 · L-1上升到43.0 μg · h-1 · L-1.从图 8也可看出,吸持率和单位质量水蚯蚓吸持量的变化趋势与吸持速率的变化相一致,10~20 ℃范围内较低,20 ℃后显著升高.有研究表明(诸晖等,2008),此温度为水蚯蚓最适生长温度;但当温度达到30 ℃时,虽然对六价铬的吸持速率很快,但水蚯蚓在六价铬和高温的双重胁迫下,15 h后水蚯蚓大量死亡.吸持速率较高的原因为水蚯蚓为减少高温带来的胁迫,加快新陈代谢速率,抗氧化酶系统启动,导致六价铬从表皮进入到水蚯蚓体内的速率加快.因此,水蚯蚓吸持不同于普通的物理化学吸持,由于受新陈代谢影响,水蚯蚓活体对六价铬的吸持速率会随温度的升高而加快.综合考虑水蚯蚓的生长情况,在实际应用中可将污水处理系统的温度控制在25 ℃.
| 表 4 不同温度下水蚯蚓对六价铬吸持速率 Table 4 Adsorption rate of Cr(Ⅵ)by live worms at different temperatures |
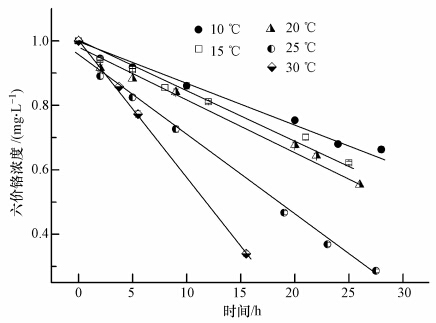 |
| 图 7 不同温度下水蚯蚓对六价铬的吸持 Fig. 7 Adsorption of Cr(Ⅵ)by live worms at different temperatures |
 |
| 图 8 不同温度下水蚯蚓对六价铬的吸持率及单位质量吸持量 Fig. 8 Adsorption efficiency and amount of Cr(Ⅵ)of worms at different temperatures |
1)在研究浓度范围内,水蚯蚓对六价铬的吸持速率随铬浓度的增大而加快,Cr6+初始浓度从0.1 mg · L-1增加到8.0 mg · L-1,吸持速率从3.0 μg · h-1 · L-1增大到72.5 μg · h-1 · L-1,单位质量吸持量从14.4 mg · kg-1(以干重计)增加到312.7 mg · kg-1;但六价铬的吸持率变化趋势却相反,从Cr6+初始浓度为0.1 mg · L-1时的89.16%下降到Cr6+初始浓度为8.0 mg · L-1时的27.35%.
2)当pH从6.0增加到8.0,水蚯蚓对六价铬的吸持速率随pH的上升而提高,吸持率和单位质量吸持量先明显增强,达到pH=7.5后逐渐趋于平衡,pH=8.0时,对应的吸持率和吸持量分别为56.45%和90.47 mg · kg-1(以干重计),在实际应用中可将系统的pH值控制在7.5.
3)水蚯蚓投加量从1.0 g(湿重)增加5.0 g,吸持速率从9.4 μg · h-1 · L-1提高到20.7 μg · h-1 · L-1,吸持率从23.6%上升到61.1%,而单位质量吸持量却随着水蚯蚓投加量的增加而减少,从61.1 mg · kg-1下降到23.6 mg · kg-1.
4)当温度在10~20 ℃范围内时,水蚯蚓对六价铬的吸持速率相对较慢,到25 ℃时,吸持速率明显加快,为25.4 μg · h-1 · L-1,吸持率和单位质量水蚯蚓吸持量的变化趋势与吸持速率的变化相一致,但当温度达到30 ℃,水蚯蚓会大量死亡,因此,在实际应用时建议将系统温度控制在20~25 ℃.
| [1] | 程永清,杨晶华,胡权刚. 2009.活性污泥对重金属离子的吸附研究[J].中国科技论文在线,4(9): 691-694 |
| [2] | Egeler P, Rombke J, Meller M, et al.1997. Bioaccumulation of lindane and hexachlobenzene by Tubificidsludgeworms (Oligochaeta) under standardised laboratory conditions[J]. Chemosphere, 35: 835-852 |
| [3] | Elissen H J H. 2007.Sludge reduction by aquatic worms in wastewater treatment: With emphasis on the potential application of Lumbriculusvariegatus. Netherlands,Wageningen University |
| [4] | Fan T,Liu Y G,Feng B Y,et al.2008.Biosorption of cadmium(II),zinc(II) and lead(II) by Penicillium simplicissimum: Isotherms,kinetics and thermodynamics[J].Journal of Hazardous Materials,160(2/3): 655-661 |
| [5] | Göksungur Y,Vren S,Güvenç U.2005.Biosorption of cadmium and lead ions by ethanol treated waste baker's yeast biomass[J].Bioresource Technology,96(1): 103-109 |
| [6] | Gong R M,Yi D,Liu H J,et al.2005.Lead biosorption and desorption by intact and pretreated Spirulina maxima biomass[J].Chemosphere,58(1): 125-130 |
| [7] | Horsfall M,Abia A A,Spiff A I.2003.Removal of Cu(II)and Zn(II) ions from wastewater by cassava (Manihot esculenta Cranz) waste biomass[J].African Journal of Biotechnology,2(10): 360-364 |
| [8] | King P,Rakesh N,Lahari S B,et al.2008.Biosorption of zinc onto Syzygium cumini L.: Equilibrium and kinetic studies[J].Chemical Engineering Journal,144(2): 181-187 |
| [9] | Kratochvil D,Volesky B.1998.Biosorption of Cu from ferruginous wastewater by algal biomass[J].Water Research,32(9): 2760-2768 |
| [10] | Lafont M.1987. Production of Tubificidae in the littoral zone of Lake Léman near Thonon-les-Bains: A methodological approach[J]. Hydrobiologia, 155: 179-187. |
| [11] | 梁郁强,贾宗剑,江凤仪.2004.活性污泥吸附重金属Cr6+的研究[J].环境技术,(1): 33-34 |
| [12] | Lou J Q,Sun P D,Guo M X,et al.2011a.Simultaneous sludge reduction and nutrient removal (SSRNR) with interaction between Tubificidae and microorganisms: a full-scale study[J].Bioresource Technology,102(24): 11132-11136 |
| [13] | Lou J Q,Guo M X,Chen M M.2011b.Studies on the effect of environmental factors on growth of Tubificidae. International Conference on Remote Sensing,Environment and Transportation Engineering (RSETE).Nanjing: IEEE.4442-4445 |
| [14] | 楼菊青,曹永青,胡跃城,等.2013.环境因子对水蚯蚓呼吸速率的影响研究[J].环境科学学报,33(10): 2737-2741 |
| [15] | Ratsak C H.2001.Effects of Nais elinguis on the performance of an activated sludge plant[J].Hydrobiologia,463(1/3): 217-222 |
| [16] | Ratsak C H,Verkuijlen J.2006.Sludge reduction by predatory activity of aquatic oligochaetes in wastewater treatment plants: science or fiction- A review[J].Hydrobiologia,564(1): 197-211 |
| [17] | Sağ Y,Kutsal T.2000.Determination of the biosorption heats of heavy metal ions on Zoogloea ramigera and Rhizopus arrhizus[J].Biochemical Engineering Journal,6(2): 145-15l |
| [18] | 申为宝,杨洪强.2008.蚯蚓和微生物对土壤养分和重金属的影响[J].中国农业科学,41(3): 760-765 |
| [19] | 孙卫玲,赵蓉,张岚,等.2001.pH对铜在黄土中吸持及其形态的影响[J].环境科学,22(3): 78-83 |
| [20] | Utkiger V,Chen B Y,Tabak H,et al.2000.Treatment of acid mine drainage: I.Equilibrium biosorption of zinc and copper on non-viable activated sludge[J].International Biodeterioration and Biodegradation,46(1): 19-28 |
| [21] | 王家强.2010.生物吸附法去除重金属的研究.长沙: 湖南大学 |
| [22] | 王开峰,彭娜,涂常青.2010.非活体生物质对水中活性艳红X-3B的吸附研究[J].环境工程学报,4(2): 309-314 |
| [23] | 张德敏,高洁,孙进,等.2008.铜离子和孔雀绿在磷酸酯化改性豆壳上的吸附行为[J].环境科学学报,28(4): 720-725 |
| [24] | Zhao L M,Wen S.2012.Progress and perspectives of microfauna as a powerful method for excess sludge reduction in wastewater treatment[J].Advanced Materials Research,446-449: 2824-2828 |
| [25] | 周文敏,傅德黔,孙宗光.1991.中国水中优先控制污染物黑名单的确定[J].环境科学研究,4(6): 9-12 |
| [26] | 诸晖,魏源送,刘俊新.2008.颤蚓在活性污泥中的生长研究[J].环境科学,29(5): 1342-1347 |
 2015, Vol. 35
2015, Vol. 35


