2. 浙江大学建筑工程学院市政工程研究所, 杭州 310058;
3. 绍兴市水环境科学研究院有限公司, 绍兴 312000
2. Civil Engineering Department, College of Engineering and Architecture, Zhejiang University, Hangzhou 310058;
3. Shaoxing Water Environmental Science Institute Co. Ltd, Shaoxing 312000
近年来,由于饮用水质量常受到各种外界环境威胁,饮用水安全已越来越受到人们的广泛重视.生物膜广泛存在于所有饮用水管网内,许多病原菌依附于生物膜生长,生物膜为其提供了良好的环境来应对不利的条件(Buswell et al., 1998;Rogers et al., 1994),因此管网生物膜对安全供水有重要影响.1989年,van der Wende等(1989)发现管壁生物膜上附着的微生物数量远多于水体中的微生物数量,多种因素(如水剪切力、流速等)皆会导致生物膜从管壁上脱落进入水体中,这不仅造成水体颜色和气味的恶化,还对人体的健康造成潜在危害(Donlan,2002; Rittman,1982).Berry等(2006)在研究饮用水管网生物膜时发现,许多病原微生物(如嗜肺军团菌,分支杆菌等)附着于生物膜生长,即生物膜为病原微生物提供了重要的生长环境,成为造成水体污染的潜在隐患.
目前对生物膜的研究大多集中于人工模拟管网.Douterelo等(2013)在室内构建循环反应器研究不同水力参数对生物膜细菌群落的影响,Revetta等(2013)通过检测饮用水管网模拟装置生物膜来研究氯胺消毒饮用水生物膜中细菌群落的形成和演替过程.有研究表明生物膜中稳定的微生物群落需要多年才能形成(Martiny et al., 2003),对于时间较短的生物膜许多因素都会干扰其微生物群落的组成,如各种管材就会影响生物膜细菌形态、数量以及种类等.
本研究以中国东部某市实际饮用水供水管网中的生物膜为实验对象,分别选取灰口铸铁管、镀锌管和不锈钢复合管来研究不同管材对管段生物膜微生物种群多样性的影响.
2 材料与方法(Materials and methods) 2.1 采样点及采样方法样品分别取于中国东部某市实际饮用水供水管网,具体管道参数见表 1.用挖土机去除管段上的覆盖土后用绳子固定需要截断的管段两端,在电锯截断管段的同时提起绳子将管段悬空取出.具体截取下来的管段用灭菌的试管刷刷洗管道内壁,并用灭菌园艺铲铲下管道内壁松软突出的管道沉积物或瘤状结垢,用无菌生理盐水冲洗,直至流出的水不再混浊,将刷洗下来的生物膜和铲下的管垢置于无菌玻璃瓶中,并置于低温采样箱中迅速转移至实验室4 ℃冰箱中保存.
| 表1 管道相关参数 Table 1 Parameters of the pipes |
往采集的样品瓶中加入足量无菌玻璃珠后置于摇床振荡15 min,使生物膜样品中的微生物脱落以制成菌悬液.振荡后使用60目的无菌筛网对样品进行过滤以去除大块杂质和砂石,并用无菌生理盐水冲洗至流出的水不再混浊.对过滤后的样品离心,将上清液与沉淀物分开,最后将沉淀物定容至一定体积.整个过程保证无菌操作.
2.2.2 R2A平板计数法按标准方法配制R2A培养基后,将预处理后的样品逐级稀释至10-3、10-4、10-5 3个梯度,取50 μL进行平板涂布,每个梯度做两个平行,并使用无菌水做空白对照.涂好后的平板用封口膜封好后在25 ℃下倒置培养7d后进行计数.
2.2.3 荧光定量PCR采用细菌16S rRNA V3区通用引物(Weisburg et al., 1991;Muyzer et al., 1993)对生物膜样品中细菌总数进行荧光定量PCR测定.PCR反应体系为(总体积25 μL):1 μL上游引物(10 mmol · L-1),1 μL下游引物(10 mmol · L-1),1 μL DNA模板(1~10 ng),9.5 μL DEPC处理水(Rnase Free dH2O),12.5 μLSYBR.PCR反应条件:96 ℃预变性3 min;96 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃延伸5 min.PCR产物用1%的琼脂糖凝胶电泳进行检测(Hu et al., 2013).
2.2.4 流式细胞法取5 mL预处理后的沉积物加入15 mL无菌水稀释,加入足量无菌玻璃珠置于摇床振荡15 min.使用中速定量滤纸将振荡好的样品过滤以去除大颗粒物质对检测结果的干扰.取500 μL水样加1.5 μL染料混合液(LIVE/DEAD BacLight 1 ∶ 1),混匀后用锡纸包好放入暗处反应15 min后用流式细胞仪(Flow cytometer,FCM,美国BD)进行检测(梁鹏和黄霞,2007).
2.2.5 扫描电镜将生物膜样品完全混匀静止30 s后取中层混合物放入离心管中,4000 r · min-1离心15 min去掉上清液后加入2.5%戊二醛溶液4 ℃固定过夜.按扫描电镜样品制备方法处理样品:倒掉固定液,用0.1 mol · L-1(pH 7.0)的磷酸缓冲液漂洗样品3次,每次15 min;用1%的锇酸溶液固定样品1~2 h;倒掉固定液,用0.1 mol · L-1,pH 7.0的磷酸缓冲液漂洗样品3次,每次15 min;用梯度浓度(包括50%,70%,80%,90%和95%五种浓度)的乙醇溶液对样品进行脱水处理,每种浓度处理15 min,再用100%的乙醇处理两次,每次20 min;用乙醇与醋酸异戊酯的混合液(V/V=1/1)处理样品30 min,再用纯醋酸异戊酯处理样品1~2 h;临界点干燥;镀膜,观察.处理好的样品在Hitachi TM-1000型扫描电镜中观察(Lou et al., 2011).
2.2.6 DNA抽提与种群多样性分析取适量生物膜样品用Power Soil DNA Kit(Mo Bio Laboratories,Carlsbad,CA)进行基因组DNA抽提,具体操作步骤按说明书进行(Shen et al., 2014).采用454高通量测序对样品的菌群组成进行测定.高通量测序在派森若生物公司进行,利用Roche 454 GSFLX+测序仪进行测序,采用mothur软件对测序的结果进行统计分析.
3 结果(Results) 3.1 不同管材管段情况观察管道内壁表面形态发现(图 1),灰口铸铁管的内表面明显比镀锌管和不锈钢复合管粗糙,内壁长满了黄褐色的、大小不一的铁瘤,并有粘滞状松散管垢存在;镀锌管内壁多处被腐蚀,内壁附有一层灰褐色生物膜;不锈钢复合管内表面较为平整,几乎未受腐蚀,内壁仅有一层薄薄的生物膜存在.样品采集后,灰口铸铁管内部表面严重腐蚀,而不锈钢复合管内壁则十分平整.由此可见,3种管材中灰口铸铁管受腐蚀最重,管道内壁形成了大量的铁瘤,同时也发现铁瘤生物膜量最多,而不锈钢复合管所受腐蚀最轻,观察到的生物膜量最少.
 |
| 图 1 不同管材管道内壁照片 Fig. 1 Photos of pipe inner face |
由图 2中的结果可知,不同管材中可培养菌数量灰口铸铁管>镀锌管>不锈钢复合管,其中灰口铸铁管中可培养菌数量最高,达4.64×105个· cm-2;其次为镀锌管,可培养菌数为3.11×105个· cm-2;而不锈钢复合管中可培养菌数最低,为6.37×104个· cm-2.不同管材中细菌总数趋势与可培养菌数一致,即灰口铸铁管中细菌总数最高,为4.29×107个· cm-2;镀锌管次之,为3.03×106个· cm-2;不锈钢复合管最少,为2.61×106个· cm-2.根据以上结果可知,灰口铸铁管最适合细菌的生长,该结果与Niquette等(2000)的研究结果相一致.分析原因可能由于铸铁在水环境下很容易由于电化学反应而被腐蚀,铁在水环境下能转化成氢氧化亚铁,并能在有氧条件下进一步转化成氢氧化铁,从而使管壁表面凹凸不平,更利于细菌的附着.当细菌附着在这些铸铁管表面后,铸铁管会发生生物电化学反应,进一步加快了管网的腐蚀(邬卓颖等,2010).本研究中灰口铸铁管锈蚀程度明显高于镀锌管和不锈钢复合管,且细菌总数最高,微生物检测结果符合观察到的管道内壁锈蚀的情况.即内壁腐蚀越严重的管段生物膜细菌数越多,该结果与李爽和张晓健(2003)的研究结果相一致.另外,管壁微生物可利用胞外聚合物粘附营养物质和细菌,从而逐渐形成生物膜.相较于不锈钢复合管,镀锌钢管壁内表面粗糙度比较高,且随着时间的增加管壁腐蚀会越来越严重,有利于微生物的附着.而不锈钢复合管由于管壁粗糙度较小,细菌附着生长的条件相对较差,且大分子营养物质较难在管壁沉积,因此细菌数量明显较低.根据管道内壁观察可知,镀锌管内壁附着的生物膜量要高于不锈钢复合管,该结果与镀锌管和不锈钢复合管的细菌总数情况相符合.
 |
| 图 2 管道内壁生物膜可培养菌数及细菌总数 Fig. 2 Number of culturable bacteria and total bacteria on the pipe inner face |
本文采用流式细胞法对生物膜中活死菌比例 进行了研究,结果表明不同管材管网生物膜中活菌 比例与可培养菌数及细菌总数趋势并不一致.其中镀锌管中活菌比例最高,达到46.5%,其次是灰口铸铁管,活菌比例为20%,活菌比例最低为不锈钢复合管,仅达到9.9%.由以上结果可知,虽然灰口铸铁管中可培养菌数最高,但相较于镀锌管,灰口铸铁管中活菌比例较少.
3.3 不同管材管网生物膜扫描电镜观察结果扫描电镜观察结果显示,灰口铸铁管生物膜中微生物数量最多,且以细菌团聚的形式大量存在.灰口铸铁管道里形成了明显的铁瘤,电镜照片显示铁瘤内部是丰富的微生物.镀锌管生物膜中微生物数量也较多,而不锈钢复合管里可见的主要是一些小球形物,微生物数量相对较少.该观察结果与可培养菌数及细菌总数趋势完全一致.而在微生物种类上,3种管道生物膜中的微生物都是以球菌和杆菌为主.张向谊等(2005)研究给水管网管壁微生物生长特性时发现,给水管网管壁中的微生物以球菌和杆菌为主,与本文研究结果较一致.而从电镜照片上来看不同管材生物膜组成的微生物相形态相对比较接近,差异不明显.
 |
| 图 3 管道内壁生物膜扫描电镜观察结果 Fig. 3 SEM images of biofilm in pipes |
不同管材生物膜样品的群落组成在门水平上存在明显差异(图 4),其中灰口铸铁管生物膜种群多样性最高,其次为镀锌管,而不锈钢复合管生物膜种群多样性最低.从门水平上观察:灰口铸铁管生物膜细菌群落主要包括变形菌门、放线菌门、酸杆菌门等12个门,其中变形菌门占总菌的91.03%;镀锌管生物膜细菌群落主要包括变形菌门、放线菌门和拟杆菌门等12个门,其中变形菌门占总菌的98.35%;不锈钢复合管生物膜细菌群落主要包括变形菌门、厚壁菌门、拟杆菌门和放线菌门等12个门,其中变形菌占总菌的97.65%.从门的水平上发现3种管材生物膜样品的群落组成皆有12个门,都以变形菌门为主,各管道变形菌门都高达90%以上.不同的是,灰口铸铁管生物膜细菌群落含较多的酸杆菌门,占总菌的2.25%;而在镀锌管和不锈钢复合管生物膜中,酸杆菌门仅分别占总菌的0.01%和0.02%.同样,在不锈钢复合管中占总菌1.07%的厚壁菌门,在灰口铸铁管和镀锌管中仅占总菌的0.13%和0.10%.可见,不同管材的生物膜群落组成具有很大差异.
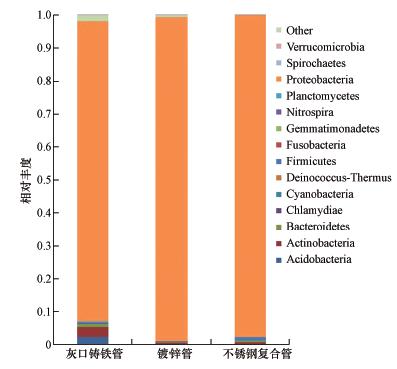 |
| 图 4 管道生物膜样品门水平上的物种分布情况 Fig. 4 Relative abundance of the major phylums in the biofilm of pipes |
1997年,Kalmbach等(1997)对饮用水管网生物膜形成动力学进行研究,结果发现生物膜群落主要由变形菌门,尤其是β-变形菌组成.类似的,美国科学家Revetta等(2013)对氯胺消毒的饮用水管网生物膜的细菌群落形成与初期演替过程进行研究,结果发现:90%的细菌群落由变形菌门、放线菌门和拟杆菌门组成.而Lautenschlager等(2013)在对饮用水供水管网的生物稳定性进行评价时也发现:各个样品中34%~70%的微生物群落为变形菌门,即变形菌门为最主要的细菌群落.2014年,Wang等(2014)模拟实际饮用水供水管网研究不同消毒剂、时间及管材对生物膜细菌群落结构的影响,结果表明在所得的14个门中,变形菌门占66%~98%.这些研究报道与本实验的结果很相似.
本文所研究的3个采样管段采样前9个月的余氯浓度分别为灰口铸铁管0.18~0.48 mg · L-1,镀锌管0.12~0.39 mg · L-1,不锈钢复合管0.18~0.42 mg · L-1,3个管段水样的余氯浓度比较接近.由于3个管段管龄均超过了10年,在长期运行过程中余氯浓度不一定能保持恒定.为了减少不同余氯浓度对管道生物膜微生物群落结构的影响,本文在选择采样点时尽量选择余氯浓度相近的管段进行研究.研究结果表明相比较来说管材对管道生物膜种群多样性的影响比余氯对生物膜群落结构的影响更大.
4 结论(Conclusions)1)灰口铸铁管中可培养菌数量和细菌总数最高,其次为镀锌管,不锈钢复合管中可培养菌数和细菌总数最低.相较于镀锌管和不锈钢复合管,灰口铸铁管最适合细菌的生长.但在活菌比例方面,镀锌管生物膜的活菌比例最高,其次是灰口铸铁管,最低为不锈钢复合管.
2)扫描电镜观察结果与可培养菌和细菌总数结果一致:灰口铸铁管生物膜中微生物数量最多,镀锌管生物膜中微生物数量也较多,而不锈钢复合管里微生物数量相对较少.3种管道生物膜中的微生物都是以球菌和杆菌为主.
3)灰口铸铁管生物膜种群多样性最高,镀锌管生物膜种群多样性相对较为单一,而不锈钢复合管生物膜种群多样性最低.饮用水管网生物膜种群以变形菌门为主,各管道变形菌门都高达95%以上.
4)综合以上结果,今后饮用水管段铺设上应尽量减少使用灰口铸铁管.
| [1] | Berry D, Xi C W, Raskin L. 2006. Microbial ecology of drinking water distribution systems[J]. Current Opinion in Biotechnology, 17(3): 297-302 |
| [2] | Buswell C M, Herlihy Y M, Lawrence L M, et al. 1998. Extended survival and persistence of Campylobacter spp. in water and aquatic biofilms and their detection by immunofluorescent-antibody and -rRNA staining[J]. Applied and Environmental Microbiology, 64(2): 733-741 |
| [3] | Donlan R M. 2002. Biofilms: microbial life on surfaces[J]. Emerging Infectious Diseases, 8(9): 881-890 |
| [4] | Douterelo I, Sharpe R L, Boxall J B. 2013. Influence of hydraulic regimes on bacterial community structure and composition in an experimental drinking water distribution system[J]. Water Research, 47(2): 503-516 |
| [5] | Hu B L, Shen L D, Liu S, et al. 2013. Enrichment of an anammox bacterial community from a flooded paddy soil[J]. Environmental Microbiology Reports, 5(3): 483-489 |
| [6] | Kalmbach S, Manz W, Szewzyk U. 1997. Dynamics of biofilm formation in drinking water: phylogenetic affiliation and metabolic potential of single cells assessed by formazan reduction and in situ hybridization[J]. FEMS Microbiology Ecology, 22(4): 265-279 |
| [7] | Lautenschlager K, Hwang C, Liu W T, et al. 2013. A microbiology-based multi-parametric approach towards assessing biological stability in drinking water distribution networks[J]. Water Research, 47(9): 3015-3025 |
| [8] | 李爽, 张晓健. 2003. 给水管壁生物膜的生长发育及其影响因素[J]. 中国给水排水, 19(13): 49-52 |
| [9] | 梁鹏, 黄霞. 2007. 利用LIVE/DEAD Baclight染色测定活性污泥中的活菌水平[J]. 环境化学, 26(5): 598-601 |
| [10] | Lou L P, Luo L, Wang L N, et al. 2011. The influence of acid demineralization on surface characteristics of black carbon and its sorption for pentachlorophenol[J]. Journal of Colloid and Interface Science, 361(1): 226-231 |
| [11] | Martiny A C, Jørgensen T M, Albrechtsen H J, et al. 2003. Long-term succession of structure and diversity of a biofilm formed in a model drinking water distribution system[J]. Applied and Environmental Microbiology, 69(11): 6899-6907 |
| [12] | Muyzer G, de Waal E C, Uitterlinden A G. 1993. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 59(3): 695-700 |
| [13] | Niquette P, Servais P, Savoir R. 2000. Impacts of pipe materials on densities of fixed bacterial biomass in a drinking water distribution system[J]. Water Research, 34(6): 1952-1956 |
| [14] | Revetta R P, Alvarez V G, Gerke T L, et al. 2013. Establishment and early succession of bacterial communities in monochloramine-treated drinking water biofilms[J]. FEMS Microbiology Ecology, 86(3): 404-414 |
| [15] | Rittman B E. 1982. The effect of shear stress on biofilm loss rate[J]. Biotechnology and Bioengineering, 24(2): 501-506 |
| [16] | Rogers J, Dowsett A B, Dennis P J, et al. 1994. Influence of temperature and plumbing material selection on biofilm formation and growth of Legionella pneumophila in a model potable water system containing complex microbial flora[J]. Applied and Environmental Microbiology, 60(5): 1585-1592 |
| [17] | Shen L D, Liu S, Zhu Q, et al. 2014. Distribution and diversity of nitrite-dependent anaerobic methane-oxidising bacteria in the sediments of the Qiantang River[J]. Microbial Ecology, 67(2): 341-349 |
| [18] | van der Wende E, Characklis W G, Smith D B. 1989. Biofilms and bacterial drinking water quality[J]. Water Research, 23(10): 1313-1322 |
| [19] | Wang H, Masters S, Edwards M A, et al. 2014. Effect of disinfectant, water age, and pipe materials on bacterial and Eukaryotic community structure in drinking water biofilm[J]. Environmental Science & Technology, 48(3): 1426-1435 |
| [20] | Weisburg W G, Barns S M, Pelletier D A, et al. 1991. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 173(2): 697-703 |
| [21] | 邬卓颖, 齐枝花, 魏博, 等. 2010. 管材、营养元素和温度对模拟给水管网生物膜形成的影响[J]. 给水排水, 36(11): 161-164 |
| [22] | 张向谊, 刘文君, 潘虹, 等. 2005. 某市给水管网管壁中微生物生长特性研究[J]. 给水排水, 31(10): 1-6 |
 2015, Vol. 35
2015, Vol. 35


