2. 承德市畜牧研究所, 承德 067000;
3. 中国农业大学资源环境学院, 北京 100094
2. Animal Husbandry Research Institute of Chengde, Chengde 067000;
3. College of Resources and Environmental Sciences, China Agricultural University, Beijing 100094
近几年来,兽药在环境中的残留及其生态风险已成为国际上的研究热点.阿苯哒唑是近年来发展迅速、应用广泛的高效抗吸虫、线虫、绦虫和囊尾蚴等寄生虫的苯并咪唑类兽药.该药进入寄生虫体内后,大约11%的原药随粪尿排出,并且在尿液和粪便中均已检测到其代谢物(赵冠宏和许炽标,2002).以前的研究(Batzias et al., 2004;李庆章等,2007)表明,阿苯达唑及其代谢物除了影响动物的能量代谢,干扰虫体的生长和繁殖,对虫卵的孵化也有抑制作用,且该类药对动物具有一定的致畸性和致突变性(Carlsson et al., 2013).这些残留的药物随粪尿进入周围环境中可能会对环境产生一定的负面作用,Escher等(2008)通过检测药物的脂/水分配系数和膜通透性证明了阿苯达唑在环境中存在较高的风险性.
蚯蚓作为评价土壤环境安全性的指示生物(Rao and Kavitha, 2004),当阿苯达唑及其代谢物随着粪尿进入土壤后,对蚯蚓可能会产生潜在的毒害作用.近几年阿苯达唑对蚯蚓存活、生长和抗氧化物酶活性的影响已有研究(Gao et al., 2007;王轶等,2009),但该药对蚯蚓繁殖性能影响的研究很少,我们前期研究显示(高玉红等,2012),高剂量的阿苯达唑损伤了蚯蚓精子的发生系统.本研究通过检测染毒56 d 时阿苯哒唑对蚯蚓产茧、孵化和幼蚓产生的影响,以及短期染毒14 d 时对精子畸形率和精子细胞超显微结构的变化,以期探讨低剂量阿苯达唑对蚯蚓繁殖性能的影响.
2 材料与方法(Materials and methods) 2.1 实验材料选用300~400 mg 健康成年蚯蚓(Eisenia fetida),蚯蚓取自中国农大蚯蚓养殖基地.实验兽药为阿苯哒唑原粉,纯度为95%以上.
2.2 染毒方法采用人工土壤法,按照OECD(1984)推荐的标准方法,人工土壤包括20%高岭土、10%草炭土和70%石英砂(0.05~0.2 mm),用碳酸钙将配置好的人工土壤pH调到6.0±0.5(Wu et al., 2012).
按照阿苯哒唑染毒的预试结果,设置5个不影响蚯蚓生长的染毒剂量(1、3、6、9和12 mg · kg-1)和1个对照组,每个处理组设8个重复,4个重复进行慢性繁殖实验(56 d),其余4个重复进行精子畸形率和超显微观察实验(14 d),每个重复10条蚯蚓,蚯蚓染毒前在实验室预养1周.染毒时,不同剂量的阿苯达唑首先溶解在丙酮中,然后与人工土壤混匀,放入玻璃容器中并在通风橱中通风12 h,待丙酮蒸发完,放入蚯蚓并于人工气候箱中培养,箱中为标准实验条件:温度为(23 ±1)℃,湿度为75%±2%,光暗比为12 h /12 h.
2.3 产茧、孵化和幼蚓产生的测定染毒28 d 时取出存活的蚯蚓,洗净并称重,同时卵茧和孵化的幼蚓被检出,记录已经孵化和未孵化的卵茧数量,并记录卵茧重量,然后将未孵化的卵茧和幼蚓重新放回先前培养的土壤中继续培养28 d,记录已经孵化和未孵化的卵茧数量、幼蚓数量及其重量.
2.4 精子畸形率的测定染毒14 d 时取出蚯蚓,5%乙醇麻醉5 min后解剖,取出贮精囊放在滴有生理盐水的载玻片上,通过挤压方法释放贮精囊中的精子形成悬液,制成涂片后甲醇固定和Giemsa染色,400倍光镜下观察,每条蚯蚓观察1000个精子,记录畸形精子的形态和数量,并计算精子畸形率(Zang et al., 2000).
2.5 超微结构的观察染毒14 d 时,取出贮精囊(方法同上),放入2.5%戊二醛溶液中固定,用磷酸缓冲溶液冲洗干净后修成1 mm3小块;然后用1%俄酸后固定,乙醇梯度脱水.环氧树脂618包埋,LKB型超薄切片机切片,醋酸双氧铀-柠檬酸铅双染色,日立H27500型透射电镜拍片.
2.6 统计分析根据SPSS17.0 软件的单因素方差分析,采用LSD法进行多重比较分析.
3 结果与分析(Results and analysis) 3.1 阿苯达唑对蚯蚓产茧、孵化和幼蚓产生的影响蚯蚓染毒28 d时,不同剂量的阿苯达唑对蚯蚓卵茧产生的数量和卵茧重量表现出不同程度的影响(见图 1).随着染毒剂量的增加(3~12 mg · kg-1),每条蚯蚓产生的卵茧数量显著下降(p<0.01),并表现出明显的剂量-效应关系,而卵茧重量只有在染毒剂量达到12 mg · kg-1时才表现为显著下降(p<0.05),这和以前报道的结果(王轶等,2009)不一致,该研究认为,当阿苯达唑的染毒剂量达到7 mg · kg-1时才会对卵茧数量表现出显著性降低,而本研究中阿苯达唑剂量达到3 mg · kg-1时就已经对卵茧数量产生了影响,这可能与染毒的土壤有关,本实验中采用的是标准的人工土壤,而该文献报道中的染毒土壤是天然砂壤土.
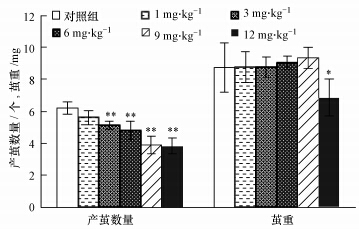 |
| 图 1 阿苯达唑对蚯蚓卵茧产生的影响(与对照组比较,* p<0.05;** p<0.01,下同) Fig. 1 Effect of albendazole on cocoon production of earthworm |
从28 d的卵茧孵化率(见图 2)可以看出,染毒剂量达到或超过6 mg · kg-1时,卵茧的孵化率显著降低(p<0.05),6~12 mg · kg-1范围内的卵茧孵化率为11.0%~3.0%,而对照组孵化率则为14.7%.可见,染毒28 d时,卵茧数量对于低剂量的阿苯达唑比其他繁殖指标(卵茧重量和孵化率)更敏感.已发表的文献(Zhang et al., 2008;Alves et al., 2013)也证明了外源化学污染物对蚯蚓慢性繁殖性能的毒理效应,但Zhang等(2008)认为,蚯蚓卵茧的孵化率比卵茧的产生对于污染物的暴露更敏感,这和我们的研究结果相反,其原因不是很清楚.本研究中阿苯达唑对蚯蚓卵茧产生的毒性影响主要是通过两种渠道,即蚯蚓的肠道吸收和皮肤扩散(Shalaby et al.,2009),而该药对蚯蚓孵化率的毒性影响只是通过卵茧表面的扩散,所以,影响卵茧产生数量的最低药物剂量为3 mg · kg-1,而影响孵化率的最低剂量则为6 mg · kg-1.
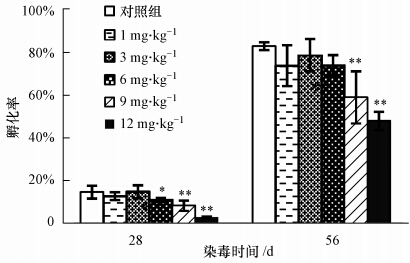 |
| 图 2 阿苯达唑对蚯蚓卵茧孵化率的影响 Fig. 2 Effect of albendazole on hatching success of cocoons of earthworms |
随着染毒时间的延长,染毒56 d时,较高剂量的阿苯达唑(9和12 mg · kg-1)显著降低了卵茧的孵化率(p<0.01),其孵化率分别只有58.9%和47.9%,而对照组的孵化率较高,为82.8%(见图 2).从图 3可以看出,染毒56 d时阿苯达唑对幼蚓产生的数量和重量也有一定的影响.较低剂量(1~6 mg · kg-1)的阿苯达唑没有影响每条蚯蚓产生的幼蚓数量(p>0.05),但较高剂量(9和12 mg · kg-1)却显著降低了幼蚓数量(p<0.01).另外,不同剂量的阿苯达唑也降低了幼蚓重量,产生毒性影响的最低剂量为 3 mg · kg-1.可见,阿苯达唑染毒56 d时,幼蚓的重量比其他繁殖指标(幼蚓数量和卵茧孵化率)对低剂量更敏感,推断可能的原因是幼蚓通过采食含有药物及其代谢物的基质以及通过皮肤扩散使更多的有毒物质进入体内,从而影响了其生长.
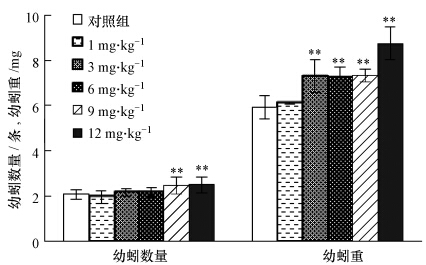 |
| 图 3 阿苯达唑对幼蚓产生的影响 Fig. 3 Effect of albendazole on juvenile production of earthworms |
不同剂量的阿苯达唑对蚯蚓精子的形态产生不同程度的影响(见表 1).蚯蚓染毒14 d 时,该药对精子畸形率产生显著影响的最低剂量为6 mg · kg-1(p<0.05),随着染毒剂量的增加,精子畸形率表现为显著性增加,尤其是当剂量达12 mg · kg-1时,精子畸形率高达14.75%,而对照组只有1.58%.从表 1和图 4也可以看出,畸形精子的形态主要包括3种:胖头、顶端成环和弯曲.低剂量(1和3 mg · kg-1)染毒时,畸形精子的形态以身体弯曲最多,而较高剂量(6~12 mg · kg-1)时,畸形精子的形态以胖头最多,其次是顶端成环,身体弯曲的精子比例最低.Zang等(2000)也研究了蚯蚓暴露于杀虫剂的环境中精子畸形率的变化,研究发现,畸形精子的主要形态为头部钩状弯曲和顶端成环,只有少数表现为胖头和卷尾,这和我们的研究不是很一致,可能与化学污染物的结构和性质有关,这仍需进一步探索和研究.
| 表 1 阿苯达唑对蚯蚓精子畸形率的影响 Table 1 Effect of albendazole on sperm deformity of earthworms |
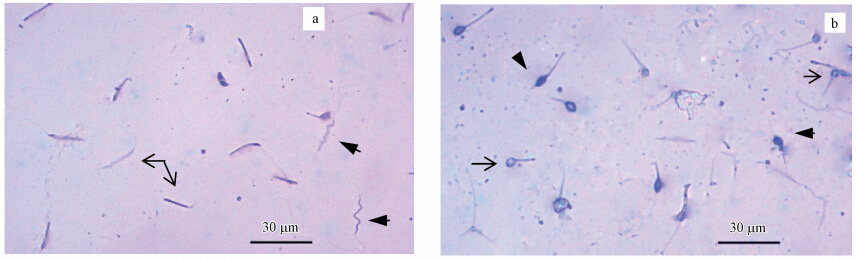 |
| 图 4 阿苯达唑染毒时蚯蚓的畸形精子形态(a. 正常精子(箭头)和弯曲的精子(粗箭头);b. 顶部成环(箭头)和胖头精子(粗箭头)) Fig. 4 Deformed sperm morphology of earthworms to albendazole exposure(a. normal sperm(arrow) and curving sperm(arrow head); b. apical loop(arrow) and swollen head(arrow head)) |
从图 5可以看到,蚯蚓精子细胞中正常的线粒体嵴发达,基质颗粒明显,致密的染色体均匀地分布于细胞核中(图 5a).当染毒剂量为 3 mg · kg-1时,一些线粒体的基质颗粒明显减少,部分嵴消失(图 5b),随着染毒剂量的增加,细胞核的核膜及染色质也出现了异常;染毒剂量为6 mg · kg-1时,核膜凹陷变形(图 5c);染毒为9 mg · kg-1时,核内染色质出现了小范围水肿(图 5d);当染毒达到最高剂量(12 mg · kg-1)时,精子细胞损伤严重,尤其是线粒体,出现严重水肿,且嵴消失,部分线粒体膜溶解模糊不清,出现空泡化状态,而且核内染色质出现大面积水肿(图 5e).我们以前的文献(高玉红等,2007)也报道了阿苯达唑损伤蚯蚓肠道上皮细胞的线粒体结构,其超微结构变化和本实验基本一致,这也与邵萍等(1996)对囊虫的研究一致,人体内、外的囊虫在阿苯哒唑作用下,囊虫线粒体出现溶解或肿胀,甚至空泡化等病变.线粒体是细胞内最易受损伤的敏感细胞器,线粒体的受损将造成能量匮乏,导致蛋白质合成、运输中断,从而引起一系列细胞功能的障碍,最后导致细胞的死亡.
 |
| 图 5 阿苯达唑对蚯蚓贮精囊超微结构的影响(a. 对照,左边箭头示正常的线粒体,右边箭头示正常的染色质;b. 3 mg · kg-1,箭头示损伤的线粒体;c. 6 mg · kg-1,箭头示变形的核膜;d. 9 mg · kg-1,箭头示水肿的染色质;e. 12 mg · kg-1,上边箭头示严重损伤的线粒体,下边箭头示水肿的染色质) Fig. 5 Effect of albendazole on ultrastructure in seminal vesicles of earthworms(a. control,normal mitochondria(left arrow) and chromatin(right arrow);b. 3 mg · kg-1,damaged mitochondria(arrow);c. 6 mg · kg-1,sunken nucleus membrane(arrow);d. 9 mg · kg-1,chromatin edema(arrow);e. 12 mg · kg-1,seriously damaged mitochondria(above arrow) and chromatin edema(below arrow)) |
结合光镜下畸形精子形态的观察和畸形率的分析,电镜下精子细胞的超微结构变化对低剂量阿苯达唑更敏感,超微结构产生明显变化的阿苯达唑最低剂量为3 mg · kg-1,而对精子畸形率产生显著影响的最低剂量为6 mg · kg-1.
4 结论(Conclusion)1)蚯蚓染毒28 d的产茧数量和染毒56 d的幼蚓重量对低剂量阿苯达唑比较敏感,当染毒剂量达到或超过3 mg · kg-1时,卵茧数量和幼蚓重量显著降低.
2)14 d短期染毒时,蚯蚓贮精囊中精子细胞的超微结构变化比光镜下精子畸形率变化对低剂量阿苯达唑敏感,发生明显变化的最低剂量分别为3和6 mg · kg-1.该研究结果可为该类兽药残留的土壤生态毒理及早期检测提供依据.
| [1] | Alves P R, Cardoso E J B, Martines A M, et al. 2013. Earthworm ecotoxicological assessments of pesticides used to treat seeds under tropical conditions [J]. Chemosphere, 90(11): 2674-2682 |
| [2] | Batzias G C, Theodosiadou E, Delis G A. 2004. Quantitative determination of albendazole metabolites in sheep spermatozoa and seminal plasma by liquid chromatographic analysis with fluorescence detection [J]. Journal of Pharmaceutical and Biomedical Analysis, 35(5): 1191-1202 |
| [3] | Carlsson G, Patring J, Kreuger J, et al. 2013. Toxicity of 15 veterinary pharmaceuticals in zebrafish (Danio rerio) embryos [J]. Aquatic Toxicology, 126: 30-41 |
| [4] | Escher B I, Berger C, Bramaz N, et al. 2008. Membrane-water partitioning, membrane permeability, and baseline toxicity of the parasiticides ivermectin, albendazole, and morantel [J]. Environmental Toxicology and Chemistry, 27(4): 909-918 |
| [5] | Gao Y H, Sun Z J, Sun X S, et al. 2007. Toxic effects of albendazole on adenosine triphosphatase activity and ultrastructure in Eisenia fetida [J]. Ecotoxicology and Environmental Safety, 67(3): 378-384 |
| [6] | 高玉红, 贾鎏辉, 吴占军, 等. 2012. 兽药阿苯达唑对蚯蚓精子发生的显微和超显微结构的影响 [J]. 环境科学学报, 32(10): 2607-2611 |
| [7] | 李庆章, 郝艳红, 高学军, 等. 2007. 苯并咪唑氨基甲酸酯类药物抗猪囊尾蚴的作用靶点 [J]. 中国农业科学, 40(5): 1024-1032 |
| [8] | Rao J V, Kavitha P. 2004. Toxicity of azodrin on the morphology and acetylcholinesterase activity of the earthworm Eisenia foetida [J]. Environmental Research, 96(3): 323-327 |
| [9] | Shalaby H A, Abdel-Shafy S, Abdel-Rahman K A, et al. 2009. Comparative in vitro effect of artemether and albendazole on adult Toxocara canis [J]. Parasitology Research, 105(4): 967-976 |
| [10] | 邵萍, 卞英华, 陈佩惠, 等. 1996. 阿苯哒唑对体外培养猪囊虫头节作用的透射电镜观察Ⅰ[J]. 寄生虫与医学昆虫学报, 3(3): 154-159 |
| [11] | 王轶, 唐云, 徐凌凌, 等. 2009. 阿苯哒唑对蚯蚓的生态毒理效应 [J]. 应用生态学报, 20(9): 2296-2300 |
| [12] | Wu S J, Zhang H X, Zhao S L, et al. 2012. Biomarker responses of earthworms (Eisenia fetida) exposured to phenanthrene and pyrene both singly and combined in microcosms[J]. Chemosphere, 87(4): 285-293 |
| [13] | Zang Y, Zhong Y, Luo Y, et al. 2000. Genotoxicity of two novel pesticides for the earthworm, Eisenia fetida [J]. Environmental Pollution, 108(2): 271-278 |
| [14] | Zhang B H, Cox S B, McMurry S T, et al. 2008. Effect of two major N-nitroso hexahydro-1, 3, 5-trinitro-1, 3, 5-triazine (RDX) metabolites on earthworm reproductive success [J]. Environmental Pollution, 153(3): 658-667 |
| [15] | 赵冠宏, 许炽标. 2002. 阿苯哒唑在猪囊尾蚴病患者体内吸收和排泄的初步研究 [J]. 中国航天医药杂志, 4(3): 4-5 |
 2015, Vol. 35
2015, Vol. 35


