随着异常气候的频繁出现和环境污染的加剧,我国北方,尤其是东北地区的一些大型水体开始出现水华爆发现象,并呈现逐渐增强的趋势,水生生态系统的结构开始失衡,功能逐渐退化,甚至威胁着饮用水安全,成为急需解决的水环境问题(金志民等,2009).我国目前关于水华控制的理论研究和技术应用主要是针对南方地区的一些大型水体(冯胜等,2008; Tian et al., 2012; 许慧萍等,2014),而对低温期较长的北方水体的富营养化现象的重视程度明显不足(黄继国等,2008; 李明堂等,2012),因此,有必要探寻针对北方水体的水华控制技术.溶藻菌是一类可通过直接接触和/或分泌化感物质来选择性抑制、杀死和溶解藻细胞的微生物.与传统的物理和化学法相比,基于溶藻菌作用的生物控藻法具有成本低、无二次污染和生态友好等特点,在控制有害藻类,调节水生生态系统平衡方面正引起人们的高度重视.目前已发现的溶藻菌主要包括假单胞菌属、粘细菌属、交替单胞菌属、腐螺旋菌属、芽孢杆菌属和弧菌属等(Dakhama et al., 1993; 裴海燕等,2005;汪辉等,2008;郭静等,2012;李东等,2013; 李三华等,2013; Yang et al., 2013;王琼等,2014).研究表明,从不同时空的环境中分离获得的优势溶藻菌往往有较大差别,说明溶藻菌与生长环境的关系密切,有一定的地域特征.因此,在溶藻菌的研究方面应该针对地域特征筛选出土著溶藻菌,并研究其在不同环境下的溶藻特征,可为提高其实际应用效果提供依据.基于此,本文从寒区处于水华爆发期的富营养化水体中分离和鉴定了一株铜绿假单胞菌,并分析其对我国北方水体中常见的水华蓝藻优势种铜绿微囊藻的抑制和溶解特征,以期为北方富营养化水体蓝藻爆发的生物控制提供优势的土著菌种资源和技术支持.
2 材料与方法(Materials and methods) 2.1 供试藻种及其培养实验用铜绿微囊藻(Microcystis aeruginosa)FACHB 928购自中国科学院淡水藻种库,该藻属于蓝藻门微囊藻属的原核生物,为藻种库同日本国立环境研究所交换所得.
实验过程中使用BG11培养基进行藻种复活和溶藻实验.铜绿微囊藻的培养条件:温度(25.0±0.5)℃,光暗比14 h ∶ 10 h,光照强度2000 lx,每日振荡4次.溶藻实验的基本条件:除不同藻密度实验外,溶藻实验的藻液初始叶绿素a的浓度大约为2.4 μg · mL-1;除不同添加比例实验外,其余实验发酵液的添加比例为1 ∶ 100,溶藻周期为5 d,每种处理重复3次,同时做无菌水代替发酵液的对照.
2.2 细菌培养和发酵液的制备细菌培养条件:除溶藻菌和最佳溶藻培养基的筛选实验温度为25 ℃外,其它获得发酵液的细菌培养温度为32 ℃,振荡速度为150 r · min-1.
发酵液制备:利用牛肉膏蛋白胨培养基将保存的菌种活化后,用无菌水制备成OD600为0.3左右的菌悬液,按照1%的比例接种至相应的培养基中,培养36 h,在8000 r · min-1下离心5 min,上清液再过0.22 μm的滤膜为发酵液,用于溶藻实验.
2.3 溶藻菌的筛选和分离2013年8月分别在吉林省和内蒙古共9处水体的水华爆发区采集水样,等比例混合后取100 mL于500 mL三角瓶中,加入等量的稀释50倍后的BG11培养基,培养15 d后,取1 mL黄化现象最明显的培养液,梯度稀释后涂在牛肉膏蛋白胨固体培养基表面上,在25 ℃下培养24 h,将具有明显数量优势的菌株JM1进行纯化.
2.4 菌株JM1的鉴定 2.4.1 菌株JM1的常规和VITEK系统鉴定按照《常见细菌系统鉴定手册》进行菌落特征观察和革兰氏染色鉴定(东秀珠等,2001),利用法国生物梅里埃公司VITEK 2 COMPACT鉴定系统进行快速鉴定.
2.4.2 菌株JM1的分子生物学鉴定总DNA提取:从平板中挑取1环菌体细胞,加入到10 mL牛肉膏蛋白胨培养基中,在25 ℃、150 r · min-1下培养24 h后取2 mL培养物在13000 r · min-1下离心1 min,弃培养基,加入200 μL ddH2O,沸水煮10 min,然后在13000 r · min-1下离心1 min,上清液移入1.5 mL离心管,用于16S rDNA扩增.
16S rDNA基因扩增和测序:扩增铜绿假单胞菌JM1的16S rDNA基因PCR反应体系包括:1 μL DNA模板,10 μmol · L-1 引物各1 μL,2 mmol · L-1 dNTPs 5 μL,10×缓冲液5 μL,RNA聚合酶 1 μL,补充36 μL双蒸水至50 μL.基因扩增引物:正向引物Pf:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物Pr:5′-ACGGCTACCTTGTTACGACT-3′.PCR 反应程序:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸3 min,35个循环;72 ℃延伸10 min,4 ℃保存.取PCR产物 5 μL进行1%琼脂糖凝胶电泳鉴定后送北京信诺金达生物科技有限公司测序.
系统发育分析:将测得的序列提交GenBank,并进行BLAST同源性序列比对.选取同源性较高的序列用RNAMEN软件编辑成头尾一致并等长的序列后,再选取属内同源性较高的模式菌株的16S rRNA 序列进行遗传距离计算,用ClustalW 2.0 软件进行序列比对,应用系统发育树分析软件MEGA4.0中Neighbor-Joining方法,采用Kimura双参数计算模型构建系统树,并评估系统发育.另外,已分离鉴定的可产生溶藻活性物质的菌株也包含在了系统发育树的构建中.
2.5 菌株JM1的溶藻特征研究 2.5.1 具有最佳溶藻效果的细菌培养基筛选分别利用蔗糖(10 g · L-1)、葡萄糖(10 g · L-1)、甘油(10 g · L-1)为碳源,蛋白胨(5 g · L-1)、硝酸钠(3.14 g · L-1)和硫酸铵(2.8 g · L-1)为氮源,加上其它无机盐制备成培养基.以蛋白胨为氮源时,无机盐为NaCl(5 g · L-1);以无机氮为氮源时,其它无机盐为KH2PO4(0.125 g · L-1)、MgSO4 · 7H2O(0.2 g · L-1)、NaCl(0.2 g · L-1)、CaCl2 · 2H2O(0.025 g · L-1),微量元素溶液2 mL(李明堂等,2012),共9种培养基.菌株JM1分别接入这9种培养基和牛肉膏蛋白胨培养基中培养,利用发酵液进行溶藻实验.通过比较叶绿素a的浓度,确定最佳的培养基组成,实验过程中观察记录发酵液的颜色和pH值变化.以下实验所用的发酵液都是用最佳培养基培养菌株JM1后获得.
2.5.2 菌株溶藻方式研究向处于对数期的藻液中加入菌体细胞和发酵液,分别做加入单一菌体细胞、单一发酵液和同时加入菌体细胞和发酵液3种处理,菌体细胞最终浓度分别为103、105、107、109、1011 CFU · mL-1,通过比较叶绿素a的浓度,分析菌株的溶藻方式.
2.5.3 初始藻密度和发酵液添加比例对溶藻效果的影响利用BG11培养基将叶绿素a浓度为 3.42 μg · mL-1的原藻藻液稀释成叶绿素a浓度为2.46 μg · mL-1和1.72 μg · mL-1的两种藻液,然后以1 ∶ 50、1 ∶ 100、1 ∶ 150、1 ∶ 200四种比例向原藻藻液和稀释后的藻液中加入发酵液,进行溶藻实验,分析藻密度和添加比例对发酵液溶藻效果的影响.
2.5.4 菌株JM1发酵液对藻细胞毒性的可逆性研究分别在溶藻实验开始后的第6、12、18和24 h收集藻细胞,再悬浮于BG11培养基中重新培养,分别培养5 d后测定叶绿素a的浓度,同时做蒸馏水代替发酵液的对照处理.
2.5.5 藻液pH值对发酵液溶藻效果的影响利用1 mol · L-1 的盐酸溶液和1 mol · L-1的氢氧化钠溶液将处于对数期的藻液的pH值调节成5.10、6.05、7.07、8.04、9.05、10.15,然后做溶藻实验,探究pH值对藻细胞生长和溶藻效果的影响.
2.5.6 发酵液的酸、碱和热稳定性研究分别利用1 mol · L-1的盐酸溶液和氢氧化钠溶液将发酵液的pH值调节为2和12,然后再用氢氧化钠和盐酸溶液将pH值调回中性;另外再将新鲜的发酵液在121 ℃下高压蒸汽处理20 min,分别利用这3种经过酸化、碱化和高温处理后的发酵液进行溶藻实验,分析溶藻活性物质的酸、碱和热稳定性.
2.6 叶绿素a的测定利用《水和废水监测分析方法》(魏复盛,2002)中的标准方法测定叶绿素a.具体操作为:将藻液振荡均匀后在8000 r · min-1下离心10 min,去掉上清液,尽量获得干燥藻细胞;用5 mL 90%丙酮将底部绿色沉淀溶至50mL锥形瓶中,用透气封口膜加盖两层报纸封口,置于4 ℃冰箱中保存,24 h后取出离心,获得上清液;以丙酮为参比溶液,用分光光度计测定上清液在630、645、665 nm波长处的吸光度(A),根据公式C=11.6×A665-1.31×A645-0.14×A630计算藻液中叶绿素a的浓度(μg · mL-1).
3 结果(Results) 3.1 菌株JM1的分离和鉴定通过驯化筛选,从水体中分离获得了一株在微藻黄化过程中具有数量优势的细菌,命名为JM1.菌株JM1在牛肉膏蛋白胨固体培养基上于25 ℃培养24 h后,可见扁平、边缘整齐、表面湿润光泽、不透明的菌落,随着培养时间的延长,平板颜色逐渐变化为深青色(图 1a),并能分泌一种特殊气味.光学显微镜观察发现,菌体细胞呈短杆状、无芽孢、无荚膜、革兰阴性(图 1b).VITEK 2 COMPACT GN鉴定卡的鉴定结果表明,菌株JM1与铜绿假单胞菌的相似度为98%(表 1).将菌株JM1的16S rRNA 基因序列提交GenBank,获得的登录号为 KJ 7559957,Blast结果表明其与铜绿假单胞菌有98%的同源性.选取铜绿假单胞菌和已分离的具有溶藻作用的菌株的16S rRNA部分基因序列构建的系统发育树(图 2)表明,菌株JM1与已报道的铜绿假单胞菌的亲源关系最近,与BLAST结果一致.综合以上鉴定结果,菌株JM1被鉴定为铜绿假单胞菌JM1,于2014年4月 17日将其保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No. 9070.
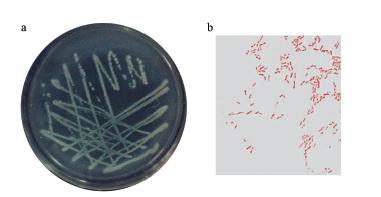 |
| 图 1 菌株JM1的菌落特征(a)和革兰氏染色(b) Fig. 1 Colony characteristics(a) and gram′s staining(b)of strain JM1 |
| 表1 菌株JM1的 VITEK 2 GN 系统鉴定结果 Table 1 Identification result of strain JM1 by VITEK 2 GN system |
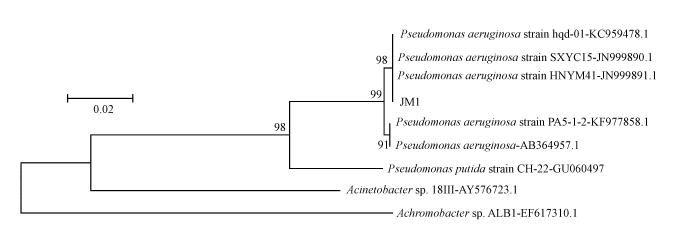 |
| 图 2 基于16S rRNA基因序列构建的系统发育树 Fig. 2 Phylogenetic tree based on the sequence of 16S rRNA |
分别利用包括牛肉膏蛋白胨在内的10种培养基培养菌株JM1,将其发酵液用于溶藻实验.培养过程中发现菌株JM1在不同培养基中的代谢产物的颜色和pH值不同,结果如表 2所示.从表中可以看出,以葡萄糖为碳源、甘油和硫酸铵分别为碳源和氮源时,发酵液的pH值呈酸性,其余培养条件下发酵液呈中性偏碱性.当葡萄糖和蛋白胨分别为碳源和氮源时,发酵液呈橘红色,溶藻效果最好;当葡萄糖和甘油分别为碳源,硝酸钠和硫酸铵分别为氮源,以及牛肉膏蛋白胨为培养基时发酵液的溶藻效果次之;蔗糖为碳源获得的发酵液的溶藻效果最差.根据最终的溶藻效果,确定最佳培养基组成为葡萄糖为碳源、蛋白胨为氮源.研究表明,假单胞菌属细菌在其生长过程中能够合成多种有色物质,龚良玉等(2004)从原油污染的土壤中分离获得的一株能抑制赤潮异湾藻及具齿原甲藻生长的铜绿假单胞菌可产生多种色素.Dakhama等(1993)从鱼腥藻的培养液中分离获得了一株铜绿假单胞菌,其在不同的培养基中生长时产生的色素不同,其中,黄色和橘红色的代谢产物对鱼腥藻的溶藻效果最好.
| 表2 菌株JM1在不同培养基中生长后的发酵液的特征和溶藻效果 Table 2 Characteristics and algicidal effect of fermentation fluid of strain JM1 in different culture media |
分别利用菌株JM1的菌悬液和发酵液做单一和混合添加的溶藻实验,结果如图 3所示.从图中可以看出,只添加菌体细胞时,细胞密度达到1011 CFU · mL-1时才对藻细胞的生长产生影响;菌体细胞密度达到105 CFU · mL-1时,随着细菌密度的增加,菌体细胞和代谢产物的协同溶藻作用逐渐增强.结果表明,菌株JM1可以通过直接和间接两种方式溶藻,但以间接溶藻方式为主,菌体细胞数量只有增加到一定量时,才产生直接溶藻作用,并且只有菌体细胞密度达到一定程度时,二者才有较强的协同溶藻作用.实验过程中观察到菌体细胞的添加比例越大,呈黄色的藻细胞残体的数量越少,藻液的颜色越发白.根据以上结果可推测:菌株JM1与铜绿微囊藻之间可能存在营养和生存空间上的竞争,当只有菌体细胞存在时,较低浓度的菌体细胞不会胁迫藻细胞的生长,并且对发酵液溶藻也没有促进作用;随着菌体细胞密度的增加,菌体细胞可对藻细胞的生长产生胁迫效应,降低了藻细胞对发酵液的抵抗能力,因此,可与发酵液产生协同溶藻效应,并且随着细胞数量的增加,协同作用逐渐增强;当菌体细胞数量增加到一定程度时,除了与藻细胞产生竞争外,还可加速藻细胞及其细胞器的溶解.因此,与具有单一溶藻方式的微生物相比(邱雪婷等,2011;李三华等,2013),菌株JM1在水华控制和应急除藻的实际应用中具有明显的优势,即可投加含有菌体细胞的发酵液,利用菌体细胞和其发酵液的协同作用控制有害藻类的过度生长.同时,菌株JM1还可通过营养竞争来调节水生生态系统的生物量,在水生生态系统平衡的维持方面发挥作用.
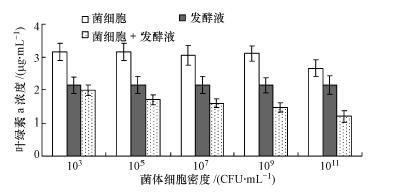 |
| 图 3 菌株JM1的菌体细胞和发酵液的单一和联合溶藻效果 Fig. 3 Single and combined algicidal effect of bacterial cells and fermentation fluid of strain JM1 |
分别利用不同初始密度和添加比例的藻液进行溶藻实验,结果如图 4所示.从图中可以看出,当藻细胞的叶绿素a浓度为1.72 μg · mL-1时,添加比例为1 ∶ 200时仍然可以产生明显的影响;当叶绿素a浓度为2.46 μg · mL-1和3.42 μg · mL-1时,随着添加比例的减少,溶藻效果逐渐降低;当叶绿素a浓度为 3.42 μg · mL-1时,发酵液添加比例为1 ∶ 150和1 ∶ 200时,无明显影响.并且培养过程观察到低密度和高添加量可加快藻液的黄化速度.结果表明,菌株JM1发酵液的溶藻效果随藻细胞初始密度的降低而增强,随发酵液添加量的增加而增强.因此,在实际应用过程中可根据水体中叶绿素a的浓度确定适宜的发酵液添加比例,并且在藻细胞密度低时投加发酵液可在使用量减少的情况下达到相同的溶藻效果,从而减少发酵液使用可能对水生生态系统造成的不利影响.
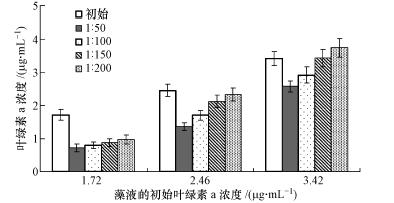 |
| 图 4 不同初始藻密度和发酵液添加比例对溶藻作用的影响 Fig. 4 Effect of initial algal density and additive ratio of fermentation fluid on algae lysing |
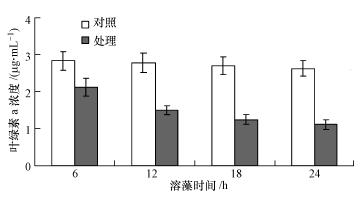
以1 ∶ 100的比例向藻液中加入发酵液,进行溶藻实验,每隔6 h收集藻体细胞重新培养,研究菌株JM1发酵液对藻细胞的毒性是否是可逆的,结果如图 5所示.培养6 h后,菌株JM1的自我恢复能力已受到明显影响,随着溶藻时间的延长,藻细胞的自我恢复能力逐渐下降,当溶藻18 h后,菌株JM1已经无恢复能力.结果表明,在一定的添加比例下,菌株JM1产生的溶藻活性物质可快速对铜绿微囊藻起到抑制和溶解作用,并且藻细胞受到影响后自我恢复能力随时间的延长逐渐下降.因此,在实际应用过程中可尽量在水流和扰动作用小的水华区域内进行溶藻,并且可在短时间内连续投加以保证足够的作用时间,从而防止藻细胞中毒后的自我恢复.
 |
| 图 5 发酵液对藻细胞毒性的可逆性 Fig. 5 Reversibility of toxicity of fermentation fluid to algal cell |
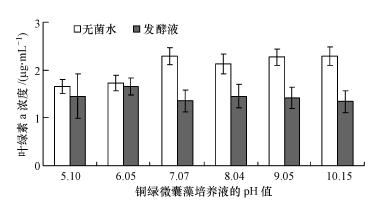
分别利用不同初始pH值的藻液进行溶藻实验,结果如图 6所示.从图中可以看出,不添加溶藻活性物质时,酸性培养液会对藻细胞的生长产生明显的影响,中性和偏碱性条件下藻细胞的生长能力最好;添加发酵液后,酸性条件下发酵液的溶藻效果不明显,但在中性和偏碱性条件下溶藻效果非常明显.结果表明,在中性和偏碱性条件下铜绿微囊藻的数量增加快,但发酵液的溶藻效果也同样增强,在酸性条件下藻细胞的生长能力差,发酵液的溶藻效果也同样较差,具体影响机制还有待于深入研究.富营养化水体的pH值大多呈中性和偏碱性,因此,菌株JM1发酵液在实际的水华治理治理过程中可发挥积极的作用,并且在应用过程中需要监测水体的pH值,以保证最佳的溶藻效果.
 |
| 图 6 pH值对溶藻作用的影响 Fig. 6 Effect of pH value on algae lysing |
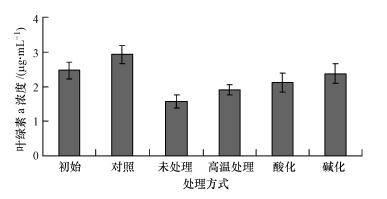
将菌株JM1发酵液的pH值分别利用盐酸和氢氧化钠溶液调节成2和12,放置2 h后再调回中性,做溶藻实验.pH值调节时发现:酸化后发酵液的颜色变为西瓜红,碱化后先变为蓝色然后变为浅棕黄色,当再调回中性时碱化发酵液的颜色变为蓝色,酸化的则变为深绿色.经过酸碱调节后的发酵液的溶藻效果如图 7所示,可以看出,酸化、碱化处理后菌株JM1发酵液仍然保持较强的溶藻活性,但与未处理的相比,溶藻效果略有下降.说明发酵液中可能含有微量的其它溶藻或助溶藻物质,在pH值变化过程中活性逐渐消失或者起溶藻作用的主要物质在酸碱变化过程中结构发生变化,溶藻活性有所下降.同时,从图 7还可以看出,发酵液经过高温处理后,溶藻效果略有下降,但溶藻效果仍然非常明显.以上结果表明,菌株JM1发酵液中起主要溶藻作用的物质酸、碱和热稳定性较高,有利于溶藻活性物质的提取和使用.
 |
| 图 7 不同处理方式对发酵液溶藻作用的影响 Fig. 7 Effect of different treatments on algae lysing |
1)从寒区富营养化水体中分离获得了可通过直接和间接方式控制和溶解铜绿微囊藻的铜绿假单胞菌JM1.研究发现,菌株JM1在不同的培养基中可产生颜色和pH值不同的代谢产物,以葡萄糖和蛋白胨分别为碳源和氮源时获得的发酵液的溶藻效果最好.
2)菌株JM1的溶藻效果随藻细胞初始密度的降低而增强,随发酵液添加量的增加而增强;当菌体细胞的密度达到1011 CFU · mL-1时,可单独抑制藻细胞的生长;当菌体细胞的密度大于105 CFU · mL-1时,菌体细胞可促进发酵液的溶藻作用.
3)发酵液和藻细胞作用6 h时已明显影响了其恢复能力,当暴露时间达18 h时,藻细胞彻底丧失了恢复能力.
4)菌株JM1发酵液在中性和偏碱性的藻液中的溶藻效果最强.酸化、碱化和高温处理不会显著影响发酵液的溶藻效果.
| [1] | Dakhama A,de la Noüe J,Lavoie M C.1993.Isolation and identification of antialgal substances produced by Pseudomonas aeruginosa [J].Journal of Applied Phycology,5(3): 297-306 |
| [2] | 东秀珠,蔡妙英.2001.常见细菌系统鉴定手册[M].北京:科学出版社 |
| [3] | 冯胜,秦伯强,高光.2008.太湖磷转化细菌与水体磷形态关系[J].湖泊科学,20(4): 428-436 |
| [4] | 龚良玉,王修林,李雁宾,等.2004.铜绿假单胞菌产吩嗪类色素的分离纯化及其对赤潮生物生长的影响[J].复旦大学学报(自然科学版),43(4): 494-499,506 |
| [5] | 郭静,Gadafii L,郭安南,等.2012.溶藻弧菌相关分离株的分子及VITEK鉴定[J].水产学报,36(3): 383-390 |
| [6] | 黄继国,彭祥捷,俞双,等.2008.水体结冰期营养盐和叶绿素a的分布特征[J].吉林大学学报(理学版),46(6): 1231-1236 |
| [7] | 金志民,杨春文,金建丽,等.2009.镜泊湖水质及富营养化现状调查[J].水资源保护,25(6): 56-57,75 |
| [8] | 李东,安新丽,傅丽君,等.2013.溶藻细菌BS03分离、鉴定及其对塔玛亚历山大藻生长的影响[J].环境科学学报,33(1): 44-52 |
| [9] | 李明堂,郝林琳,刘梦洋,等.2012.反硝化耐冷菌Acinetobacter johnonii DBP-3的低温除磷特性[J].环境科学学报,32(7): 1557-1562 |
| [10] | 李三华,张奇亚.2013.1株溶藻菌的部分生物学特性及溶鱼腥藻作用[J].环境科学,34(2): 583-588 |
| [11] | 裴海燕,胡文容,曲音波,等.2005.一株溶藻细菌的分离鉴定及其溶藻特性[J].环境科学学报,25(6): 796-802 |
| [12] | 邱雪婷,钱雨婷,周韧,等.2011.溶藻菌N25的筛选及溶藻效果观察[J].上海交通大学学报(医学版),31(10): 1375-1379 |
| [13] | Tian C,Liu X L,Tan J,et al.2012.Isolation,identification and characterization of an algicidal bacterium from Lake Taihu and preliminary studies on its algicidal compounds [J].Journal of Environmental Sciences,24(10): 1823-1831 |
| [14] | 汪辉,刘兆普,魏微,等.2008.一株溶藻菌的分离、鉴定及其溶藻物质的研究[J].中国环境科学,28(5): 461-465 |
| [15] | 王琼,吴伟,季丽.2014.侧孢芽孢杆菌对铜绿微囊藻生长胁迫的研究[J].农业环境科学学报,33(2): 383-391 |
| [16] | 魏复盛.2002.水和废水监测分析方法(第4版)[M].北京:中国环境科学出版社 |
| [17] | 许慧萍,杨桂军,周健,等.2014.氮、磷浓度对太湖水华微囊藻(Microcystis flos-Aquae)群体生长的影响[J].湖泊科学,26(2): 213-220 |
| [18] | Yang F,Wei H Y,Li X Q,et al.2013.Isolation and characterization of an Algicidal bacterium indigenous to Lake Taihu with a red pigment able to lyse Microcystis aeruginosa [J].Biomedical and Environmental Science,26(2): 148-154 |
 2015, Vol. 35
2015, Vol. 35


