2. 辽宁大学药学院, 沈阳 110036
2. School of Pharmacy, Liaoning University, Shenyang 110036
多环芳烃(polycyclic aromatic hydrocarbon,PAHs)是受到广泛关注的一类环境污染物质,在环境中普遍存在,并不断积累.菲(Phenanthrene)是一种三环芳烃,具有一个“湾”区(Bayregion)和一个“K”区(Kregion),这2种结构与PAHs的致癌性有着非常密切的关系,凭借其独特的化学结构,菲成为PAHs研究的模式化合物(艾芳芳等,2008; Li et al., 2010;刘爽等,2013).由于菲具有持久性、生物累积性、致癌、致畸、致突变性及内分泌干扰等特性,对生态环境和人类健康构成重大危害(Wang et al., 2007;杨轩等,2012).
环境中有毒有害有机污染物的自然衰减主要依赖相关微生物代谢作用,生物修复技术具有成本低、效果好、无二次污染等优点,因此该方法是目前菲污染修复最具潜力的修复手段(Samanta et al., 1999;杨秀虹等,2012).从Kiyohara等分离得到一株菲降解菌株以来,相继报道了许多可降解菲的菌株,包括Aeromonas sp.、vanbaalenii、Sphingomonas、Micrococcus sp.、Rhodococcus sp.等(Kiyohara et al., 1976;Stingley et al., 2004;陶雪琴等,2006).近年来国内外科研工作者已从自然环境中分离得到一些菲降解菌,并对其降解性能进行初步研究(侯宁等,2013).Janikowski TB等试验表明投加鞘氨醇单胞菌属菌株的生物反应器能完全降解萘、菲、蒽和芘,在75 h内菲降解速率达到98 mg · L-1 · h-1(Janikowski et al., 2002).倪雪等从多环芳烃污染区植物体内分离得到两株具有降解菲能力的寡养单胞菌属(Stenotrophomonas sp.)和假单胞菌属(Pseudomonas sp.),该两株菌在7 d内可降解90%无机盐培养基中的菲(100 mg · L-1)(倪雪等,2013).邓军等从长期受PAHs污染的土壤中分离得到1株菲降解菌氧化节杆菌(Arthrobacter oxydans),在菲初始质量浓度为50 mg · L-1的无机盐培养液中培养5 d后,菲降解率为60%左右(邓军等,2010).田志刚等从胜利油田附近石油污染土壤采集土样,筛选到能以菲为唯一碳源的芽孢杆菌属,在菲初始浓度为200 mg · L-1时,培养96 h后的菲降解率为98.36%(田智刚等,2011).目前,国内外对高浓度底物环境下菲降解菌株的研究鲜有报道,但是由于工矿业、农业等人为活动以及土壤环境背景值高等因素已经造成了环境中多环芳烃的严重污染及严重超标,并且化工类园区及周边土壤、采油区、采矿区、污水灌溉区的主要污染物都为多环芳烃(刘芳等,2011).因此,筛选出能有效降解高浓度菲的菌株更具应用价值.本实验以质量浓度为1000 mg · L-1的菲作为菌株降解的底物,以期为菲及其它多环芳烃的生物处理提供数据支持.
本研究报道的耳炎假单胞菌(Pseudomonas otitidis.)是在2006年鉴定出的新型假单胞菌属的菌株,但关于该菌株对PAHs降解途径和机理的研究,国内外还未见报道(Clark et al., 2006).同时,基因分析和生化分析显示此菌株非常接近绿脓假单胞菌.由于该菌株第一次是从感染的人耳临床样本中分离得到的,“otitidis”就以它本身菌株的名字命名.Pseudomonas otitidis.曾被报道具有潜在工业运用的标志性特征,如在一个染坊废水处理厂的活性污泥中分离出的WL-13对三苯甲烷染料具有高效脱色能力;在生物反应器中显示出通过使用合成废水和致酸化物质生成多羟基链烷酸酯的能力(Wu et al., 2009;Venkateswar Reddy et al., 2012).根据最新报道,此耳炎假单胞菌(Pseudomonas otitidis )已被王鹏等申请为专利,专利申请号:CN201310480187,其指出该菌株于2013年9月29日保藏于中国武汉大学的中国典型培养物保藏管理中心,保藏编号为CCTCC NO:M2013458,同时指出该菌株可用于水体净化,具有好氧反硝化的功能,营养需求简单,应用前景广阔(王鹏等,2014).本研究从沈阳北部污水处理厂曝气池活性污泥中驯化和分离得到1株以高浓度菲作为碳源的高效菌株,对其进行鉴定,并研究其生长特性和对菲的降解特性,为PAHs 污染环境的生物修复提供参考.
2 材料和方法(Materials and methods) 2.1 菌种来源从沈阳北部污水处理厂曝气池中采集活性污泥,以菲为碳源进行长期驯化,通过多次筛选和分离纯化得到菌株.
2.2 培养基富集培养基:蛋白胨(10 g · L-1)、牛肉膏(3 g · L-1)、NaCl(5 g · L-1)、pH值7.0(含菲溶液).
无机盐培养基:Na2HPO4 · 12H2O(3.8 g · L-1)、KH2PO4(1 g · L-1)、NaCl(1 g · L-1)、MgSO4(0.2 g · L-1)、NH4Cl(0.1 g · L-1)(含菲溶液).
分离培养基:蛋白胨(10 g · L-1)、牛肉膏(3 g · L-1)、NaCl(5 g · L-1)、琼脂15%~20%,pH值7.0(含菲溶液).
2.3 菌株的驯化、筛选和分离将采集的活性污泥加入富集培养基中进行富集培养,得到可降解菲的菌株.利用以菲为碳源的无机盐培养基进行菌株驯化,7 d为一个驯化周期,每周期按序增大培养基中菲的浓度.当菲的驯化浓度提高到1000 mg · L-1时,待培养液颜色变成红棕色,即混合菌液降解菲效果稳定后,菌株降解菲能力驯化结束.选取不同稀释倍数下驯化后的菌液,分别涂布于分离培养基平板上,并做若干平行样.待菌落特征明显后,挑取周围形成透明圈的典型单菌落,经过几个周期的反复平板划线分离后,镜检得到20株以菲为碳源的纯菌株,进行菌株降解能力实验,最终从6株降解率较高的菌株中筛选得到1株对菲有高效降解性能的菌株W12.
2.4 分析方法菲浓度的测定采用紫外分光光度法,即将经处理后的菲溶液加入环己烷萃取,5000 r · min-1离心分离15 min后转入分液漏斗中静置分层.取上清液,把下层液体放回摇瓶用等体积环己烷重复萃取离心,合并萃取液,用无水硫酸钠过滤后放入10 mL容量瓶中,用环己烷定容.稀释一定倍数以环己烷为空白对照,于251 nm波长处测定吸光度.菌体细胞浓度的测定采用光电比浊法,在紫外分光光度计中,由于菌体散射及吸收作用,紫外光透过菌液时的光透过量降低,在一定范围内,菌体细胞浓度跟透光率成反比,即与光密度值成正比,菌液样品的光密度值越大说明菌液内细胞浓度越大.本实验的菌体细胞浓度以OD600来表示,即波长为600 nm时紫外光透过所测定菌液样品的光密度值.
2.5 菌株鉴定常规鉴定:根据菌株的革兰氏染色反应结果、个体形态、菌落特征对菌株进行初步鉴定.
16S rDNA序列分析:从目的菌株W12中提取DNA后,以菌株的DNA为模板,利用通用引物F27(5′AGACTTTGATCCTGGCTCAG -3′)和R1492(5′-ACGGTTACCTGTTACGACTT -3′)进行PCR扩增,构建25 μL的反应体系:1 μL DNA模板、2 μL dNTP、2.5 μL 10×PCR Buffer、引物各1 μL、0.2 μL Taq酶、17.3 μL去离子水.PCR反应流程:①94 ℃预变性(5 min);②94 ℃变性(30 s),58 ℃退火(30 s),72 ℃延伸(90 s),共30个循环;③重复第二步,共30个循环;④72 ℃复性(10 min);⑤4 ℃保持,将PCR扩增产物与PMD18-T载体(Takara公司生产)连接,转化到大肠杆菌感受态细胞.16S rDNA测序工作由哈尔滨博仕生物技术有限公司完成,将测得的16S rDNA序列在GenBank进行Blast,对获得的同源序列进行序列分析.用BioEditv 5.06进行多序列比对,采用MEGA 4.0软件中的邻接法(Neighbor-joining,NJ)构建系统进化树.
3 结果(Results) 3.1 菌株筛选结果将纯化分离得到的20株以菲为碳源的目标菌株进行初筛,按照序号依次进行菲降解能力实验.将目标菌株分别接入到无机盐培养基(其中菲浓度为1000 mg · L-1)中好氧培养,并测定其在7 d的菲降解率,降解情况如图 1所示.由图 1可见,20株菌株中有6株菌株降解性能比较突出,降解率达到50%以上,菌株分别编号为W2、W6、W9、W12、W16和W20.将初筛得到的6株降解性能良好的降解菌株进行复筛,分别在菲为1000 mg · L-1的无机盐培养基中,振荡培养7 d,菌株降解情况如图 2所示.由图 2可见,菌株W12降解菲的能力最强,故确定菌株W12为高效菲降解菌,对W12的形态特征进行分析,并对其进行菲降解实验.
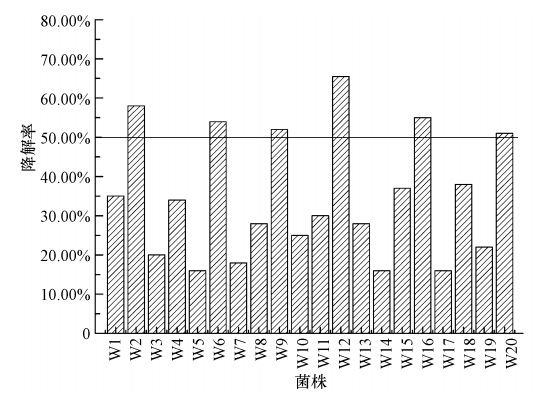 |
| 图 1 不同菌株的菲降解率 Fig. 1 Degradation rate of different phenanthrene degradation bacteria |
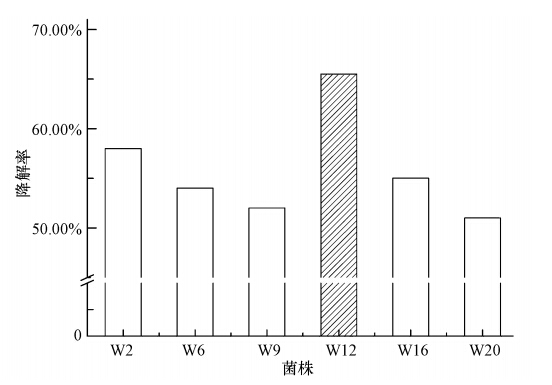 |
| 图 2 6株高效菌株的菲降解率 Fig. 2 Degradation rate of six high effective phenanthrene degradation bacteria |
菌株W12:菌落凸起,表面湿润、淡黄色(随着培养时间的延长菌体颜色越来越深)、不透明、易挑起、边缘不整齐、无芽孢、无鞭毛、革兰氏染色呈阴性、菌株个体为杆状、大小为(0.3~0.6)μm×(1.1~3.2)μm.
3.2.2 菌株W12的鉴定根据菌株W12的形态特征和16S rDNA分子水平测序结果,确定菌株W12为耳炎假单胞菌(Pseudomonas otitidis.),该菌在GenBank中登录号为AY953147.图 3为菌株W12系统进化树(代号W为菌株W12).目前,在环境领域内关于该菌株的应用鲜有报道.因此,得到高效的菲降解菌对含菲废水及多环芳烃污染的处理和深度修复有重要的理论和实际意义.
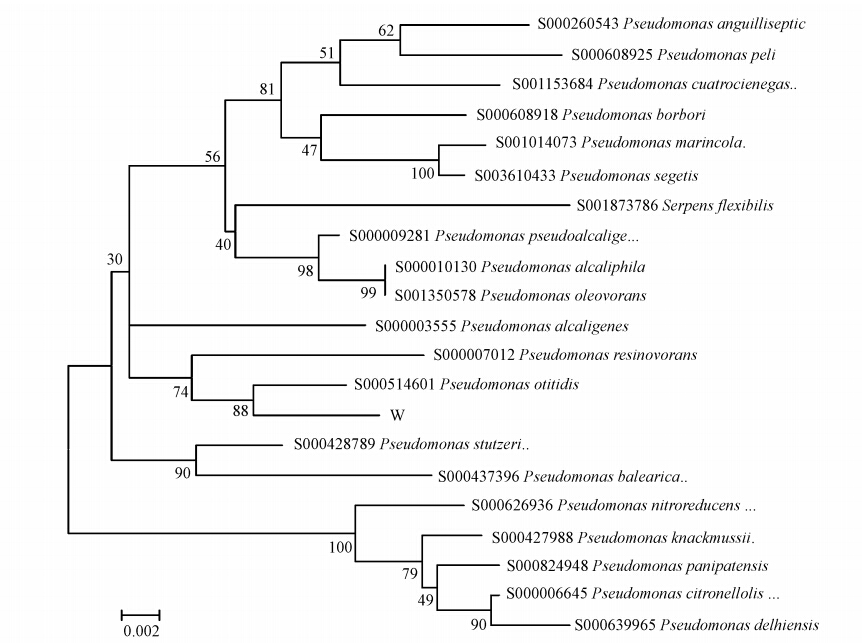 |
| 图 3 菌株W12系统进化树 Fig. 3 Phylogenetic tree of the strain W12 |
本实验将处于对数生长期的菌株W12按10%的接种量(原菌液的吸光度OD600为0.20)接种于含有初始菲浓度为1000 mg · L-1的无机盐培养基中,振荡培养,并做平行实验3次,菌株W12的生长和降解曲线如图 4所示.从图 4中可以看出,在0~24 h菌株W12生长速度缓慢,应为适应期;24~72 h菌株生长加快,并大量繁殖,为菌株的对数生长期,同时菲降解率提高较快;72~96 h生长速度开始平缓,菌体数量也不再发生大变化,为菌株的稳定期,并在96 h时菲降解率达到65.01%;在96 h以后出现菌株负增长的趋势,为菌株生长的衰亡期,菲降解开始不明显,其原因可能为菲降解菌W12降解菲后产生的代谢产物阻碍了菌株的生长繁殖,也有可能为碳源不足导致菌株自溶死亡.因此本实验选定的最佳降解时间为96 h.
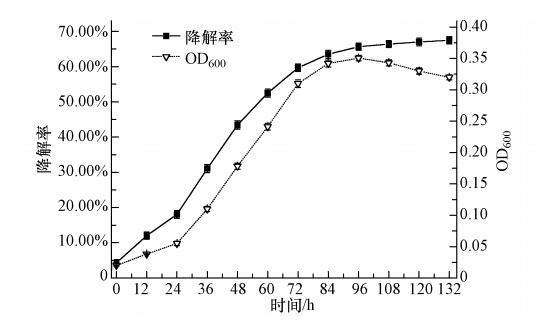 |
| 图 4 菌株W12生长曲线和菲的降解曲线 Fig. 4 Growth curve of strain W12 and phenanthrene degradation |
温度是微生物生存繁殖的重要环境影响因素.本实验将处于对数生长期的菌株W12按10%的接种量(原菌液的吸光度OD600为0.20)接种于含有初始菲浓度为1000 mg · L-1、盐度为0.5%的无机盐培养基中,并在pH 7.0的条件下振荡培养96 h(摇床转速为170 r · min-1).与此同时,分别考察菌株W12在不同温度(15、20、25、30、35、40 ℃)下的适应性,并做平行实验3次.96 h时菌株W12在各个温度下的生长和菲被降解的情况如图 5所示.从图 5可知,菌株W12在不同温度下均生长,并且菌株降解菲具有较广的温度适宜范围,且温度对菌株生长和菲降解的影响一致;30 ℃时菌株生长量与菲降解率均达到最高;30 ℃以下时,随着温度的上升,菌株生长增加,菲的降解率升高,但30 ℃以上时,随着温度的上升,菌株生长减退,对菲的降解显著降低,并且低温时菌株的生长及菲的降解率均高于高温,说明W12菌株更适应低温胁迫.因此选定30 ℃为菌株W12降解菲的最适温度.
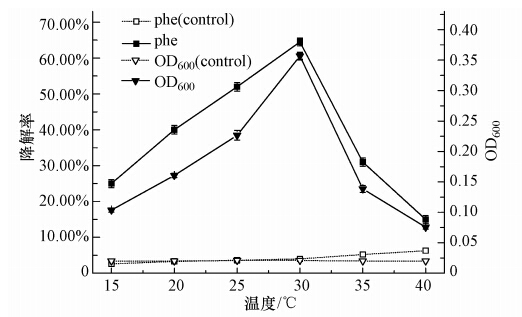 |
| 图 5 温度对菌株W12生长和降解率的影响 Fig. 5 Effects of temperature on the growth and degradation rate of W12 |
任何微生物都有其生长最迅速的pH值,即最适pH值,且pH值对微生物的生长繁殖有着很大的影响.本实验将处于对数生长期的菌株W12按10%的接种量(原菌液的吸光度OD600为0.20)接种于含有初始菲浓度为1000 mg · L-1、盐度为0.5%的无机盐培养基中,并在温度为30 ℃的条件下振荡培养96 h(摇床转速为170 r · min-1).与此同时,分别考察菌株W12在不同pH(4.0、5.0、6.0、7.0、8.0、9.0)下的适应性,并做平行实验3次.96 h时的菌株W12在各个pH下的生长和菲被降解的情况如图 6所示.从图 6可知,菌株W12对pH 的适应范围较小,酸性条件(pH=4.0)时,菌株W12的生长及对菲的降解率都很低,仅在 pH 为6.0~8.0之间生长较好,但在酸性条件(pH=5.0~6.0)下的生长量及菲的降解率要大于碱性条件(pH=8.0~9.0);并且根据图 7可看出菌株W12的生长和菲降解率在pH为7.0时达到最大值,因此选定pH=7.0为菌株W12降解菲的最佳pH.
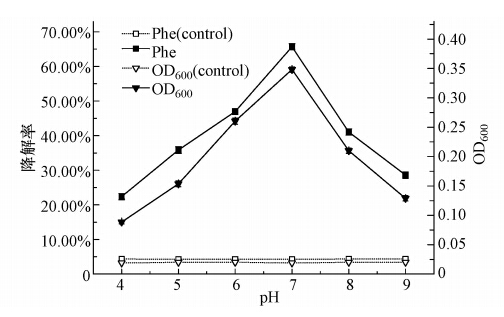 |
| 图 6 pH对菌株W12生长和降解率的影响 Fig. 6 Effects of pH on the growth and degradation rate of W12 |
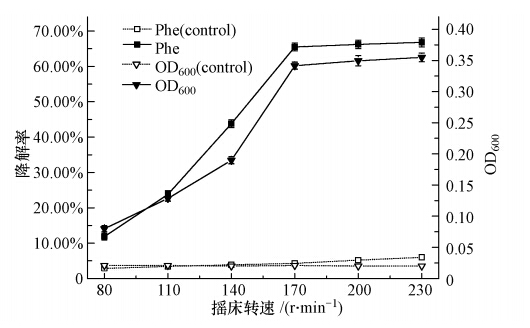 |
| 图 7 摇床转速对菌株W12生长和降解率的影响 Fig. 7 Effects of shaker rotary speed on the growth and degradation rate of W12 |
摇床转速间接地反映了实验环境培养液中的溶解氧含量.本实验将处于对数生长期的菌株W12按10%的接种量(原菌液的吸光度OD600为0.20)接种于含有初始菲浓度为1000 mg · L-1、盐度为0.5%的无机盐培养基中,并在温度为30 ℃、pH为7.0的条件下振荡培养96 h.与此同时,分别考察菌株W12在不同摇床转速(80、110、140、170、200、230 r · min-1)下的适应性,并做平行实验3次.96 h时的菌株W12在各个摇床转速下的生长和菲被降解的情况如图 7所示.从图 7可知,当摇床转速过低(低于110 r · min-1)时,菌株W12的生长及菲降解能力均受到一定程度抑制,随着摇床转速的加快,菌株W12的生长及菲降解能力呈增长趋势,经分析可能的原因是菌株W12为好氧菌,随着摇床转速的提升,空气中的氧气向培养基扩散速率上升,很好的满足菌株生长代谢的需求,但当摇床转速提升到170 r · min-1时,增长趋势开始缓慢,可能原因为摇床过于震荡造成菌株细胞破裂或培养液中的溶解氧已达到饱和.因此,从能量与效率角度考虑,认为菌株W12降解菲的最适摇床转速为170 r · min-1.
3.4.4 接种量对菌株W12生长和降解率的影响本实验将处于对数生长期的菌株W12按不同的初始接种量(1%、5%、10%、15%、20%,且原菌液的吸光度OD600为0.20),接种于含有初始菲浓度为1000 mg · L-1、盐度为0.5%的无机盐培养基中,在温度为30 ℃、pH为7.0的条件下振荡培养96 h(摇床转速为170 r · min-1),并做平行实验3次.96 h时菌株W12在各个初始浓度下的生长和菲被降解的情况如图 8所示.从图 8可知,当初始接种量小于10%时,其显著影响了菲降解率,随着初始接种量的增加,菌株W12的生长及菲降解率也随之增加,但当初始接种量大于10%时,初始接种量的增加对菌株W12的生长及菲降解率的影响并无显著性差异,造成此现象的可能原因是过大的初始接种量促使培养液中菌株的密度过大,从而使得菌株处于碳源不足的贫营养状态,进而菌株无法正常的生长繁殖.因此,菌株W12降解菲的最适接种量为10%.
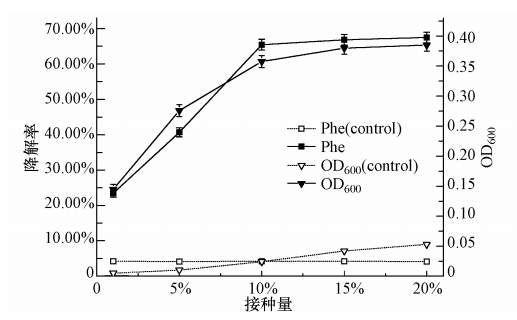 |
| 图 8 接种量对菌株W12生长和降解率的影响 Fig. 8 Effects of inoculum on the growth and degradation characteristics of the W12 |
盐度也是微生物降解菲能力的重要影响因素.盐度的变化主要体现为环境渗透压的变化,过高的盐度可促使细胞原生质分离,最终导致微生物的死亡.本实验将处于对数生长期的菌株W12按10%的接种量(原菌液的吸光度OD600为0.20)接种于含有初始菲浓度为1000 mg · L-1的无机盐培养基中,并在温度为30 ℃、pH为7.0的条件下振荡培养96 h(摇床转速为170 r · min-1).与此同时,分别考察菌株W12在不同盐度(0%、0.1%、0.5%、1.0%、2.0%、3.0%、4.0%)下的适应性,并做平行实验3次.96 h时菌株W12在各个盐度下的生长及菲被降解的情况如图 9所示.从图 9可知,盐度对菌株W12的菲降解率有显著影响.盐度为0%~0.5%时,菌株W12的生长及菲降解率呈现明显的上升趋势,但当培养基内盐度高于0.5%时,菌株的生长受到抑制,特别是盐含量达到2.0%时,高盐含量严重抑制了菌株的生长,从而导致菲降解率明显下降.因此认为菌株W12降解菲的最适盐度为0.5%.
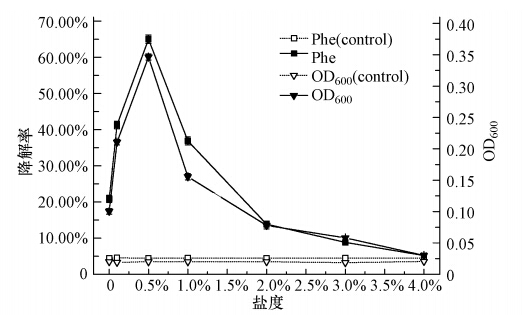 |
| 图 9 盐度对菌株W12生长和降解率的影响 Fig. 9 Effects of salinity on the growth and degradation rate of W12 |
本实验将处于对数生长期的菌株W12按10%的接种量(原菌液的吸光度OD600为0.20)接种于无机盐培养基中,并在温度为30 ℃、pH为7.0的条件下振荡培养96h(摇床转速为170 r · min-1).与此同时,分别考察菌株W12在不同菲初始浓度(100、500、1000、1500、2000、2500 mg · L-1)下的适应性,并做平行实验3次.96h时菌株W12在各个浓度下的生长及菲被降解的情况如图 10所示.由图 10可以看出,菌株W12在100~500 mg · L-1菲含量培养基上生长缓慢,菲降解率变化也相对缓慢,分析原因可能是菲含量过低造成培养基中的碳源不足;随着菲含量的加大,菌株W12在500~1000 mg · L-1菲含量培养基生长速度相应加快,且菲含量为1000 mg · L-1时,培养基中生物量达到最大,菲降解效果较好,当菲含量大于1000 mg · L-1时随着菲含量的增大菌株的生长及对菲的降解都有所抑制,但当菲含量为2000 mg · L-1时,菌株生长量为0.2256,降解率仍达20.65%,说明菌株W12是一种降解菲及耐受菲能力均较强的菌株,对多环芳烃适应性较强.
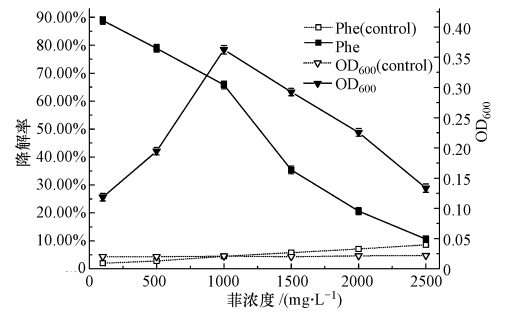 |
| 图 10 菲初始浓度对菌株W12生长和降解率的影响 Fig. 10 Effects of initial concentration of phenanthrene on the growth and degradation rate of W12 |
为验证培养基中添加有机物是否可以促进微生物降解有机污染物.本实验将处于对数生长期的菌株W12按10%的接种量(原菌液的吸光度OD600为0.20)接种于含有初始菲浓度为1000 mg · L-1的无机盐培养基中,并在温度为30 ℃、pH为7.0的条件下振荡培养96 h(摇床转速为170 r · min-1).与此同时,分别考察酵母膏、葡萄糖、蛋白胨的加入(加入比例1‰)对菌株W12生长和降解菲的影响,并做平行实验3次.96 h时菌株W12的生长及菲被降解的情况如图 11所示.由图 11可以看出,向培养基中投加有机质蛋白胨、酵母膏后,对菌株W12的生长和菲降解起到促进效应,而葡萄糖的加入则抑制了菌株生长和菲降解,在此实验过程中,蛋白胨、酵母膏为微生物提供了生长所需物质,同时和污染物质不形成竞争性抑制,没有毒害性,促进了其生长,这与它们对菲降解影响的次序刚好一致,说明此条件下菌体生长状况可以反映其对菲的降解进程,而葡萄糖对比菲,具有结构简单,容易被菌株分解代谢与利用等特点,所以菌株W12更倾向利用葡萄糖,致使其生长并没有受到明显影响,但菲的利用却受到严重抑制.因此认为蛋白胨、酵母膏是菌株W12生长的必须营养物质.
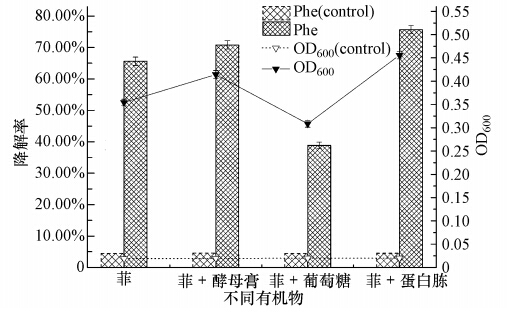 |
| 图 11 有机物对菌株W12生长和降解率的影响 Fig. 11 Effects of organics on the growth and degradation rate of W12 |
1)从沈阳北部污水处理厂曝气池的活性污泥中分离获得6株能以菲为碳源生长的高效菌株,菌株编号为W2、W6、W9、W12、W16和W20,在温度为30 ℃条件下,菲浓度为1000 mg · L-1的无机盐培养基中培养7 d后,对菲的降解率均达到50%以上,其中菌株W12表现出来的降解效果最佳,该6株菌株进行复筛时,菌株W12的菲降解率达65.51%,故确定菌株W12为高效菲降解菌.
2)菌株W12革兰氏染色呈阴性,其菌落在固体培养基中呈淡黄色,不透明,边缘不整齐,无芽孢,无鞭毛,菌株个体为杆状.并依据16S rDNA基因测序结果,菌株W12鉴定为耳炎假单胞菌(Pseudomonas otitidis.),并绘制了其进化树.目前针对耳炎假单胞菌(Pseudomonas otitidis.)的报道很少,尤其是利用其降解多环芳烃的研究尚未见报道.
3)菌株W12的生长和降解性能实验结果表明:菌株降解菲的最适温度为30 ℃;最适pH值为7.0;最适摇床转速为170 r · min-1;最适接种量为10%;最适宜盐度为0.5%;当菲质量浓度为1000 mg · L-1时,降解率达到65.80%,对菲的耐受浓度可以达到2000 mg · L-1;当加入蛋白胨和酵母膏时,对菌株降解菲起到了促进作用,降解率分别提高到75.65%和70.85%,而葡萄糖的加入则抑制了菌株对菲的降解.
| [1] | 艾芳芳, 曲媛媛, 周集体, 等. 2008. 菲降解菌株的分离鉴定及特性研究[J]. 环境科学, 29(4): 1066-1071 |
| [2] | Clark L L, Dajcs J J, McLean C H, et al. 2006. Pseudomonas otitidis sp. nov., isolated from patients with otic infections[J]. International Journal of Systematic and Evolutionary Microbiology, 56(4): 709-714 |
| [3] | 邓军, 尹华, 叶锦韶, 等. 2010. 菲降解菌的降解特性及菲对其细胞表面形态的影响[J]. 暨南大学学报(自然科学与医学版), 31(1): 53-57 |
| [4] | 侯宁, 李春艳, 成小松, 等. 2013. 一株菲降解菌筛选鉴定及降解性能研究[J]. 东北农业大学学报, 44(8): 48-52 |
| [5] | Janikowski T B, Velicogna D, Punt M, et al. 2002. Use of a two-phase partitioning bioreactor for degrading polycyclic aromatic hydrocarbons by a Sphingomonas sp. [J]. Applied Microbiology and Biotechnology, 59(2/3): 368-376 |
| [6] | Kiyohara H, Nagao K, Nomi R. 1976. Degradation of phenanthrene through o-phthalate by an Aeromonas sp. [J]. Agricultural and Biological Chemistry, 40(6): 1075-1082 |
| [7] | Li J W, Shang X, Zhao Z X, et al. 2010. Polycyclic aromatic hydrocarbons in water, sediment, soil and plants of the Aojiang River waterway in Wenzhou, China[J]. Journal of Hazardous Materials, 173(1/3): 75-81 |
| [8] | 刘爽, 刘娟, 凌婉婷, 等. 2013. 一株高效降解菲的植物内生细菌筛选及其生长特性[J]. 中国环境科学, 33(1): 95-102 |
| [9] | 刘芳, 梁金松, 孙英, 等. 2011. 高分子量多环芳烃降解菌LD29的筛选及降解特性研究[J]. 环境科学, 32(6): 1799-1804 |
| [10] | 倪雪, 刘娟, 高彦征, 等. 2013. 2株降解菲的植物内生细菌筛选及其降解特性[J]. 环境科学, 34(2): 746-752 |
| [11] | Samanta S K, Chakraborti A K, Jain R K. 1999. Degradation of Phenanthrene by different bacteria: Evidence for novel transformation sequences involving the formation of 1-naphthol[J]. Applied Microbiology and Biotechnology, 53(1): 98-107 |
| [12] | Stingley R L, Khan A A, Cerniglia C E. 2004. Molecular characterization of a phenanthrene degradation pathway in Mycobacterium vanbaalenii PYR-1[J]. Biochemical and Biophysical Research Communications, 322(1): 133-146 |
| [13] | 陶雪琴, 卢桂宁, 党志, 等. 2006. 菲降解菌株GY2B的分离鉴定及其降解特性[J]. 中国环境科学, 26(4): 478-481 |
| [14] | 田智刚, 李红芳, 梁生康, 等. 2011. 一株菲降解细菌的分离、鉴定及其降解特性研究[J]. 青岛科技大学学报(自然科学版), 32(1): 39-41 |
| [15] | Venkateswar Reddy M, Nikhil G N, Venkata Mohan S, et al. 2012. Pseudomonas otitidis as a potential biocatalyst for polyhydroxyalkanoates (PHA) synthesis using synthetic wastewater and acidogenic effluents[J]. Bioresource Technology, 123: 471-479 |
| [16] | Wang B C, Wang Q H, Zhu L C, et al. 2007. Degrade naphthalene using cells immobilized combining with low-intensity ultrasonic technique[J]. Colloids and Surfaces (B: Biointerfaces), 57(1): 17-21 |
| [17] | 王鹏, 甄丽, 郑玉莲. 2014. 一种耳炎假单胞菌株及其应用[D]. 中国, A, 201310480187. 2014-1-22 |
| [18] | Wu J, Jung B G, Kim K S, et al. 2009. Isolation and characterization of Pseudomonas otitidis WL-13 and its capacity to decolorize triphenylmethane dyes[J]. Journal of Environmental Sciences, 21(7): 960-964 |
| [19] | 杨轩, 张威, 李师翁, 等. 2012. 多环芳烃降解菌的分离鉴定及其生理特性研究[J]. 环境科学学报, 32(5): 1033-1040 |
| [20] | 杨秀虹, 汤婉环, 李适宇. 2012. 一株菲降解菌的生长特性及其对荧蒽和芘的降解能力[J]. 中山大学学报(自然科学版), 51(1): 107-113 |
 2015, Vol. 35
2015, Vol. 35


