沉积物微生物燃料电池(SMFC)是一种特殊的生物电化学系统,其基本构型为置于厌氧沉积物层的阳极和置于好氧水层的阴极.通过阴阳极之间的溶解氧梯度,形成电位梯度,实现质子在水相和沉积物相的迁移和电子在外电路中的转移.SMFC装置通过为沉积物层提供电子受体,实现底泥的原位修复,同时产生电能.
SMFC最初用于海洋环境,又称为深海底泥微生物燃料电池,借助电导率较高的海水(一般为25~40 mS · cm-1)使装置具有较好的导电性,通过后期放大电路,可满足小型传感设备用电需求(Donovan et al., 2008).随着近年来的不断发展,SMFC也开始应用于淡水湖泊和湿地方面的研究.目前,关于SMFC的研究主要集中在电极材料、反应装置的构型等方面,而关于沉积物的来源和性质对SMFC产电性能的影响研究还比较少.沉积物是SMFC系统中微生物和有机质的来源,因而对SMFC的性能具有重要影响.已有研究表明,对比农田土壤MFC和森林土壤MFC的输出功率、呼吸速率以及微生物种群,发现利用农田土壤作为基质可以得到更加稳定高效的阳极产电菌群(Dunaj et al., 2012).在最初关于SMFC的报道中,SMFC的输出功率仅为10~20 mW · m-2(Reimers et al., 2001).贺震等采用旋转式阴极以提高阴极的溶解氧浓度,在沉积物中添加2.16 g · L-1蔗糖溶液作为基质,输出功率可提高到49 mW · m-2(He et al., 2007).也有报道采用石墨毡阴极和活性碳纤维毡阳极,SMFC的最大输出功率达到了(74.5±7.5)mW · m-2(Song et al., 2012a).尽管沉积物的来源和有机质含量对SMFC的运行性能具有重要影响,但是有关沉积物的性质与SMFC运行效果的关系的研究还十分有限.
本研究选取了6种自然环境中常见的沉积物,利用沉积物中固有的微生物菌群,通过周期性的驯化过程,考察沉积物的性质对SMFC产电性能的影响.
2 材料与方法(Materials and methods) 2.1 沉积物选择6种不同来源的沉积物作为SMFC的基质,沉积物来源及有机质含量(即挥发性固体VS占总固体干重TS的百分比)如表 1所示.分别选取6种沉积物中有机质含量最高(F)和最低(E)的沉积物,在不外加碳源的条件下,构建SMFC-G和SMFC-H作为对照组,考察沉积物中的有机质含量对SMFC产电性能的影响.对沉积物的盐度进行分析,SMFC-A和SMFC-B,具有较高盐度,为0.22%,其他4种沉积物盐度均低于0.1%.
| 表1 沉积物来源及有机质含量 Table 1 Sediment source and the volatile solid contents |
SMFC的阴极和阳极均采用厚度为10 mm,直径为75 mm的活性炭毡(阴阳极面积比为1 ∶ 1),两极通过直径1 mm的钛丝相连,负载为1000 Ω.SMFC反应器为直径80 mm,高70 mm的圆柱形容器.阳极水平置于下层沉积物中,阳极上层和下层的沉积物厚度为10 mm,反应器在启动过程中,沉积物中的氧气被微生物消耗殆尽,形成厌氧环境.
沉积物层上方为2 cm高的水层,为了保证阴极与氧气充分接触,阴极置于水层表面,阴极附近的溶解氧浓度为4.50~4.94 mg · L-1,水层电导率为724~794 μS · cm-1.阴极的预处理参照Logan方法(Cheng et al., 2006),表面涂刷0.5 mg · cm-2的20%的铂碳催化剂(以Pt计).实验过程中由于蒸发造成的水分损失通过蒸馏水来补充.在进行补充蒸馏水的操作时,反应器阴极液的pH、电导率以及含盐量都会相对趋近于反应器的初始状态,同时也与江河湖泊通过降雨等形式维持稳定的水环境较为类似(An et al., 2010).
在SMFC装置A~F中均匀投加乙酸钠作为微生物碳源,每个产电周期投加0.183 g 乙酸钠(相当于0.5 g(COD)· dm-3(电极体积)),将乙酸钠溶解为25 mL的溶液,采用针孔注射器多点均匀缓慢投加至阳极的多孔结构中.
2.3 分析方法使用高精度性能测试仪(CT-3008W-5V50mA-S4,新威尔,深圳)对SMFC的输出电压进行实时监测.记录的电压数据通过欧姆定律转化成电流数据,并根据式(1)计算得到功率密度.

式中,U为负载两端的输出电压(V),I为通过负载的电流(A),A为阳极的几何面积(m2),P为功率密度(W · m-2).
极化曲线和最大功率密度的测定方法为:将反应器开路稳定2 h,将外阻从10000 Ω逐渐改变至10 Ω,每个阻值下保持30~60 min,记录在每个阻值下达到稳态时的输出电压,将电压对电流作图,斜率即为系统的内阻,将功率密度对相应电流作图,曲线的最高点的值即为最大功率密度.
沉积物的TS和VS测定方法参照《水和废水监测分析方法》(魏复盛,2002).沉积物盐度在配置5 ∶ 1水土浸出液后,用电导率仪测定,并以盐的质量百分含量表示.
微生物群落结构分析选用OMEGA公司土壤DNA提取试剂盒Soil DNA Kit E.Z.N.A.TM(OMEGA D5625-01,USA)对沉积物DNA进行提取,并利用PCR仪(Eppendorf 5331,Hamburg,Germany)进行PCR扩增,上下游引物分别为 968F-GC和1392R.变性梯度凝胶电泳(DGGE)分析采用美国C.B.S. SCIENTIFIC 公司的DGGE-2001系统,电泳缓冲溶液为1×TAE.在150 V电压下电泳6 h后,将胶板进行EB染色,采用Quantum ST4 成像系统(Vilber,Quantum ST4,France)进行凝胶成像,并采用软件Quantity One进行种群多样性分析.
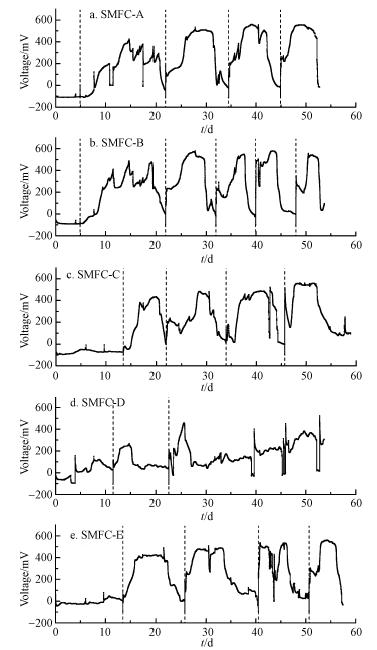
3 结果与讨论(Results and discussion) 3.1 输出电压图 1为SMFC A-E的输出电压变化.图 1中由虚线和纵坐标轴划分的第一阶段为未投加乙酸钠的阶段,由此阶段可以看出在该实验条件下,此5种沉积物不能实现自发产电.因此,在电压稳定一段时间后,开始周期性投加碳源,图中虚线表示反应器加入碳源的时间点,即两条虚线之间为一个产电周期.在外加充足碳源的条件下,SMFC A-E开始产电,由此可见,影响该5种沉积物产电的主要因素是有机物含量.不同来源的沉积物构建的SMFC表现出不同的产电特性,由于外阻相同,图 1中输出电压较高的SMFC,其输出功率也较高,由此可以衡量不同沉积物的自然菌群结构是否具有产电优势.
 |
| 图 1 SMFC-A、B、C、D、E运行过程的输出电压 Fig. 1 Output voltage of SMFC-A,B,C,D,E |
图 1a和1b为表层底泥SMFC-A和浅层底泥SMFC-B的产电情况,两个反应器在启动后5 d内,电压稳定在-100 mV,之后向阳极表面添加乙酸钠以促进微生物的代谢活动.SMFC-A在添加乙酸钠之后,电压缓慢上升,第15天时达到最大输出电压416.3 mV,在第21 d时电压迅速下降,在24 h内下降至50 mV以下,认为第一个产电周期结束,加入的乙酸钠被微生物消耗掉.第一个周期为菌种的驯化期,随着之后几个周期的进行,可以明显看出除了由于反应器液位波动而产生电压的小范围波动外,达到峰值电压的时间逐渐缩短并且峰值电压有所提高.虽然A、B两个反应器在运行的最初阶段产电较为相似,但是随着反应时间的延长,反应器消耗定量碳源完成一个周期的时间逐渐缩短.此外,同样的运行时间内SMFC-A运行了4个周期,而SMFC-B完成了5个周期的运行,SMFC-B单位周期的产电量(180.6 C)明显小于SMFC-A(299.9 C),这可能是由于SMFC-B中的其它厌氧菌与产电微生物竞争基质,使得部分基质未能被产电微生物利用产生电荷.
如图 1c所示,花池土壤接种的SMFC-C在开始的两周内,没有有效的电流产生,而在加入乙酸钠强化产电后,出现明显周期性产电变化,这说明在短期内,产电微生物不能利用花池土壤中的有机物,在加入乙酸钠后,对产电菌起到了一定的富集作用.
接种花池土壤和厌氧污泥混合沉积物的SMFC-D(见图 1d)在初始的1个月没有规律性产电状况,而在1个月后,除了由于水分损失和补充造成的波动,输出电压呈现出稳步上升的趋势,但是在实验周期内电压一直在300 mV以下,明显低于其他反应器的输出电压.这可能是由于厌氧污泥中含有丰富的厌氧微生物,与产电菌竞争基质,因此尽管完成一个产电周期的时间较短,但产生的最大输出电压相对较低.
图 1e所示为1#校园景观湖表层底泥(VS/TS=3.1%)的输出电压.在加入碳源后,反应器的4个产电周期的峰值电压分别为420、490、530 mV和560 mV.在消耗相同量碳源的情况下,产电周期逐渐缩短,产电菌逐渐在阳极驯化富集.在产电实验后期,可以看出由于水分的蒸发和补充造成的液面波动使得输出电压大幅度波动,这与加水过程中对阴极与氧气接触的扰动有一定关系.在后期构建的SMFC-H(不加碳源运行,VS/TS=2.4%)中,输出电压长期稳定在-100 mV左右,这个现象与SMFC-E在初期未加碳源时的情况较一致,说明该装置在沉积物有机质含量较低时,不能实现有效的产电.
尽管微生物可以利用电极作为电子受体来完成在MFC中的筛选和富集,但是仍然有大量的非产电菌生长在阳极的生物膜中.如果这些非产电细菌在初始的接种阶段占据阳极上的大量空间,就会抑制MFC的有效产电.除此之外,进行厌氧呼吸的产甲烷菌和反硝化菌也会在阳极上与产电菌发生竞争(Song et al., 2012b).
随着产电周期数的增加,阳极逐渐形成生物膜,微生物的驯化将提高阳极电容,提升产电能力(Peng et al., 2013).对各个SMFC的启动时间进行比较可以发现,达到最大输出电压以及完成启动的时间各不相同.如上文所述,随着产电的进行,达到最大输出电压所需的时间逐渐缩短.阳极还原菌在阳极表面形成生物膜对于MFC的构建有重要作用,达到最大电压所用的时间从1 h到2个月不等(Sonawane et al., 2013),所以对于选择合适的接种沉积物,建立高效的微生物结构来缩短启动时间非常重要.
图 2为有机质含量较高(VS/TS=12.6%)的2#校园景观湖表层底泥构建的SMFC输出电压变化情况,SMFC-F在运行第4 d投加乙酸钠,SMFC-G为不外加碳源的对照组.由图 2可见,SMFC-F由于其较高的VS含量,可以实现自发产电.SMFC-F与SMFC-G输出电压差别不大,稳定产电时间可达到20 d左右.在运行25 d内,SMFC-F和SMFC-G产生电荷总量也较为相近,分别为841.4 C和958.0 C.由此可见,在沉积物有机质含量较高时,有机质不再作为限制微生物产电的因素,不需要外加碳源来实现电能的输出.
 |
| 图 2 SMFC-F、G运行阶段输出电压 Fig. 2 Output voltage of SMFC-F,G |
因此,相比于SMFC A~E接种的各种沉积物,仅有接种VS含量较高的2#校园景观湖表层底泥的SMFC-F可以在不外加碳源的条件下实现电能的输出.在SMFC A~E沉积物中阶段性投加碳源后,可以实现周期性产电.
3.2 pH变化在生物电化学系统中,几乎所有与阴阳极有关的反应都存在质子的消耗和电子的释放.pH的变化会对电极的性能造成一定的影响,尤其是在缓冲能力较低的系统中.在SMFC装置中,阴阳极的反应可以分别由式(2)和(3)表示.
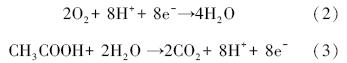
在反应器运行过程中,对反应器水层取样测pH,各反应装置水相的pH变化如图 3所示.在运行两个月后,SMFC A~E 5组反应器的水层均出现明显的pH上升,而运行时间较短的SMFC F~H 3组反应器中,pH基本保持不变.这是由于阴极反应消耗了水中的质子,由于传质阻力,来自阳极的质子不能及时补充.因此,水层的pH出现小幅度上升.此外,由阳极反应产生的质子滞留在阳极附近会导致沉积物层酸化,这是限制SMFC应用的一个重要原因.
 |
| 图 3 不同来源沉积物构建的SMFC在运行过程中水层的pH变化 Fig. 3 pH of water layer in the SMFC during operation |
文献报道,当阳极区pH为9时,产电功率比pH=5和pH=7时分别高89%和29%,并且在pH=5时,阳极电位急剧上升,这说明阳极的碱性条件更有利于提高MFC的产电效果,酸性条件最终限制反应的发生(Yuan et al., 2011).为了考察质子在固相MFC(Solid phase microbial fuel cell)阴阳极的传递效率,王鑫等(Wang et al., 2012)比较了固体介质在不同含水率时反应器产生的总电荷量和内阻,发现当含水率从33%降低到23%时,产生的总电荷量下降至原来的12%,内阻升高为原来的6倍,说明含水率对传质的重要作用.在本研究建立的SMFC反应器中,沉积物层的含水率约为60%,为沉积物层的良好传质提供了保证.此外,阳极pH环境的改变对阳极微生物也会产生一定影响,一般认为在pH <4时不适宜阳极微生物生存.有研究报道,在用于处理餐厨废物的固相MFC中,由于酸性发酵导致阳极环境酸化,通过投加碳酸钠来提高阳极环境的缓冲能力,可使输出功率得到明显提高(Mohan and Chandrasekhar, 2011).但是,依靠投加碳酸钠来缓解阳极环境酸化,并不能使阳极长期稳定地作为固相终端电子受体支持微生物的氧化反应.与阳极部分为固相的SMFC相比,采用各种类型离子交换膜的水相MFC,同样也存在阴阳两室pH分化的问题(Harnisch et al., 2008),而阳极室出水回流至阴极室以缓解pH变化的方法(Freguia et al., 2008)并不能应用于接种沉积物的SMFC,所以,寻求解决单室SMFC阳极酸化问题的方法还需要进一步研究.
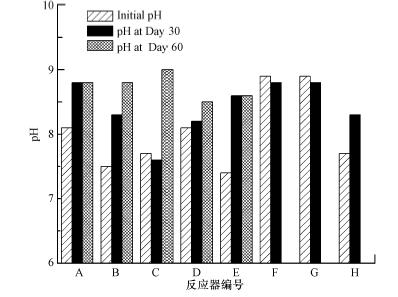
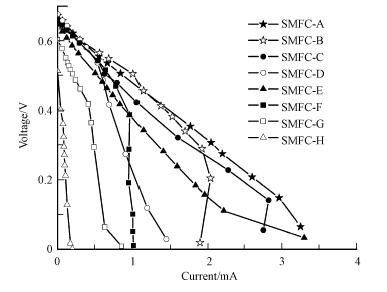
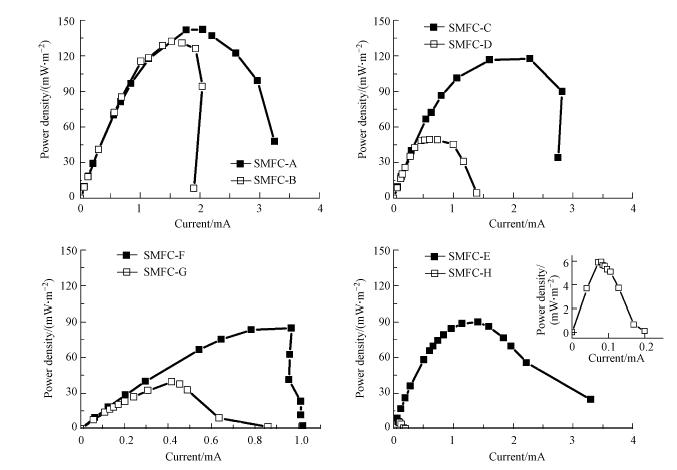
3.3 产电性能利用极化曲线法测定不同组SMFC的内阻和最大功率密度,电流-电压(C-V)极化曲线和电流-功率密度(C-P)极化曲线分别如图 4和图 5所示,相对应的最大功率密度和内阻如表 2所示.其中,SMFC-A和SMFC-B的功率密度相对较高,分别为142.3 mW · m-2和132.2 mW · m-2,这可能是由于这两个反应器中的沉积物取自河流入海口附近,含盐量(盐度为0.22%)高于其他几个反应器的沉积物层(盐度<0.1%),因而具有较高的导电性和较小的内阻,从而具有较高的产电效率.本实验中得到的最高产电功率密度142.3 mW · m-2,明显高于大部分文献报道的10~80 mW · m-2(Reimers et al., 2001;He et al., 2007;Song et al., 2012a),也略高于报道的140 mW · m-2(Nielsen et al., 2007).
 |
| 图 4 不同种类沉积物SMFC的极化曲线(C-V) Fig. 4 Polarization curve of SMFC corresponding to various types of sediment(current-voltage) |
 |
| 图 5 不同种类沉积物SMFC的极化曲线(C-P) Fig. 5 Polarization curve of SMFC corresponding to various types of sediment(current-power density) |
| 表2 不同SMFC的内阻和最大功率密度 Table 2 Internal resistance and maximum power density of SMFC |
对比花池土壤SMFC-C和混合了厌氧污泥的花池土壤SMFC-D的产电性能,最大功率密度在加入厌氧污泥后下降了57%.这可能是由于厌氧污泥中含有丰富的非产电厌氧微生物,与产电菌竞争基质,使得产电量下降.
比较SMFC-E和不投加碳源的对照组SMFC-H的功率密度,由于沉积物自身有机质含量较低(VS/TS=2.4%~3.1%),乙酸钠是产电微生物的主要能量来源.
对于有机质含量较高(VS/TS>12%)的沉积物构建的SMFC,SMFC-F的功率密度明显高于其不加碳源的对照组SMFC-G,由极化曲线图 4和表 2可知,SMFC-G的内阻较高,限制了SMFC的产电效果.
3.4 有机物降解SMFC的突出特点是在产生电能的同时可以降解沉积物中的有机物.在各SMFC产电实验结束时,对反应器中不同位置沉积物中的有机物含量进行了分析.对于运行时间较长的A~E反应器,阳极下方沉积物各层VS含量表现出由表层至底层逐渐降低的趋势,即VS去除率逐渐上升(如图 6所示).但是,阳极上方沉积物层的VS没有发现明显的降解状况.分析其原因可能包括:①阳极下方相对于上方 具有更好的厌氧环境,除了产电菌对有机质的降解,其他厌氧微生物充分利用沉积物中的有机质进行代谢反应,从而降低VS含量.②由于反应器水层是蒸馏水,这就使得阳极上方沉积物中的有机质具有向水层扩散的趋势,而且向反应器中投加碳源的方法是用注射器均匀注射在阳极上表面,以达到最大程度的聚集和驯化产电菌的目的,这也会造成部分碳源在投加过程中向上层扩散,因此反应器中VS含量表现出由上至下递减的规律.
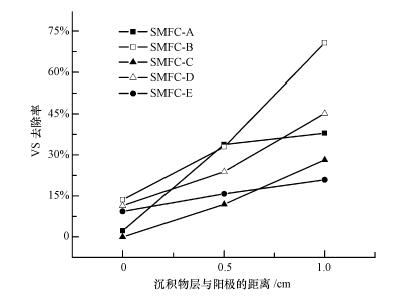 |
| 图 6 SMFC-A~SMFC-E中阳极下方3层沉积物(0 cm,0.5 cm,1 cm)的VS去除率 Fig. 6 VS removal efficiencies of the sediment layers below the anode at different distances to the anode in the SMFC-A~SMFC-E |
对6种沉积物样品和SMFC系统运行结束后各反应器中阳极附近的沉积物样品进行了DNA提取,PCR和DGGE分析,得到包含14个条带的DGGE图谱(如图 7所示).初始的6种沉积物样品标记为A1~A6,对应的样品分别为河道表层底泥(SMFC-A)、河道浅层底泥(SMFC-B)、1#校园景观湖表层底 泥(SMFC-E和SMFC-H)、花池土壤(SMFC-C)、花 池土壤与厌氧污泥混合(SMFC-D)、2#校园景观湖表层底泥(SMFC-F和SMFC-G),反应器运行结束后的样品标记为B1~B8,分别对应反应器SMFC A、B、E、C、D、F、G、H.
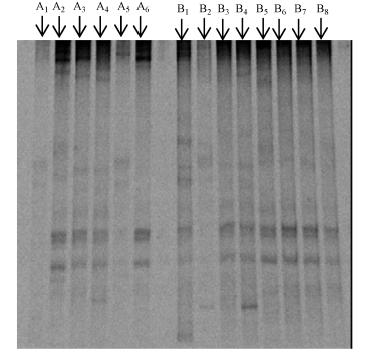 |
| 图 7 不同种类沉积物在SMFC运行前后的DGGE图谱 Fig. 7 DGGE profiles based on the DNA extracted from sediments before and after the SMFC operation |
对初始沉积物(A1~A6)以及SMFC运行结束后阳极附近的沉积物(B1~B8)的菌群条带分别进行 相似性比较,如图 8a和图 8b所示.由图 8所示,初始沉积物组a和运行结束后的沉积物组b的菌群结构均表现出较大的差异性.这可能是由于在沉积物中微生物较丰富,实现微生物产电的群落可能不在沉积物菌群结构中占据主导地位.在SMFC运行结束后的沉积物中微生物群落相似性要高于初始的沉积物,并具有较相似的优势菌(如图 7所示).这说明SMFC系统运行对沉积物中的微生物群落存在一定的驯化过程,使其更适应电化学产电环境.在复杂的群落结构中,鉴别具有产电性能的微生物还需要进一步的研究.
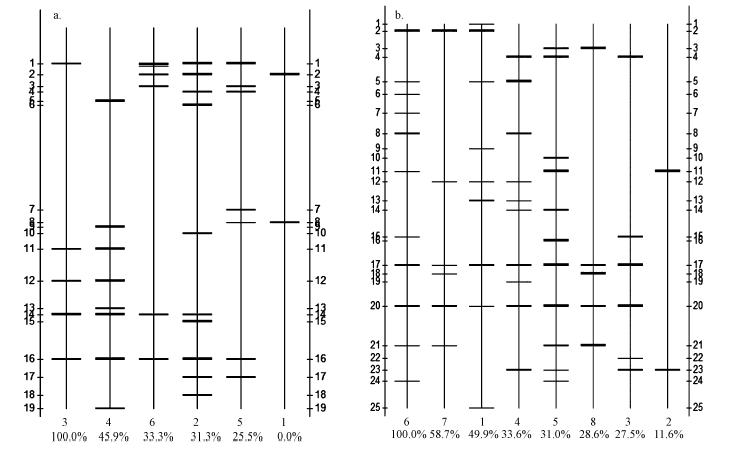 |
| 图 8 初始沉积物菌群(A1~A6)(a)及SMFC运行结束后沉积物菌群(B1~B8)(b)相似性分析 Fig. 8 Similarity analysis of b and s from six kinds of sediment before the operation of SMFCs(A1~A6)(a) and b and s from sediments after the operation of SMFCs(B1~B8)(b) |
1)在选用不同来源沉积物作为SMFC的基质时,SMFC的长期产电性能具有显著差异.沉积物的有机质含量是限制微生物产电的重要因素,并对SMFC能否自发产电(不外加有机碳源)具有决定性作用.在单一种类沉积物VS含量大于12%时,可以实现自发产电,功率密度可达到39.57 mW · m-2.在沉积物VS含量较低,不能实现自发产电时,可以通过投加外加碳源实现产电.
2)在投加乙酸钠的SMFC系统中,高盐度的沉积物由于导电性能较好,构建的SMFC内阻相对较小,可获得更高的产电功率密度.在沉积物盐度为0.22%时,最大功率密度可达到142.3 mW · m-2,明显高于含盐量较低的沉积物构建的SMFC.
3)将厌氧污泥与花池土壤进行混合,接种在SMFC系统中,非产电厌氧菌对SMFC系统的产电性能产生抑制作用,最大功率密度由117.7 mW · m-2下降到49.5 mW · m-2.
| [1] | An J, Lee S J, Ng H Y, et al. 2010. Determination of effects of turbulence flow in a cathode environment on electricity generation using a tidal mud-based cylindrical-type sediment microbial fuel cell[J]. Journal of Environmental Management, 91(12): 2478-2482 |
| [2] | Cheng S, Liu H, Logan B E. 2006. Increased performance of single-chamber microbial fuel cells using an improved cathode structure[J]. Electrochemistry Communications, 8(3): 489-494 |
| [3] | Donovan C, Dewan A, Heo D, et al. 2008. Batteryless, wireless sensor powered by a sediment microbial fuel cell[J]. Environmental Science & Technology, 42(22): 8591-8596 |
| [4] | Dunaj S J, Vallino J J, Hines M E, et al. 2012. Relationships between soil organic matter, nutrients, bacterial community structure, and the performance of microbial fuel cells[J]. Environmental Science & Technology, 46(3): 1914-1922 |
| [5] | Freguia S, Rabaey K, Yuan Z G, et al. 2008. Sequential anode-cathode configuration improves cathodic oxygen reduction and effluent quality of microbial fuel cells[J]. Water Research, 42(6/7): 1387-1396 |
| [6] | Harnisch F, Schröder U, Scholz F. 2008. The suitability of monopolar and bipolar ion exchange membranes as separators for biological fuel cells[J]. Environmental Science & Technology, 42(5): 1740-1746 |
| [7] | He Z, Shao H B, Angenent L T. 2007. Increased power production from a sediment microbial fuel cell with a rotating cathode[J]. Biosensors and Bioelectronics, 22(12): 3252-3255 |
| [8] | Mohan S V, Chandrasekhar K. 2011. Solid phase microbial fuel cell (SMFC) for harnessing bioelectricity from composite food waste fermentation: influence of electrode assembly and buffering capacity[J]. Bioresource Technology, 102(14): 7077-7085 |
| [9] | Nielsen M E, Reimers C E, Stecher H A. 2007. Enhanced power from chambered benthic microbial fuel cells[J]. Environmental Science & Technology, 41(22): 7895-7900 |
| [10] | Peng X H, Yu H, Yu H B, et al. 2013. Lack of anodic capacitance causes power overshoot in microbial fuel cells[J]. Bioresource Technology, 138: 353-358 |
| [11] | Reimers C E, Tender L M, Fertig S, et al. 2001. Harvesting energy from the marine sediment-water interface[J]. Environmental Science & Technology, 35(1): 192-195 |
| [12] | Song T S, Tan W M, Wu X Y, et al. 2012a. Effect of graphite felt and activated carbon fiber felt on performance of freshwater sediment microbial fuel cell[J]. Journal of Chemical Technology and Biotechnology, 87(10): 1436-1440 |
| [13] | Song T S, Cai H Y, Yan Z S, et al. 2012b. Various voltage productions by microbial fuel cells with sedimentary inocula taken from different sites in one freshwater lake[J]. Bioresource Technology, 108: 68-75 |
| [14] | Sonawane J M, Gupta A, Ghosh P C. 2013. Multi-electrode microbial fuel cell (MEMFC): A close analysis towards large scale system architecture[J]. International Journal of Hydrogen Energy, 38(12): 5106-5114 |
| [15] | Wang X, Cai Z, Zhou Q X, et al. 2012. Bioelectrochemical stimulation of petroleum hydrocarbon degradation in saline soil using U-tube microbial fuel cells[J]. Biotechnology and Bioengineering, 109(2): 426-433 |
| [16] | 魏复盛. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社. 354-359 |
| [17] | Yuan Y, Zhao B, Zhou S G, et al. 2011. Electrocatalytic activity of anodic biofilm responses to pH changes in microbial fuel cells[J]. Bioresource Technology, 102(13): 6887-6891 |
 2015, Vol. 35
2015, Vol. 35


