2. 中国21世纪议程管理中心, 北京 100038
2. The Administrative Center for China's Agenda 21, Beijing 100038
随着工农业的生产发展,大量含有氮、磷污染物的工业废水和生活污水排入水体中,使水体的富营养化不断加剧,导致藻类的异常繁殖,进而爆发水华,引起水质恶化,使得水中溶解氧减少,生物多样性降低.欧洲、非洲、北美洲和南美洲分别有53%、28%、48%和41%的湖泊存在不同程度的富营养化现象(Chorus and Bartram ,1999),我国60%以上湖泊受到营养盐不同程度的污染(李子成等,2012).
常见的水华蓝藻有微囊藻、鱼腥藻、颤藻、束丝藻、念珠藻等,其中以铜绿微囊藻在数量和爆发频率上占绝对优势.而在国内外引起各种动物甚至人类中毒死亡事件(Voloshko et al., 2008;Codd et al., 2005;Hirooka et al., 1999;Harada,1999)的微囊藻毒素(microcystins,MCs)就是由铜绿微囊藻产生.微囊藻毒素具有强烈的肝毒性(Batista et al., 2003;Žegura et al.,2003;陈华等,2002)、肾毒性(杨希存和张洪霞,2009;Bhattacharya et al., 1997)以及遗传毒性(胡智泉等,2006)等,因此如何控制铜绿微囊藻的生长繁殖以及藻毒素的产生一直是国内外研究的热点.
研究发现影响微囊藻生长和产毒的因素主要是营养盐、藻龄、温度、光照、pH和重金属离子等(Robarts and Zohary, 1987;Dai et al., 2009;Jiang et al., 2008;刘红涛等,2004;余游等,2011;崔俊涛和蔡秋波,2010;石鲁娜等,2010;Joung et al., 2011).由于铜绿微囊藻属于非固氮蓝藻,氮源是其生长的限制因素之一,同时也是MCs分子的主要构成元素,所以研究不同氮源对铜绿微囊藻的生长和产毒影响也是十分必要的.
自然水体中的氮能以多种形态存在,溶解态氮不仅能以可溶性无机氮(dissolved inorganic nitrogen,DIN)如硝氮(NO3--N)、亚硝氮(NO-2-N)、铵氮(NH4+-N)形式存在,还能以可溶性有机氮(dissolved organic nitrogen,DON)如游离氨基酸、尿素、酰胺、维生素、次黄嘌呤、鸟嘌呤等形式存在(胡章喜等,2010).很多学者已经对铵氮、硝态氮等无机含氮化合物对铜绿微囊藻生长和产毒影响做了一定的探究,但研究结果并不一致:张青田(2011)认为适宜的铵氮浓度促进其生长;唐全民(唐全民等,2008)认为铵氮不利于铜绿微囊藻的生长和产毒.至于有机氮,也多是尿素(张青田等,2011)等对铜绿微囊藻生长产毒的影响研究,而对于水中溶解性氨基酸的研究却不多.丙氨酸是水源水中较为常见的小分子氨基酸,并且是藻毒素分子结构中的一个氨基酸残基,故水体中的丙氨酸有可能对微囊藻生长和产毒有一定的促进作用.
本文以氯化铵和丙氨酸作为无机氮和有机氮的代表性化合物,探究比较两种不同浓度、不同形式的氮源对铜绿微囊藻的生长和产毒的影响,为控制水华爆发和藻毒素污染提供一定的基础理论支持.
2 材料与方法(Materials and methods) 2.1 铜绿微囊藻培养条件本研究所使用的铜绿微囊藻及标准藻毒素购自中国科学院水生生物研究所.采用BG11培养基(Blue-Green Medium)对铜绿微囊藻进行接种培养(代瑞华等,2008).每次接种前将配制好的BG11培养基在121 ℃下灭菌30 min.采用BIG-300人工气候箱(博迅人工气候箱有限公司)对铜绿微囊藻进行12 h/12 h昼夜交替光照培养.每天摇动藻液2次,并将三角瓶随机放置,以减少光强对藻类生长的影响.
2.2 实验方法本研究以丙氨酸、氯化铵为研究对象,在以空白样(不添加氮源)的对照下,研究不同浓度的氯化铵、丙氨酸(以氮元素的质量浓度为准,下同)对铜绿微囊藻的生长和产毒影响.本实验以18 d为一个生长周期,设置2个平行样,每3 d测定藻细胞个数、藻毒素含量、基质利用率等生长及产毒指标,对以上指标进行分析,以研究不同含氮化合物对铜绿微囊藻生长和产毒的影响.
2.3 分析方法 2.3.1 藻细胞生物量测定和细胞计数取少量混合均匀的藻液,加入一滴鲁格试剂固定后,在显微镜下用血球计数板对藻细胞数量进行计数两次.若两次相差超过20%,则需进行第3次计数.同时,测定该藻液的光密度(optical density,OD),绘制藻细胞数量和光密度值的标准曲线.对于每个样品,取出5 mL测定其光密度值,从而计算出相应的藻细胞数量.
2.3.2 培养液中丙氨酸和NH4+浓度的测定丙氨酸的分析方法采用OPA柱前衍生法,利用液相色谱(Agilent Technologies 1260 infinity HPLC),分离柱为3.5 μm,4.6 mm×75 mm ZORBAX Eclipse-AAA色谱柱.光电二极管阵列检测器在338 nm波长处进行紫外检测,流动相为:A相(5.5 g NaH2PO4 · H2O+1 L水,用NaOH溶液调节pH=7.8),B相(ACN ∶ MeOH ∶ 水的体积比为45 ∶ 45 ∶ 10),进样量0.5 μL.通过自动进样器混合后,氨基酸与OPA试剂发生衍生反应,然后进行色谱的分离分析.检测器:安捷伦1100HPLC二元泵及二极管阵列检测器(DAD);进样量:每种125 pmol的氨基酸进样0.5 μL.培养液中NH4+的浓度采用纳氏试剂分光光度法测定(APHA,1995).在测定丙氨酸及NH4+浓度时,分别取30 mL藻液,用离心机在5000 r · min-1的条件下(Dai,2008)离心15 min得到上清液,上清液用0.45 μm膜过滤后,采用上述标准方法测定丙氨酸及NH4+浓度,其前处理方法对丙氨酸及NH4+浓度测定的影响可以忽略.
2.3.3 藻毒素的提取和分析取30 mL藻细胞培养液,用离心机在5000 r · min-1的条件下离心15 min,将上清液再离心1次.混合两次离心沉淀的藻细胞,用80%的甲醇定容至10 mL,依次用液氮冻融20~30 min、50 ℃水浴20 min、5000 r · min-1离心15 min,将上清液倒出留待最后水浴.上述步骤重复1次,将2次离心所得上清液混合,99 ℃水浴加热至剩余液体为10 mL左右,用0.45 μm的滤膜将其过滤至KD浓缩瓶中(滤膜提前用45 ℃温水浸泡),把KD浓缩瓶继续置于99 ℃下水浴中直至液体剩余1 mL,若不足用去离子水定容至1 mL.将KD浓缩瓶中的液体吸出放在小离心管中,在冰箱的冷冻室保存.生命周期后期藻浓度较高时,将冻融次数增至3次,并增加甲醇量至15 mL.
本实验利用高效液相色谱(HPLC)测定所选藻种产生的藻毒素MCLR.所选用的HPLC(Agilent Technologies 1260)色谱柱为5 μm,4.6 mm×150 mm.光电二极管阵列检测器在238 nm波长处进行毒素的紫外检测,流动相比例为乙腈 ∶ 水(含0.05% 冰乙酸)=0.35 ∶ 0.65,流速1 mL · min-1,进样量20 μL.乙腈为进口色谱纯(德国默克公司),冰乙酸为分析纯,用水为高纯水.用以上分析处理方法测定样品,结合先前测定的藻细胞数目,求得样品中平均每个藻细胞中毒素的含量.
3 结果和讨论(Results and discussion) 3.1 铜绿微囊藻对不同氮源的利用情况 3.1.1 铜绿微囊藻对氯化铵的利用情况图 1显示了铜绿微囊藻对不同浓度氯化铵利用情况.从图 1可以发现,对于不同浓度的氯化铵实验组,基质中铵氮含量的总体呈缓慢下降的趋势,但下降速率非常缓慢,如对于20 mg · L-1氯化铵组,第3天至第12天铵氮浓度几乎不变.从利用率来看,在实验室进行到第15天时,0.5 mg · L-1和2 mg · L-1实验组的氯化铵利用率能达到100%,10 mg · L-1实验组氯化铵利用率为75.9%,然而在20 mg · L-1时,氯化铵利用率只有35.6%,50 mg · L-1时则更低,为9.8%,且50 mg · L-1组的氯化铵变化曲线较其它浓度曲线波动幅度大.
基质中铵氮含量下降证明铜绿微囊藻在利用氯化铵,但是吸收速率较慢.虽然10 mg · L-1 组氯化铵的利用率较0.5 mg · L-1和2 mg · L-1实验组小,但氯化铵的实际消耗量仍旧上升.但是,从10 mg · L-1到20 mg · L-1再到50 mg · L-1,氯化铵的实际消耗量为7.59、7.12、4.90 mg · L-1,逐渐下降.原因是随着氯化铵浓度的上升,氯化铵水解产生的氢离子增多,导致溶液pH值下降,呈酸性环境,不利于铜绿微囊藻的正常生长(Dai et al., 2009),使其无法正常利用铵氮来进行细胞繁殖或产毒,因此铵氮的消耗量下降,且氯化铵浓度变化曲线波动更大.
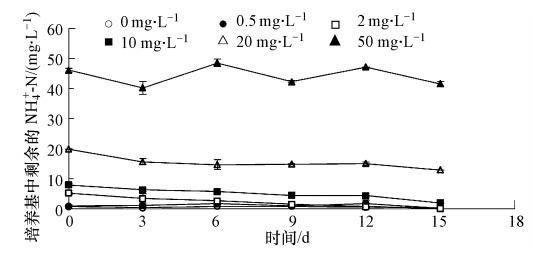 |
| 图 1 铜绿微囊藻对不同浓度氯化铵的利用情况 Fig. 1 Utilization of ammonium chloride by Microcystis aeruginosa at different concentrations |
图 2显示了铜绿微囊藻对不同浓度丙氨酸的利用情况.从图 2中看出在第3天时5 mg · L-1和10 mg · L-1组的丙氨酸几乎已被藻细胞完全吸收,20 mg · L-1组在第6天时被完全吸收,50 mg · L-1组丙氨酸被藻细胞完全吸收则需要12 d.在实验浓度范围内,当丙氨酸作为单一氮源时,微囊藻对其吸收效率达到近100%,且吸收速率较快.这主要是由于丙氨酸作为小分子氨基酸,能够通过主动转运的方式被藻细胞吸收进入胞内,此时细胞壁上的蛋白质起到载体功能,加快了丙氨酸进入藻细胞胞内的速率(Sauer et al., 1983).
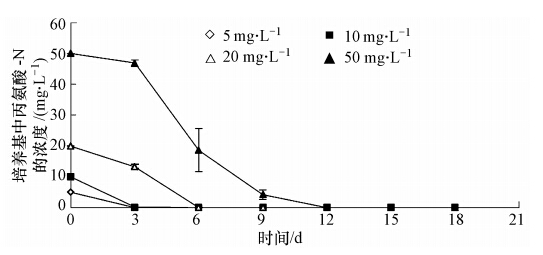 |
| 图 2 铜绿微囊藻对不同浓度丙氨酸的利用情况 Fig. 2 Utilization of alanine by Microcystis aeruginosa at different concentrations |
对比图 1和图 2,可以看出铜绿微囊藻对低浓度氯化铵具有较好的吸收效果,而当铵氮浓度大于等于20 mg · L-1时,铜绿微囊藻对其利用率显著降低.但是对于丙氨酸,在50 mg · L-1浓度及以下,铜绿微囊藻对其利用率都能够达到100%,且吸收速率较快.对于相同浓度的丙氨酸和氯化铵,尽管同是小分子化合物,但铜绿微囊藻对丙氨酸的吸收能力更强.因此,关注自然水体中小分子氨基酸如丙氨酸等对水华藻类的影响是十分有必要的.
3.2 不同氮源对铜绿微囊藻生物量的影响 3.2.1 氯化铵对铜绿微囊藻生物量的影响图 3为不同浓度氯化铵下铜绿微囊藻藻细胞数量的变化曲线.实验组和对照组初始藻细胞数量都为3×105个 · mL-1.图 3显示,对照组和实验组的铜绿微囊藻细胞数目总体呈增加趋势.对照组铜绿微囊藻生物量的增加说明即使无外源性氮源,铜绿微囊藻在一定时间内仍能保持一定程度的增殖,此时铜铝微囊藻繁殖所需的氮来自其他衰亡的藻细胞.相对于对照组,20 mg · L-1和50 mg · L-1的氯化铵浓度对铜绿微囊藻生长繁殖有一定的抑制作用,且50 mg · L-1组抑制作用更为明显,15 d时藻细胞生物量仅为对照组的84.5%.相反,较低浓度的铵氮对铜绿微囊藻生长繁殖却有一定的促进作用,其中促进作用最强的是0.5 mg · L-1实验组,15天时藻细胞生物量为初始值的2.17倍,是同时期对照组细胞生物量的1.08倍,这与许多之前的报道相类似(张青田等,2011;唐全民等,2008).不同浓度氯化铵对铜绿微囊藻生长的影响不同,这是因为在不同浓度氯化铵条件下,培养液中的pH值会有明显不同.研究表明(Mclachlan and Gorham, 1962),pH值对铜绿微囊藻的生长会有一定影响,在酸性条件下,藻细胞的生长会受到一定抑制,因此50 mg · L-1 的氯化铵抑制作用最为明显;较低浓度的氯化铵对培养液的pH值改变不显著,氯化铵作为氮源的作用更为明显,因此藻细胞的生长得到了促进.
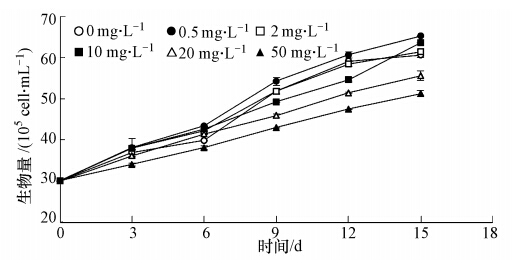 |
| 图 3 不同浓度氯化铵对微囊藻生物量的影响 Fig. 3 Growth curves of Microcystis aeruginosa at different ammonium chloride concentrations |
不同浓度丙氨酸对铜绿微囊藻生物量的影响如图 4所示.对照组和实验组初始藻细胞数量依然控制为3×105 cell · mL-1,.根据图 4,随着实验的进行,对照组藻细胞数量略有上升但不明显.50 mg · L-1组藻细胞数量虽然总体有所增加,但呈现的趋势为先增加后减少且在第6天出现峰值.其余3组的藻细胞数量都先慢后快增长,最后逐渐趋于稳定,基本符合延滞期、对数生长期、稳定期的规律.5组实验组中以丙氨酸浓度为20 mg · L-1的微囊藻长势最好,实验进行到第18天时,藻细胞数量达到初始值的6.42倍.因此,在实验设定的丙氨酸浓度范围内,最适宜铜绿微囊藻生长的丙氨酸浓度约为20 mg · L-1.
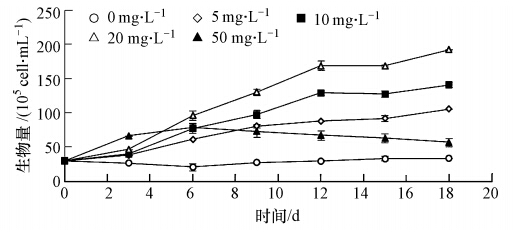 |
| 图 4 不同浓度丙氨酸对微囊藻生物量的影响 Fig. 4 Growth curves of Microcystis aeruginosa at different alanine concentrations |
比较图 3和图 4可知,低浓度铵氮促进铜绿微囊藻生长繁殖而高浓度铵氮对于铜绿微囊藻生长繁殖具有一定的抑制作用,这与之前的一些报道相类似(代瑞华等,2008;胡章喜等,2010;张青田等,2011).通过比较图 1、2、3、4又可知,铜绿微囊藻消耗的铵氮及丙氨酸有很大一部分被用于自身的生长繁殖.对于丙氨酸,不同浓度的丙氨酸对铜绿微囊藻生长繁殖均具有良好的促进作用,且相同浓度的铵氮抑制铜绿微囊藻的生长,而丙氨酸却极大地促进铜绿微囊藻的生长.丙氨酸等小分子氨基酸对铜绿微囊藻生长的促进作用较铵氮明显,氯化铵实验组中促进作用最明显的0.5 mg · L-1组在15 d的生物量与丙氨酸实验组中的5 mg · L-1组较为接近,远远小于丙氨酸实验组中的10 mg · L-1和20 mg · L-1组.因此,除了氮浓度会对铜绿微囊藻生长繁殖起到一定影响之外,氮的存在形态对铜绿微囊藻生长繁殖也起到了至关重要的作用,这在之前的报道中也得到了印证(张青田等,2011).
3.3 不同氮源对铜绿微囊藻藻产毒素的影响 3.3.1 氯化铵对铜绿微囊藻藻毒素含量的影响图 5为单位藻细胞藻毒素含量随时间的变化情况.对于实验组和对照组,实验初始MCLR的浓度都为35 fg · cell-1,单位藻细胞藻毒素含量都大致经历了先升高后下降的过程.其原因是前6 d铜绿微囊藻仍处于生长延滞期,细胞数量相对较少.此时藻细胞吸收培养基中的氮源用于生长繁殖的比率较小,而用于藻毒素合成的比率较多,使得单位藻细胞藻毒素含量一直上升.6 d以后,铜绿微囊藻进入快速生长期,细胞生命活动旺盛,繁殖速率增大,细胞数目急剧增多.此时从培养基中吸收的氮源主要用于生长繁殖,而用于藻毒素合成的氮较少,使得单位藻细胞藻毒素含量降低(Orr and Jones, 1998).
从图 5中还可以看出,各实验组单位藻细胞藻毒素含量曲线到达峰值的时间有所差异,这是铵氮浓度不同所导致的铜绿微囊藻生命活动和生长周期的差异所造成的.趋势实验结果表明,第15天时对照组和各实验组单位细胞藻毒素含量均低于初始值.第15天时,各个实验组与对照组(MCLR浓度29 fg · cell-1)相比,2 mg · L-1铵氮浓度对铜绿微囊藻产毒的促进效果最好,MCLR浓度为34.5 fg · cell-1,但同时也只是15 d时对照组MCLR浓度的1.19倍,并不是十分显著;而0.5 mg · L-1的铵氮浓度实验组仅为28.5 fg · cell-1,与对照组基本一致.铵氮浓度较高时(50 mg · L-1),单位藻细胞藻毒素含量并未明显增加,基本呈缓慢下降趋势,这表明高浓度的铵氮对铜绿微囊藻产毒具有一定抑制作用.在较低浓度范围内(0.5~20 mg · L-1),单位藻细胞藻毒素含量在6 d内都呈上升趋势,6 d后才逐渐下降,说明低浓度铵氮能够促进铜绿微囊藻的产毒,与之前的报道类似(Vézie et al., 2002).Song等(1998)的实验结果表明,pH值对微囊藻的产毒会有一定影响,在pH=7.8左右时产毒量最大,而不同浓度的氯化铵溶液中的pH值不同,当浓度较大时,溶液酸性较强,因此对铜绿微囊藻的产毒起到了一定的抑制作用.
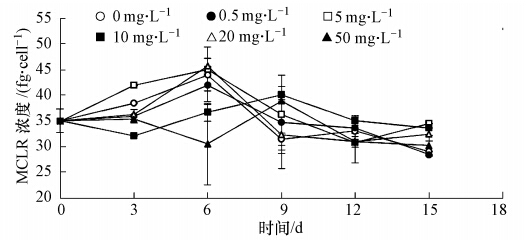 |
| 图 5 不同浓度氯化铵对微囊藻产毒量的影响 Fig. 5 MCLR production at different ammonium chloride concentrations |
不同浓度丙氨酸对微囊藻产毒量的影响如图 6所示.实验初始MCLR浓度为13.15 fg · cell-1.由图 6可知,与氯化铵实验结果类似,第18 d时,对照组以及各实验组MCLR浓度均低于初始值.这是由于铜绿微囊藻对丙氨酸的吸收利用情况较好,而且丙氨酸对铜绿微囊藻的生长促进作用也十分明显,第18 d时藻细胞生物量增加,使得各组MCLR浓度较初始值均有所降低.与同时间对照组相对比,发现50 mg · L-1的丙氨酸浓度对微囊藻产毒的促进作用最强,MCLR浓度为10.85 fg · cell-1,是第18 d对照组MCLR浓度的6倍.胞内MCLR浓度在第3 d达到了峰值.此图大体趋势与图 5类似,MCLR浓度均是先上升后下降.前3 d藻细胞仍处于延滞期,藻细胞繁殖缓慢但代谢旺盛,因此胞内MCLR含量高.但在3 d后所有实验组胞内MCLR含量均呈下降趋势,且实验进行到最后时,所有实验组的胞内藻毒素含量均比初始值小.这表明3 d后藻细胞吸收的氮大部分用于生长繁殖等代谢活动,而用于次生代谢产物MCLR的合成较少,所以单位藻细胞MCLR含量开始下降;后期藻细胞进入了稳定期,各组藻细胞数量都较多,对于基质需求量大,细胞之间产生竞争,个体能获得的氮源有限,用于合成MCLR的氮也就相对缺乏,因此单位藻细胞产毒量下降.
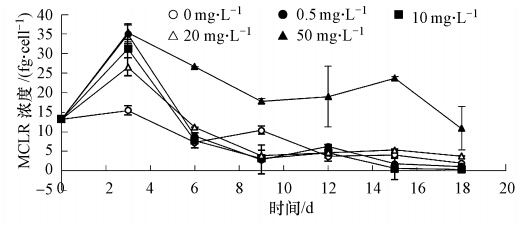 |
| 图 6 不同浓度丙氨酸对微囊藻产毒量的影响 Fig. 6 MCLR production at different alanine concentrations |
比较图 5和图 6,可以发现单位藻细胞产毒量随培养时间的变化情况是类似的,均是先上升后下降,这一现象与许多学者的研究结果类似(Lee et al., 2000;Kameyama et al., 2004;Song et al., 1998).不同的是,结合图 1、2、3、4,对于50 mg · L-1的丙氨酸实验组,铜绿微囊藻对50 mg · L-1的铵氮利用率仅为9.8%,而对50 mg · L-1丙氨酸的利用率为100%;50 mg · L-1的丙氨酸对铜绿微囊藻单位藻细胞产毒量促进作用最强,而氯化铵组50 mg · L-1浓度对铜绿微囊藻单位产毒量作用效果却并不明显.
4 结论(Conclusions)1)低浓度(<2 mg · L-1)氯化铵能被铜绿微囊藻充分吸收利用氯化铵,而高浓度(>10 mg · L-1)下氯化铵不能被铜绿微囊藻完全吸收利用;对于不同浓度的丙氨酸,铜绿微囊藻对其吸收利用率均为100%.
2)低浓度铵氮(<10 mg · L-1)促进铜绿微囊藻生长,高浓度(>20 mg · L-1)铵氮抑制铜绿微囊藻生长;不同浓度的丙氨酸对铜绿微囊藻生长均具有促进作用,且浓度为20 mg · L-1左右时促进作用最强.
3)以氯化铵、丙氨酸作为氮源,单位藻细胞中MCLR含量变化均符合在延滞期上升、在对数生长期和稳定期下降的趋势.在不同氮源条件下,藻细胞对氮源的利用效率不同,铜绿微囊藻单位藻细胞产毒量也不相同.氯化铵对单位藻细胞产毒量促进作用不明显,是对照组单位藻细胞MCLR浓度的0.98~1.19倍;丙氨酸对单位藻细胞产毒量促进作用明显,最高可达对照组单位藻细胞MCLR浓度的6倍.
4)相同浓度下的丙氨酸比氯化铵更易于被铜绿微囊藻吸收利用,更能促进铜绿微囊藻的生长和单位藻细胞产毒量,故水体中溶解性的小分子氨基酸对水华藻类的刺激作用不容忽视.
| [1] | APHA (American Public Health Association). 1995. Standard methods for the examination of water and wastewater (19th ed.) [S]. Washington DC: American Public Health Association, American Water Works Association, Water Environmental Federation |
| [2] | Batista T, de Sonsa G, Suput J S, et al. 2003. Microcystin-LR causes the collapse of actin filaments in primary human hepatocytes [J]. Aquatic Toxicology, 65(1): 85-91 |
| [3] | Bhattacharya R, Sugendran K, Dangi R S, et al. 1997. Toxicity evaluation of freshwater cyanbacterium Microcystis aeruginsoa PCC 7806: Ⅱ Nephrotoxicity in rats [J]. Biomedical and Environmental Sciences, 10(1): 93-101 |
| [4] | 陈华, 孙昌盛, 胡志坚, 等. 2002. 饮水微囊藻毒素污染促肝癌作用实验研究 [J]. 肿瘤防治杂志, 9(5): 454-456 |
| [5] | Chorus I, Bartram J. 1999. Toxic Cyanobacteria in Water: a guide to their public health consequences, monitoring and management [M]. London: E&FN Spon Publisher. 57 |
| [6] | Codd G A, Morrison L F, Metcalf J S. 2005. Cyanobacterial toxins: risk management for health protection [J]. Toxicology and Applied Pharmacology, 203(3): 264-272 |
| [7] | 崔俊涛, 蔡秋波. 2010. 环境因子对新立城水库铜绿微囊藻生长的影响 [J]. 吉林农业大学学报, 32 (1): 72-74; 85 |
| [8] | Dai R H, Liu H J, Qu J H, et al. 2008. Relationship of energy charge and toxin content of Microcystis aeruginosa in nitrogen-limited or phosphorous-limited cultures [J]. Toxicon, 51(4): 649-658 |
| [9] | Dai R H, Liu H J, Qu J H. 2009. The effects of different nitrogen compounds on the growth and microcystin production of Microcystis aeruginosa [J]. Journal of Water Supply: Research and Technology-AQUA, 58(4): 277-284 |
| [10] | 代瑞华, 刘会娟, 曲久辉, 等. 2008. 氮磷限制对铜绿微囊藻生长和产毒的影响 [J]. 环境科学学报, 28(9): 1739-1744 |
| [11] | Harada K. 1999. Recent advances of toxic cyanobacteria researches [J]. Journal of Health Science, 45(3): 150-165 |
| [12] | Hirooka E Y, Pinotti M H P, Tsutsumi T, et al. 1999. Survey of microcystins in water between 1995 and 1996 in Paraná, Brazil using ELISA [J]. Natural Toxins, 7(3): 103-109 |
| [13] | 胡章喜, 徐宁, 段舜山. 2010. 不同氮源对4种海洋微藻生长的影响 [J]. 生态环境学报, 19(10): 2452-2457 |
| [14] | 胡智泉, 李敦海, 刘永定, 等. 2006. 微囊藻毒素对水生生物的生态毒理学研究进展 [J]. 自然科学进展, 16(1): 14-20 |
| [15] | Jiang Y, Ji B, Wong R N S, et al. 2008. Statistical study on the effects of environmental factors on the growth and microcystins production of bloom-forming cyan bacterium-Microcystis aeruginosa [J]. Harmful Algae, 7(2): 127-136 |
| [16] | Joung S H, Oh H M, Ko S R, et al. 2011. Correlations between environmental factors and toxic and non-toxic Microcystis dynamics during bloom in Daechung Reservoir, Korea [J]. Harmful Algae, 10(2): 188-193 |
| [17] | Kameyama K, Sugiura N, Inamori Y, et al. 2004. Characteristics of microcystin production in the cell cycle of Microcystis viridis [J]. Environmental Toxicology, 19(1): 20-25 |
| [18] | Lee S J, Jang M H, Kim H S, et al. 2000. Variation of microcystin content of Microcystis aeruginosa relative to medium N: P ratio and growth stage [J]. Journal of Applied Microbiology, 89(2): 323-329 |
| [19] | 李子成, 邓义祥, 郑丙辉. 2012. 中国湖库营养状态现状调查分析 [J]. 环境科学与技术, 35(6I): 209-213 |
| [20] | 刘红涛, 李杰, 席宇, 等. 2004. 铜离子对铜绿微囊藻生长及生理的影响 [J]. 郑州大学学报(医学版), 39(1): 57-60 |
| [21] | McLachlan J, Gorham P R. 1962. Effects of pH and nitrogen sources on growth of Microcystis aeruginosa Kütz [J]. Canadian Journal of Microbiology, 8(1): 1-11 |
| [22] | Orr P T, Jones G J. 1998. Relationship between microcystin production and cell division rates in nitrogen-limited, Microcystis aeruginosa cultures [J]. Limnology and Oceanography, 43(7): 1604-1614 |
| [23] | Robarts R D, Zohary T. 1987. Temperature effects on photosynthetic capacity, respiration, and growth rates of bloom-forming cyanobacteria [J]. New Zealand Journal of Marine and Freshwater Research, 21(3): 391-399 |
| [24] | Sauer N, Komor E, Tanner W. 1983. Regulation and characterization of two inducible amino-acid transport systems in Chlorella vulgaris [J]. Planta, 159(5): 404-410 |
| [25] | 石鲁娜, 李正魁, 吴凯. 2010. 铁·磷对太湖水华微囊藻FACHB1028生长的影响及相互作用 [J]. 安徽农业科学, 38(27): 15178-15182 |
| [26] | Song L R, Sano T, Li R H, et al. 1998. Microcystin production of Microcystis viridis (cyanobacteria) under different culture conditions [J]. Phycological Research, 46 (S2): 19-23 |
| [27] | 唐全民, 陈峰, 向文洲, 等. 2008. 铵氮对铜绿微囊藻 (Microcystis aeroginosa) FACHB905的生长、生化组成和毒素生产的影响 [J]. 暨南大学学报(自然科学与医学版), 29(3): 290-294 |
| [28] | Vézie C, Rapala J, Vaitomaa J, et al. 2002. Effect of nitrogen and phosphorus on growth of toxic and nontoxic microcystis strains and on intracellular microcystin concentrations [J]. Microbial Ecology, 43(4): 443-454 |
| [29] | Voloshko L N, Plyushch A V, Titova N N. 2008. Toxins of cyanobacteria (Cyanophyta) [J]. International Journal on Algae, 10(1): 14-33 |
| [30] | 杨希存, 张洪霞. 2009. 微囊藻毒素毒作用机制研究进展 [J]. 河北医药, 31(16): 2126-2128 |
| [31] | 余游, 冉奎林, 张涛. 2011. 环境因子对铜绿微囊藻生长、生理影响研究进展 [J]. 科技致富向导, (24): 265-267 |
| [32] | 张青田, 王新华, 林超, 等. 2011. 不同氮源对铜绿微囊藻增殖的影响 [J]. 水生态学杂志, 32(4): 115-120 |
| [33] | Žegura B, Sedmak B, Filipi č M, et al. 2003. Microcystin-LR induces oxidative DNA damage in human hepatoma cell line HepG2 [J]. Toxicon, 41(1): 41-48 |
 2015, Vol. 35
2015, Vol. 35


