2. 水域环境生态上海高校工程研究中心, 上海 201306
2. Engineering Research Center for Water Environment Ecology in Shanghai, Shanghai 201306
近年来,在农业生产及城市景观水体中,丝状藻藻华极易爆发,其大量腐烂导致水体水质严重污染,并引起生态失衡,进而造成恶劣影响(Hawes et al.,1993).目前,相关处理方法多集中于物理打捞和化学药物两方面(陈孝花等,2011),而生物控制法因具有高针对性、高效性及可持续性等优势,已成为抑制丝状藻藻华春季、夏季爆发的研究热点.
光倒刺鲃(Spinibarbus hollandi)属鲤科,鲃亚科,倒刺鲃属.笔者曾于2012年7—10月在上海海洋大学水域环境生态上海高校工程研究中心室外实验平台试验发现(黎臻等,2013),光倒刺鲃对丝状藻水绵具有良好的适口性,在低密度(26 g · m-3)投放条件下,可高强度摄食水绵,且对受试3种水藻的摄食选择性为:水绵>轮叶黑藻>金鱼藻,但会导致指示浮游生物量的叶绿素a较空白组显著上升.而国内外的相关研究表明(Leventer et al.,1990; Starling,1993;刘建康等,1998),放养鲢、鳙鱼可以有效控制湖泊水华爆发,抑制水中浮游藻类的生物量.因此,本研究进一步通过在水绵易爆发的水体内建立试验围隔,结合上述两种鱼类的食性特点,研究协同放养不同比例、不同密度的光倒刺鲃和白鲢(Hypophthalmichthys molitrix)对围隔内丝状藻(水绵)的抑制效果及对水质的影响.从而为利用生物控制法抑制丝状藻藻华,维护良好的水域生态环境提供新思路.
2 材料与方法(Materials and methods) 2.1 试验材料 2.1.1 试验用鱼光倒刺鲃为购于福建泉州昌盛渔业有限公司的同批次鱼苗,体长15~16 cm,平均体重(31.5±3.5)g.白鲢为来自于上海海洋大学滨海养殖基地的同批次鱼苗,体长15~16 cm,平均体重(33.0 ± 4.8)g.试验用鱼均经过仔细筛选,体表无明显伤痕.
2.1.2 试验围隔试验围隔建于上海海洋大学南汇普露湾实验基地(30.92224°N,121.8976°E),实验塘长100 m,宽20 m,平均水深1.5 m,泥质基底,春、夏季节丝状藻水绵极易生长,爆发藻华.试验前,将池水抽干并清底.由南向北每排2个,构建7排共14个PVC防水布形成的正方体围隔(1.5 m×1.5 m×1.7 m),PVC膜随围隔支架深入池塘基底0.3 m.向围隔内外注水,水位均为1.5 m,围隔高出水面0.2 m,围隔内外基本无水体交换.试验开始后,不再引入任何其他水生植物、动物,无投饵或肥料,也不再注水或排水.
2.2 试验设计与检验方法 2.2.1 光倒刺鲃、白鲢协同投放的密度及比例试验于2013年6月3日至9月18日进行.试验围隔加水稳定7 d后,投放试验用鱼.试验设3个密度梯度,分别为高密度H(80 g · m-3)、低密度L(40 g · m-3)及无鱼空白组(0 g · m-3),高、低密度梯度下分别设立光倒刺鲃与白鲢的投放比例为1 : 3、1 : 1及3 : 1,共7个试验组,每个试验组设2个重复;所有围隔中水量均为3 m3,光、鲢单尾鱼体重均为30 g,各试验组围隔随机设置(表 1).
| 表1 各试验组光倒刺鲃、白鲢协同投放尾数 Table 1 Number of S. holl and i and H. molitrix in each treatment |
试验期间,由于丝状藻易漂浮于水面,故选择通过计算盖度以指示丝状藻的生物量.每隔半月测定围隔内丝状藻的盖度,并在试验初(6月3日)、试验中(8月1日)及试验末(9月18日)对各试验组中丝状藻取样20 g(湿重),根据《中国淡水藻类》(胡鸿钧等,2006)鉴定漂浮丝状藻的组成.
2.2.3 试验组沉水植物最终生物量及组成试验结束时,排干试验围隔中的水,分别称量每组围隔中沉水植物的湿重,并且根据《水生植物图鉴》鉴定沉水植物(赵家荣等,2009),计算其组成.
2.2.4 试验组主要水质理化指标变化试验期间,每隔半个月在下午3点,在所有试验组水面下0.5 m处取样,取样后人工去除样品中大型丝状藻.采用便携水下温度计检测水温,便携pH计检测pH值,便携式溶氧仪检测DO,透明度、TN、TP、KMnO4及叶绿素a(Chl.a)均参照《水和废水检测分析方法》测定(魏复盛,2002).
2.2.5 试验组浮游藻类生物量及组成变化在试验初(6月3日)、试验中(8月1日)及试验末(9月18日)于水面下0.5 m处采集各试验组水样1 L,经超声波处理后采用血球计数板法分别计算,并通过细胞体积推算浮游藻类生物量(g · m-3)(金相灿等,1990).根据《中国淡水藻类》鉴定至属,以明确试验组中的浮游藻类组成.计数分类时,忽略丝状绿藻水绵及刚毛藻(Chladophora sp.).全部操作在Olympus DP21 显微镜下进行.
2.3 数据分析试验数据表示为算术平均值±标准差(Mean±SD),由于本次试验中重复较少,采用单因素方差分析(One-way ANOVA),选用LSR多重比较法比较均值之间的差异显著性,显著性水平为p<0.10,尽可能避免犯第二类错误(接受错误零假设)(李春喜等,2000).采用Pearson相关系数检验相关性.数据整理和统计分析采用Excel、PASW Statistics 18.0软件.
3 结果与分析(Results and analysis) 3.1 试验期间围隔内丝状藻盖度及组成的变化由图 1可见,试验不同时期内,各试验组丝状藻主要为水绵和少量的刚毛藻,其中,水绵占85.86%±7.96%,刚毛藻占14.14%±7.96%,因此,可以判定水绵为试验中主要的丝状藻.但刚毛藻在试验后期所占比例较前期显著增大(p<0.10),平均为23.86%±2.04%,且各试验组间无显著差异(p> 0.10).
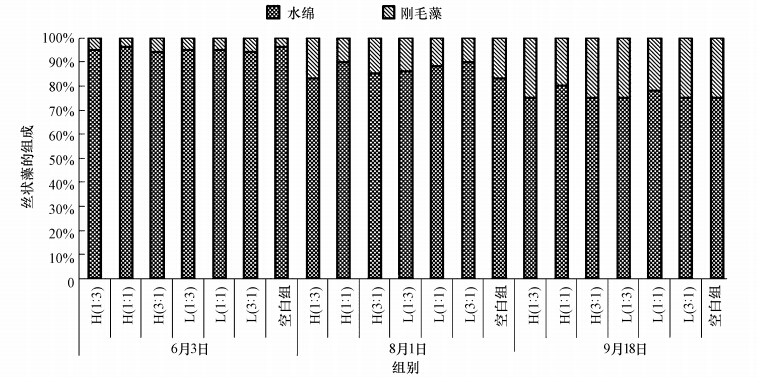 |
| 图 1 不同试验组中丝状藻的组成变化 Fig. 1 Composition of filamentous algae in different enclosures during the experiment |
由图 2可知,试验开始时,各试验组中已有少量的丝状藻水绵漂浮于水面,各组盖度较为一致(p>0.10),平均为15.13%±1.59%.各试验组丝状藻的盖度在试验前期(6月3日—7月1日)均呈上升趋势,其中,空白组的盖度于7月1日—8月1日达到100%,且在各个时期均远高于其他有鱼组(p<0.10).同时,现场观察发现,在试验后期,空白组水面上丝状藻水绵开始发黄腐烂,围隔内水体散发臭味.而在整个试验期内,光倒刺鲃的投放量与围隔内丝状藻的盖度成负相关(r=-0.652),说明光倒刺鲃的摄食作用是导致围隔内丝状藻盖度降低的主要 原因.在试验后期,各试验组中的丝状藻盖度均有所下降.至试验结束时,空白组的丝状藻盖度(45.7%± 6.5%)高于其他有鱼组(p<0.10),盖度最低的为H(3 : 1)组(10.3%±1.5%),而L(3 : 1)组的盖度为15.6%±2.6%,也处于较低水平.
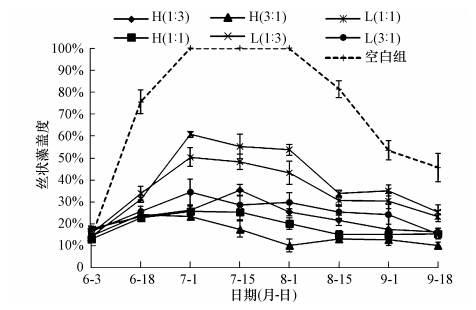 |
| 图 2 不同试验组中丝状藻的盖度变化 Fig. 2 Cover degree of filamentous algae in different enclosures during the experiment |
由于试验围隔水体较小,对围隔内沉水植物进行采集会严重影响试验数据的准确性,故选择在试验结束时对所有围隔内沉水植物的生物量及组成进行采集统计(图 3).由图 3可知,空白组沉水植物的生物量为(2.13 ± 0.26)kg,显著低于其他试验组(p<0.10);而有鱼试验组中,仅H(3 : 1)、H(1 : 1)组的沉水植物生物量显著低于其他有鱼组(p<0.10),其他有鱼试验组间的沉水植物生物量无显著差异(p>0.10).所有试验组中,沉水植物经鉴别主要为轮叶黑藻(Hydrilla verticillata)、金鱼藻(Ceratophyllum demersum)及穗状狐尾藻(Myriophyllum spicatum).但试验发现,所有有鱼试验组与空白组的沉水植物组成有明显不同:所有有鱼试验组中轮叶黑藻为优势种,平均为55.75%±7.67%,金鱼藻为23.67%±5.65%,其中,仅H(3 : 1)、H(1 : 1)组的轮叶黑藻比例略有下降,分别为48.50%±2.35%、44.50%±3.57%;而空白组中,优势种为金鱼藻(59.20%±4.13%),轮叶黑藻仅为25.80%±3.22%.
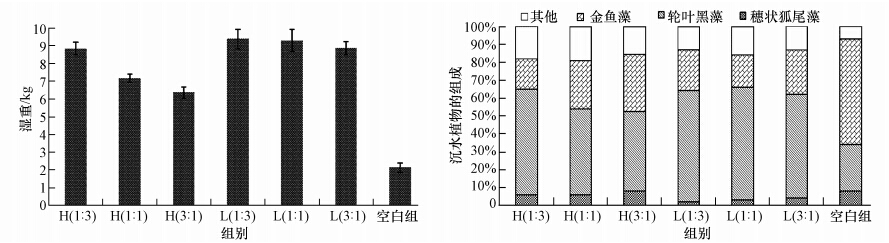 |
| 图 3 不同试验组中沉水植物的生物量和组成 Fig. 3 Biomass and composition of submerged plants in the enclosures at the end of the experiment |
试验期间,各围隔内水温变化较为一致,均随季节变化呈先升后降的趋势(图 4a),除8月15日 空白组水温(29.3 ℃)显著低于其他有鱼试验组外(p<0.10),其余时期各有鱼试验组与空白组无显著差异(p>0.10).由此可见,丝状藻水绵的“遮蔽作用”(马军等,2008)减少了水体对阳光热量的吸收,可以在一定程度上降低水温的上升.但由于本试验围隔水体较小,水深仅1.5 m,受热后水温波动较大,且热量可通过围隔外水体传递进入,因此,这种“降温”作用十分有限.
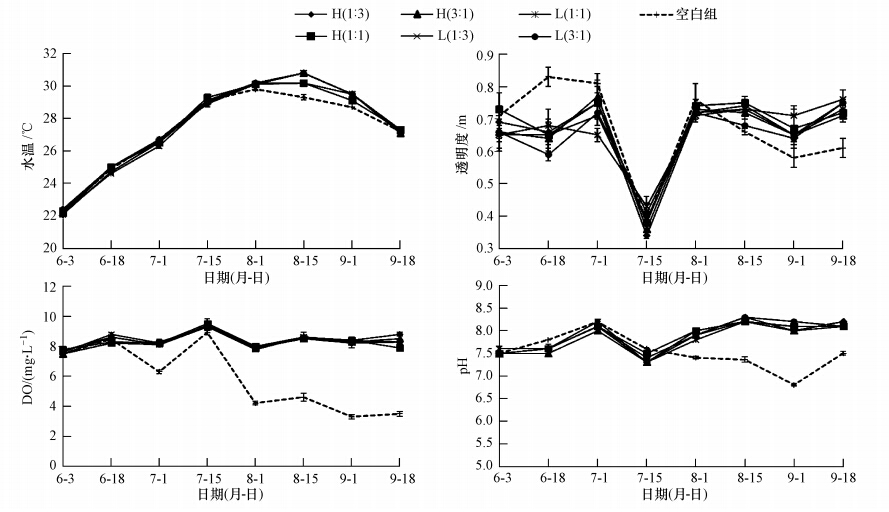 |
| 图 4 不同试验组中水温、透明度、DO和pH的变化 Fig. 4 Variations of water temperature,transparency,DO and pH in different enclosures during the experiment |
由图 4b可知,试验前期,由于丝状藻水绵对水体的“遮蔽作用”,从而减少了上下水体的交换,并抑制了浮游藻类的生长,空白组的水体透明度为(0.85 ± 0.06)m,显著高于其他有鱼组(p<0.10),而试验后期,空白组的透明度显著下降(p<0.10).
由图 4c可知,试验初期,所有试验组的DO均在7.5 mg · L-1左右.试验期间,除7月15日受暴雨影响导致所有试验组DO均显著上升外(p<0.10),其他时期空白组的DO均显著低于各有鱼组(p<0.10),其中,空白组DO最低时为(3.30 ± 0.27)mg · L-1.各有鱼组DO变化具有较高的一致性,各时期各组间无显著差异(p>0.10),平均为(8.45 ± 0.45)mg · L-1.
如图 4d所示,在试验前期(6月3日—7月15日),各有鱼试验组与空白组的pH无显著差异(p>0.10),而8月1日后,空白组的pH显著低于各有鱼试验组(p<0.10),最低时为6.83±0.05.这可能与试验后期空白组中丝状藻水绵开始大片发黄腐烂有关.
试验期间,不同试验组中的TN、TP变化基本一致(图 5).6月3日,各试验组中TN、TP均在0.70、0.16 mg · L-1左右;6月18日—7月1日,空白组的TN、TP显著低于其他有鱼试验组(p<0.10).7月15日,由于受暴雨的影响,全部试验组TN、TP均处于较高水平,且组间无显著差异(p>0.10).8月1日后,空白组的TN、TP均显著高于全部的低密度组及H(1 : 3)组(p<0.10),最高分别为(1.73 ± 0.13)、(0.48 ± 0.05)mg · L-1,而与H(1 : 1)、H(3 : 1)组间无显著差异(p<0.10).同时发现,高密度组TN、TP显著高于低密度组(p<0.10),且仅在高密度组中发现,白鲢的投放量与TN、TP成负相关(r=-0.751、-0.694),而低密度组中,不同比例的光倒刺鲃、白鲢投放之间TN、TP无显著差异(p>0.10).
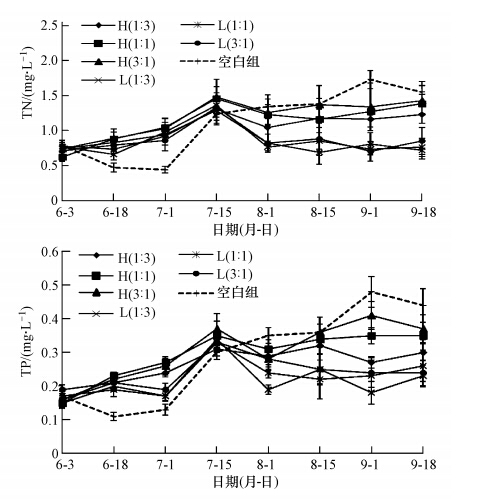 |
| 图 5 不同试验组中总氮和总磷的变化 Fig. 5 Variations of TN and TP in different enclosures during the experiment |
不同试验组的高锰酸钾指数变化与TN、TP相似(图 6).试验开始时,各试验组高锰酸钾指数均在7.12 mg · L-1左右,空白组中丝状藻水面盖度达到100%后,高锰酸钾指数开始显著上升(p<0.10),且7月15日后显著高于其他有鱼试验组(p<0.10),最高为(22.18 ± 1.33)mg · L-1.高密度组的高锰酸钾指数显著高于低密度组(p<0.10),但仅在高密度组中发现,白鲢的投放量与高锰酸钾指数负相关(r=-0.850),而在低密度组中,不同比例的光倒刺鲃、白鲢投放之间高锰酸钾指数无显著差异(p> 0.10).
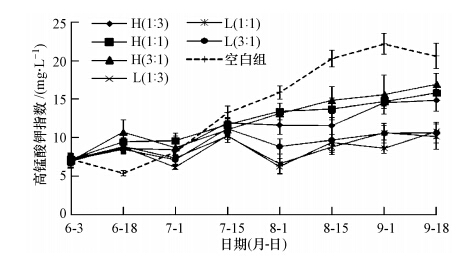 |
| 图 6 不同试验组中高锰酸钾指数的变化 Fig. 6 Variations of KMnO4 index in different enclosures during the experiment |
由图 7可见,试验初期,各试验组的叶绿素a浓度均在3.95 μg · L-1左右.6月18日时,H(1 : 3)、H(1 : 1)组中由于高密度白鲢对浮游藻类的牧食作用,叶绿素a浓度显著低于其他有鱼试验组(p<0.10),但后期逐渐升高.8月1日以后,高密度组的叶绿素a浓度均显著高于各低密度组(p<0.10),且在高密度组中,白鲢的投放量与叶绿素a负相关(r=-0.814),而在低密度组中,不同比例的光倒刺鲃、白鲢投放之间叶绿素a无显著差异(p>0.10).由于丝状藻漂浮在水面形成“遮蔽作用”,阻碍了浮游藻类的生长,空白组的叶绿素a浓度在8月15日前均显著低于其他有鱼试验组(p<0.10),但在试验后期,丝状藻水绵逐渐发黄死亡,遮蔽作用减弱,同时释放了大量的营养物质,叶绿素a浓度迅速上升,最高为(16.64 ± 0.73)μg · L-1,显著高于其他有鱼试验组(p<0.10).
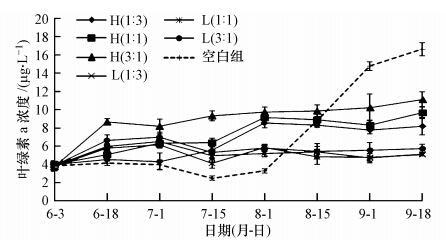 |
| 图 7 不同试验组中叶绿素a的变化 Fig. 7 Variations of Chl.a in different enclosures during the experiment |
如图 8可见,试验组中浮游植物生物量与叶绿素a浓度变化基本一致.试验初期,所有试验组浮游植物生物量均在6.25 mg · L-1左右.试验中期,H(3 : 1)组的浮游植物生物量为(14.56 ± 0.76)mg · L-1,显著高于其他试验组(p<0.10);H(1 : 3)、H(1 : 1)组由于白鲢投放量较高,其浮游植物生物量显著低于H(3 : 1)组(p<0.10),且与低密度组无显著差异(p>0.10);低密度组浮游植物生物量之间无显著差异(p>0.10);空白组由于丝状藻水绵的“遮蔽作用”,浮游植物生物量((4.23 ± 0.52)mg · L-1)显著低于其他有鱼试验组.试验后期,空白组的浮游植物生物量为(27.44 ± 1.28)mg · L-1,较之前显著上升(p<0.10),且显著高于其他有鱼试验组(p<0.10);高密度组的浮游植物生物量显著高于低密度组(p< 0.10),且H(3 : 1)组的浮游植物生物量((17.06 ± 0.73)mg · L-1)显著高于H(1 : 3)、H(1 : 1)组(p<0.10),低密度组间的浮游植物生物量无显著差异(p<0.10).
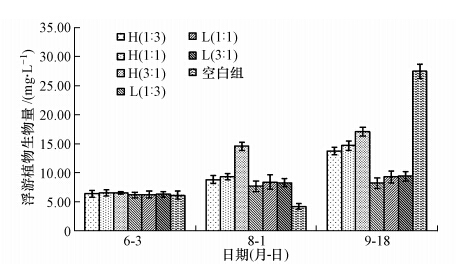 |
| 图 8 不同试验组中浮游植物生物量的变化 Fig. 8 Variations of biomass of phytoplankton in different enclosures during the experiment |
各试验组的浮游植物组成在放鱼前后均发生了明显变化(图 9).试验初期,各试验组的浮游藻类组成较为一致,主要包括绿藻门、蓝藻门、硅藻门、甲藻门及隐藻门,其中,绿藻和蓝藻为绝对优势藻,平均分别为38.31%±0.24%和25.46%±0.55%,绿藻主要为多细胞结构的空星藻(Coelastrum sp.)及球衣藻(Chlamydomonas globosa sp.),蓝藻主要为微囊藻(Microcystis sp.).放鱼后,空白组中以微囊藻为主的蓝藻比例逐渐上升并最终达到34.30%,超过绿藻的30.3%,在水面上可以看到大量藻体颗粒,且隐藻和甲藻比例有小幅增加,而硅藻比例明显下降;在有鱼试验组中,蓝藻的比例逐渐下降,绿藻逐渐上升,且以小环藻(Cyclotella sp.)为主的硅藻比例也有上升.但在H(1 : 3)、H(1 : 1)组中,绿藻的优势种在后期变为单细胞结构的角星鼓藻(Staurastrum sp.),同时以尖尾蓝隐藻(Chroomonas acuta.)为主的隐藻比例明显上升并显著高于其他试验组(p<0.10),而甲藻的比例明显下降;低密度组之间浮游藻类的组成未发现显著差异(p>0.10).
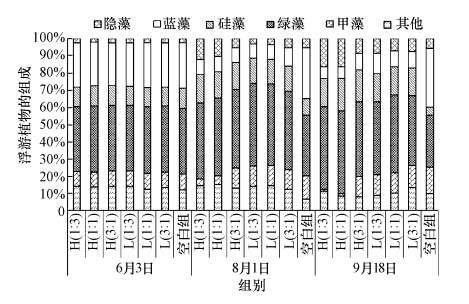 |
| 图 9 不同试验组中浮游植物的组成 Fig. 9 Variations of composition of phytoplankton in different enclosures during the experiment |
本试验镜检发现,所有围隔内丝状藻为水绵和刚毛藻,其中,水绵在各个时期均为绝对优势种,平均为85.86%±7.96%,这与围隔水体的实地考察一致.光倒刺鲃对丝状藻水绵具有较高的摄食选择性及去除率,且在较低密度下(26 g · m-3)对水绵的去除率即可达到68.53%±2.63%.本试验结果也显示,在整个试验期间光倒刺鲃的投放量与围隔内丝状藻的盖度成负相关(r=-0.652),L(3 : 1)组中,光倒刺鲃投放量为30 g · m-3,即可对围隔内丝状藻水绵表现出明显的去除作用,丝状藻盖度在试验结束时为15.6%±2.6%,显著低于空白组(p<0.10),与之前的水族箱试验结果较为一致.而相比之下,空白组中丝状藻大量生长爆发,并在试验后期迅速死亡,水面盖度剧烈下降,造成水质恶化.有研究表明(马顷,2011),水绵的最适生长温度为20 ℃,刚毛藻为25 ℃,当环境温度高于30 ℃时,水绵的生长会受到明显抑制(Den Hartog,1994);同时,水绵喜漂浮于水面,在其藻团内易形成封闭环境,造成局部温度剧增,而刚毛藻具有更强的生态适应能力(Choo et al., 2004).这可能是导致试验后期所有试验组盖度均下降且刚毛藻所占比例逐渐上升的主要原因.试验中未发现同时期各试验围隔内丝状藻组成有显著不同(p>0.10),说明光倒刺鲃在试验中在两种丝状藻间并无摄食偏好.
4.2 不同密度、比例的光倒刺鲃、白鲢协同投放对围隔内沉水植物生物量及组成的影响沉水植物一直被认为是水域生态环境修复中的先锋物种(黄子贤等,2011),在稳定水体、去除营养盐、保持生态平衡等方面均有显著作用.而水绵可以通过光竞争、营养盐竞争、物理缠绕及化感作用抑制沉水植物的生长(马剑敏等,2011;凡传明等,2011),占据其生态位.
本次试验结果发现,空白组中沉水植物的生物量显著低于其他有鱼试验组(p<0.10),而有鱼试验组中,仅H(3 : 1)、H(1 : 1)组的沉水植物生物量显著低于其他有鱼组(p<0.10),其他有鱼试验组间沉水植物生物量无显著差异(p>0.10).说明高密度放养光倒刺鲃不适用于以种植沉水植物为处理手段的生态修复中.同时试验发现,对照组中金鱼藻的比例要显著高于其他有鱼试验组,这可能是因为金鱼藻相比轮叶黑藻对丝状藻水绵具有较高的生态适应性.
4.3 不同密度、比例的光倒刺鲃、白鲢协同投放对围隔内水质条件的影响研究表明(凡传明等,2011),水绵等丝状藻可以大量吸附水中营养盐,并通过“光遮蔽作用”抑制水体中藻类的生长,但水绵的过度生长会导致更加严重的环境问题.本次试验发现,空白组中水绵的大量爆发,在试验前期确实可以通过这种“光遮蔽作用”使围隔的透明度提升,且抑制其他微型藻类的生长,使叶绿素a浓度显著低于其他有鱼试验组;但也正是这种“光遮蔽作用”,在试验后期阻碍了围隔水体上下交换,抑制了底层沉水植物光合作用及生长,而其夜间的呼吸作用消耗了水中的溶氧,降低了生物多样性,并在试验后期大量死亡腐烂,造成二次污染,从而导致试验后期水中DO显著低于其他有鱼组(p< 0.10),TN、TP、高锰酸钾指数及叶绿素a浓度显著高于各有鱼试验组(p<0.10),且水质偏酸性.
在有鱼试验组中,投放密度同样会导致水质的变化.8月1日后,低密度组中的TN、TP、高锰酸钾指数及叶绿素a浓度均显著低于高密度组(p<0.10);且在高密度组中发现,上述指标均与白鲢的投放量成显著负相关(r =-0.751、-0.694、-0.850、-0.814),而在低密度组中未发现明显差异(p>0.10).说明本试验中投放白鲢对TN、TP、高锰酸钾指数及叶绿素a具有一定的控制作用.研究表明(陈少莲等,1991),投放鲢、鳙鱼可以加快水中氮、磷的循环,提高对初级生产量的利用率,并通过鱼体贮存将大量的氮、磷移出水体.在本试验“藻-草-鱼”共生的条件下,一方面鱼的高投放量会导致环境中营养盐释放量的增加(Drenner et al., 2002);另一方面,营养盐通过水生植物(包括丝状藻)被吸附,并被光倒刺鲃、白鲢通过对丝状藻及浮游藻类的摄食所固定.因此,低密度围隔内,沉水植物生长良好,不同比例的光倒刺配、白鲢放养对水质影响无显著差异,而高密度组中由于鱼体投放密度过大,白鲢对浮游藻类的牧食作用显著加强了对水中营养盐的固定.
4.4 不同密度、比例的光倒刺鲃、白鲢协同投放对围隔内浮游藻类生物量及组成的影响光倒刺鲃的鳃耙十分稀疏,第一鳃弓外鳃耙11~12个,内侧鳃耙17~18个,较难直接对围隔内浮游藻类产生摄食作用.水中浮游藻类的生物量常用叶绿素a值来指示.各试验组中浮游藻类的生物量变化与叶绿素a高度一致,试验前期空白试验组浮游藻类生物量显著低于其他试验组(p<0.10),后期显著升高.研究表明(马祖友,2005),铜绿微囊藻具有极强的生态适应性,在高温及低光照条件下拥有较强的竞争优势,同时丝状藻大量死亡腐烂,释放营养物质,从而导致空白组后期蓝藻比例逐渐上升,最终达到34.30%,并在部分水面观察到大量藻体颗粒.空白试验围隔极有可能在水绵爆发藻华后发生蓝藻水华.
研究表明(Leventer et al.,1990;Starling,1993;刘建康等,1998),投放鲢、鳙鱼可以有效控制湖泊水华的发生;同时也有研究表明(Laws et al.,1990;王丽卿等,2011),单纯的投放鲢、鳙可以抑制蓝藻数量而非浮游藻类生物总量,同时会导致浮游藻类的小型化.这是因为鲢、鳙的鳃耙可以滤食较大颗粒的浮游藻类,以及以小型藻为食的浮游动物(钟金香等,2001).本次试验结果未能完全支持上述结论,虽高密度组由于鱼体投放密度过大,超过了环境承受力,导致浮游藻类生物量显著高于低密度组(p<0.10);但同时发现在高密度组中,H(3 : 1)组的浮游藻类生物量((17.06 ± 0.73)g · m-3)显著高于H(1 : 3)、H(1 : 1)组(p<0.10),证明在此密度条件下,白鲢投放量的增加可以减少浮游藻类生物量.同时,仅在 H(1 : 3)、H(1 : 1)组中发现浮游藻类有小型化的趋势,而在低密度组中没有发现.这可能是因为本次试验围隔水体为浅层池塘型水体,在有鱼组水体内,沉水植物生长较好且孔隙丰富,可以为浮游动物提供良好的饵料环境及庇护场所.
5 结论(Conclusions)1)光倒刺鲃可以显著摄食丝状藻水绵,且在L(3 : 1)组中,即可对丝状藻的生长产生明显抑制作用.
2)高密度投放光倒刺鲃、白鲢,无论比例如何,都会引起水体水质下降,引起轻微富营养化,并导致浮游藻类生物量上升,因此,不适用于本试验水体.
3)本试验“藻-草-鱼”共生条件下,在高密度(80 g · m-3)投放条件下,白鲢可以抑制浮游生物总量,H(1 : 3)、H(1 : 1)组中,藻类有小型化的趋势;而在低密度(40 g · m-3)投放条件下,未发现滤食导致浮游藻类小型化.因此,本试验L(3 : 1)组,即光倒刺鲃30 g · m-3、白鲢10 g · m-3,可以有效控制试验水体丝状藻水绵滋生,且能够兼顾水质.
| [1] | 陈少莲, 刘肖芳, 华俐. 1991. 鲢、鳙在东湖生态系统的氮、磷循环中的作用[J]. 水生生物学报, 15(1): 8-25 |
| [2] | 陈孝花, 潘连德, 张饮江. 2011. 水中丝状藻类有害藻华的形成与对策[J]. 南方水产科学, 7(2): 77-82 |
| [3] | Choo K, Snoeijs P, Pedersén M. 2004. Oxidative stress tolerance in the filamentous green algae Cladophora glomerata and Enteromorpha ahlneriana[J]. Journal of Experimental Marine Biology and Ecology, 298(1): 111-123 |
| [4] | Den Hartog C. 1994. Suffocation of a littoral Zostera bed by Enteromorpha radiata[J]. Aquatic Botany, 47(1): 21-28 |
| [5] | Drenner R W, Baca R M, Gilroy J S, et al. 2002. Community responses to piscivorous largemouth bass: A biomanipulation experiment[J]. Lake and Reservoir Management, 18(1): 44-51 |
| [6] | 凡传明, 刘云国, 郭一明, 等. 2011. 水绵(Spirogyra)对蓝藻复苏及藻类群落结构的影响[J]. 环境科学学报, 31(10): 2132-2137 |
| [7] | Hawes I, Smith R. 1993. Influence of environmental factors on the growth in culture of a New Zealand strain of the fast-spreading alga Hydrodictyon reticulatum (water-net)[J]. Journal of Applied Phycology, 5(4): 437-445 |
| [8] | 胡鸿钧, 魏印心. 2006. 中国淡水藻类: 系统、分类及生态[M]. 北京: 科学出版社 |
| [9] | 黄子贤, 张饮江, 马海峰, 等. 2011. 4种沉水植物对富营养化水体氮磷的去除能力[J]. 生态科学, 30(2): 102-106 |
| [10] | 金相灿, 屠清瑛. 1990. 湖泊富营养化调查规范(第2版)[M]. 北京: 中国环境科学出版社 |
| [11] | Laws E A, Weisburd R S J. 1990. Use of silver carp to control algal biomass in aquaculture ponds[J]. The Progressive Fish-Culturist, 52(1): 1-8 |
| [12] | Leventer H, Teltsch B. 1990. The contribution of silver carp (Hypophthalmichthys molitrix) to the biological control of Netofa rescervoirs[J]. Hydrobiologia, 191(1): 47-55 |
| [13] | 李春喜, 王志和, 王文林. 2000. 生物统计学(第2版)[M]. 北京: 科学出版社 |
| [14] | 黎臻, 张饮江, 张乐婷, 等. 2013. 光倒刺鲃对水绵、轮叶黑藻、金鱼藻的摄食选择性及对水质影响[J]. 水生生物学报, 37(4): 735-743 |
| [15] | 刘建康, 谢平. 1998. 揭开武汉东湖蓝藻水华消失之谜[J]. 长江流域资源与环境, 8(3): 312-319 |
| [16] | 马剑敏, 马顷, 苏秀燕, 等. 2011. 水绵对3种沉水植物的化感作用研究[J]. 河南农业科学, 40(9): 70-73 |
| [17] | 马军, 雷国元. 2008. 水绵(spirogyra)的除磷特性及其对微藻生长的抑制作用[J]. 环境科学学报, 28(3): 476-483 |
| [18] | 马顷. 2011. 水绵和刚毛藻的生态适应性及其干扰作用对四种沉水植物的影响[D]. 新乡: 河南师范大学 |
| [19] | 马祖友. 2005. 蓝藻的生长生理特征及其竞争优势研究[D]. 西安: 西北农林科技大学 |
| [20] | Starling F L R M. 1993. Control of eutrophication by silver carp (Hypophthalmichthys molitrix) in the tropical Paranoá Reservoir (Brasília, Brazil): a mesocosm experiment[J]. Hydrobiologia, 257(3): 143-152 |
| [21] | 王丽卿, 许莉, 陈庆江, 等. 2011. 鲢鳙放养水平对淀山湖浮游植物群落影响的围隔实验[J]. 环境工程学报, 5(8): 1790-1794 |
| [22] | 魏复盛. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社 |
| [23] | 赵家荣, 刘艳玲. 2009. 水生植物图鉴[M]. 武汉: 华中科技大学出版社 |
| [24] | 钟金香, 林小涛, 许忠能, 等. 2001. 放养鱼类对淡水生态环境的下行影响[J]. 暨南大学学报(自然科学版), 22(5): 131-136 |
 2015, Vol. 35
2015, Vol. 35


