2. 成都乐攀环保科技有限公司, 成都 610071;
3. 工业聚集区污染控制与生态修复教育部重点实验室, 华南理工大学, 广州 510006
2. Chengdu Lepan Environmental Protection Technology Co., Ltd., Chengdu 610071;
3. The Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters of the Ministry of Education, South China University of Technology, Guangzhou 510006
近年来,纳米零价铁(nZVI)因具有比表面积大、反应活性高、应用灵活等特点被广泛地应用于地下水污染物的治理.目前利用nZVI处理的地下水污染物主要包括重金属、无机化合物、有机卤代化合物(Chen et al., 2004; Kanel et al., 2006; Liu et al., 2005).nZVI独特的核壳结构为具有强还原性的Fe0,能快速降解污染物,壳则是铁的氧化物.nZVI去除不同重金属机理有所不同,如去除Cr(Ⅵ)主要为还原作用和共沉淀作用,去除Zn(Ⅱ)主要为吸附和共沉淀作用,去除Ni(Ⅱ)主要为吸附和还原作用,去除As(Ⅲ)主要为吸附、还原和氧化作用(Yan et al., 2013).nZVI去除无机化合物如硝酸盐(NO-3)以氧化还原反应为主,Fe0失去电子氧化成Fe2+,NO-3被还原成NO-2、N2、NH+4等(Chen et al., 2004).而nZVI降解有机卤代污染物通常包括吸附和还原脱卤两个过程,其表面的氧化层可将有机物快速吸附在其表面,Fe0作为强的还原剂,能释放电子,释放出来的电子穿过氧化层,迅速转到有机物分子上,还原有机物造成碳卤键断裂(Liu et al., 2005; Yan et al., 2013).为了进一步提高nZVI的活性,可在nZVI表面负载另一种活性较低的金属,如Cu、Ag、Ni、Pd等,在表面形成微电池促进电子转移,加快反应速率.在纳米铁双金属材料中,零价铁作为还原剂提供电子,而Ni、Pd作为催化剂加速H2的生成,将H2吸附在双金属的表面转化成还原性极强的原子态H*,用于加氢反应(Chun et al., 2010; Huang et al., 2013).Fang等(2011)利用nZVI/Ni和nZVI降解多溴联苯醚,在相同条件下,nZVI/Ni对多溴联苯醚的去除速率明显快于nZVI.此外,Ni、Pd的负载可在一定程度上防止钝化层的形成,并且可减少有毒副产物的形成(Schrick et al., 2002; Zhang et al., 1998).Zhu等(2011)利用nZVI/Ni降解PCBs,其产物主要为联苯和环已基苯,并没有氯代产物检出.
多环芳烃(PAHs)是一类由2个或2个以上苯环结合在一起的持久性有机物污染物.作为最主要的地下水污染物之一,特别是二环和三环的PAHs,在水中的溶解度能达到1~200 μg · L-1并具有很强的迁移活动能力(Nelkenbaum et al., 2007).PAHs具有致癌、致畸、致突变性和难生物降解性等特性,并能通过生物富集进入食物链,对人体健康和生态环境具有很大危害,已引起了全世界范围内的广泛关注(Dugay et al., 2002; Hecht 1999; vander Oost et al., 2003; Wolfe et al., 1987).目前去除水中PAHs主要是微生物修复技术和催化加氢技术(Nelkenbaum et al., 2007; Wang et al., 2008).微生物修复技术利用微生物将PAHs作为碳源或能源,或者将PAHs与其他有机质进行共代谢,从而将PAHs降解(Gottfried et al., 2010).Masakorala and Gottfried(Masakorala et al.,2013; Gottfried et al., 2010)将从石油污染的土壤中分离出来的新型细菌菌株USTB-RU接种到含有菲的液体介质中,8 d后菲的降解去除率达86.65%.但微生物生长受到pH、温度、营养物质等环境因素影响较大,并且效率不高,反应周期长.催化加氢技术是利用Ni、Pd、Pt等贵金属作为催化剂,让不饱和烃与吸附在催化剂上的原子态氢发生加成反应.Nelkenbaum等(2007)利用纳米零价铁活化的镍卟啉将萘转化成毒性较低的四氢萘,可用于合成液晶材料及分散型燃料电池的贮氢材料.然而传统的催化反应需要高温高压,或者往反应体系通入气体、加入有机溶剂,因此很多研究工作致力于研发高效催化剂、改善催化条件,使之能在温和条件下便可以进行反应.
目前将nZVI及其双金属颗粒用于地下水中PAHs的降解研究尚未报道.本文选择PAHs典型代表—菲(Phenanthrene)作为目标物,探讨nZVI、 nZVI/Ni和nZVI/Cu降解菲的动力学和机理.研究了nZVI、nZVI/Ni和nZVI/Cu的投加量,菲的初始浓度、溶液初始pH、反应温度等因素对反应的影响,并分析菲还原反应的中间产物,对比研究3种反应剂去除菲的反应机理,为地下水环境中多环芳烃的去除提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料菲(Phenanthrene,Sigma,纯度>99%),硼氢化钠(NaBH4,成都市科龙化工试剂厂,分析纯)、六水合氯化铁(FeCl3 · 6H2O,国药集团化学试剂有限公司,分析纯)、六水合氯化镍(NiCl2 · 6H2O,汕头市西陇化工有限公司,分析纯),氯化铜(CuCl2,成都市科龙化工试剂厂,分析纯),叠氮化钠(NaN3,成都市科龙化工试剂厂,分析纯),正己烷、乙腈、二氯甲烷(C6H14、C2H3N、CH2Cl2,上海安谱公司,色谱纯).
2.2 nZVI、nZVI/Cu和nZVI/Ni的制备将0.25 mol · L-1NaBH4水溶液,经蠕动泵(流速为50 mL · min-1)逐滴加入到浓度为0.045 mol · L-1的FeCl3水溶液中,同时用电动搅拌器以600 r · min-1的转速不断搅拌溶液,制备nZVI(雷蕾等,2013).其反应方程式为:
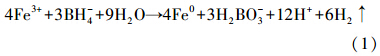
nZVI经抽滤、超纯水清洗3次、无水乙醇清洗1次后密封并在4 ℃条件下保存备用.
称取10.0 g nZVI于平底三角瓶中,加入300 mL无水乙醇,在氮气保护下用电动搅拌器以150 r · min-1的转速搅拌.加入2.5 mL 20 g · L-1的Cu(或Ni)储备液(Ni或Cu负载率为0.5%(质量比)),继续搅拌15 min后真空抽滤、超纯水清洗3次、无水乙醇清洗1次后密封并在4 ℃条件下保存备用.
2.3 纳米材料的表征 2.3.1 扫描电子显微镜(SEM)采用LEO 1530 VP(德国LEO公司)扫描电子显微镜仪分析新鲜制备的nZVI、nZVI/Cu和nZVI/Ni颗粒的表面形貌及粒子尺寸.将少量纳米铁用无水乙醇稀释,在超声波下分散30 min,移取1~2滴待测样品于铜片上,自然风干后喷金,用扫描电子显微镜在加速电压为5.0 kV的条件下放大扫描.
2.3.2 比表面积测定仪(BET)采用ASAP2020(美国麦克仪器)比表面积测定仪测定nZVI、nZVI/Cu和nZVI/Ni颗粒的比表面积.待测量样品在200 ℃下脱气5 h,以液氮作为吸附介质,在77.298 K时测试不同压力下纳米铁对N2的吸附体积,再根据等温吸附方程计算出材料的比表面积.
2.3.3 X-射线衍射(XRD)采用D8 Advance(德国Bruker公司)X-射线衍射仪测定nZVI、nZVI/Cu和nZVI/Ni颗粒的晶体结构.测试条件:铜靶,Kα射线(λ= 0.15418 nm),Ni滤波片,管压40 kV,管流40 mA,扫描步长0.02°,扫描速度0.1 s ·步-1,狭缝DS=0.5°,RS=8 mm.
2.4 菲的降解反应以甲醇为溶剂,配置成浓度为1.0 g · L-1的菲储备液.在进行菲的降解实验前,用超纯水将菲储备液稀释至0.5 mg · L-1或1.5 mg · L-1,调节溶液初始pH分别为3.0、7.5和10.0,并加入叠氮化钠以防止微生物的降解作用.称取0.05 g或0.25 g新鲜制备的nZVI、nZVI/Ni和nZVI/Cu于60 mL的棕色顶空反应瓶中,并加入50.0 mL的菲稀释液,密封,超声,置于控温摇床中,于15、25、30、35、40 ℃,160 r · min-1条件下反应,间隔时间取样.
2.5 液相色谱分析(HPLC)菲的取样分析方法:在预订的反应时间取反应后的混合液20.0 mL,3500 r · min-1离心15 min后取上清液用高效液相色谱(LC-20A,Shimadz,日本)进行测定.测定条件:C18分离柱(250 mm×4.6 mm,Phenomenex,美国),流动相为乙腈 ∶ 水=90 ∶ 10,流速1 mL · min-1,检测波长254nm.
2.6 气相色谱-质谱联用分析(GC-MS)中间产物分析方法:在预订的反应时间取反应后的混合液离心,取20.00 mL上清液,用40.0 mL二氯甲烷和40.0 mL正己烷依次萃取后装入梨形瓶,再通过40 ℃水浴抽真空旋转蒸发进行浓缩,然后用GC-MS(7890A-5975C,Agilent,美国)检测分析.参数设置:HP-5MS 柱(30 m×0.25 mm×0.25 μm,Agilent,美国);进样口温度280 ℃,检测器温度300 ℃;升温程序为70 ℃保持1 min,15 ℃ · min-1升到300 ℃,保持10 min;载气为N2,流速1.0 mL · min-1;进样量为1 μL,不分流模式.
2.7 酸溶出实验在nZVI和nZVI/Cu与菲的反应过程中,在预定的反应时间往溶液中加入3.0 mL浓盐酸.待溶液里的纳米铁溶解完全,溶液澄清,调节pH至8.0,取样用HPLC检测菲的浓度.
3 结果(Results) 3.1 纳米材料表征结果 3.1.1 SEM表征结果SEM图像显示(图 1a),实验室新鲜制备的nZVI呈球状,颗粒与颗粒之间因磁性作用团聚,颗粒平均粒径为80~100 nm.表面负载Ni和Cu对nZVI表面形态和粒径无明显影响(图 1b和1c).nZVI、nZVI/Cu和nZVI/Ni颗粒的比表面积分别为18.95、32.46和33.75 m2 · g-1.
 |
| 图 1 扫描电镜图(a,b,c分别为新鲜制备的nZVI,nZVI/Cu,nZVI/Ni) Fig. 1 SEM images of freshly prepared nZVI(a),nZVI/Cu(b) and nZVI/Ni(c) |
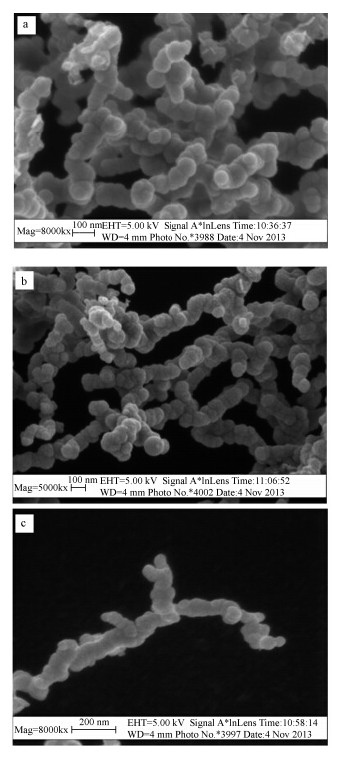
XRD结果显示(图 2),实验室新鲜制备nZVI、nZVI/Ni和nZVI/Cu均在2θ为44.8°处出现α-Fe0的特征峰,表明合成的纳米铁主要以α-Fe0的形式存在,原子排序性好,结晶程度高.但在衍射图谱中并未发现Ni或Cu及其氧化物的特征峰,这可能是因为Ni或Cu的含量很低未达到XRD的检测限.根据文献报道nZVI表面附着一层铁氧化物的钝化层(Zhu and Lim, 2007),而在新鲜制备的纳米铁及其双金属的衍射图谱中均未发现铁氧化物的峰,这可能是因为纳米铁表面附着的铁氧化物是无定型状态的,在XRD图谱中不会形成明显的峰.
 |
| 图 2 X-射线衍射图谱(a,b,c分别为新鲜制备的nZVI,nZVI/Cu,nZVI/Ni) Fig. 2 XRD patterns of freshly prepared nZVI(a),nZVI/Cu(b) and nZVI/Ni(c) |
1)nZVI投加量和菲初始浓度对菲去除的影响
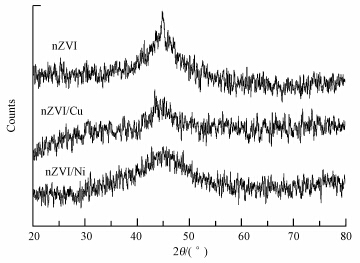
本实验研究了初始pH为7.5,nZVI投加量为1.0 g · L-1和5.0 g · L-1,菲初始浓度为0.5 mg · L-1和1.5 mg · L-1时菲的去除情况,结果如图 3a所示.菲的去除率随着nZVI投加量的增加而升高,随着菲初始浓度的增加而降低.当nZVI的投加量为1.0 g · L-1时,0.5 mg · L-1和1.5 mg · L-1的菲溶液在2 d内浓度基本保持不变.这可能是因为nZVI的量太少,不足以提供足够的活性位.当nZVI的投加量提高到5.0 g · L-1,菲在49h内基本去除.增加nZVI投加量能够提供更多的活性位,从而加速水中菲的去除.当菲的浓度分别为0.5 mg · L-1和1.5 mg · L-1时,其浓度分别在12 h和21 h内基本维持稳定.这可能是因为nZVI先与水反应生成铁的氢氧化物(如[Fe(OH)]+、[Fe(OH)3]-、[Fe(OH)4]2-、Fe(OH)2)(Luo et al., 2010; 刘菲等,2006).
 |
| 图 3 三种纳米铁投加量和菲初始浓度对菲降解的影响 Fig. 3 Effect of three different nanoscale iron dosage and phenanthrene initial concentration on the removal of phenanthrene |
2)nZVI/Cu投加量和菲初始浓度对菲去除的影响
本实验研究了初始pH为7.5,nZVI/Cu投加量分别为1.0 g · L-1和5.0 g · L-1、菲初始浓度分别为0.5 mg · L-1和1.5 mg · L-1时,溶液中菲的浓度随时间变化的关系(图 3b).当nZVI/Cu的投加量为1.0 g · L-1时,0.5 mg · L-1的菲20 h内浓度基本保持不变,随后浓度迅速降低,在45h内去除93%,但对1.5 mg · L-1的菲溶液没有去除效果.当nZVI/Cu的投加量提高到5.0 g · L-1时,对0.5 mg · L-1和1.5 mg · L-1的菲在8 h内浓度基本保持不变,随后迅速去除,去除88% 0.5 mg · L-1的菲溶液只需29h,而去除88%1.5 mg · L-1的菲溶液需要40h以上.
3)nZVI/Ni投加量和菲初始浓度对菲降解的影响
本实验研究了初始pH为7.5,nZVI/Ni投加量为1.0 g · L-1和5.0 g · L-1、菲初始浓度为0.5 mg · L-1和1.5 mg · L-1时,溶液中菲的浓度随时间变化的关系(图 3c).当nZVI/Ni投加量为1.0 g · L-1、菲的初始浓度0.5 mg · L-1时,菲浓度在1 h内降低了50%,22 h后降低了90%.当nZVI/Ni的投加量提高到5.0 g · L-1时,菲的去除速率加快,在0.5 h内菲的去除率达到85%,在7 h后反应基本达到稳态,去除率达到96%.当菲的浓度增加时,去除速率相应减慢,当nZVI/Ni投加量为1.0 g · L-1,菲的初始浓度1.5 mg · L-1时,22 h后菲的去除率只有75%.
3种纳米铁对菲的去除率均随着nZVI投加量的增加而升高,随着菲溶液初始浓度的增加而降低.nZVI和nZVI/Cu去除菲的前期均有菲溶液浓度维持稳定的现象,但nZVI/Cu的前期浓度稳定时间较短,而nZVI/Ni去除菲时,菲在短时间内迅速被降解.总体对菲的去除活性依次为nZVI/Ni>nZVI/Cu >nZVI.因此,选用nZVI/Ni双金属进一步研究溶液初始pH和反应温度对菲降解的影响.
3.2.2 溶液初始pH对菲降解的影响pH是影响nZVI/Ni表面性能的重要因素,因此初始pH的改变可能会影响菲的去除.本实验研究了初始pH分别为3.0、7.5和10.0,菲初始浓度为1.5 mg · L-1,nZVI/Ni投加量为5 g · L-1时菲的降解情况,结果如图 4所示.5 g · L-1的nZVI/Ni均能在22 h将1.5 mg · L-1的菲全部降解,在12 h内,pH为7.5时的降解率略高于初始pH为3.0或10.0时的降解率.但在12 h之后降解率基本保持一致.总的来说pH对反应影响不大.
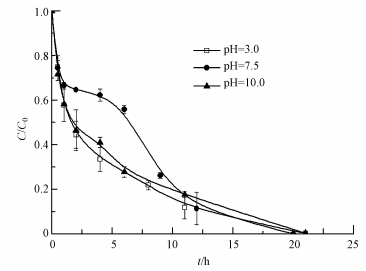 |
| 图 4 不同初始pH对菲降解的影响 Fig. 4 Effect of initial pH on the removal of phenanthrene |
nZVI与H2O的反应如反应式(2)和(3)所示:
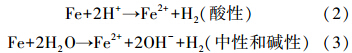
在初始pH值为3时,由于H+的存在,有较多的H2生成,Ni作为有效的加氢催化剂,能将H2固定在双金属表面并催化H2转化成还原性极强的高活性H*加速反应(Han et al., 2008; Xu et al., 2012),因此在短时间内菲的降解速率快.在中性碱性条件下,Fe2+与OH-结合形成一系列氢氧化亚铁络合离子,如[Fe(OH)]+、[Fe(OH)3]-、[Fe(OH)4]2-和Fe(OH)2(式(4)~(7)),对菲可能有一定的吸附作用,促进菲的去除(Luo et al., 2010; 刘菲等,2006).
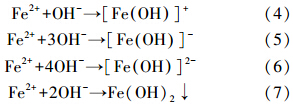
温度是影响整个化学反应速率的关键因素.本实验研究了温度分别为15、25、30、35和40 ℃时,初始pH为7.5,5 g · L-1 nZVI/Ni对1.5 mg · L-1菲的降解情况,结果如图 5所示.反应温度从15 ℃增加到40 ℃时,反应明显加快.当温度升至40 ℃时,1.5 mg · L-1的菲完全去除仅需4 h.可见反应温度的升高有利于nZVI/Ni催化降解菲反应的进行,这与Luo等的结论一致(Luo et al., 2010).在高温(≥30 ℃)时菲的降解遵循一级反应动力学模型.用Arrhenius公式可计算nZVI/Ni降解菲的反应活化能(Venkatapathy et al., 2002).Arrhenius公式见式(8):
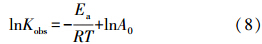
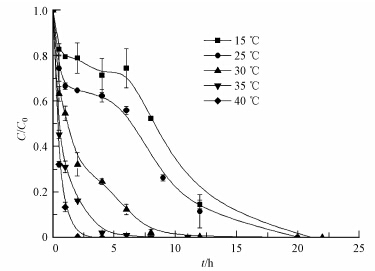 |
| 图 5 不同反应温度对菲降解的影响 Fig. 5 Effect of temperature on the removal of phenanthrene |
式中,Ea为活化能(J · mol-1),A0为指前因子(h-1),Kobs为一级动力学速率常数(h-1),R为气体常数(8.314 J · mol-1 · K-1),T为反应温度(K),做-lnKobs~1/T图,得到直线方程为:
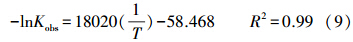
由直线斜率可算出活化能Ea为149.82 kJ · mol-1.温度升高不仅加快了反应体系中菲分子的运动速度,加速了菲与nZVI/Ni的接触,而且还提供了菲被催化降解所需的活化能,使更多的菲分子转化为活化分子.
3.3 反应机理研究利用GC-MS对菲的降解产物进行定性分析,将浓度为5.0 g · L-1的nZVI、nZVI/Cu、nZVI/Ni与1.5 mg · L-1的菲溶液在初始pH为7.5条件下反应,预订时间取样分析,结果如图 6所示.nZVI和nZVI/Cu与菲反应的过程中除了菲的气相峰外并没有检测到其他峰,说明nZVI和nZVI/Cu与菲没有发生加氢反应.但nZVI/Ni与菲反应12 h后,除了有残余的菲(Phen,20.291 min)之外另有4种产物气相峰,分别代表 1,2,3,4,4a,9,10,10a-八氢菲(OHP-1),9,10-二氢菲(DHP),1,2,3,4,5,6,7,8-八氢菲(OHP-2)和1,2,3,4-四氢菲(THP)4种物质,说明nZVI/Ni与菲发生催化加氢反应,并将菲转化成氢菲化合物.这与(Nelkenbaum et al., 2007)的研究一致.
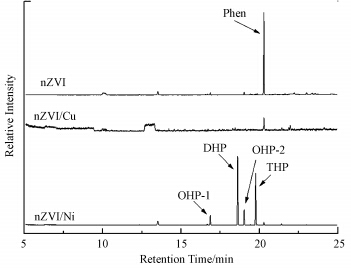 |
| 图 6 nZVI与菲反应50 h后,nZVI/Cu双金属与菲反应50 h后和nZVI/Ni双金属与菲反应12 h后的气-质联用色谱图 Fig. 6 GC-MS chromatogram of intermediates of phenanthrene after reaction with nZVI in 50 h,nZVI/Cu in 50 h and nZVI/Ni in 12 h |
图 7所示为5.0 g · L-1的nZVI/Ni与1.5 mg · L-1菲溶液反应的反应产物随时间变化图.初始反应时就有二氢菲DHP与四氢菲THP生成,THP作为中间产物相对不稳定,浓度在12 h达到最大值后开始向更饱和更稳定的八氢菲OHP-1或者OHP-2转化,而DHP浓度在24 h达到最大值后才缓慢下降;OHP-1和OHP-2反应一段时间后(6 h和1.5 h)开始生成并逐渐增加;从图中可以看出OHP-2增长速度较OHP-1快,这是因为OHP-2异构体较OHP-1稳定;菲在12 h内全部转化.反应40h后,菲经过催化加氢作用后产生的3种主要产物为DHP、OHP-1、OHP-2.
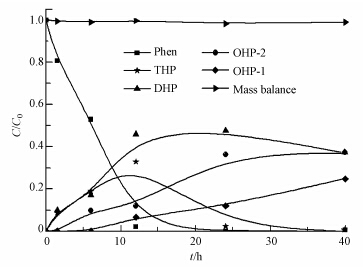 |
| 图 7 nZVI/Ni与菲反应过程中各物质百分含量变化 Fig. 7 Formation and degradation of intermediates during the reaction of nZVI/Ni and phenanthrene |
当Ni负载在纳米铁时,会形成一种还原性极强的高活性H*.H*的形成有两种途径.一是Ni加速铁的腐蚀和水分子的还原生成H2,作为加氢催化剂有效吸附H2,催化H2形成H*,并将其聚集在Ni或nZVI/Ni的表面,如方程式(3)和(10).

二是Ni催化H+接收铁腐蚀释放出来的电子直接形成了H*(式(11)和(12)).H*能溶解于Ni中形成活性极高的镍氢化合物(Ni-H)(式(13)),将吸附在nZVI/Ni表面的菲进行催化加氢(Luo et al., 2010; Mackenzie et al., 2006; Zhang et al., 2007).目前报道研究发现纳米零价铁活化的镍卟啉同样可以将菲催化加氢,生成TDP、DHP、OHP-1和OHP-2 4种产物(Nelkenbaum et al., 2007).
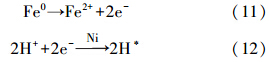

结合图 7菲催化加氢过程中各物质百分含量随反应时间的变化可知,nZVI/Ni对菲(Phen)的催化还原过程的方程式如下:

据此推测菲可能的还原反应途径如图 8所示,两种八氢菲可以通过氢转移进行异构化.
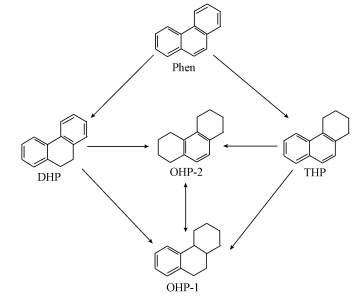 |
| 图 8 nZVI/Ni与菲可能的反应途径 Fig. 8 Proposed degradation pathways of phenanthreneby by nZVI/Ni |
为进一步研究nZVI和nZVI/Cu对菲的去除机理,将5.0 g · L-1的nZVI和nZVI/Cu分别与1.5 mg · L-1的菲溶液反应,在预定的反应时间进行产物酸溶出实验.结果显示(图 9)待残留的纳米铁完全溶于盐酸后,样品溶液中的菲浓度约等于空白样品(未投加nZVI和nZVI/Cu)的菲浓度,表明之前去除的菲是被吸附在纳米铁的表面,随着纳米铁的溶解而被释放回溶液中.因此,nZVI和nZVI/Cu对菲的去除主要为吸附作用.
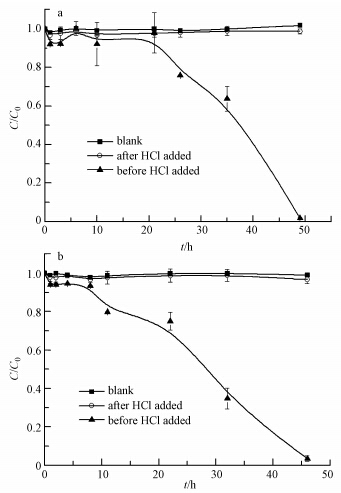 |
| 图 9 酸溶出实验(a. nZVI,b. nZVI/Cu) Fig. 9 Acid dissolution experiments of nZVI(a) and nZVI/Cu(b) |
结合图 3a和3b,nZVI和nZVI/Cu与菲反应的初始阶段,菲的浓度基本维持不变,可能是因为此时nZVI与水、氧等物质发生反应,使得铁表面铁氧化合物加厚,随后对菲起吸附作用. Nejati等(2013)利用实验室制备的nZVI/Cu去除2,4-二氯苯氧乙酸,其机理也主要是利用表面的铁氧化物吸附.Cwiertny等(2006)考察了不同零价铁双金属体系对1,1,1-三氯乙烷催化还原的效能,并用相对偏摩尔焓来表征原子态H*在贵金属中的溶解度,结果显示原子态H*在Ni晶体结构中的溶解度远高于Cu晶体结构中的溶解度.这表明Ni是有效的加氢催化剂,而Cu不是.Cu的负载提高了纳米材料的比表面积,有利于加速电子的转移和传递,加快纳米铁表面氧化物的生成,从而促进了菲在表面的吸附.
4 结论(Conclusions)1)实验室制备的nZVI,nZVI/Cu和nZVI/Ni平均粒径均为80~100 nm,主要以α-Fe0的形式存在.
2)5g · L-1的nZVI,nZVI/Cu和nZVI/Ni对菲溶液均有去除效果,且去除活性依次为nZVI/Ni> nZVI/Cu>nZVI.
3)nZVI/Ni双金属降解菲溶液的去除率随着nZVI/Ni投加量和反应温度的升高而升高,随着菲溶液初始浓度的升高而降低,pH对反应影响不大.
4)nZVI/Ni双金属能在常温常压下将菲催化加氢,反应生成中间产物为DHP、THP、OHP-1和OHP-2;nZVI和nZVI/Cu双金属对菲溶液的去除主要为吸附作用.
| [1] | Chen S S, Hsu H D, Li CW. 2004. A new method to produce nanoscale iron for nitrate removal[J]. Journal of Nanoparticle Research, 6(6): 639-647 |
| [2] | Chun C L, Baer D R, Matson D W, et al. 2010. Characterization and reactivity of iron nanoparticles prepared with added Cu, Pd, and Ni[J]. Environmental Science and Technology, 44(13): 5079-5085 |
| [3] | Cwiertny D M, Bransfield S J, Livi K J T, et al. 2006. Exploring the influence of granular iron additives on 1, 1, 1-trichloroethane reduction[J]. Environmental Science and Technology, 40(21): 6837-6843 |
| [4] | Dugay A, Herrenknecht C, Czok M, et al. 2002. New procedure for selective extraction of polycyclic aromatic hydrocarbons in plants for gas chromatographic–mass spectrometric analysis[J]. Journal of Chromatography A, 958(1/2): 1-7 |
| [5] | Fang Z, Qiu X, Chen J, et al. 2011. Debromination of polybrominated diphenyl ethers by Ni/Fe bimetallic nanoparticles: Influencing factors, kinetics, and mechanism[J]. Journal of Hazardous Materials, 185(2/3): 958-969 |
| [6] | Gottfried A, Singhal N, Elliot R, et al. 2010. The role of salicylate and biosurfactant in inducing phenanthrene degradation in batch soil slurries[J]. Applied Microbiology and Biotechnology, 86(5): 1563-1571 |
| [7] | Han Y, Li W, Zhang M H, et al. 2008. Catalytic dechlorination of monochlorobenzene with a new type of nanoscale Ni(B)/Fe(B) bimetallic catalytic reductant[J]. Chemosphere, 72(1): 53-58 |
| [8] | Hecht S S. 1999. Tobacco smoke carcinogens and lung cancer[J]. JNCI Journal of the National Cancer Institute, 91(14): 1194-1210 |
| [9] | Huang Q, Liu W, Peng P A, et al. 2013. Reductive debromination of tetrabromobisphenol A by Pd/Fe bimetallic catalysts[J]. Chemosphere, 92(10): 1321-1327 |
| [10] | Kanel S R, Grenèche J M, Choi H. 2006. Arsenic(V) removal from groundwater using Nano scale Zero-Valent iron as a colloidal reactive barrier material[J]. Environmental Science and Technology, 40(6): 2045-2050 |
| [11] | 雷蕾, 李筱琴, 殷其亮, 等. 2013. 聚苯乙烯磺酸钠对零价纳米铁表面结构和去除水中As(Ⅲ)的影响[J]. 环境科学学报, 33(2): 408-414 |
| [12] | 刘菲, 黄园英, 张国臣. 2006. 纳米镍/铁去除氯代烃影响因素的探讨[J]. 地学前缘, 13(1): 150-154 |
| [13] | Liu Y Q, Majetich S A, Tilton R D, et al. 2005. TCE dechlorination rates, pathways, and efficiency of nanoscale iron particles with different properties[J]. Environmental Science and Technology, 39(5): 1338-1345 |
| [14] | Luo S, Yang S G, Wang X D, et al. 2010. Reductive degradation of tetrabromobisphenol A over iron-silver bimetallic nanoparticles under ultrasound radiation[J]. Chemosphere, 79(6): 672-678 |
| [15] | Mackenzie K, Frenzel H, Kopinke F D. 2006. Hydrodehalogenation of halogenated hydrocarbons in water with Pd catalysts: Reaction rates and surface competition[J]. Applied Catalysis (B: Environmental), 63(3/4): 161-167 |
| [16] | Masakorala K, Yao J, Cai M M, et al. 2013. Isolation and characterization of a novel phenanthrene (PHE) degrading strain Psuedomonas sp. USTB-RU from petroleum contaminated soil[J]. Journal of Hazardous Materials, 263(Part 2): 493-500 |
| [17] | Nejati K, Davary S, Saati M. 2013. Study of 2, 4-dichlorophenoxyacetic acid (2, 4-D) removal by Cu-Fe-layered double hydroxide from aqueous solution[J]. Applied Surface Science, 280: 67-73 |
| [18] | Nelkenbaum E, Dror I, Berkowitz B. 2007. Reductive hydrogenation of polycyclic aromatic hydrocarbons catalyzed by metalloporphyrins[J]. Chemosphere, 68(2): 210-217 |
| [19] | Schrick B, Blough J L, Jones A D, et al. 2002. Hydrodechlorination of trichloroethylene to hydrocarbons using bimetallic Nickel-Iron nanoparticles[J]. Chemistry of Materials, 14(12): 5140-5147 |
| [20] | van der Oost R, Beyer J, Vermeulen N P E. 2003. Fish bioaccumulation and biomarkers in environmental risk assessment: a review[J]. Environmental Toxicology and Pharmacology, 13(2): 57-149 |
| [21] | Venkatapathy R, Bessingpas D G, Canonica S, et al. 2002. Kinetics models for trichloroethylene transformation by zero-valent iron[J]. Applied Catalysis B: Environmental, 37(2): 139-159 |
| [22] | Wang J, Xu H K, An M Q, et al. 2008. Kinetics and characteristics of phenanthrene degradation by a microbial consortium[J]. Petroleum Science, 5(1): 73-78 |
| [23] | Wolfe A, Shimer G H, Meehan T. 1987. Polycyclic aromatic hydrocarbons physically intercalate into duplex regions of denatured DNA[J]. Biochemistry, 26(20): 6392-6396 |
| [24] | Xu F Y, Deng S B, Xu J, et al. 2012. Highly active and stable Ni-Fe bimetal prepared by ball milling for catalytic hydrodechlorination of 4-chlorophenol[J]. Environmental Science and Technology, 46(8): 4576-4582 |
| [25] | Yan W L, Lien H L, Koel B E, et al. 2013. Iron nanoparticles for environmental clean-up: recent developments and future outlook[J]. Environmental Science: Processes & Impacts, 15(1): 63-77 |
| [26] | Zhang W H, Quan X, Zhang Z Y. 2007. Catalytic reductive dechlorination of p-chlorophenol in water using Ni/Fe nanoscale particles[J]. Journal of Environmental Sciences, 19(3): 362-366 |
| [27] | Zhang W X, Wang C B, Lien H L. 1998. Treatment of chlorinated organic contaminants with nanoscale bimetallic particles[J]. Catalysis Today, 40(4): 387-395 |
| [28] | Zhu B W, Lim T T. 2007. Catalytic reduction of chlorobenzenes with Pd/Fe nanoparticles: Reactive sites, catalyst stability, particle aging, and regeneration[J]. Journal of Environmental Sciences, 41(21): 7523-7529 |
| [29] | Zhu N M, Yi L, Zhang F S. 2011. Catalytic dechlorination of polychlorinated biphenyls in subcritical water by Ni/Fe nanoparticles[J]. Chemical Engineering Journal, 171(3): 919-925 |
 2015, Vol. 35
2015, Vol. 35


