将Fenton技术应用于环境废水中有机污染物的治理是当前的研究热点之一,而在传统Fenton反应的基础上,如何进一步提高有毒无机和有机污染物的降解效能也受到越来越多的关注(Chen et al., 2002,邹志刚等,2005).研究发现,在紫外光照射及添加特定的活化试剂条件下,可以提高Fenton技术对有机污染物的降解效率(Anipsitakis et al., 2004; Chen et al., 2011).从绿色节能的角度出发,太阳光是最佳的光源来源(Menager et al., 2012; 黄应平等,2005).因此,如何建立太阳光驱动下且能有效降解有机污染物的Fenton法,是该技术应用于实际环境治理过程中的关键科学问题.有关Fe(Ⅲ)或Fe(Ⅱ)、络合试剂及光照条件等对Fenton反应过程和污染物的降解特征影响已有大量的研究报道(Chen et al., 1997; Ma et al., 2005; Uchimiya et al., 2009),但对Fenton反应的活化和促进作用机理的研究仍需进一步加强.基于对蒽醌类溶解有机质的化学结构(含氧化敏感型官能团)和Fenton反应的原理分析,本文利用自制的光催化反应器和Fenton试剂在模拟太阳光照射下,研究了自然界中普遍存在的不同种类蒽醌类溶解有机质对染料罗丹明B(RhB)光催化脱色特征的影响,并初步探讨了光照作用和有机质耦合驱动下的Fenton法降解有机污染物的机理,以期为太阳光驱动下的降解有机污染物的Fenton法研究提供理论依据和参考.
2 实验部分(Experiment sections) 2.1 光源及反应设备模拟太阳光的光源为500 W 的氙灯,氙灯置于含冷却水的双层石英玻璃夹套中,所有的反应均在125 mL的玻璃反应瓶中进行.反应装置示意图见图 1.
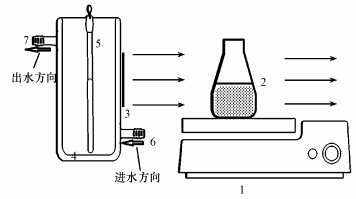 |
| 图 1 光源及反应体系示意图(1.磁粒子搅拌器,2.反应容器,3.照射窗口,4.冷凝套管,5.氙灯,6.冷凝套管进水口,7.冷凝套管出水口) Fig. 1 Light source and photoreactor |
根据具体的实验目的,在100 mL反应体系中加入不同浓度的H2O2、Fe(Ⅲ)和甲醇,以及不同种类和浓度的醌:AQS(2-磺酸钠蒽醌)、AQDS(2,6-蒽醌二磺酸钠)、HQ(对苯二酚).体系中EDTA和RhB浓度分别为0.5 mmol · L-1和20 mmol · L-1.每隔一定的时间移取3mL反应溶液至石英比色皿中,测定体系中RhB脱色后的浓度.
2.3 分析与测定方法在RhB的最大吸收波长处(554 nm)测定其吸光度,利用朗伯比尔定律,换算成相应的浓度.RhB最大吸收波长处(554 nm)的吸光度与其浓度之间的关系为:y=2.7124x-0.1637,其中,y 为RhB浓度(mmol · L-1),x为554 nm处的吸光度.
3 结果与讨论(Results and discussion) 3.1 不同醌类介导下的RhB光脱色特征由图 2可知,含不同醌类的反应体系中,无光照条件下,各反应体系中的RhB几乎不发生脱色;在光照条件下,如果体系不含Fe(Ⅲ),含HQ体系中的RhB也几乎不发生脱色,而在含AQS和AQDS的体系中,在分别经历约170 min和100 min后才发生脱色现象,但脱色程度均不明显,不超过30%.而在含Fe(Ⅲ)和相应醌类的反应体系中,在光照作用下,RhB的光脱色程度得到显著提升,脱色率可达到80%左右.在模拟太阳光条件下,不同醌类介导下的RhB的光脱色程度大小顺序依次为:AQS>AQDS>HQ.
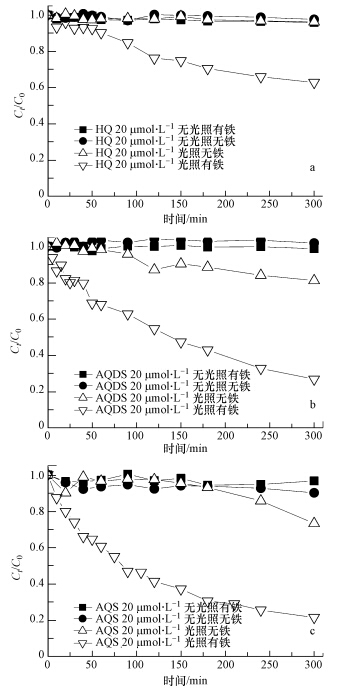 |
| 图 2 不同醌类介导下的RhB光脱色特征(体系中Fe(Ⅲ)和H2O2浓度分别为10 μmol · L-1和10 mmol · L-1) Fig. 2 Characteristics of RhB decolorazation process influenced by different quinones(Content of Fe(Ⅲ) and H2O2 were 10 μmol · L-1 and 10 mmol · L-1 respectively) |
体系中EDTA可使Fe(Ⅲ)以络合物形式稳定存在,在光照作用下,醌类物质产生半醌自由基,作为自由基负离子中间体的半醌具有较强的还原性(Fang et al., 2013),能迅将Fe(Ⅲ)还原为Fe(Ⅱ),Fe(Ⅱ)进一步与双氧水反应生成羟基自由基,促进了Fenton反应的进行.由此可见,在模拟太阳光作用下,体系中醌类和Fe(Ⅲ)的耦合作用,使得RhB脱色程度得到进一步加强,加速了RhB的脱色.
3.2 体系中醌浓度对RhB光脱色特征的影响实验进一步表明,随着体系中醌浓度的增加,RhB的光脱色率也随之升高,但当AQS浓度增加至50 μmol · L-1以上时,对RhB光脱色率的促进作用不再明显(图 3).这是因为体系中AQS 浓度增加,在光照作用下生成相应的还原态氢醌含量也相应上升,而氢醌能淬灭羟基自由基(Fang et al., 2013),故AQS浓度上升至50 μmol · L-1以上时,同20 μmol · L-1 AQS体系相比,光脱色率反而出现稍微下降.对于AQDS而言,当浓度升至100 μmol · L-1时,也出现了类似的现象.在含HQ的反应体系中,HQ浓度在0~100 μmol · L-1范围内变化,均没有发生高醌浓度下RhB脱色程度下降的现象.这可能是由于不同种类的醌在光照作用下,生成相应还原态氢醌的速率和反应活性存在差异(Chen et al.,1997).
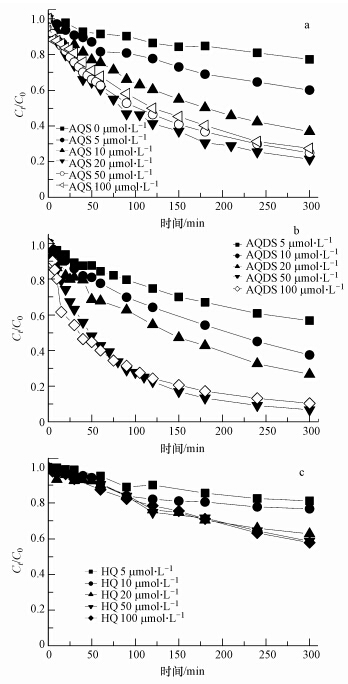 |
| 图 3 不同含量醌类对RhB光脱色特征的影响(体系中Fe(Ⅲ)和H2O2浓度分别为10 μmol · L-1和10 mmol · L-1) Fig. 3 Characteristics of RhB decolorazation process influenced by contents of different quinones(Content of Fe(Ⅲ) and H2O2 were 10 μmol · L-1 and 10 mmol · L-1 respectively) |
为进一步证实醌和Fe(Ⅲ)在光照条件下发生的耦合作用过程中产生的活性羟基自由基驱动了RhB的光脱色过程,并考虑到甲醇是有效的羟基自由基淬灭剂(Zepp et al., 1992),本文考察了反应体系中不同含量的甲醇对RhB脱色特征的影响.总体而言,随着体系中甲醇含量的增加,RhB脱色程度不断减弱(图 4),证实了羟基自由基是导致RhB脱色的主要因素.在含10 mmol · L-1的甲醇体系中,HQ对RhB脱色过程的促进作用基本被完全抑制(图 4c).
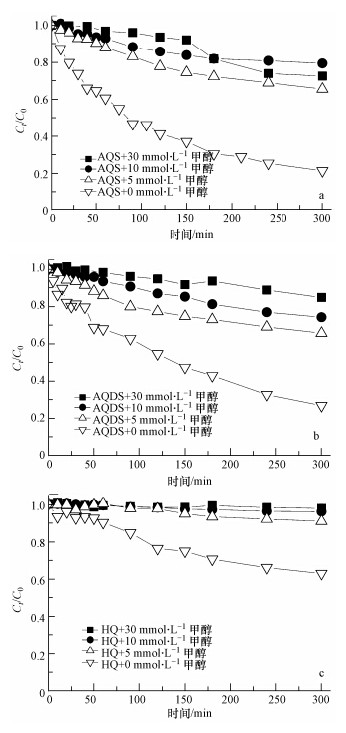 |
| 图 4 不同甲醇含量对RhB光脱色特征的影响(体系中Fe(Ⅲ)、H2O2浓度和醌分别为10 μmol · L-1、10 mmol · L-1和20 μmol · L-1) Fig. 4 Characteristics of RhB decolorazation process influenced by contents of radical quencher(Content of Fe(Ⅲ),H2O2 and quinones were 10 μmol · L-1,10 mmol · L-1 and 20 μmol · L-1 respectively) |
实验还进一步讨论了Fe(Ⅲ)含量对RhB光脱色特征的影响,结果如图 5所示.在无光照条件下,Fe(Ⅲ)含量对RhB脱色程度的影响程度不大,脱色率均不超过10%.而在光照条件下,随着Fe(Ⅲ)含量的增加,RhB脱色程度也逐渐加强.在含HQ的反应体系中,只有当Fe(Ⅲ)含量增加至20 μmol · L-1时,RhB的脱色程度才有明显的提升(图 5c).这也进一步说明在光照条件下,相对于HQ,AQS和AQDS存在条件下的“蒽醌-Fe(Ⅲ)”耦合作用驱动下的Fenton光脱色体系具有更强的效能和灵敏度.
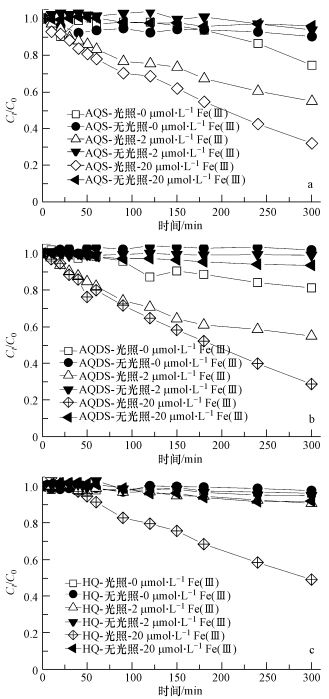 |
| 图 5 不同含量Fe(Ⅲ)对RhB光脱色特征的影响(体系中H2O2浓度和醌分别为10 mmol · L-1和20 μmol · L-1) Fig. 5 Characteristics of RhB decolorazation process influenced by contents of Fe(Ⅲ)(Content of H2O2 and quinones were 10 mmol · L-1 and 20 μmol · L-1 respectively) |
不同体系组成条件下,H2O2含量直接制约着RhB的脱色程度.由图 6可知,无H2O2的体系中,光照或非光照情况下,含3种醌类的反应体系中RhB均不发生脱色作用.而在光照条件下,随H2O2含量的增加,RhB脱色程度不断上升.非光照条件下,H2O2含量由2 mmol · L-1增加至20 mmol · L-1时,RhB脱色程度较低,基本不超过10%.
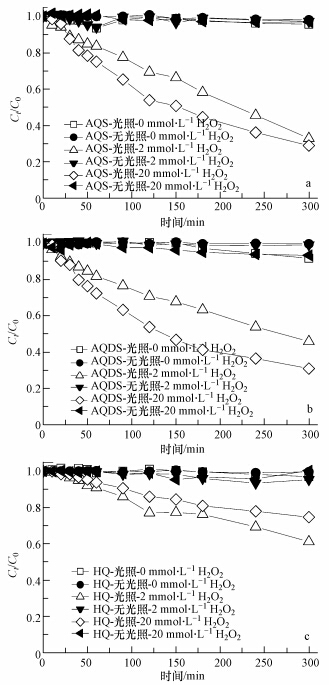 |
| 图 6 不同含量H2O2对RhB光脱色特征的影响(体系中Fe(Ⅲ)和醌浓度分别为10 μmol · L-1和20 μmol · L-1) Fig. 6 Characteristics of RhB decolorazation process influenced by contents of H2O2(Content of Fe(Ⅲ) and quinones were 10 μmol · L-1 and 20 μmol · L-1 respectively) |
由经典Fenton理论可知,Fe(Ⅱ)与H2O2反应生成了具有氧化能力的羟基自由基(· OH),这是Fenton法降解污染物的重要活性物种.由上述实验结果可知,光照作用促进了蒽醌向相应的还原态氢醌转变的过程,而还原态氢醌随之将Fe(Ⅲ)还原为Fe(Ⅱ),保证了体系中Fenton反应得以持续进行所需的Fe(Ⅱ).实验中可检测到Fe(Ⅱ)的生成,监测数据表明:反应初始添加的10 mmol · L-1 Fe(Ⅲ)在经历300 min后,在不同醌的体系中,75.9%~86.3%的Fe(Ⅲ)已经转变为Fe(Ⅱ)(图 7),保证了Fenton反应过程中关键活性物种羟基自由基的持续生成.
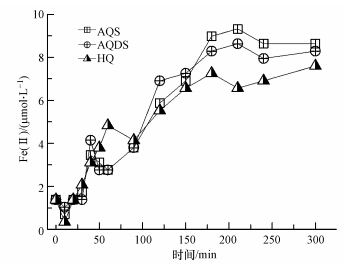 |
| 图 7 不同醌体系反应过程中还原为Fe(Ⅱ)的含量(体系中初始Fe(Ⅲ)、H2O2和醌浓度分别为10 μmol · L-1、10 mmol · L-1和20 μmol · L-1) Fig. 7 Contents of reductively produced Fe(Ⅱ)in reaction systems containing different quinones(Content of Fe(Ⅲ),H2O2 and quinones were 10 μmol · L-1,10 mmol · L-1 and 20 μmol · L-1 respectively) |
综上,基于本实验构建的不同反应体系中RhB的脱色特征,“蒽醌-Fe(Ⅲ)”耦合作用驱动下的Fenton光脱色机理总结如下(图 8).具体过程为:①蒽醌类有机质(Quinone)在模拟日光的作用下,生成具有较强还原性的半醌自由基(Semi-quinone*),随后半醌自由基将Fe(Ⅲ)还原为Fe(Ⅱ);②Fe(Ⅱ)进一步与H2O2反应生成羟基自由基(· OH),促进了Fenton法对RhB脱色过程的进行;③在形成羟基自由基过程中产生的Fe(Ⅲ)继续与半醌自由基反应生成Fe(Ⅱ),不同形态的铁在此过程中不断循环,从而保证了“蒽醌-Fe(Ⅲ)”耦合作用驱动下的Fenton光脱色反应得以顺利进行.
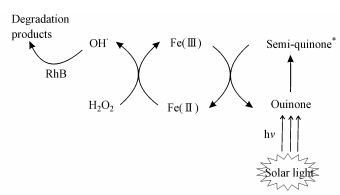 |
| 图 8 “蒽醌-Fe(Ⅲ)”耦合作用驱动下的Fenton光脱色反应机理图 Fig. 8 Proposed mechanism of Fenton decolorazation driven by interaction process of quinones and simulated solar light irradiation |
1)模拟太阳光驱动下体系中醌类和Fe(Ⅲ)的耦合作用过程中,Fe(Ⅲ)向Fe(Ⅱ)的转化促进了羟基自由基(· OH)的生成,使得光Fenton脱色反应程度得到显著加强,RhB的脱色率随之上升.
2)随着体系中羟基自由基淬灭剂含量的增加,RhB脱色程度不断减弱,证实了光Fenton反应过程中产生的羟基自由基是导致RhB脱色的主要因素.
3)随着体系中醌含量的增加,RhB的脱色率也随之升高,但含不同种类醌的反应体系中,RhB光脱色率对醌含量变化的敏感程度存在差别.
| [1] | Anipsitakis G P, Dionysiou D D. 2004. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 38(13): 3705-3712 |
| [2] | Chen F, Ma W H, He J J, et al. 2002. Fenton degradation of malachite green catalyzed by aromatic additives[J]. The Journal of Physical Chemistry A, 106(41): 9485-9490 |
| [3] | Chen L W, Ma J, Li X C, et al. 2011. Strong enhancement on fenton oxidation by addition of hydroxylamine to accelerate the ferric and ferrous iron cycles[J]. Environmental Science & Technology, 45(9): 3925-3930 |
| [4] | Chen R Z, Pignatello J J. 1997. Role of quinone intermediates as electron shuttles in fenton and photoassisted fenton oxidations of aromatic compounds[J]. Environmental Science & Technology, 31(8): 2399-2406 |
| [5] | Fang G D, Gao J, Dionysiou D D, et al. 2013. Activation of persulfate by quinones: free radical reactions and implication for the degradation of PCBs[J]. Environmental Science & Technology, 47(9): 4605-4611 |
| [6] | 黄应平, 刘德富, 张水英, 等. 2005. 可见光/Fenton光催化降解有机染料[J]. 高等学校化学学报, 26(12): 2273-2278 |
| [7] | Ma J H, Ma W H, Song W J, et al. 2005. Fenton degradation of organic pollutants in the presence of low-molecular-weight organic acids: cooperative effect of quinone and visible light[J]. Environmental Science & Technology, 40(2): 618-624 |
| [8] | Menager M, Sarakha M. 2012. Simulated solar light phototransformation of organophosphorus azinphos methyl at the surface of clays and goethite[J]. Environmental Science & Technology, 47(2): 765-772 |
| [9] | Sun C Y, Chang W, Ma W H, et al. 2013. Photoreductive debromination of decabromodiphenyl ethers in the presence of carboxylates under visible light irradiation[J]. Environmental Science & Technology, 47(5): 2370-2377 |
| [10] | Uchimiya M, Stone A T. 2009. Reversible redox chemistry of quinones: Impact on biogeochemical cycles[J]. Chemosphere,77(4): 451-458 |
| [11] | Zepp R G, Faust B C, Hoigne J. 1992. Hydroxyl radical formation in aqueous reactions (pH 3-8) of iron (II) with hydrogen peroxide: the photo-Fenton reaction[J]. Environmental Science & Technology, 26(2): 313-319 |
| [12] | 邹志刚,赵进才,付贤智,等.2005.光催化材料在太阳能转换与环境净化方面的研究现状和发展趋势[J].功能材料信息, 2(6):15-20 |
 2015, Vol. 35
2015, Vol. 35

 , 袁博, 杨瑞
, 袁博, 杨瑞