Fe(Ⅲ)-羧酸盐体系的光降解是目前较受关注的一种高级氧化技术,已广泛应用于水中污染物的降解(Zhang et al., 2009;Ou et al., 2008;孙杰等,2012).例如,Guo等(2011)利用Fe(Ⅲ)-柠檬酸盐体系降解甲基橙,Zhang等(2013)研究了磺胺嘧啶在Fe(Ⅲ)-草酸盐-海藻体系中的降解机理,丁世敏等(2010)研究了可见光照射下橙黄Ⅱ在Fe(Ⅲ)-苹果酸-H2O2体系中的脱色情况,均取得了良好效果.在目前的研究中,常见的羧酸盐有柠檬酸盐、草酸盐、苹果酸盐、丙酮酸盐等.由于Fe(Ⅲ)易发生水解,这些Fe(Ⅲ)-羧酸盐体系只能在酸性条件下对污染物进行处理,给实际应用带来了不便.
乙二胺-N,N′-二琥珀酸(EDDS,结构式见图 1)是一种天然的多羧基氨基酸类螯合剂,具有易生物降解性和低毒性(Nagaraju et al., 2007;Zhang et al., 2008),几乎能与所有的金属离子形成稳定的配合物,目前最常用于土壤重金属修复方面(Theo et al., 2009;Yang et al., 2012;Guo et al., 2010).由于EDDS具有与常见羧酸类似的性质,因此,可将其应用于污水处理中. EDDS本身具有良好的生物降解性,其与金属离子螯合后形成的金属-EDDS螯合物具也有一定的生物降解能力且毒性较低(Fabbricino et al., 2013),且EDDS具有较强的螯合作用,与Fe(Ⅲ)螯合后使得Fe(Ⅲ)在中性和碱性条件下也不会产生沉淀(Huang et al., 2013),因而该体系可以在较广的pH范围内进行污染物降解,比传统的Fe(Ⅲ)-羧酸盐体系更适于实际应用.在目前发表的文献中,将EDDS用于水中污染物降解的研究还比较少.因此,本文利用Fe(Ⅲ)-EDDS体系,在紫外光照射下处理废水中的Cr(Ⅵ),探讨Fe(Ⅲ)、EDDS、Cr(Ⅵ)初始浓度及体系pH对Cr(Ⅵ)光还原效率的影响,探索最佳的反应条件,以期为该体系在污水处理中的应用提供新的数据,同时有利于进一步探索该体系光降解污染物的可能性.
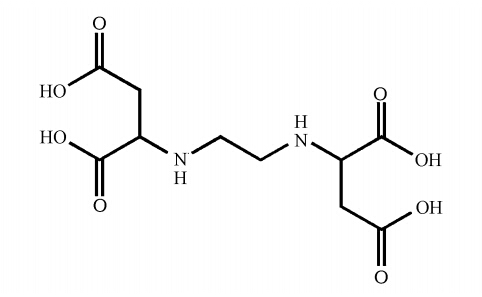 |
| 图 1 乙二胺-N,N′-二琥珀酸结构式 Fig. 1 Structure formula of ethylenediamine-N,N′-disuccinic acid |
试剂:Fe(ClO4)3 · 6H2O(上海aladdin试剂)、35%(S,S)-乙二胺-N,N′-二琥珀酸三钠盐溶液(美国sigma公司)、重铬酸钾(天津博迪化工)、二苯碳酰二肼、H2SO4、H3PO4、HClO4、NaOH均为AR级;实验用水为二次蒸馏水.
仪器:UV1800紫外可见分光光度计(上海凤凰光学科仪有限公),pHs-3C精密酸度计(Multi340i,WTW,Germany),FC204型电子天平,GGZ 500型500W紫外线高压汞灯(上海亚明照明有限公司),磁力搅拌器.
2.2 实验方法配制一定浓度的含Fe(Ⅲ)、EDDS和Cr(Ⅵ)的溶液,由于Fe(Ⅲ)和EDDS以1 : 1的比例进行螯合(Li et al., 2010),因此,溶液中Fe(Ⅲ)和EDDS的摩尔浓度比为1 : 1.用HClO4和NaOH溶液调节体系的pH值.将配制好的溶液放入石英烧杯中,置于500 W紫外灯下进行紫外光降解反应,分别在0、1、2、3、4、6、8、10、15、20、25、30 min时取样.
样品中Cr(Ⅵ)的浓度用二苯碳酰二肼分光光度法测定,具体操作为:取10 mL溶液于50 mL比色管中,用水稀释至标线;加入1+1硫酸溶液0.5 mL和1+1磷酸溶液0.5 mL,摇匀,加入2 mL显色剂,摇匀;5~10 min之后,于540 nm波长处(用1 cm比色皿,以水为参比)测定吸光度.
利用Cr(Ⅵ)浓度与吸光度间的标准线性关系按式(1)计算Cr(Ⅵ)的去除率E,进行拟一级动力学分析时,按照公式(2)对反应过程中溶液中Cr(Ⅵ)浓度C与光反应时间t进行拟合.
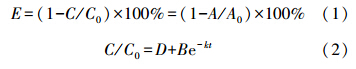
式中,C为光照t min后溶液中剩余Cr(Ⅵ)的浓度,C0为反应初始时溶液中Cr(Ⅵ)的浓度,A为光照t min后溶液中剩余Cr(Ⅵ)的吸光度值,A0为反应初始时Cr(Ⅵ)的吸光度值,B、D为常数,k为反应速率常数.
3 实验结果分析(Results and analysis) 3.1 Cr(Ⅵ)还原对照试验在Fe(Ⅲ)-EDDS浓度为0.15 mmol · L-1,Cr(Ⅵ)浓度为10 mg · L-1,pH=6.0和紫外光照射的条件下进行Cr(Ⅵ)降解的对比实验,Cr(Ⅵ)的去除率变化曲线如图 2所示.由图 2可知,无紫外光照射时,Cr(Ⅵ)的去除率几乎为零.溶液中未加入Fe(Ⅲ)和EDDS时,在紫外光的照射下,30 min后Cr(Ⅵ)的去除率仅为10.9%,Cr(Ⅵ)在只含有Fe(Ⅲ)的溶液中光照反应30 min后去除率为10.5%,在只含有EDDS的溶液中Cr(Ⅵ)光照反应30 min后去除率为18.7%,而同时含有Fe(Ⅲ)、EDDS和Cr(Ⅵ)的溶液在紫外光下反应30 min后Cr(Ⅵ)的去除率达到80.3%.
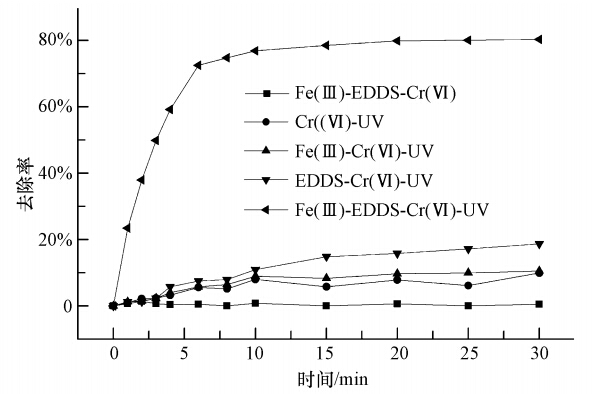 |
| 图 2 Cr(Ⅵ)去除的对比实验 Fig. 2 Contrast experiment under different experimental conditions |
Cr(Ⅵ)在Fe(Ⅲ)-EDDS体系中可能的光化学反应机理(Hug et al., 1997)如图 3所示.当溶液中只存在Fe(Ⅲ)时,部分Fe(Ⅲ)会在紫外光激发下转化成Fe(Ⅱ)对Cr(Ⅵ)进行还原,但pH为6.0时Fe(Ⅲ)会发生水解,因而Fe(Ⅱ)产生量较少,Cr(Ⅵ)去除率较低;而当溶液中只含有EDDS时,EDDS在紫外光激发下产生还原性自由基对部分Cr(Ⅵ)进行还原;当没有光照时,溶液中Cr(Ⅵ)的去除率几乎为零.因此,光照是Cr(Ⅵ)降解的必要条件,Fe(Ⅲ)和EDDS的存在能促进Cr(Ⅵ)的降解.
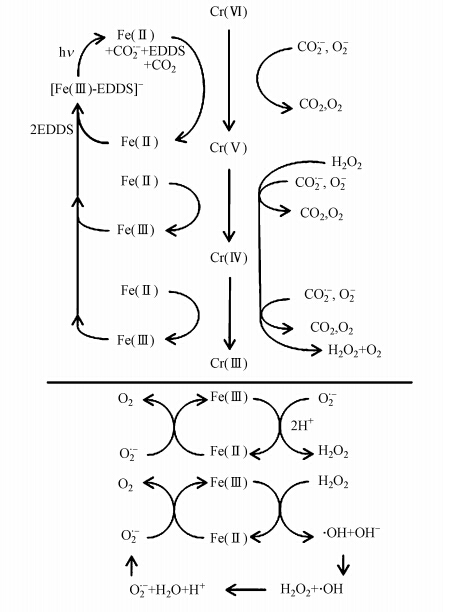 |
| 图 3 Cr(Ⅵ)在Fe(Ⅲ)-EDDS体系中的光化学反应机制 Fig. 3 Photoreaction mechanism of Cr(Ⅵ)in the Fe(Ⅲ)-carboxylate system |
配制含Fe(Ⅲ)-EDDS 0.15 mmol · L-1、Cr(Ⅵ)10 mg · L-1的溶液,pH分别调至3.0、4.0、5.0、6.0、7.0和8.0,将其置于紫外光下反应,取样测定Cr(Ⅵ)浓度,考察Cr(Ⅵ)在不同pH条件下的降解情况,结果如图 4所示.由图 4可知,相比传统Fe(Ⅲ)-羧酸盐体系,该体系适用的pH范围较宽,中性和碱性条件下反应也能顺利进行.在pH为3.0~8.0的范围内,溶液的pH值越小,Cr(Ⅵ)的还原效果越好,去除率越高.当pH为3.0时,Cr(Ⅵ)的去除效果最好,光照30 min后去除率可达99.4%.而溶液pH为8.0时,反应30 min后Cr(Ⅵ)的去除率仅为53.4%.由于溶液pH减小会导致Cr(Ⅵ)电极电势增大,从而使其氧化能力增强.在酸性条件下,Cr(Ⅵ)主要以HCrO-4形态存在,是强的氧化剂;而在中性及弱碱性条件下,Cr(Ⅵ)的主要存在形态是CrO2-4,而HCrO-4的光活性可能比CrO2-4更强.因此,溶液pH值较低时Cr(Ⅵ)的去除率大于高pH值条件下Cr(Ⅵ)的去除率.
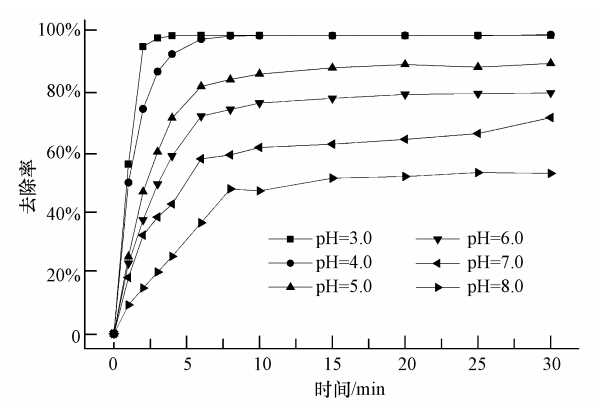 |
| 图 4 溶液pH值对Cr(Ⅵ)降解的影响 Fig. 4 Effect of pH on the photoreduction of Cr(Ⅵ) |
配制Cr(Ⅵ)浓度为10 mg · L-1的溶液,调节pH为6.0,控制Fe(Ⅲ)-EDDS的初始浓度分别为0.10、0.15、0.20、0.30 mmol · L-1,进行光照反应,考察Cr(Ⅵ)在不同Fe(Ⅲ)-EDDS初始浓度条件下的降解情况,结果如图 5所示.由图 5可知,在Fe(Ⅲ)-EDDS浓度为0.10~0.30 mmol · L-1范围内变化时,随着Fe(Ⅲ)-EDDS浓度的增加,Cr(Ⅵ)的去除率逐渐升高.Fe(Ⅲ)-EDDS浓度为0.10 mmol · L-1时,光照反应30 min后,Cr(Ⅵ)的去除率为59.8%;Fe(Ⅲ)-EDDS浓度为0.30 mmol · L-1时,对相同浓度Cr(Ⅵ)的去除率可达到99.2%. Fe(Ⅲ)-EDDS的存在关系着反应中HO · 的产生,Fe(Ⅲ)-EDDS浓度的增大导致体系在紫外光照下产生更多的HO ·,从而促进了Cr(Ⅵ)的降解.
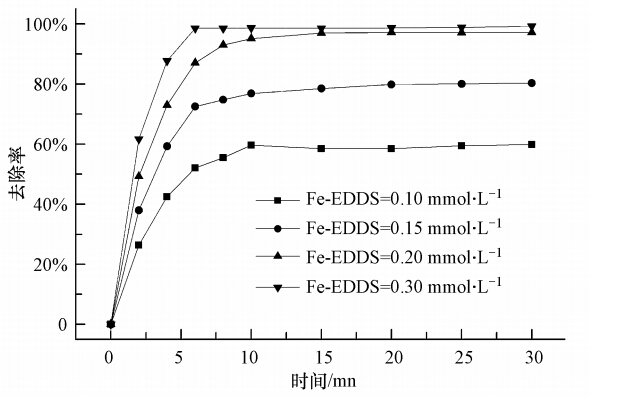 |
| 图 5 Fe(Ⅲ)-EDDS浓度变化对Cr(Ⅵ)降解的影响 Fig. 5 Reduction efficiencies of Cr(Ⅵ)in Fe(Ⅲ)-EDDS system at different initial concentrations of Fe(Ⅲ)-EDDS |
Fe(Ⅲ)-EDDS浓度变化的动力学分析如表 1所示.Fe(Ⅲ)-EDDS初始浓度分别为0.10、0.15、0.20和0.30 mmol · L-1时,按照方程(2)对反应数据进行拟合,发现拟合的可决系数均大于0.99,说明溶液中Cr(Ⅵ)浓度随反应时间t的变化符合拟一级动力学方程. Fe(Ⅲ)-EDDS浓度在0.10~0.30 mmol · L-1范围内时,随着Fe(Ⅲ)-EDDS浓度的增加,Cr(Ⅵ)的反应速率常数k也逐渐增大,表明Fe(Ⅲ)-EDDS浓度的增大对Cr(Ⅵ)的还原有促进作用.
| 表1 Fe(Ⅲ)-EDDS的反应动力学分析 Table 1 Kinetics analysis of Fe(Ⅲ)-EDDS |
配制含0.15 mol · L-1 Fe(Ⅲ)-EDDS的溶液,pH调至6.0,控制溶液中Cr(Ⅵ)浓度分别为5、10、15、20 mg · L-1,将其置于紫外光下进行反应,考察Cr(Ⅵ)在不同初始浓度条件下的降解情况,结果如图 6所示. 当溶液中Cr(Ⅵ)的浓度为5 mg · L-1时,光照30 min后,Cr(Ⅵ)的去除率为98.6%;而当溶液中Cr(Ⅵ)的浓度增加至20 mg · L-1时,30 min后Cr(Ⅵ)的去除率仅为48.8%.对于定量的Fe(Ⅲ)-EDDS溶液而言,在紫外光照下反应产生的HO ·量是确定的,溶液中Cr(Ⅵ)的浓度增加时,体系产生的HO · 无法将溶液中所有的Cr(Ⅵ)还原成Cr(Ⅲ).
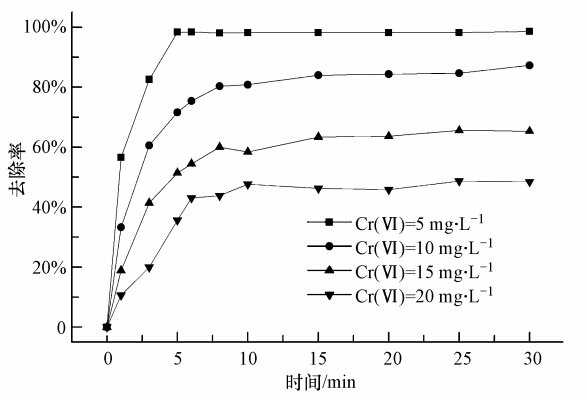 |
| 图 6 Cr(Ⅵ)初始浓度变化对Cr(Ⅵ)降解的影响 Fig. 6 Reduction efficiencies of Cr(Ⅵ)in Fe(Ⅲ)-EDDS system at different initial concentrations of Cr(Ⅵ) |
Cr(Ⅵ)浓度变化的动力学分析结果如表 2所示,反应数据按照方程(2)拟合后的可决系数均大于0.98,说明溶液中Cr(Ⅵ)浓度随反应时间t的变化符合拟一级反应动力学规律.随着Cr(Ⅵ)浓度的增加,溶液中Cr(Ⅵ)的反应速率常数相应减小,因此,当溶液中Fe(Ⅲ)-EDDS浓度不变时,Cr(Ⅵ)的去除率会随其浓度的增加而降低.
| 表2 Cr(Ⅵ)的反应动力学分析 Table 2 Kinetics analysis of Fe(Ⅲ)-EDDS |
1)在紫外光照射下,Fe(Ⅲ)-EDDS体系能还原Cr(Ⅵ),而在暗反应条件下Cr(Ⅵ)无法被还原,因此,光照是反应顺利进行的必要条件.可生物降解低毒的EDDS与Fe(Ⅲ)可以在紫外光体系下还原Cr(Ⅵ).
2)反应能在较宽的pH范围内进行,当pH为3.0~8.0时,溶液的pH值越小,Cr(Ⅵ)的还原效果越好,去除率越高,体系的最佳反应条件为酸性条件.
3)Fe(Ⅲ)-EDDS浓度在0.10~0.30 mmol · L-1范围时,溶液中Cr(Ⅵ)浓度随反应时间t的变化符合拟一级反应动力学规律,随着Fe(Ⅲ)-EDDS浓度的增大,溶液中Cr(Ⅵ)的反应速率常数相应增加,Cr(Ⅵ)的去除率增大,因此,Fe(Ⅲ)-EDDS浓度的增加对Cr(Ⅵ)还原有促进作用.
4)当溶液中Fe(Ⅲ)-EDDS浓度不变,Cr(Ⅵ)浓度在5~20 mg · L-1范围时,溶液中Cr(Ⅵ)浓度随反应时间t的变化符合拟一级反应动力学规律,随着Cr(Ⅵ)浓度的增加,溶液中Cr(Ⅵ)的反应速率常数相应减小,Cr(Ⅵ)的去除率随其浓度的增加而降低.
| [1] | 丁世敏,刘元华,封享华,等. 2010. Fe(Ⅲ)/苹果酸/H2O2体系对有机物的光降解特性研究[J].环境科学学报,30(9):1839-1845 |
| [2] | Fabbricino M,Ferraro A,Del Giudice G,et al.2013.Current views on EDDS use for ex situ washing of potentially toxic metal contaminated soils[J].Reviews in Environmental Science and Bio/Technology,12(4): 391-398 |
| [3] | Guo H Y,Wang W,Sun Y Y,et al.2010.Ethyl lactate enhances ethylenediaminedisuccinic acid solution removal of copper from contaminated soils[J].Journal of Hazardous Materials,174(1/3): 59-63 |
| [4] | Guo J,Dua Y Y,Lan Y Q,et al.2011.Photodegradation mechanism and kinetics of methyl orange catalyzed by Fe(Ⅲ) and citric acid[J].Journal of Hazardous Materials,186(2/3): 2083-2088 |
| [5] | Huang W Y,Brigante M,Wu F,et al.2013.Assessment of the Fe(Ⅲ)-EDDS complex in fenton-like processes: from the radical formation to the degradation of Bisphenol A[J].Environmental Science & Technology,47(4): 1952-1959 |
| [6] | Hug S J,Laubscher H U.1997.Iron(Ⅲ)catalyzed photochemical reduction of chromium(VI) by oxalate and citrate in aqueous solutions[J].Environmental Science & Technology,31(1): 160-170 |
| [7] | Li J,Mailhot Gilles,Wu F,et al.2010.Photochemical efficiency of Fe(Ⅲ)-EDDS complex: · OH radical production and 17β-estradiol degradation[J].Journal of Photochemistry and Photobiology A: Chemistry,212(1): 1-7 |
| [8] | Nagaraju V,Goj T,Crouch A M,et al.2007.Determination of copper and iron using - ethylenediaminedisuccinic acid as a chelating agent in wood pulp by capillary electrophoresis[J].Analytical Sciences,23(4): 493-496 |
| [9] | Ou X X,Quan X,Chen S,et al.2008.Photocatalytic reaction by Fe(Ⅲ)-citrate complex and its effect on the photodegradation of atrazine in aqueous solution[J].Journal of Photochemistry and Photobiology A: Chemistry,197(2/3): 382-388 |
| [10] | 孙杰,田奇峰.2012.Cr(Ⅵ) 在Fe(Ⅲ) -柠檬酸盐体系中紫外光还原研究[J].环境科学学报,32(3): 626-630 |
| [11] | Yang R X,Luo C L,Zhang G,et al.2012.Extraction of heavy metals from e-waste contaminated soils using EDDS[J].Journal of Environmental Sciences,24(11): 1985-1994 |
| [12] | Yip T C M,Tsang D C W,Kelvin T W Ng,et al.2009.Empirical modeling of heavy metal extraction by EDDS from single-metal and multi-metal contaminated soils[J].Chemosphere,74(2): 301-307 |
| [13] | Zhang C B,Wang L,Pan G,et al.2009.Degradation of atrazine photoinduced by Fe(Ⅲ)-pyruvate complexes in the aqueous solution[J].Journal of Hazardous Materials,169(1/3): 772-779 |
| [14] | Zhang J W,Ma L.2013.Photodegradation mechanism of sulfadiazine catalyzed by Fe(Ⅲ),oxalate and algae under UV irradiation[J].Environmental Technology,34(12): 1617-1623 |
| [15] | Zhang L H,Zhu Z L,Zhang R H,et al.2008.Extraction of copper from sewage sludge using biodegradable chelant EDDS[J].Journal of Environmental Sciences,20(8): 970-974 |
 2014, Vol. 34
2014, Vol. 34


