石灰石-石膏湿法脱硫工艺因具有大容量、低成本和运行简便等优点而成为燃煤电厂控制二氧化硫排放的有效手段(Liu et al., 2007).同时,该工艺对烟气中的氧化态汞(主要以氯化汞形式存在)也具有较高的捕集效率,可达80%以上(Srivastava et al., 2006;Stergaršek et al., 2008).大量的含汞烟气进入脱硫循环浆液,富集在脱硫石膏中,使得脱硫石膏成为巨大的汞汇.由于煤种和污染物控制工艺的不同,脱硫石膏汞含量在0.04~2.30 mg · kg-1(干基)范围内变化(Kairies et al., 2006;Pekney et al., 2009).Al-Abed等(2008)研究发现,汞主要分布在复杂化合物相中,其与铁氧化物(FeOOH等)存在密切联系,而铁元素主要来自于煤炭或脱硫剂石灰石等(Gustin et al., 2010).据估计,到2020年中国脱硫石膏年产量将达到9000万t以上(Wang et al., 2008),其综合利用效益如水泥缓凝剂、石膏墙板、粉刷石膏、土地改良剂(Shi et al., 2011)等愈加受到关注.然而在后续利用过程中,酸雨的侵蚀、煅烧时的高温等因素容易产生汞的二次释放问题(Cheng et al., 2012),将严重危害人和环境的健康.因此,对脱硫浆液中汞与石膏的关系进行研究迫在眉睫.
目前,大多数研究主要着眼于两部分,一是通过调节脱硫塔操作参数和离子种类,以及添加汞的捕集剂等,寻求高效捕集汞的方法,从而降低大气汞排放(Ochoa-González et al., 2013;Tang et al., 2010);二是考察脱硫石膏中汞的二次释放潜能,模拟汞在液相的浸出(Kairies et al., 2006),以及制品过程中对温度的释放性(Heebink et al., 2005)等,并通过添加稳定剂增强汞的固化(Sun et al., 2012),从而减少可能产生的不利影响.然而,关于脱硫塔中汞是如何进入石膏的研究却鲜有报道.脱硫浆液中汞与石膏的结合量和结合形态不仅影响烟气汞的富集,也影响脱硫石膏后续利用过程中汞的毒性和迁移性.因此,本研究通过模拟脱硫浆液体系中的石膏生成反应,考察液相汞浓度等操作条件和浆液中存在的其它离子的影响,寻求汞进入石膏的量和形态的变化趋势.
2 实验部分(Experiment section)以氢氧化钙和硫酸反应模拟脱硫浆液体系中的石膏生成反应,首先在锥形瓶中加入一定量的氢氧化钙和去离子水,调节温度,进行磁力搅拌,接着加入氯化汞溶液,控制液相汞浓度为一定值.然后逐次加入稀硫酸反应液,待反应完全后,调节pH值,石膏静置老化24 h,抽滤洗涤烘干,测定石膏汞含量.
采用单因子变量法考察不同影响因素,如液相汞浓度、浆液密度、pH值、静置时间、反应温度等操作条件,以及Cl-、NO3-和SO42-等常见阴离子和钙、镁、铝、铁等常见金属元素等的影响.
汞含量测定采用LUMEX RA-915+汞分析仪,该仪器在塞曼原子吸收光谱法的基础上应用了高频调制偏振光技术,具有高灵敏度、宽量程、超低汞检测限等优点,其固体样品检测限为0.5 μg · kg-1.
3 结果与分析(Results and discussion) 3.1 操作条件的影响 3.1.1 液相汞浓度的影响实验在浆液浓度 10%,室温,pH=7,石膏老化时间 24 h且石膏结晶次数10次的条件下,考察了液相汞浓度对石膏汞结合量和汞转移比例的影响.由图 1可知,随着液相汞浓度从0.16 mg · L-1增加到2.67 mg · L-1,石膏汞含量也相应从0.38 mg · kg-1增加到4.17 mg · kg-1,其趋势几乎为线性增长,而汞转移比例从24.5%下降到16.0%左右,然后保持不变.为解释上述现象,本文推测脱硫浆液中汞与石膏结合的两种主要方式为:石膏晶体的包裹作用和石膏表面吸附作用.在模拟脱硫浆液体系中,石膏晶体在不断生成和长大,液相中的汞很有可能随之进入而被硫酸钙晶体封闭于内部,此时,汞从液相不间断向固相转移,直至石膏生成反应结束.而后汞进入石膏的主要途径转为石膏的表面吸附,其平衡则取决于汞的固液相分配行为,在足够的静置时间后,当该物质从液相进入固相的速率等于从固相进入液相的速率时,体系就不再有净的变化,宏观上即表现为动态平衡.
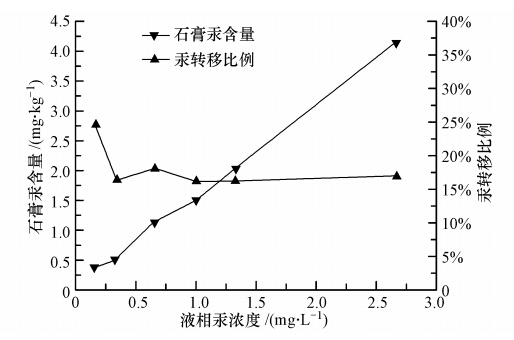 |
| 图 1 液相汞浓度对汞进入石膏的影响 Fig. 1 Effect of liquid mercury concentration on the mercury content in gypsum |
实验表明,随着液相汞浓度不断增加,汞在石膏晶体的内部包裹绝对量和比例都相应增加,这是因为晶体长大过程中对液相离子的络合密度和作用会不断增强.然而石膏表面吸附作用呈现不同趋势,汞吸附绝对量随液相汞浓度的增加而增加,其吸附比例却不断减少.这是由于氯化汞在液相中为弱电解质,当浓度越高,它所电离出来的汞离子量虽然越多,但电离度相应越低,反映在吸附分配平衡上即出现吸附绝对量和比例变化相异的情况.综上,在以上两方面因素的共同作用下,呈现出如图 1所示的趋势.
3.1.2 浆液浓度的影响实验在液相汞浓度 1.00 mg · L-1,室温,pH=7,石膏老化时间 24 h且石膏结晶次数10次的条件下,考察了浆液浓度对石膏汞结合量和汞转移比例的影响.由图 2可知,随着脱硫浆液浓度从1%增加到20%,浆液中石膏生成量也相应增加,由液相进入石膏中的汞比例不断上升,但石膏汞含量却不断下降,此两者趋势刚好相反,并且当浆液浓度较低时,该趋势更加显著.当浆液浓度从1%增加到2%时,汞转移比例从7.97%增加到8.71%,增加不到1%,可是石膏汞含量却从7.40 mg · kg-1下降到4.04 mg · kg-1,下降幅度为50%左右;当浆液浓度从2%增加到10%时,汞转移比例从8.71%增加到17.71%,石膏汞含量从4.04 mg · kg-1下降到1.65 mg · kg-1,其下降趋势开始变慢;当浆液浓度从10%增加到20%时,汞转移比例的增幅较大,但石膏汞含量已基本保持不变.
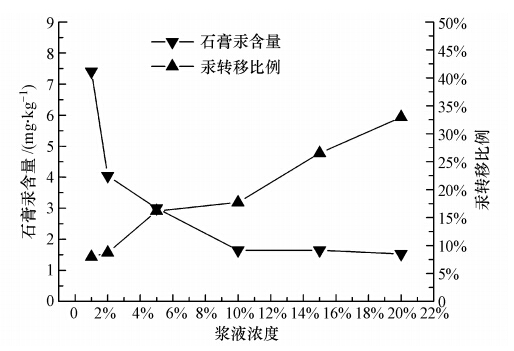 |
| 图 2 脱硫浆液浓度对汞进入石膏的影响 Fig. 2 Effect of desulfurization slurry concentration on the mercury content in gypsum |
实验发现,当液相汞浓度一定时,石膏总量的增加不仅加强了对汞的包裹作用,也增加了晶体表面的吸附面积,从而有利于汞向固相转移,两者共同促进,表现在图 2即为汞转移比例的上升.然而,石膏量增长过快,会产生部分闲置石膏,这部分石膏对汞的结合没有贡献,当新增的汞结合量被均分时,即呈现出总体的石膏汞含量下降的趋势.
3.1.3 温度的影响实验在液相汞浓度 1.00 mg · L-1、浆液浓度10%、pH=7、石膏老化时间 24 h且石膏结晶次数10次的条件下,考察了温度对汞转移比例的影响.由图 3可知,随着反应温度从20 ℃增加到60 ℃,石膏汞含量先增加后下降.当温度在30~40 ℃时,汞含量最高,当温度为50~60℃时,汞含量最低.温度在多方面影响脱硫浆液的性质,如影响氢氧化钙的溶解度、石膏结晶速率(即氢氧化钙和硫酸的化学反应速率)、石膏的晶种形态、汞在固液相的分配平衡系数等.当温度从室温上升到40 ℃时,氢氧化钙的溶解度下降,但石膏结晶速率增加,且汞的传质速率也相应增加,从而在一定程度上促进了汞向石膏固相的转移;然而当温度继续上升到60 ℃时,分子运动更加剧烈,有可能突破了石膏表面对汞的吸附作用或石膏晶格对汞的束缚作用,体现在宏观上即为石膏汞含量的下降.
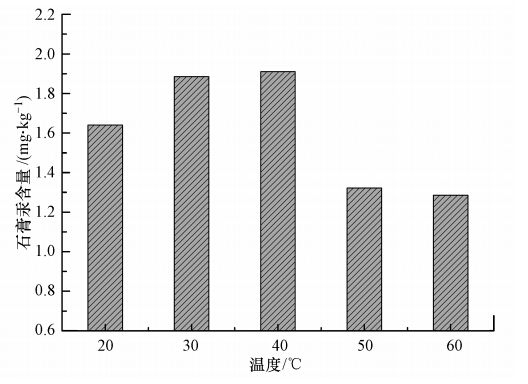 |
| 图 3 反应温度对汞进入石膏的影响 Fig. 3 Effect of temperature on the mercury content in gypsum |
实验在液相汞浓度 1.00 mg · L-1、浆液浓度10%、室温、石膏老化时间 24 h且石膏结晶次数10次的条件下,考察了pH值对汞转移比例的影响.由图 4可知,浆液pH值对石膏汞含量具有较大影响,随着pH值从3增加到11,石膏汞含量呈不断上升趋势.研究表明(陆荣杰,2012),当浆液的pH≤3.0时,汞大部分以二价形式存在;当pH在3.0~7.0之间时,部分汞以Hg(OH)+和Hg(OH)2的形式存在;当pH大于7.0时,汞开始大量以Hg(OH)2形式沉淀.
进一步观察可得,当pH值从3增加到5时,石膏汞含量增加并不多,而当pH值从5增加到11时,石膏汞含量急剧增加.这在一定程度上反映了浆液在石膏生成时汞并没有完全以氯化汞形式与石膏结合或吸附,而是部分形成了Hg(OH)2吸附或沉积在石膏表面,由于Hg(OH)2难溶,故洗涤抽滤操作对其影响不大.pH值也有可能影响石膏表面汞的吸附分配系数,其通过改变氯化汞的电离度影响游离汞的量,或通过改变硫酸钙表面带电情况影响吸附点位等.
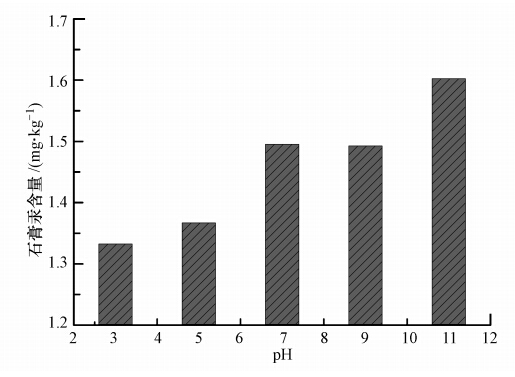 |
| 图 4 pH值对汞进入石膏的影响 Fig. 4 Effect of pH on the mercury content in gypsum |
实验在液相汞浓度 1.00 mg · L-1、浆液浓度10%、室温、pH=7且石膏结晶次数10次的条件下,考察了石膏老化时间对汞转移比例的影响.由图 5可知,石膏老化时间对石膏汞含量影响较大,在1~24 h范围内,石膏汞含量相应从1.03 mg · kg-1 增加到1.60 mg · kg-1,呈先上升后平缓的趋势.由于石膏老化开始时,石膏生成反应已经结束,因此,可以认为该变化是由于石膏表面吸附的分配平衡引起的.随着时间的递延,液相汞开始向石膏固相的吸附点位转移,最终在近20 h后达到动态平衡.
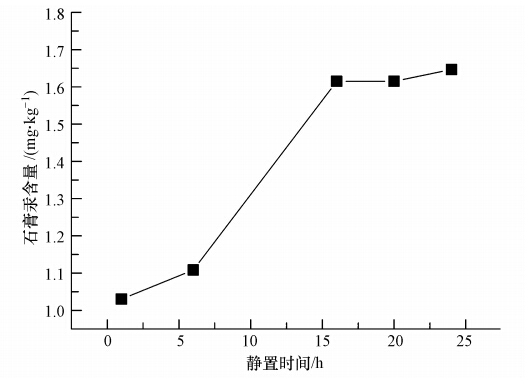 |
| 图 5 石膏老化时间对汞进入石膏的影响 Fig. 5 Effect of time on the mercury content in gypsum |
脱硫浆液中石膏生成所需要的硫酸盐主要来自于强制氧化系统对亚硫酸盐的氧化.石膏生成反应的快慢往往会影响石膏的结晶速率与形态,在充满Ca2+的浆液氛围中,若少量多次引入硫酸根,则首先形成较小的硫酸钙晶核,其后在该石膏晶体上后续的硫酸钙再进一步生长,从而形成较大的晶体;若大量少次引入硫酸根,则会在浆液中瞬间形成大量晶核,导致晶体粒径过小.实验在液相汞浓度 1.00 mg · L-1,浆液浓度10%,室温,pH=7且石膏老化时间 24 h的条件下,考察了总量为0.375 mol的20%稀硫酸以不同次数的添加方式对石膏汞结合量的影响,即通过控制硫酸根的引入时间来控制石膏的生成速率.
由图 6可知,随着硫酸添加次数的增加,石膏汞含量也不断增大.当硫酸一次性添加时,石膏汞含量只有1.02 mg · kg-1,当硫酸分16次添加时,石膏汞含量可以达到1.53 mg · kg-1,增加幅度达50%之多.这主要是由于石膏晶体的汞包裹作用与石膏结晶方式有密切关系,当硫酸添加次数多时,即意味着石膏生成速率减慢,石膏晶体容易长大,而不会形成大量的小晶体,而较大的石膏晶体就具有较强的包裹作用,有利于对汞的富集.另外,进一步观察可得,当一定时间内硫酸添加次数越来越多时,石膏汞含量虽然还在增加,但增加量开始减少,表现在图 6上为曲线变得平缓.这可能是因为一定质量的石膏对汞的包裹作用存在一个最大值,当硫酸添加次数少的时候,晶体缓慢长大会大量增加包裹区域,使得汞富集量迅速增加,当硫酸添加次数越来越多时,晶体的包裹区域趋于饱和,表现为石膏汞含量开始保持基本不变.
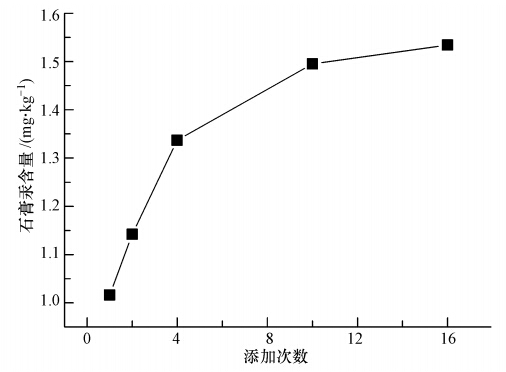 |
| 图 6 石膏结晶方式对汞进入石膏的影响 Fig. 6 Effect of gypsum crystallization on the mercury content in gypsum |
脱硫浆液中的酸性阴离子大多来源于燃煤烟气,主要包括Cl-、SO42-和NO3-等.由图 7可知,当酸根离子浓度从0增加到10 g · L-1时,Cl-、SO42-和NO3-对石膏汞含量的变化趋势具有不同的影响.若考察单一离子浓度的影响可以发现,当液相中Cl-浓度不断增加,石膏汞含量先较快下降,而后平缓下降;NO3-同样也会抑制汞进入石膏,当NO3-浓度不断增加,石膏汞含量先下降较快,而后基本不变;相比于前面两者,SO42-却呈现出不同的趋势,当SO42-浓度从0增加到1 g · L-1,石膏汞含量先增加,接着当SO42-浓度从1 g · L-1增加到10 g · L-1时,石膏汞含量则缓慢下降,其中,SO42-浓度在10 g · L-1时的石膏汞含量仍然比没有添加SO42-时的要高.若考察相同离子浓度下不同酸根的影响可以发现,SO42-促进汞进入石膏,Cl-和NO3-则抑制汞进入石膏,并且Cl-的抑制作用要大于NO3-;在每个浓度梯度值,SO42-对应的石膏汞含量都相应最大,而Cl-所对应的石膏汞含量都相应最小.
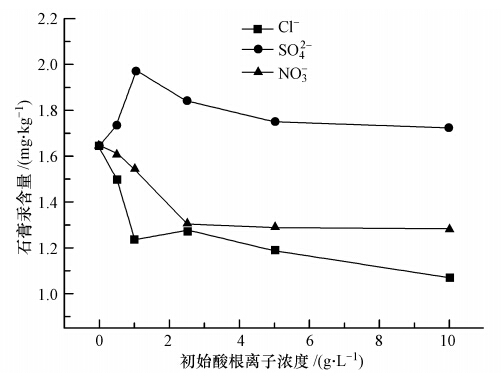 |
| 图 7 常见酸根离子对汞进入石膏的影响 Fig. 7 Effect of common anions on the mercury content in gypsum |
由于石膏的汞结合量与浆液中的游离汞浓度密切相关,上述酸根离子正是通过改变游离汞含量从而影响汞富集到石膏.氯化汞是可溶于水的弱电解质,其在液相中多以未离解的HgCl2分子存在,只有少量离解为HgCl+、Hg2+和Cl-.当浆液中存在大量Cl-时,不仅会抑制氯化汞的电离导致游离汞更少,还会形成更加复杂的四面体型[HgCl4]2-配离子,进一步降低游离汞的量,反映在图 7上即为石膏汞含量的不断降低.同样的,NO3-也会减少液相游离汞的浓度,当NO3-较多时,可能会与Hg2+反应生成较稳定的Hg(NO3-)2或Hg(NO3-)2-H2O,降低了液相中Hg2+浓度(沃静静,2010),从而减少石膏汞含量;但由于Hg2+-NO3-结合物不如Hg2+-Cl-结合物稳定,因此,石膏汞含量下降幅度相对较小.对于SO42-来说,其趋势则与Cl-和NO3-相反,为促进作用,这可能是由于SO42-容易与Hg2+反应生成稳定的HgSO4沉淀(朱振武等,2013),表现在图 7上即为石膏汞含量增加;但当SO42-变得更多时,石膏汞含量略有下降,这可能是因为形成了Hg(SO4)42-等可溶性盐,一定程度上减少了石膏表面的汞吸附量.
3.3 常见金属元素的影响脱硫浆液中的金属离子和其他阳离子主要来自石灰石浆液和烟气飞灰.在脱硫塔中,碳酸盐与二氧化硫反应并经强制氧化后形成硫酸钙,而各种杂质则以不同形式沉积在石膏上,或随脱硫废水排出.脱硫浆液中铁元素浓度一般较小,有文献报道,某电厂脱硫液铁浓度平均为43.90 mg · L-1(张淑芳,2009);钙、镁元素常常大量存在于脱硫浆液中,Ca2+约为270~580 mg · L-1,Mg2+约为5587~7400 mg · L-1(张淑芳,2009;禾志强等,2008);铝的大量引入主要来源于铝基脱硫添加剂(Ochoa-González et al., 2012).
由图 8可知,当初始铁离子(Fe3+)浓度从0增加到100 mg · L-1时,石膏汞含量也随之从1.65 mg · kg-1增加到2.95 mg · kg-1,说明浆液中的铁能够促进汞向石膏的富集.有研究认为(Al-Abed et al., 2008),脱硫石膏的汞主要分布在复杂化合物相,其与铁氧化物(FeOOH等)结合密切,因此,推测在石膏晶体生成长大过程中,铁与游离汞络合进而沉积进入石膏,促进石膏汞含量增加.另外,即使液相pH值弱酸性,氢氧化铁也会大量生成,而其具有一定的絮凝捕集作用,不仅加强了石膏表面汞的吸附量,还会直接促进汞的沉积.
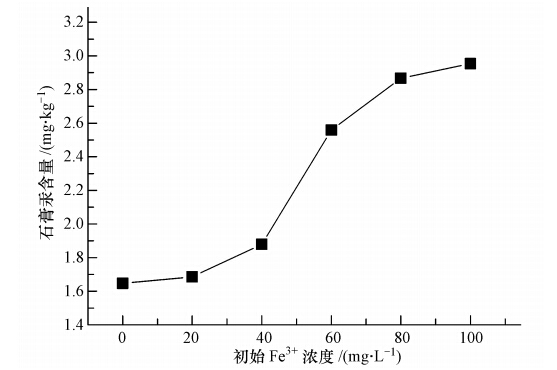 |
| 图 8 铁含量对汞进入石膏的影响 Fig. 8 Effect of ferrous ion on the mercury content in gypsum |
由图 9可知,当Ca2+和Mg2+浓度从0增加到100 mmol · L-1时,石膏汞含量先下降后略微上升然后基本不变,其下降量都约在0.25 mg · kg-1,说明总体的影响不大.0~5 mmol · L-1范围,石膏汞含量下降可能是由于钙、镁离子形成少量微溶的氢氧化钙和氢氧化镁,固相析出而覆盖在硫酸钙晶体表面,竞争性地减少了汞的吸附点位,从而降低了石膏汞含量; 5~100 mmol · L-1范围略有上升可能是因为析出的氢氧化钙或氢氧化镁固体变多,发生了粉末团聚作用,从而减少了本来分散在石膏表面的竞争点位,使得石膏汞吸附量上升.其中,在0~5 mmol · L-1范围,含Mg2+的浆液的石膏含汞下降量约为0.45 mg · kg-1,而含Ca2+的浆液的石膏含汞下降量约为0.22 mg · kg-1,说明Mg2+对汞进入石膏的抑制作用要大于Ca2+.这可能是因为氢氧化镁比氢氧化钙难溶,固体析出量更多,从而占据了更多的吸附点位.
考察Al3+从0增加到100 mmol · L-1,石膏汞含量大幅上升,从1.27 mg · kg-1增加到约2.50 mg · kg-1,说明Al3+对汞进入石膏具有较大促进作用.这可能是因为含铝溶液具有絮凝沉淀效果,其通过吸附微粒及在微粒间“架桥”等作用,使悬浮微粒集聚变大,或形成絮团,从而加快粒子的聚沉.脱硫浆液中石膏微溶于水,因此,铝基物质有可能在集聚硫酸钙固体的同时捕集了部分汞在石膏上,从而导致石膏汞含量的上升.
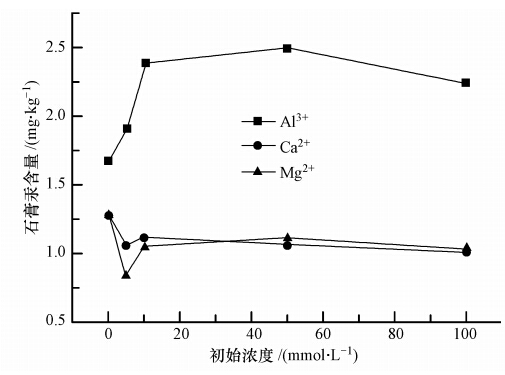 |
| 图 9 常见大量阳离子对汞进入石膏的影响 Fig. 9 Effect of common cations on the mercury content in gypsum |
1)随着液相汞浓度的增加,石膏汞含量也相应增加,而汞转移比例先下降然后基本不变.随着脱硫浆液浓度从1%增加到20%,石膏汞含量不断下降,而汞转移比例却不断上升.推测汞与石膏结合的两种主要方式为:石膏的内部包裹作用和表面的吸附作用.当反应温度从20 ℃增加到60 ℃,石膏汞含量先增加后下降,这是因为温度可在多方面影响脱硫浆液的性质.当浆液pH值从3增加到11,石膏汞含量呈不断上升趋势,这可能是因为形成了Hg(OH)2而吸附或沉积在石膏表面.当石膏老化时间在1~24 h范围内,石膏汞含量呈先上升后平缓的趋势,可能与石膏表面吸附的分配平衡有关.当石膏生成速率较慢时,石膏汞含量较高,这是因为较大的石膏晶体具有较强的包裹作用,有利于对汞的富集.
2)当酸根离子浓度不断增加时,Cl-和NO3-起抑制作用,并且Cl-的抑制作用要大于NO3-;SO42-起促进作用,石膏汞含量先增加后下降.酸根离子对石膏汞含量的影响主要通过改变浆液中的游离汞浓度:Cl-会抑制氯化汞的电离,NO3-会与Hg2+生成较稳定的Hg(NO3-)2或Hg(NO3-)2-H2O,从而降低液相中Hg2+浓度;SO42-容易与Hg2+反应生成稳定的HgSO4沉淀,故石膏汞含量增加.
3)铁、铝含量的增加会促进石膏汞含量,这是因为在石膏晶体长大过程中,铁容易与游离汞络合进入晶体;而含铝溶液有絮凝沉淀效果,汞被捕集在石膏上.钙、镁含量增加会略微减少石膏汞含量,可能是由于形成氢氧化钙和氢氧化镁,固相析出而覆盖在硫酸钙晶体表面,减少了汞的吸附点位.
| [1] | Al-Abed S R,Jegadeesan G,Scheckel K G,et al. 2008. Speciation,characterization,and mobility of As,Se,and Hg in flue gas desulphurization residues[J]. Environmental Science and Technology,42(5): 1693-1698 |
| [2] | Cheng C M,Chang Y N,Sistani K R,et al. 2012. Mercury emission and plant uptake of trace elements during early stage of soil amendment using flue gas desulfurization materials[J]. Journal of the Air & Waste Management Association,62(2): 139-150 |
| [3] | Gustin M,Ladwig K. 2010. Laboratory investigation of Hg release from flue gas desulfurization products[J]. Environmental Science and Technology,44(10): 4012-4018 |
| [4] | 禾志强,田雁冰,赵全中,等. 2008. 火力发电厂烟气脱硫废水处理工程实例[J].工业用水与废水,39(5): 83-85 |
| [5] | Heebink L V,Hassett D J. 2005. Mercury release from FGD[J]. Fuel,84(11): 1372-1377 |
| [6] | Kairies C L,Schroeder K T,Cardone C R. 2006. Mercury in gypsum produced from flue gas desulfurization[J]. Fuel,85(17/18): 2530-2536 |
| [7] | Liu S H,Yan N Q,Liu Z R,et al. 2007. Using bromine gas to enhance mercury removal from flue gas of coal-fired power plants[J]. Environmental Science and Technology,41(4): 1405-1412 |
| [8] | 陆荣杰. 2012. 有机硫螯合剂对烟气脱硫液中汞离子的稳定化研究[D]. 杭州: 浙江大学. 23-24 |
| [9] | Ochoa-González R,Díaz-Somoano M,Antón M A,et al. 2012. Effect of adding aluminum salts to wet FGD systems upon the stabilization of mercury[J]. Fuel,96: 568-571 |
| [10] | Ochoa-González R,Díaz-Somoano M,Martínez-Tarazona M R. 2013. Control of Hg0 re-emission from gypsum slurries by means of additives in typical wet scrubber conditions[J]. Fuel,105: 112-118 |
| [11] | Pekney N J,Martello D,Schroeder K,et al. 2009. Environmental chamber measurements of mercury flux from coal utilization by-products[J]. Fuel,88(5): 890-897 |
| [12] | Shi L,Xu P Z,Xie K Z,et al. 2011. Preparation of a modified flue gas desulphurization residue and its effect on pot sorghum growth and acidic soil amelioration[J]. Journal of Hazardous Materials,192(3): 978-985 |
| [13] | Srivastava R K,Hutson N,Martin B,et al. 2006. Control of mercury emissions from coal-fired electric utility boilers[J]. Environmental Science and Technology,40(5): 1385-1393 |
| [14] | Stergaršek A,Horvat M,Kotnik J,et al. 2008. The role of flue gas desulphurisation in mercury speciation and distribution in a lignite burning power plant[J]. Fuel,87(17): 3504-3512 |
| [15] | Sun M Y,Hou J A,Tang T M,et al. 2012. Stabilization of mercury in flue gas desulfurization gypsum from coal-fired electric power plants with additives[J]. Fuel Processing Technology,104: 160-166 |
| [16] | Tang T M,Xu J,Lu R J,et al. 2010. Enhanced Hg2+ removal and Hg0 re-emission control from wet fuel gas desulfurization liquors with additives[J]. Fuel,89(12): 3613-3617 |
| [17] | Wang S J,Chen C H,Xu X C,et al. 2008. Amelioration of alkali soil using flue gas desulfurization byproducts: Productivity and environmental quality[J]. Environmental Pollution,151(1): 200-204 |
| [18] | 沃静静. 2010. 烟气脱硫液中汞离子还原释放机制及二次污染控制研究[D].杭州: 浙江大学. 39-40 |
| [19] | 张淑芳. 2009. 电厂石灰石-石膏法湿法烟气脱硫废水处理[J]. 能源环境保护,(3): 34-35 |
| [20] | 朱振武,禚玉群,安忠义,等. 2013. 湿法脱硫系统中痕量元素的分布[J]. 清华大学学报(自然科学版),53(3): 330-335 |
 2015, Vol. 35
2015, Vol. 35


 , 瞿赞, 徐浩淼, 马永鹏, 陈万苗, 黄文君, 赵松建
, 瞿赞, 徐浩淼, 马永鹏, 陈万苗, 黄文君, 赵松建