2. 中国科学院生态环境研究中心环境水质学国家重点实验室, 北京 100085;
3. 北京城市排水集团有限责任公司, 北京 100044
2. State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
3. Beijing Drainage Group Company Limited, Beijing 100044
再生水的利用已成为解决水资源短缺的重要途径之一,景观环境用水通常在城市用水总量中占有较大比率,国内外已有许多城市将再生水作为景观水体的补充水源(Ernst et al., 2007; Yi et al., 2011).景观水体色度是评价水体水质重要的指标之一,也是直接反映水质好坏程度的重要参数(周军等,2008). 过高的色度表明景观水质恶化,丧失了美学景观效应.臭氧具有很强的脱色、嗅、味能力,能有效改善水体的感官指标,可直接或间接地降解污水中的有机物(Takanashi et al., 2002; Xu et al., 2002).臭氧是一种强氧化剂,可以有效去除水中的有机污染物、色度和浊度等(Facile et al.,2000),但是在经过臭氧处理的水补充景观水体一段时间之后又会复色,国内外对臭氧的脱色作用已有大量的研究报道,但引起处理后的水体复色的原因及解决的办法研究较少.
为了研究再生水深度处理过程臭氧氧化后水体复色的原因及防止复色的方法,以北京某城市污水处理厂二级出水-砂滤-臭氧氧化深度处理出水为研究对象进行人工条件培养,考察臭氧氧化对再生水中藻类繁殖的影响以及与藻类生长有关的氨氮、磷酸盐等指标随时间变化和培养过程中色度的变化分析,研究了再生水体复色的原因和防止水体复色的方法,为再生水臭氧化处理防止水体复色提供技术支持.
2 材料与方法(Material and methods) 2.1 臭氧氧化实验臭氧氧化试验在中试处理装置中完成,中试处理流程如图 1所示,其中主要包括空气压缩净化装置、空气冷凝机、制氧装置、臭氧发生器、臭氧反应塔(不锈钢材质)、臭氧浓度检测器和催化臭氧尾气处理装置.空气经压缩机和净化装置进入臭氧发生器放电室,产生含有臭氧气体的混合气体,臭氧混合气体经钛金属曝气装置均匀布气进入臭氧反应塔,气水逆流进行,以便充分混合反应,剩余臭氧进入臭氧尾气破坏器被催化分解.臭氧浓度通过在线监测仪(Hare EG-600,Jitsugyo 日本)检测.臭氧反应塔有效容积为250 L,臭氧与水的接触时间10 min,进水流量为1.5 m3 · h-1.通过调节臭氧发生装置的臭氧浓度与进气流量,将投加量分别控制在2、4、6、8、10 mg · L-1.
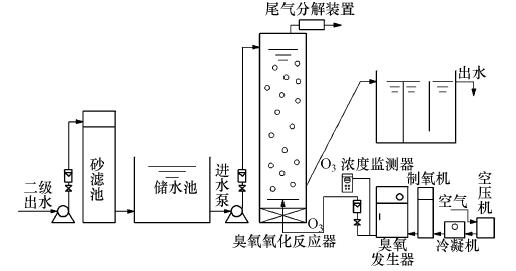 |
| 图 1 臭氧处理流程示意图 Fig. 1 Schematic diagram of O3 test device |
臭氧氧化后用高温灭菌的白广口瓶各取6 L水样放入恒温气候箱中进行培养,培养条件为:昼长14 h,25 ℃,35% RH,20%光照,夜长10 h,20 ℃,60%RH.
以实验当天为培养第一天,取一定体积的水样测定色度与浊度.使用0.45 μm滤膜过滤后水样进行色度、NH+4-N、溶解性正磷酸盐、UV254、TOC、DOC和三维荧光分析.滤膜经6~8 h冷冻干燥后测定叶绿素a的含量.
2.3 分析方法 2.3.1 水质参数分析测定水质指标氨氮(NH+4-N)的测定采用纳氏试剂比色法;TOC、DOC的测定采用Analytikjena Multi N/T2100 TOC/TN测定仪测量;UV254采用UV-2401(SHIMADZU)型紫外/可见分光光度计测定;表色色度与真色色度测定采用SD-9012A色度测定仪;浊度测定采用2100AN型台式浊度仪.
叶绿素a采用三波长法测定,其具体方法为:用醋酸纤维酯微孔滤膜(孔径0.45 μm)对一定体积的藻液过滤,然后将滤膜放入10 mL离心管中,加入90%的丙酮10 mL,用涡旋混合仪使其充分振荡,放置冰箱内提取24 h,然后于冰冻离心机在4500 r · min-1下离心10 min,移取上清液于1 cm比色皿中,用分光光度计测定750、663、645和630 nm处的吸光度,以90%丙酮溶液作为参比,按公式(1)计算得出叶绿素a含量.
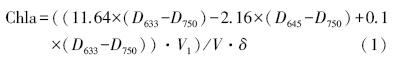
式中,Chla是叶绿素a浓度(mg · m-3),V是水样体积(L),D是吸光度,V1表示提取液定容后的体积,δ是比色皿光程(cm).
2.3.2 三维荧光光谱分析三维荧光光谱采用Hitachi F-4500荧光光度计测定.激发波长范围为200~400 nm,发射波长范围为 280~500 nm.间隔均为10 nm,扫描速度为12000 nm · min-1,带通为10 nm.
3 结果与讨论(Results and discussion) 3.1 不同臭氧投加剂量对表色与真色的去除影响表色主要是溶解物质及不溶解性悬浮物产生的颜色,真色仅由溶解物质产生的颜色(Nguyen et al., 2005).表色与真色随臭氧投加量的变化如图 2所示.臭氧投量超过4 mg · L-1时,表色与真色的去除率趋于稳定,这是可能是由于水中仍有部分显色物质难以经臭氧氧化得到去除.当臭氧投量大于6 mg · L-1时,对色度的去除率趋于平缓.当臭氧投加量为10 mg · L-1时,表色由最开始的20度下降到5度,去除率为75%,真色值由13度下降到2度,去除率为84.6%.由此可知,臭氧对水中溶解有机物和不溶解悬浮物都具有很好的氧化作用.
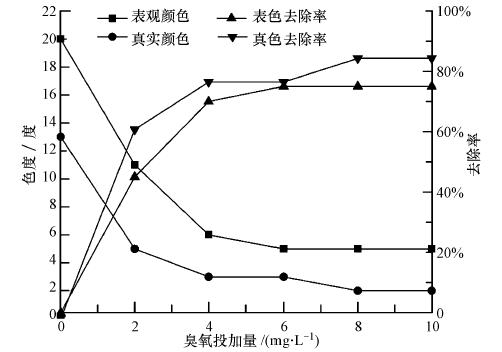 |
| 图 2 表色与真色随臭氧投加量的变化曲线 Fig. 2 Effect of dosage of ozonation on surface color and true color |
如图 3所示,随着臭氧投加量的增加,UV254由原来的0.097降为0.056,说明臭氧氧化对芳香环类化合物有一定的去除能力.此外,当臭氧投加量为10 mg · L-1时,浊度由起始的2.08 NTU降为最终的0.77 NTU,浊度降低了1.31 NTU.
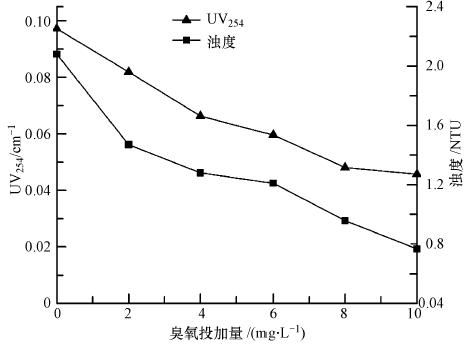 |
| 图 3 UV254与浊度随臭氧投加量的变化 Fig. 3 Variation of UV254 and turbidity with different dosages of ozonation |
从外观看,经过臭氧投加量为2、4、6、8、10 mg · L-1氧化后的水样起初均比较清澈,没有悬浮物质.只有未经臭氧处理的原水呈现浅绿色,同时有少量悬浮物质.当模拟自然条件15 d后,未经臭氧氧化的水样变为绿色,水体也变得浑浊,悬浮物质增多.投加量2、4、6 mg · L-1再生水水体先由无色转为浅黄色,随后又变为绿色,臭氧投加量为4、6 mg · L-1的再生水体变为绿色的时间比较短.而投加量为8、10 mg · L-1的再生水样无明显颜色和浊度的变化.24 d后,投加量为0、2、4、6 mg · L-1的再生水样变为深绿色,且随着臭氧投加量的增加,水样中浊度也越高,尤其4、6 mg · L-1水样最明显.这些现象与藻类的生长密切相关,在前期当水体中开始出现藻类时,其均匀地分散在整个水体之中,水体逐渐变得浑浊.在后期,藻类开始聚集在水体的表面和底部,投加量为8、10 mg · L-1的水样逐渐变为浅绿色,有少量悬浮物质出现.
3.3.2 叶绿素a随时间的变化特征由于所有藻类均含有叶绿素a,故作为反映水中微生物初级生产力的指标能够较为直接的反映藻细胞的生长情况(于海燕等,2009; 董正臻等,2004; 陈永川等.,2008).图 4为不同臭氧投加量下叶绿素a随时间增长的变化曲线.可以看出,藻类生长经过了迟缓期、对数增长期和稳定生长期几个阶段(Yates and Smotzer, 2007). 臭氧投加量为2、4、6 mg · L-1水样的叶绿素a在经过藻生长初期约6 d的延滞期后开始逐渐增多,12 d后藻类开始突然急剧生长超过了未经氧化处理的水样.这可能是由于低浓度时,臭氧只能破坏少量的藻细胞,促使其体内的N、P等释放到水中,反而促进了藻类的生长. 然而,当臭氧投加量为8、10 mg · L-1的水样的外观一直未出现明显变化.这是由于在高剂量条件下,臭氧杀死了绝大部分的藻类,保证了水样的生物稳定性.
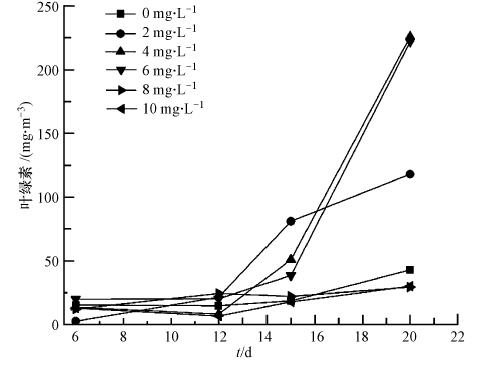 |
| 图 4 叶绿素a浓度随时间的变化 Fig. 4 Change in content of chlorophyll a with time |
图 5a显示DOC随着臭氧投加量为2、4、6 mg · L-1从原来的5.03 mg · L-1增加到5.64 mg · L-1,投加量为8、10 mg · L-1时DOC浓度上升幅度又降为5.38 mg · L-1.可以说明臭氧分子氧化破坏细胞壁,导致细胞裂开死亡,胞内容物质释放到水中(李夏青和赵新华,2011; 汪小雄等,2010),从而DOC上升;但随着臭氧投加量进一步增加后,释放出的细胞内容物被矿化为CO2.当模拟自然环境6 d后,细菌的大量繁殖利用了水中的部分有机物,DOC大幅降低.24 d后随着水中藻类进入衰亡期,细胞内物质开始释放,导致DOC上升.如图 5b所示,未进行氧化预处理和高臭氧投加量下(大于8 mg · L-1),水中的TOC变化不大,而在低臭氧投加量下,水样TOC有很大的提高,该结果和叶绿素a的分析结果相一致.说明低剂量的臭氧处理反而会促进藻类的繁殖.
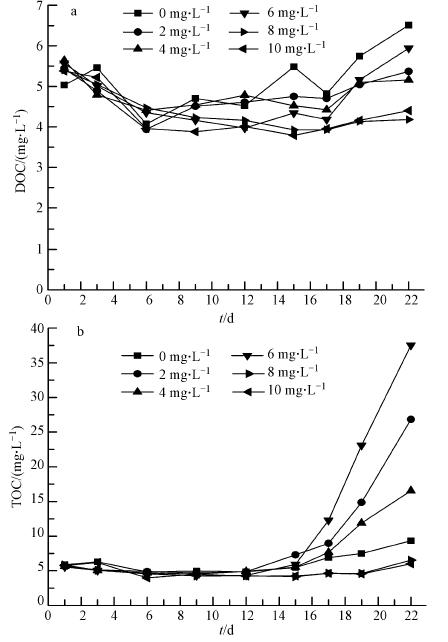 |
| 图 5 DOC(a)和TOC(b)随时间的变化 Fig. 5 Variation of DOC(a) and TOC(b)with time |
从图 6a可以看出,氨氮浓度在前6 d明显下降,随后趋于平缓,这是由于藻类的生长利用水中的氨氮(刘莉等,2007).从图 6b可以看出,磷酸盐浓度在初始的15 d内迅速下降,臭氧投加量为2、4、6 mg · L-1下降最快,之后缓慢下降,最后趋于稳定.在初始的15 d,藻类利用水中的N、P等营养物质快速生长,在臭氧投加量为6 mg · L-1的水样中藻类生长最旺盛.在后期磷酸盐被消耗殆尽,藻类也进入衰亡期,其数量迅速减少.
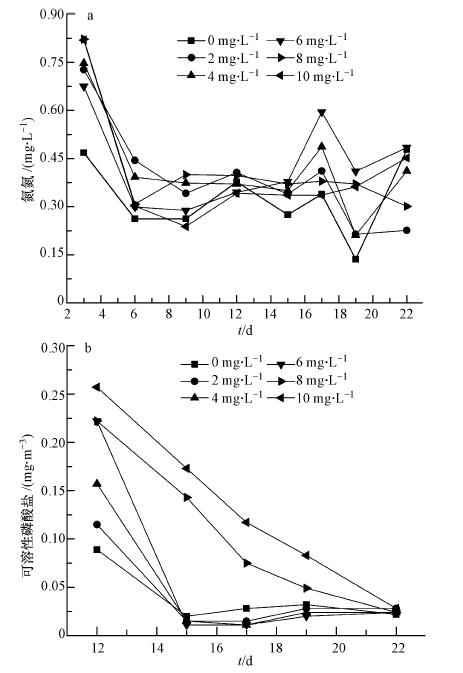 |
| 图 6 氨氮(a)和磷酸盐(b)浓度随时间的变化 Fig. 6 Variation of ammonia nitrogen(a) and soluble phosphate(b)concentration with time |
三维荧光光谱(Excitation-emission matrix,EEM)是一种高灵敏度的水中有机物的分析方法,能够很好地反映水体中天然有机物的组成(Bourgeois et al.,2001; Chen et al., 2003; Henderson et al., 2009). 水中溶解性有机物可以按照荧光所属位置,分为5个区域Flu I~Flu V(Chen et al., 2003).污水中主要的致色物质为富里酸类和腐殖质类物质,分别位于荧光光谱的III区和V区.图 7为未进行处理和臭氧投加量为6 mg · L-1的荧光光谱图.
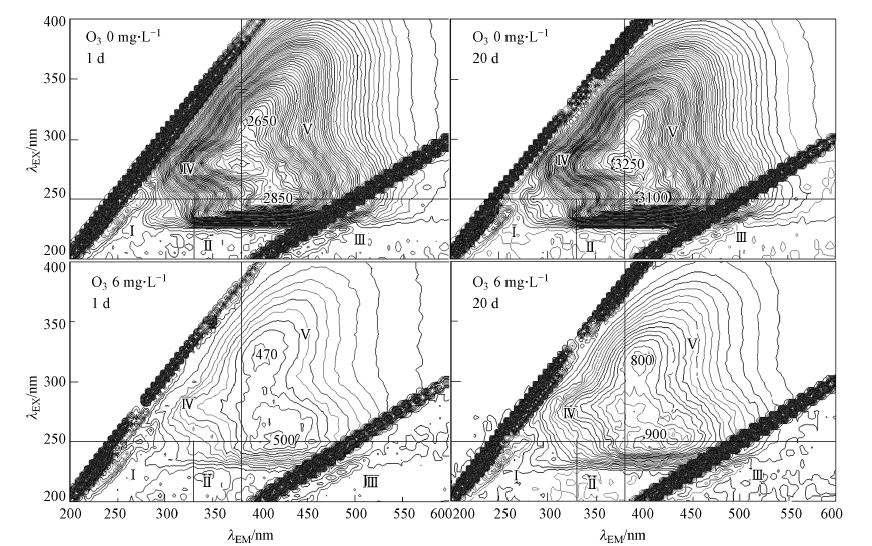 |
| 图 7 腐殖质随时间变化三维荧光图谱 Fig. 7 Fluorescence excitation-emission matrices graphs of humic substances |
从图 8a和b可以看出,腐殖酸与富里酸类物质的去除率随着臭氧投加量的增加逐渐增大. 当臭氧投加量为10 mg · L-1时,腐殖酸类和富里酸类物质的去除率达到88.7%和87.7%.随着时间的变化,不同臭氧投加量的水样中两种物质的荧光强度变化不大,只有小幅度的增加,可能是由于水样中藻类的衰亡腐败导致.
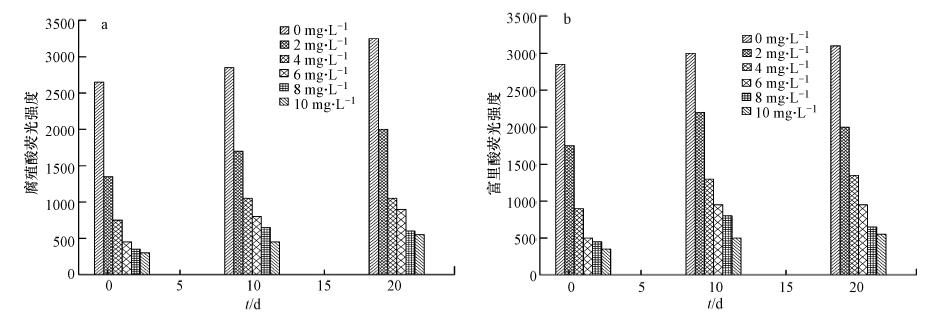 |
| 图 8 腐殖酸(a)和富里酸(b)荧光强度随时间的变化 Fig. 8 Variation in fluorescence intensity of humic acid(a) and fulvic acid(b)with time |
如图 9a所示,低剂量臭氧(小于6 mg · L-1)处理的水样,表色在前12 d缓慢增加,之后快速上升,而超过8 mg · L-1臭氧处理后的水样表色在19 d前未发生明显变化,只有在19 d到22 d时突然增加.图 9b显示模拟条件下水样的真色无明显变化.图 9c可以看出浊度同表色色度的变化相一致,15 d之前,水样浊度并没有很大变化,之后开始迅速上升.需要指出的是,水样的表色、浊度变化和叶绿素a呈现出十分相似的变化规律,这也反映出水样的外观变化主要由藻类的生长繁殖而引起.
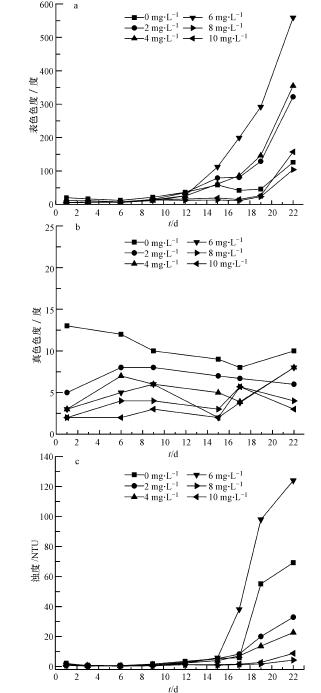 |
| 图 9 表色、真色和浊度随时间的变化 Fig. 9 Variation of surface color,true color and turbidity with st and ing time |
1)臭氧处理可以有效去除二级出水的表色和真色.当臭氧投加量为6 mg · L-1时,表色和真色的去除率超过75%.
2)模拟自然条件的过程中,所有水样的真色未发现明显变化,而叶绿素a、浊度和表色3个指标的变化趋势十分相似,均出现缓慢增加和快速上升两个阶段.在起初的12 d,各指标均缓慢增加,之后开始快速增加,到22 d时达到最大.
3)臭氧氧化后水体复色主要是由于藻类的繁殖.提高臭氧投加量可以延长水体复色时间,保持水体的色度稳定性.再生水深度处理过程建议臭氧投加量为8 mg · L-1.
| [1] | Bourgeois W, Burgess J E, Stuetz R M. 2001. On-line monitoring of wastewater quality: a review[J]. Journal of Chemical Technology and Biotechnology, 76(4): 337-348 |
| [2] | Chen W, Westerhoff P, Leenheer J A, et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 37(24): 5701-5710 |
| [3] | 陈永川, 汤利, 张德刚, 等. 2008. 滇池叶绿素a的时空变化及水体磷对藻类生长的影响[J]. 农业环境科学学报, 27(4): 1555-1560 |
| [4] | 董正臻, 董振芳, 丁德文. 2004. 快速测定藻类生物量的方法探讨[J]. 海洋科学, 28(11): 1-2; 5 |
| [5] | Ernst M, Sperlich A, Zheng X, et al. 2007. An integrated wastewater treatment and reuse concept for the Olympic Park 2008, Beijing[J]. Desalination, 202(1/3): 293-301 |
| [6] | Facile N, Barbeau B, Prévost M, et al. 2000. Evaluating bacterial aerobic spores as a surrogate for Giardia and Cryptosporidium inactivation by ozone[J]. Water Research, 34(12): 3238-3246 |
| [7] | Henderson R K, Baker A, Murphy K R, et al. 2009. Fluorescence as a potential monitoring tool for recycled water systems: A review[J]. Water Research, 43(4): 863-881 |
| [8] | 李夏青, 赵新华. 2011. 臭氧氧化法用于再生水回用的研究[J]. 安徽农业科学, 39(22): 13681-13682; 13693 |
| [9] | 刘莉, 郑兴灿, 廖飞凤, 等. 2007. TP浓度和季节变化对再生水水体中藻类生长的影响[J]. 中国给水排水, 23(21): 102-104 |
| [10] | Nguyen M L, Westerhoff P, Baker L, et al. 2005. Characteristics and reactivity of algae-produced dissolved organic carbon[J]. Journal of Environmental Engineering, 131(11): 1574-1582 |
| [11] | Takanashi H, Mayumi M, Kato M, et al. 2002. Removal of mutagen precursor from wastewater by activated sludge and oxidation treatment[J]. Water Science & Technology, 46(11/12): 389-394 |
| [12] | 汪小雄, 林细池, 姜成春, 等. 2010. 臭氧氧化铜绿微囊藻及其对水质的影响[J]. 环境保护科学, 36(6): 4-6 |
| [13] | Xu P, Janex M L, Savoye P, et al. 2002. Wastewater disinfection by ozone: main parameters for process design[J]. Water Research, 36(4): 1043-1055 |
| [14] | Yates G T, Smotzer T. 2007. On the lag phase and initial decline of microbial growth curves[J]. Journal of Theoretical Biology, 244(3): 511-517 |
| [15] | Yi L L, Jiao W T, Chen X N, et al. 2011. An overview of reclaimed water reuse in China[J]. Journal of Environmental Sciences, 23(10): 1585-1593 |
| [16] | 于海燕, 周斌, 胡尊英, 等. 2009. 生物监测中叶绿素a浓度与藻类密度的关联性研究[J]. 中国环境监测, 25(6): 40-43 |
| [17] | 周军, 于德淼, 白宇, 等. 2008. 再生水景观水体色度和臭味控制研究[J]. 给水排水, 34(1): 47-49 |
 2014, Vol. 34
2014, Vol. 34


