2. 中国科学院大学, 北京 100049;
3. 山西师范大学生命科学学院, 临汾 041000
2. University of Chinese Academy of Sciences, Beijing 100049;
3. School of Life Science, Shanxi Normal University, Linfen 041000
锰在地壳中的含量位居第10,是丰度仅次于铁的第二大过渡重金属元素(Post,1999).环境中的锰氧化物一般具有较大的比表面积,负电荷量高,具有较强的反应活性,调控着土壤、水体、沉积物中多种元素的运移和转化(Todd et al., 1988; Tebo et al., 2004; Webb et al., 2006; Miyata et al., 2007),直接或间接决定着它们在环境中的浓度、形态、环境行为和生物有效性.
锰氧化物的形成主要有化学氧化和生物氧化两种机制.在化学氧化过程中,虽然Mn2+氧化形成Mn3+/Mn4+是热力学的自发过程,但是此氧化过程的动力学速度较慢.而微生物因有特异的酶或者有特异性的代谢途径,可强烈催化Mn2+的氧化及锰氧化物的生成,使Mn3+/Mn4+的生成速率相比表面化学催化氧化要快很多,甚至高达105倍(Tebo et al., 1997).由于地壳中的锰氧化物主要来源于生物氧化,而微生物氧化形成的锰氧化物在经历老化或其他地质变更后会形成海洋、沉积物或土壤中的铁锰结核,所以透过铁锰结核可以窥见锰氧化物的形成过程和历史演变过程及在此过程中锰氧化微生物的种群变迁(He et al., 2008;Zhang et al., 2007).因此,对海洋、沉积物或土壤中铁锰结核及其附近环境中锰氧化菌的研究具有非常重要而深远的意义.
锰氧化微生物主要是指参与锰氧化作用的细菌和真菌,目前已从海洋和陆地等环境中分离得到了一些锰氧化细菌,主要对其中3类模式菌株,即生盘纤发菌(Leptothrix discophora)SS-1(Corstjens et al., 1997)、SP-6(Saratovsky et al., 2006),恶臭假单胞菌(Pseudomonas putida)MnB1、GB-1(Caspi et al., 1996;Caspi et al., 1998)及芽孢杆菌(Bacillus sp.)SG-1(Waasbergen et al., 1996)进行了深入研究.此外,真菌氧化Mn(Ⅱ)的研究逐渐增多,包括类枝顶孢属的丝状真菌KR21-2(Tani et al., 2004)和子囊真菌(Paraconiothyrium sp.)WL-2(Yu et al., 2012)等.
随着人们对生存环境和洋底锰结核资源的认识与关注以及地生物学研究的突起,近些年来在氧化锰矿物生物成因的分子机制和性质方面的研究取得了突出进展(Webb et al., 2005;Toner et al., 2005,2006;Villalobos et al., 2005;Murray and Tebo, 2007),但土壤是一个多组分的开放体系,其物质组成、理化性质等因素如何影响锰氧化物的生物形成,却鲜有报道(刘凡等,2008).
本研究利用从土壤铁锰结核及其附近土壤中分离筛选得到4株锰氧化细菌,研究了锰氧化细菌的锰氧化特性及其最优适用条件,为微生物与锰氧化物的交互作用及其环境应用提供科学依据.
2 材料与方法(Materials and methods) 2.1 培养基的制备WHS26、GY16、LZ2、LZ4采用改进的K培养基(Boogerd and de Vrind,1987; Krumbein and Altmann, 1973)进行培养.改进的K培养基成分为:蛋白胨0.2%(M/V,g/L),酵母粉0.05%(M/V,g/L),人工海水溶液50%(V/V),微量元素溶液0.1%(V/V).
其中,人工海水溶液组分为:NaCl 0.3 mol · L-1,KCl 0.01 mol · L-1,MgSO4 0.05 mol · L-1,CaCl2 0.01 mol · L-1.
微量元素溶液组分为:CuSO4 · 5H2O 10 mg · L-1,ZnSO4 · 7H2O 44 mg · L-1,CoCl2 · 6H2O 20 mg · L-1,Na2MoO4 · 2H2O 13 mg · L-1.
2.2 菌株的培养本实验选用的菌株为:WHS26、GY16、LZ2、LZ4,分别筛选于湖北武汉的粘磐湿润淋溶土、湖南桂阳的富铝湿润富铁土、广东雷州的暗红湿润铁铝土的亚表层土壤铁锰结核.以改进的K培养基为这4株菌的基础培养基,将培养基的pH调节至7.5,在115 ℃下灭菌30 min,待培养基冷却至室温后,向培养基中加入过0.22 μm滤膜的HEPES(pH值为7.5,终浓度为20 mmol · L-1)及MnCl2,Mn2+的终浓度分别为1 mmol · L-1(用于培养种子菌)和10 mmol · L-1(用于合成生物氧化锰).4株菌按2%的接种量接种后于30 ℃恒温摇床中以170 r · min-1连续培养20 d.
2.3 环境因子对菌株锰氧化活性的影响 2.3.1 pH对菌体锰氧化活性的影响配制改进的K培养基(液体),将培养基的pH分别调至5.0、6.0、6.5、7.0、7.5、8.0、8.5和9.0,在115 ℃下灭菌30 min,待培养基温度降至室温后在超净台中分别加入过0.22 μm滤膜的HEPES(pH与培养基一致,终浓度为20 mmol · L-1)和浓度为10 mmol · L-1的MnCl2.混合均匀后分装至经灭菌的50 mL的塑料离心管中,每管10 mL,以2%接种量接种后将离心管用橡胶塞密封,置于30 ℃ 恒温摇床中以170 r · min-1转速培养.分别设置含MnCl2不接种菌对照(CK1)和接种细菌但不含MnCl2(CK2)两组对照.培养20天后用LBB法测定含菌株的培养液中MnO2的浓度(Krumbein and Altmann, 1973),减去对应pH条件下CK1中的MnO2生成量,即为锰氧化菌对于Mn(Ⅱ)的氧化量.测定CK2中培养液的OD600即表示菌株的生长量.
2.3.2 最优pH下MnCl2初始浓度对菌体锰氧化活性的影响配制改进的K培养基(液体),调节pH至各菌株锰氧化效率最优的pH值,将其分装到100 mL的三角瓶中,每瓶50 mL,用封口膜密封,在115 ℃下灭菌30 min.灭菌后待培养基温度降至室温,将其在超净台中加入用0.22 μm滤膜过滤的HEPES(pH为各菌株锰氧化效率最优pH值,终浓度为20 mmol · L-1)及MnCl2,使MnCl2的终浓度分别为0、1、5、10、20、40和60 mmol · L-1.混合均匀后以2%的接种量接种,然后将三角瓶置于30 ℃恒温摇床中,以170 r · min-1转速培养.设置含不同浓度MnCl2但不接种细菌的一组对照(CK1).分别在培养5、10、15和20 d后采样,以LBB法测定含菌株的培养液中MnO2的生成量,减去对应的CK1中MnO2的生成量即为菌株对锰的氧化活性.
2.4 菌株锰氧化活性检测本实验采用LBB(Leukoberbelin blue)显色法测定样品中的锰氧化物浓度(Krumbein and Altmann, 1973).具体操作过程如下:首先,将LBB用45 mmol · L-1乙酸溶解,使其终浓度为0.4%(M/V).其次,用KMnO4为标准配置系列标准溶液.取2.3节中样品(或标准溶液)和LBB以1 ∶ 5的比例混合,在黑暗条件下显色15 min(22~25 ℃),然后将混合液在10000 r · min-1下离心10 min,取350 μL上清液至酶标板,用连续光谱酶标仪(SPECTRA Max 190,美国MD公司)检测620 nm波长处的吸光值,根据吸光值和标准曲线计算锰氧化物的含量.
2.5 扫描电镜及元素分析(SEM-EDS)和透射电镜(TEM)样品的准备采用扫描电镜及元素分析(SEM-EDS)和透射电镜(TEM)对生物氧化锰和化学氧化锰的形貌及化学组分进行测定.
2.5.1 生物氧化锰及化学氧化锰的制备SEM-EDS及TEM分析所选用的生物氧化锰由锰氧化菌WHS26、GY16在含Mn(Ⅱ)的改进K培养基中培养14 d制得.SEM-EDS及TEM分析所选用的化学氧化锰水羟锰矿由华中农业大学资源与环境学院冯雄汉教授提供.
2.5.2 扫描电镜及元素分析(SEM-EDS)样品的制备SEM分析的样品按照生物样品制备方法进行准备(Miyata et al., 2006).第一步,将样品用灭菌且去NaCl的磷酸盐缓冲盐溶液PBS(KCl: 2.7 mmol · L-1; Na2HPO4: 10 mmol · L-1;KH2PO4: 2 mmol · L-1;pH 7.1)清洗1次,离心(2000 r · min-1,5 min)后弃掉上清液;第二步,样品固定.向样品中加2.5%戊二醛1 mL,在4 ℃条件下放置4.5 h后,取出离心(4000 r · min-1,3 min);第三步,脱水.样品中依次加入50%、70%、80%、90%、95%、100%的乙醇,分别停留5 min后离心;第四步,取10 μL悬液滴于喷金玻片上,干燥.观察几种生物氧化锰的形貌,并与化学氧化锰进行比较.
2.5.3 透射电镜(TEM)样品的制备用于TEM分析的样品首先用去NaCl的PBS溶液清洗一次,离心(10000 r · min-1,5 min),加2.5%戊二醛1 mL,于4 ℃过夜,滴加到铜网中进行电镜分析(Miyata et al., 2006).
3 结果(Results) 3.1 pH对4株菌锰氧化活性的影响将锰氧化细菌在改进的K培养基中培养20 d后发现,4株菌的最佳生长条件与最佳锰氧化效率所对应的pH均不一致;4株菌所获得的锰氧化物含量差别较大(图 1).随着pH的升高,4株菌产生的MnO2浓度均逐渐升高,但是,GY16在pH 7.5时锰氧化活性已达到最大,而WHS26、LZ2、LZ4在pH 8时锰氧化活性才达到最大.虽然菌株来自酸性土壤,但其最佳的锰氧化pH均偏碱性.此外,4株菌在一系列的pH梯度下菌株的生长量呈现出不同的变化趋势.LZ2与GY16两株菌的生长量均随pH的升高而呈现出了逐渐下降的趋势.WHS26的生长量则随pH升高呈现上升趋势,LZ4的生长量随pH的变化虽然没有呈现明显的变化趋势,但是当其培养基的pH>7时,菌株生长量趋于稳定.
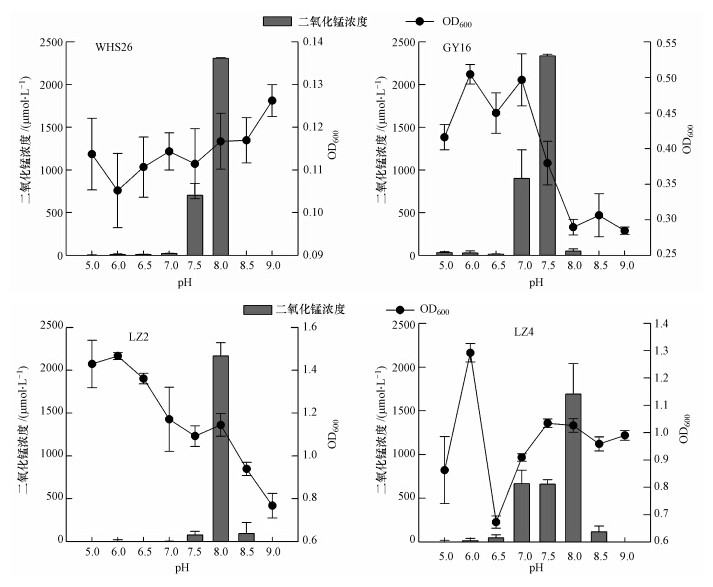 |
| 图 1 pH对细菌锰氧化活性的影响 Fig. 1 Effects of pH on Mn-oxidizing activities of bacteria |
设定培养基pH为菌株锰氧化效率最优pH,在不同初始Mn2+浓度下,随着培养时间的延长4株菌生成的锰氧化物逐渐增多,到20 d时达到最大值(图 2).随Mn2+初始浓度的升高,4个菌株生成的MnO2的量均呈现先增加后减小的趋势.GY16在Mn2+浓度为20 mmol · L-1时生成的MnO2最多,而WHS26、LZ4、LZ2菌株则在Mn2+浓度为10 mmol · L-1时生成的MnO2最多.此外,WHS26、GY16的氧化锰生成量显著高于LZ2、LZ4.表明在最优的锰氧化条件下,WHS26、GY16具有更高的锰氧化效率,可能具有更好的潜在应用价值.
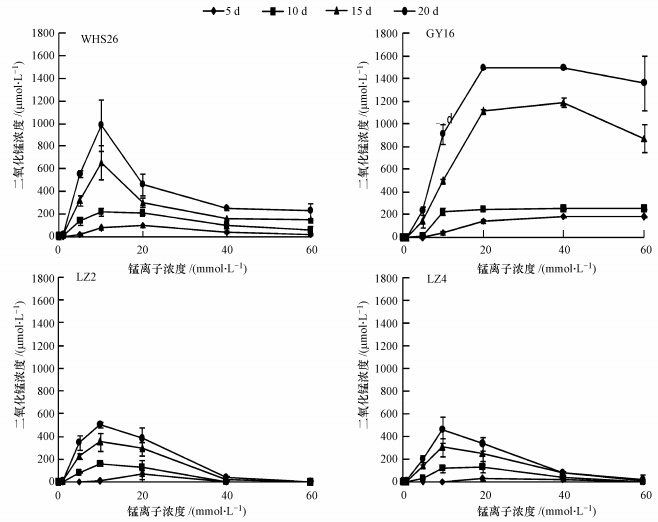 |
| 图 2 最优pH条件下Mn2+初始浓度对细菌锰氧化活性的影响 Fig. 2 Effects of initial Mn2+ concentration on Mn-oxidizing activities of bacteria at the optimal pH |
化学氧化锰水羟锰矿在TEM下呈明显的结晶态(图 4a),用SEM-EDS进行分析,结果显示(图 3a):水羟锰矿在SEM下呈纤维状或弯曲的叶片状,其结构中含有大量的Mn、O元素.
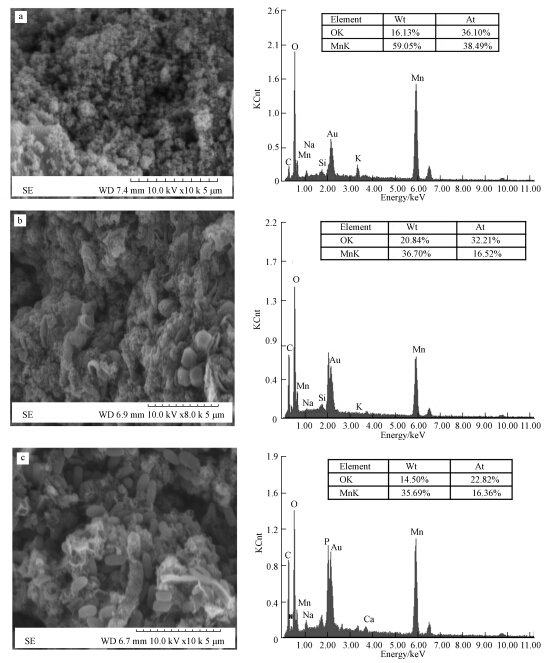 |
| 图 3 锰氧化物的SEM-EDS结果(a. 水羟锰矿(×10000);b. GY16(×8000);c. WHS26(×10000)) Fig. 3 SEM and EDS analysis of Mn oxides(a. Vernadite(×10000); b. GY16(×8000); c.WHS26(×10000)) |
 |
| 图 4 锰氧化物的TEM结果(a.水羟锰矿(×50000);b. GY16(×100000);c. WHS26(×150000)) Fig. 4 TEM analysis of Mn oxides(a. Vernadite(×50000); b. GY16(×100000); c. WHS26(×150000)) |
锰氧化菌WHS26、GY16形成的生物氧化锰在TEM下为形状不规则的微粒(图 4b、4c),用SEM-EDS进行分析,结果显示(图 3b、3c):在加入MnCl2的培养基中,两种锰氧化物都形成了大量氧化锰沉淀.但形成的生物氧化锰扫描电镜图像有所不同,GY16的菌体表面形成了大量胶膜状物质(图 3b);WHS26菌体表面不光滑,形成的生物氧化锰附着在菌体周围(图 3c).元素分析结果显示,这两个样品中Mn质量分数在14.5%到36.7%之间,原子百分比O元素都大于Mn元素.
4 讨论(Discussion) 4.1 Mn(Ⅱ)浓度和pH对锰氧化菌氧化活性的影响本研究从pH、Mn(Ⅱ)浓度等几方面探讨了多个环境因子对于锰氧化菌氧化Mn(Ⅱ)的影响. 由图 1可见,4株锰氧化菌在不同的pH下锰氧化活性发生了很大的改变.其变化趋势与文献报道的锰细菌Arthrobacter sp. MN1405以及Arthrobacter chlorcphenolicus MN409 在不同pH下的锰氧化趋势基本相近.除此以外,随着pH的增加,菌株WHS26的生长量逐渐增加,而GY16、LZ2的生长量逐渐下降,LZ4在pH为8时,其生长量趋于稳定.由此可以看出,不同的菌株对于pH的耐受范围不同,因而其在不同pH下的生长趋势也呈现出一定差异.比较图 1中4株菌的生长量及锰氧化活性可以看出,WHS26在pH为9时,菌株生长量最高,而GY16、LZ2、LZ4在pH<7时,菌株生长量最高,但是他们的锰氧化活性均在pH 7~8时最好.由此可以看出,锰氧化菌生长量和pH对菌株的锰氧化活性均有影响.菌株生长量过低会降低生物氧化锰的形成量,而在最优的生长环境下,菌株氧化Mn(Ⅱ)的能力会受到pH的限制.由于Mn(Ⅱ)氧化生成Mn(IV)的过程是由微生物产生的一种多铜氧化酶体系介导的两个连续的单电子传递过程(Webb et al., 2005),所以在最优生长pH下,锰氧化活性未能达到最高,可能是由于多铜氧化锰在这一pH条件下,活性受到抑制,从而影响了其氧化Mn(Ⅱ)的能力.另一方面,从土壤中筛选出的锰氧化细菌其氧化Mn(Ⅱ)的最优pH均在7.5~8.0之间,此外,细菌WH4、SS-1形成生物氧化锰的最优pH在7.5左右(Meng et al., 2009)、SG-1形成生物氧化锰的最优pH在7.3~7.9之间(Toyoda et al., 2013).而Miyata从河床中分离的1株锰氧化真菌KR21-2(Saratoysky et al., 2009)以及Sasaki从湿地中分离出的真菌WL-2(Yu et al., 2012),它们氧化Mn(Ⅱ)的pH均在5.5~6.5之间.由此可见,锰氧化真菌与细菌体内氧化Mn(Ⅱ)的特异性酶对pH的适应性存在较大差异.
筛选自土壤铁锰结核的4株菌,其锰氧化效率达到最优点时的Mn(Ⅱ)浓度均在10~20 mmol · L-1之间.Toyoda从海洋沉积物中分离出的1株芽孢杆菌SG-1,形成生物氧化锰时的Mn(Ⅱ)浓度为50 μmol · L-1左右(Toyoda and Tebo, 2013).从淡水环境中分离出的Pseudomonas putida MnB1形成生物氧化锰时最优Mn(Ⅱ)浓度为1 mmol · L-1(Toner et al., 2006).与土壤中的锰氧化菌相比,源于水体的菌株只能在较低的Mn(Ⅱ)浓度下形成生物氧化锰.这主要是由于细菌氧化Mn(Ⅱ)可能是为实现以下生理功能:提供生命活动的能量;同化和固定CO2;保护菌体免受重金属、活性氧、紫外线等的毒害和损伤;作为嫌气条件下无氧呼吸的电子受体;清除过量的营养元素;将难容有机质转化成可利用的底物等(刘凡等,2008).而土壤环境的理化性质、物质组成较水体环境更为复杂,从而使得土壤中的锰氧化菌对Mn(Ⅱ)有更高的耐受性.
4.2 锰氧化物SEM和TEM结果扫描和透射电镜结果显示,化学氧化锰和生物氧化锰结构存在很大的差异,化学氧化锰呈规则的细颗粒弱晶质结构,生物氧化锰则附着在菌体周围呈不规则的颗粒.对两种锰氧化菌形成的生物氧化锰进行元素分析,结果显示,这两种生物氧化锰Mn质量分数均在14.5%到36.7%之间,O元素原子百分比均大于Mn元素.说明两种锰氧化菌都把培养基中二价锰氧化成了高价锰.
用扫描电镜观察两种生物锰氧化物时发现,生成的两种生物氧化锰都附着在菌体周围,其中GY16的菌体表面形成了大量胶膜状物质、WHS26菌体表面不光滑,这些结果与Bargar等(Tebo et al., 2004)从水体中筛选的锰氧化菌产生的生物氧化锰的电镜结果一致.虽然两种生物氧化锰均是附着在菌体周围,但是由不同菌株产生的生物氧化锰其外部形态存在很大差异,而这种差异会进一步影响生物氧化锰与其它元素的氧化吸附机制.这一现象的产生可能是由于不同的锰氧化菌,其氧化二价锰的路径不同,因而导致不同锰氧化菌生成的生物氧化锰形态结构也存在一定差异.Tebo(Tebo et al., 2004)在其研究中指出,锰氧化菌主要是通过多铜氧化酶以单电子转移方式对Mn(Ⅱ)进行氧化,Mn(IV)的形成途径可能有以下几种:① 形成的Mn(III)与酶分离,在反应溶液中歧化形成Mn(IV);② 锰氧化酶将Mn(III)氧化为Mn(IV);③ Mn(Ⅱ)直接通过单电子转移方式氧化为Mn(IV).除此以外,对不同锰氧化菌的研究结果表明,并非所有锰氧化菌均会产生中间产物Mn(III),在恶臭假单胞菌 MnB1氧化Mn(Ⅱ)的过程中并未发现Mn(III)(Villalobos et al., 2003),而SG-1形成生物氧化锰的过程中则用焦磷酸钠捕捉到了Mn(III)(Webb et al., 2005).
5 结论(Conclusions)1)培养菌株所用培养基的pH值及初始Mn2+浓度对于4株菌的锰氧化活性均有影响.当培养基pH在7~8时,菌株的生长情况良好,菌株的锰氧化效率也最好;在最佳pH条件下,WHS26、LZ2、LZ4在Mn2+浓度为10 mmol · L-1时生成的锰氧化物量最多,而GY16则在Mn2+浓度为20 mmol · L-1时生成的锰氧化物量最多.
2)生物氧化锰和化学氧化锰的结构存在较大差异,化学氧化锰呈纤维状或弯曲的叶片状,而生物氧化锰附着在菌体周围,呈不规则的颗粒状.不同菌株形成的生物氧化锰的形貌也存在明显差别,GY16形成的生物氧化锰为胶膜状物质;WHS26菌体表面不光滑,形成的生物氧化锰附着在菌体周围.
| [1] | Boogerd F C, de Vrind J P. 1987. Manganese oxidation by Leptothrix discophora[J]. Journal of Bacteriology, 169(2): 489-494 |
| [2] | Caspi R, Haygood M G, Tebo B M. 1996. Unusual ribulose-1, 5-bisphosphate carboxylase/oxygenase genes from a marine manganese-oxidizing bacterium[J]. Microbiology, 142(9): 2549-2559 |
| [3] | Caspi R, Tebo B M, Haygood M G. 1998. c-Type cytochromes and manganese oxidation in Pseudomonas putida MnB1[J]. Applied and Environmental Microbiology, 64(10): 3549-3555 |
| [4] | Corstjens P L A M, de Vrind J P M, Goosen T, et al. 1997. Identification and molecular analysis of the Leptothrix discophora SS-1 mofA gene, a gene putatively encoding a manganese-oxidizing protein with copper domains[J]. Geomicrobiology Journal, 14(2): 91-108 |
| [5] | He J Z, Zhang L M, Jin S S, et al. 2008. Bacterial communities inside and surrounding soil iron-manganese nodules[J]. Geomicrobiology Journal, 25(1): 14-24 |
| [6] | Krumbein W E, Altmann H J. 1973. A new method for the detection and enumeration of manganese oxidizing and reducing microorganisms[J]. Helgoländer Wissenschaftliche Meeresuntersuchungen, 25(2/3): 347-356 |
| [7] | 刘凡, 冯雄汉, 陈秀华, 等. 2008. 氧化锰矿物的生物成因及其性质的研究进展[J]. 地学前缘, 15(6): 66-73 |
| [8] | 刘颜军, 周静晓, 王革娇. 2009. 锰氧化菌Bacillus sp. MK3-1的Mn(Ⅱ)氧化特性和除锰能力研究[J]. 微生物学通报, 36(4): 473-478 |
| [9] | Meng Y T, Zheng Y M, Zhang L M, et al. 2009. Biogenic Mn oxides for effective adsorption of Cd from aquatic environment[J]. Environmental Pollution, 157(8/9): 2577-2583 |
| [10] | Miyata N, Tani Y, Maruo K, et al. 2006. Manganese (IV) Oxide Production by Acremonium sp. Strain KR21-2 and Extracellular Mn(Ⅱ) Oxidase Activity[J]. Applied and Environmental Microbiology, 72(10): 6467-6473 |
| [11] | Miyata N, Tani Y, Sakata M, et al. 2007. Microbial manganese oxide formation and interaction with toxic metal ions[J]. Journal of Bioscience and Bioengineering, 104(1): 1-8 |
| [12] | Murray K J, Tebo B M. 2007. Cr (III) is indirectly oxidized by the Mn (II)-oxidizing bacterium Bacillus sp strain SG-1[J]. Environmental Science & Technology, 41(2): 528-533 |
| [13] | Post J E. 1999. Manganese oxide minerals: Crystal structures and economic and environmental significance[J]. Proceedings of the National Academy of Sciences of the United States of America, 96(7): 3447-3454 |
| [14] | Saratovsky I, Wightman P G, Pastén P A, et al. 2006. Manganese oxides: parallels between abiotic and biotic structures[J]. Journal of the American Chemical Society, 128(34): 11188-11198 |
| [15] | Saratovsky I, Gurr S J, Hayward M A. 2009. The structure of manganese oxide formed by the fungus Acremonium sp. strain KR21-2[J]. Geochimical et Cosmochimica Acta, 73(11): 3291-3300 |
| [16] | Tani Y, Miyata N, Ohashi M, et al. 2004. Interaction of inorganic arsenic with biogenic manganese oxide produced by a Mn-oxidizing fungus, strain KR21-2[J]. Environmental Science & Technology, 38(24): 6618-6624 |
| [17] | Tebo B M, Ghiorse W C, van Waasbergen L G, et al. 1997. Bacterially-mediated mineral formation: Insights into manganese (II) oxidation from molecular genetic and biochemical studies[J]. Reviews in Mineralogy and Geochemistry, 35(1): 225-266 |
| [18] | Tebo B M, Bargar J R, Celement B G, et al. 2004. Biogenic manganese oxides: Properties and mechanisms of formation[J]. Annual Review of Earth and Planetary Sciences, 32(1): 287-328 |
| [19] | Todd J F, Elsinger R J, Moore W S. 1988. The distributions of uranium, radium and thorium isotopes in two anoxic fjords: Framvaren fjord (Norway) and Saanich Inlet (British Columbia)[J]. Marine Chemistry, 23(3/4): 393-415 |
| [20] | Toner B, Fakra S, Villalobos M, et al. 2005. Spatially resolved characterization of biogenic manganese oxide production within a bacterial biofilm[J]. Applied and Environmental Microbiology, 71(3): 1300-1310 |
| [21] | Toner B, Manceau A, Webb S M, et al. 2006. Zinc sorption to biogenic hexagonal-birnessite particles within a hydrated bacterial biofilm[J]. Geochimica et Cosmochimica Acta, 70(1): 27-43 |
| [22] | Toyoda K, Tebo B M. 2013. The effect of Ca2+ ions and ionic strength on Mn (II) oxidation by spores of the marine Bacillus sp. SG-1[J]. Geochimica et Cosmochimica Acta, 101: 1-11 |
| [23] | van Waasbergen L G, Hildebrand M, Tebo B M. 1996. Identification and characterization of a gene cluster involved in manganese oxidation by spores of the marine Bacillus sp. strain SG-1[J]. Journal of Bacteriology, 178(12): 3517-3530 |
| [24] | Villalobos M, Toner B, Bargar J, et al. 2003. Characterization of the manganese oxide produced by Pseudomonas putida strain MnB1[J]. Geochimica et Cosmochimica Acta, 67(14): 2649-2662 |
| [25] | Villalobos M, Bargar J, Sposito G. 2005. Mechanisms of Pb (II) sorption on a biogenic manganese oxide[J]. Environmental Science & Technology, 39(2): 569-576 |
| [26] | Webb S M, Dick G J, Bargar J R, et al. 2005. Evidence for the presence of Mn(III) intermediates in the bacterial oxidation of Mn(Ⅱ)[J]. Proceedings of the National Academy of Sciences, 102(15): 5558-5563 |
| [27] | Webb S M, Fuller C C, Tebo B M, et al. 2006. Determination of uranyl incorporation into biogenic manganese oxides using X-ray absorption spectroscopy and scattering[J]. Environmental Science & Technology, 40(3): 771-777 |
| [28] | Yu Q Q, Sasaki K, Tanaka K, et al. 2012. Structural factors of biogenic birnessite produced by fungus Paraconiothyrium sp. WL-2 strain affecting sorption of Co2+[J]. Chemical Geology, 310-311: 106-113 |
| [29] | Zhang G S, Qu J H, Liu H J, et al. 2007. Preparation and evaluation of a novel Fe-Mn binary oxide adsorbent for effective arsenite removal[J]. Water Research, 41(9): 1921-1928 |
| [30] | 张林静, 张琼, 郑袁明, 等. 2013. 环境修复中锰氧化物与变价重金属交互作用的研究进展[J]. 环境科学学报, 33(6): 1519-1526 |
 2015, Vol. 35
2015, Vol. 35


