Pb位于元素周期表的第五周期第四主族,电子构型为6s26p2,可以失去4个电子变成Pb4+.第四主族中的元素随着原子序数的增加,稳定氧化态从正4价逐渐变成正2价.作为本族最后一个元素,自然界中铅元素主要以Pb2+形式存在,而Pb4+只有在一些极罕见的强氧化环境中才会存在(刘英俊和曹励明,1984).铅在储能电池制造、X射线防护等方面具有不可代替的作用,但同时铅也对动物、植物、微生物以及人体有一定的危害作用(韩磊和张恒东,2009).伴随着铅矿的大规模开采和应用,我国的大气、土壤和水体都存在着不同程度的铅污染(冯福建等,2001).随着环境微生物学的发展,研究人员发现一些微生物能够去除被污染环境中的Pb2+(Petr,2003; Sayer et al., 1997; Kumar et al., 2011).一般情况下,微生物修复铅污染环境时,难以对其进行回收,无法降低环境中的Pb2+含量,并未将环境Pb2+“去除”,而是通过螯合、矿化、吸附等作用,将环境中游离的、有活性的Pb2+以矿物、某些不溶物的形式“固定”于细胞内、细胞壁或环境中,降低Pb2+的生物有效性(杨金燕等,2005),减少其对环境的毒害.综上所述,在提法上,本文认为:菌株对Pb2+的“固定”比“去除”更符合实际情况.与传统的化学和物理方法相比,微生物法固定Pb2+具有材料来源广泛、高效、廉价、无二次污染等优点,已成为近代铅污染处理的研究热点.许多研究者正在致力于筛选更高效、更安全的菌种用于固定Pb2+,修复铅污染环境(周薇等,2009).目前报道比较多的有效固定Pb2+的菌种有:白腐真菌(吴涓等,1999; Petr,2003;Zeng et al., 2007;)、秀珍菇(李维焕等,2011)、黑曲霉(Wang et al., 2001;Dursun et al.,2003; Amini et al., 2008; 尹利利等,2013)、酵母菌(韩润平等,2000)、木霉(沈薇等,2006)、拉微球菌、青霉、镰刀菌等(潘蓉等,2010).以上各种微生物对Pb2+的耐受能力、去除率(固定率)以及固定Pb2+的最优条件都各不相同,分别有其各自的特点.本实验从某铅锌矿土壤中筛选出一株塔宾曲霉(Aspergillus tubingensis),其对Pb2+有较好的耐受性和较高的固定率.本文对塔宾曲霉的生物学特征及其对Pb2+的固定作用进行初步的探索、研究.
2 材料和方法(Materials and methods) 2.1 仪器振荡培养箱(东联电子,HZQ-F100),高压蒸汽灭菌锅(滨江医疗设备有限公司,LS-B50L),高速冷冻离心机(科大创新有限公司,HC-3018),真空冷冻干燥机(SP Industries,2KBTES),万分天平(梅特勒,AL204-IC),1 mL微量滴定管,超声波振荡器(昆山超声仪器有限公司,KQ-100B)等.
2.2 试剂、溶液0.04、1、4 mmol · L-1 EDTA(西陇化工有限公司,AR)溶液,铅标准溶液(国家标准物质研究中心提供,1000 mg · L-1),0.5%二甲酚橙(XO,北京化工厂,AR)溶液,10% H2O2(西陇化工有限公司,AR)溶液,100 g · L-1六次甲基四胺(北京化工厂,AR)缓冲溶液(硝酸调节其pH为5.95),2.5%戊二醛(国药集团,AR)溶液(以0.1 mol · L-1,pH=7.2磷酸盐缓冲溶液进行稀释定容),0.5%美蓝(国药集团,AR)溶液,硝酸(北京化学试剂研究所,MOS).
2.3 培养基 2.3.1 富集培养基牛肉膏1.0 g,蛋白胨3.0 g,酵母膏0.5 g,葡萄糖3.0 g,NaCl 0.5 g,NaNO3 0.5 g,MgSO4·7H2O 0.01 g,NH4Cl 0.1 g,去离子水1 L,pH =4.5.
2.3.2 分离培养基每升富集培养基添加Pb(NO3)2 1.33 g(Pb2+含量约4 mmol · L-1,即828 mg · L-1)、琼脂18 g,灭菌后制成固体培养基,用于分离菌株.
2.4 实验方法 2.4.1 菌种分离、筛选称取5 g采集于某铅锌矿尾矿坝的含菌土样,置于250 mL富集培养基,30 ℃,160 r · min-1下培养3 d.以划线法,在Pb2+浓度为4 mmol · L-1的固体培养基上,对上述菌液进行分离、筛选.因Pb2+的选择作用,连续分离、纯化数次后所获菌株对浓度≥4 mmol · L-1的Pb2+具有耐受性.配制Pb2+浓度为4 mmol · L-1的富集培养基250 mL.将上述菌株接种于其中,30 ℃,160 r · min-1下振荡培养.每2 d取样1次,以络合滴定法测定其Pb2+浓度.连续培养、测定2周,检验菌株能否有效固定Pb2+.
2.4.2 LYF12的菌落特征2.4.1节分离到1株可高效固定Pb2+的真菌,实验编号为LYF12(以下用LYF12表示该菌株).过LYF12菌落圆心,将分离培养基切出宽约5 mm,略长于菌落直径的琼脂条,使有菌苔的一面垂直于载玻片,于光学显微镜下对其进行观察、分析.同样的方法切出一小块带有菌苔的琼脂块,粘附在硅片上,于北京大学电镜中心环境扫描电镜下进行观察研究.
2.4.3 LYF12生理、生化特征对LYF12菌株进行淀粉、油脂、明胶水解试验、糖发酵试验、柠檬酸试验、硫化氢产生试验、产氨试验、尿素分解试验和过氧化氢分解等试验(钱存柔和黄仪秀,2008),以研究LYF12的生理、生化特性.
2.4.4 菌株分子生物学鉴定用酶提取法提取LYF12的DNA.使用引物(上游引物ITS1,下游引物ITS4),进行PCR扩增(杨亮等,2012).产物送北京诺赛基因组研究中心有限公司测序.将所得序列数据在NCBI在线数据库进行BLAST分析,使用MEGA4.1生成发育树.将测序数据提交GenBank,申请序列号.
2.4.5 pH、Pb2+对LYF12生物量的影响①配制富集培养基11瓶,各100 mL.用1%硝酸及饱和乙酸钠溶液将其pH分别调节为5、1、2、3、4、5、6、7、8、9、10,编号为0~10.1~10号分别接入新鲜LYF12种子液1 mL,0号不接菌,在30 ℃,160 r · min-1下振荡培养5 d.过滤称重,1~10号测得质量减去0号质量作为1~10号的生物量(湿重,下同).
②配制富集培养基7瓶,各100 mL.Pb2+浓度分别为0、1、2、3、4、5、6 mmol · L-1,编号为0~7.灭菌后1~7号各接入LYF12新鲜种子液1 mL,0号不接菌.在30 ℃,160 r · min-1下振荡培养5 d.过滤称重,1~7号测得质量减去0号质量作为1~7号的生物量.
2.4.6 不同初始pH、Pb2+浓度下,LYF12对培养基中Pb2+的固定①配制富集培养基6瓶,各170 mL,调节其Pb2+浓度为4 mmol · L-1.pH分别调节为1、2、3、4、5、6,编号为1~6.另配培养基6瓶,参数同上,编号a~f.灭菌后在1~6分别接入LYF12新鲜种子液1 mL,30 ℃,160 r · min-1振荡培养.a~f作为空白对照,不接菌.每12 h各取样1次,测定其Pb2+浓度,至前后2次取样、测定所得结果相近时停止测定.t时刻,1~6中Pb2+浓度记为C1t、C2t、…、C6t,a~f中Pb2+浓度记为Cat、Cbt…Cft,则1~6培养基中Pb2+浓度的固定率分别为(Cat-C1t)/ Cat×100%、(Cbt-C2t)/Cbt×100% …(Cft-C6t)/Cft×100%.
②配制富集培养基6瓶,各250 mL.分别调节其Pb2+浓度为0、0.5、1、2、4、6 mmol · L-1,编号为1~6.另配培养基6瓶,参数同上,编号为a~f.采用与①相同的方法接菌、培养、测定Pb2+浓度,以研究不同初始Pb2+浓度对LYF12的Pb2+固定率的影响.
2.4.7 LYF12固定Pb2+微观研究在Pb2+浓度为4 mmol · L-1的富集培养基中培养5 d,LYF12在三角瓶底部形成大量球形菌丝团.挑取少量菌丝团,经固定、漂洗、包埋等处理,切成40 nm厚的薄片,固定在铜网上,于F30透射电镜下进行观察研究.
2.4.8 能量供应对LYF12吸附Pb2+的影响在超净工作台中,将培养5 d的LYF12菌丝团转移到滤纸上吸去水分,称取3份,每份1 g,编号1~3.1号转入厌氧培养箱,2、3保存在有氧无菌环境待用.配制3瓶Pb2+浓度为4 mmol · L-1的Pb(NO3)2溶液,各100 mL,编号为a、b、c.c溶液添加0.3 g葡萄糖后,将a、b、c溶液的pH均调节为5.共同灭菌后,不待冷却,a瓶立即转移到厌氧培养箱中,b、c瓶放入超净工作台.冷却至室温后,1号菌丝团投入a瓶,2、3号菌丝团分别投入b、c瓶.设置和a、b、c相同,而不接入菌丝团的a′、b′、c′作为对照.a、b、c、a′、b′、c′均放在30 ℃,160 r · min-1的电磁振荡器上振荡(a、a′处于厌氧环境).每10 min各1次,测定其Pb2+浓度.t时刻a瓶Pb2+浓度记为Cat,a′瓶Pb2+浓度记为C′at,则t时刻a瓶Pb2+吸附率为(C′at-Cat)/ C′at,b、c瓶Pb2+吸附率以相同方法计算.
3 结果(Results) 3.1 菌株形态、生理、生化特征及鉴定分离培养基上的菌落呈同心圆状,外环为白色营养菌丝,中心部位黑褐色,为分生孢子颜色,质地丝绒状,反面呈淡黄色(图 1a).随着培养时间增加,菌落可以长满整个平板,且全部产生分生孢子,使整个平板呈黑褐色.菌落表面有淡褐色渗出液.孢梗柄长约1000~1600 μm,直径15~20 μm,分生孢子头球形,直径60~150 μm(图 1b、1c).分生孢子近球形,直径3 μm,两端内凹,以内凹处相互连接构成分生孢子链,分生孢子表面稍粗糙,有平行孢子链方向的纵向条纹.以上形态特征和塔宾曲霉的相关特征吻合(齐祖同,1997).光学显微镜下观察可见,球形分生孢子头之间有菌丝(或某种丝状结构)相连,长400~1200 μm,直径3~4 μm,明显比孢梗柄要细的多.一般每个分生孢子头只产生两条这样的菌丝,分别和前、后两个分生孢子头相连(图 1b).已有文献报道塔宾曲霉存在有性生殖(齐祖同,1997),但上述菌丝连接方式及形态与文献报道的真菌有性生殖过程中形成接合菌丝并不相似,其具体功能尚不明确.值得注意的是在某些孢梗柄中部也会产生类似的菌丝(图 2a),该菌丝并不直接连接相邻的孢梗柄,而是通过一种近三角形构造相连(图 2b).这些菌丝直接从孢梗柄某一部位生出(图 2c),可形成分支,分岔处明显可见有隔膜存在(图 2d).
 |
| 图 1 LYF12菌株的平板培养特征(a. LYF12接种在含铅分离培养基上形成的菌落照片;b. LYF12菌丝光学显微镜照片,放大倍数10×10;c. LYF12分生孢子头SEM照片;d. 图局部放大,分生孢子链) Fig. 1 Plate culture characteristics of strain LYF12(a. Bacterial colony of LYF12 on media containing lead. b. Mycelia of LYF12 under optical microscope,10×10; c. SEM image of LYF12′s pycnidia. d. Partial enlarged detail of c) |
 |
| 图 2 孢梗柄间菌丝图(a. 孢梗柄中部形成的菌丝;b. 图中菌丝连接处形成的近三角形结构;c. 图中菌丝从孢梗柄生出方式;d. 图中菌丝的分支及连接处隔膜结构.) Fig. 2 Optical micrographs of hyphae between sporangiophores(a. Hypha grown from the middle of the sporangiophore; b. Triangle between hyphae in image; c. Way of hyphae growing from sporangiophore; d. Branch of hyphae and its septa.) |
微生物生理生化反应特征的测定对微生物进行初步分类鉴定有一定参考意义.2.4.3节结果表明:LYF12菌株水解淀粉、明胶、过氧化氢、柠檬酸钠,不分解油脂、尿素.糖酵解试验产酸、产气.产硫化氢、不产氨.可利用蔗糖、麦芽糖和纤维二糖.
将2.4.4节测序数据通过在线数据库进行 BLAST分析,选取同源性较高的12株,应用MEGA4.1软件构建系统发育树(图 3). LYF12和塔宾曲霉(Aspergillus tubingensis,USMF07)同源性为99%,结合LYF12菌落形态、孢梗柄、分生孢子等形态特征,LYF12为塔宾曲霉,属子囊菌门,散囊菌纲,散囊菌目,曲霉科,曲霉属.GenBank序列号为KJ569519.
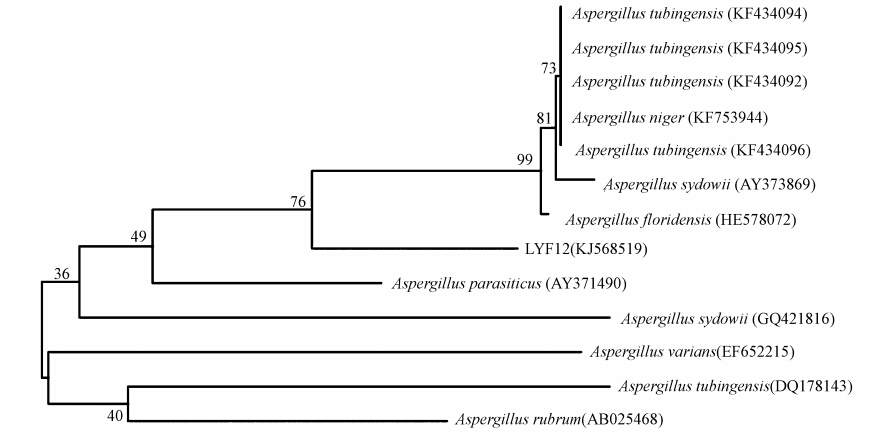 |
| 图 3 LYF12系统发育树 Fig. 3 Phylogenetic tree of LYF12 |
图 4a表明,LYF12能够在2~10的pH值范围内生长.pH在其最适范围5~6时,生物量可达到将近40 g · L-1.LYF12对Pb2+有较高耐受能力,图 4b显示,在Pb2+浓度高达6 mmol · L-1培养基中生物量仍可达到26 g · L-1左右.随培养基中Pb2+浓度升高,生物量逐渐下降.Pb2+浓度高于4 mmol · L-1时,生物量迅速下降.这一现象可能与LYF12的保存条件有关系.LYF12自2008年分离至今,一直保存在Pb2+浓度为4 mmol · L-1的培养基中,培养基中的Pb2+对菌株不断进行选择,使得LYF12菌株对该浓度Pb2+具有良好耐受性,而Pb2+浓度高于4 mmol · L-1时,其对LYF12毒害作用加深,导致LYF12生物量下降.
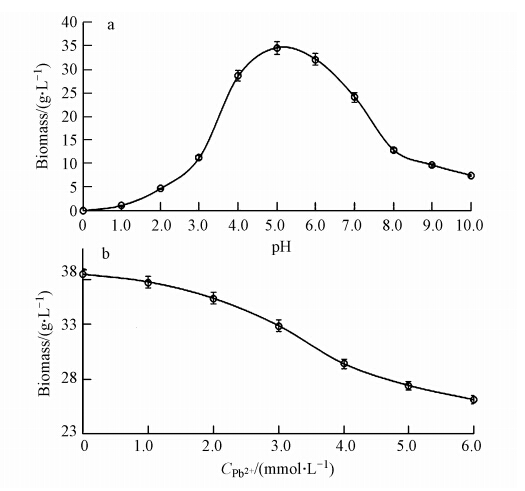 |
| 图 4 pH、铅离子浓度对LYF12生物量的影响 Fig. 4 Effect of pH and concentration of Pb2+ on LYF12 biomass |
Pb2+是较容易水解的离子,经验证,在pH高于6.5富集培养基中添加Pb2+会产生Pb(OH)2沉淀,这和通过溶度积计算结果是相符的,调节培养基pH值时,不可使用强碱或碳酸钠等物质,以使用乙酸钠为宜.本文在研究pH对LYF12固定Pb2+作用的影响时,最高pH设定为6,高于6时,培养基中Pb2+浓度的降低可能不是由LYF12对其固定作用所引起的.同时,经验证:在富集培养基中添加Pb2+,其浓度不宜高于6 mmol · L-1,超出此浓度,也容易有沉淀生成,故实验中Pb2+浓度最高值设置为6 mmol · L-1.2.4.6节研究了各初始pH、 Pb2+浓度下,LYF12对Pb2+的固定率,以固定率作为纵坐标,pH、Pb2+浓度作为横坐标,进行作图,如图 5所示.图 5 a、b曲线分别为不同初始pH、Pb2+浓度下LYF12对Pb2+固定率的差异和变化.
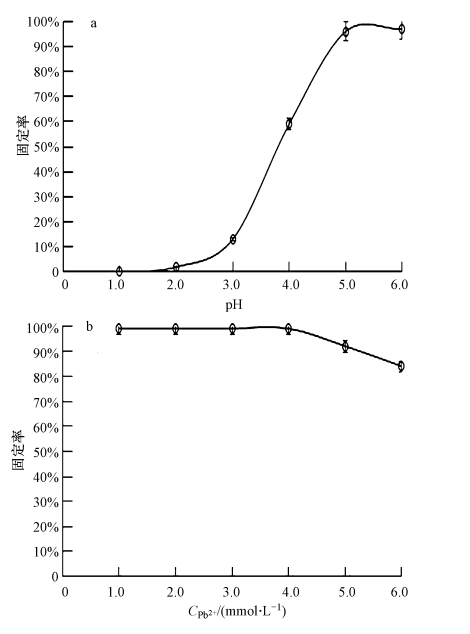 |
| 图 5 不同pH、初始Pb2+浓度条件下LYF12对Pb2+的固定率 Fig. 5 Fixation rate of LYF12 to Pb2+ at different pHs and initial concentrations of Pb2+ |
初始pH在1~3范围内,LYF12对Pb2+的固定率很低,可能因为酸性环境中存在大量质子,使菌体胞壁质子化,在静电排斥力影响下Pb2+难以和细胞壁结合;也可能与酸性较强时,LYF12的生物量较低有关系.pH高于3,LYF12对Pb2+的固定率与pH呈正相关,pH增至5时固定率达到最大值,99%.这一现象可能与pH较高时,菌体表面负电荷增多,Pb2+更容易被吸附于细胞壁且此时生物量增高有关.该现象和镰刀菌(杨亮等,2012;周薇等,2009;潘蓉等,2010)、酵母菌(韩润平等,2000)、白腐真菌(吴涓等,1999)所出现情况类似,在一定范围内随pH的升高相关菌株对Pb2+的固定作用增强.同时需要注意的是,在初始pH高于6.5时,培养基中Pb2+浓度的降低不是全部由生长于其中的微生物所引起的.pH影响微生物对Pb2+的固定,只有在其最适合pH范围内,菌株才能更好地固定其生长环境中的Pb2+.已有较多菌种固定Pb2+的最适pH范围被揭示,如镰刀菌固定Pb2+的最适pH为5.5(杨亮等,2012),短小芽孢杆菌为6(任广明和曲娟娟,2010),浮游球衣菌为5.5(秦玉春等,2005),黑根霉菌为5(顾超等,2003)等.
当pH为5,初始Pb2+浓度在1~4 mmol · L-1范围内时,LYF12对Pb2+的固定率都可达99%;当初始Pb2+浓度超过4 mmol · L-1时,固定率开始缓慢下降,6 mmol · L-1时固定率下降至81%,这和该初始Pb2+浓度下微生物的生物量下降趋势相符合.该现象与 Norcardia amarae(朱一民等,2003)和 Fusarium sp.(杨亮等,2012)在随Pb2+浓度升高而固定率(吸附率)下降的特性相似.
3.3 LYF12固定Pb2+的微观研究LYF12能够有效地固定Pb2+.为研究LYF12固定Pb2+后,Pb2+在细胞内、外的赋存位点、赋存形式,2.4.6节实验中将固定Pb2+后的菌体进行固定、包埋、切片在TEM下进行观察、研究(图 6).
 |
| 图 6 LYF12细胞吸附Pb2+后的电子显微图像 Fig. 6 Electron micrographs of LYF12 cell after adsorbing Pb2+ |
图 6a为LYF12菌体切片TEM照片(TEM模式下拍摄),可见胞内部赋存大量含铅物质(EDX数据见图 6d),几乎占满整个细胞内部.细胞壁外也有少量含铅物质附着.胞内含铅物质的选区电子衍射研究表明该物质是某种矿物集合体(图 6b).囿于数据不足,目前只能据其电子衍射图的特征,判断其为某种含铅的矿物集合体,其物相、晶体结构尚不明确.图 6c是LYF12菌体切片STEM照片,STEM模式下,细胞任意部位的亮度与该部位的Pb2+含量呈正相关.图 6c显示,Pb2+被LYF12固定(或吸附)后,主要以含铅矿物集合体的形式赋存于胞内,仅少量赋存于胞外.图 6d为6c区域1的EDX谱图,其元素组成主要有C、O、Pb等.由于该集合体检出于细胞内部,C、O的谱峰,不可能仅由其产生,故其元素比例需进一步研究才能准确得出.
3.4 不同能量供应水平下LYF12对Pb2+的吸附根据是否需要能量,胞外物质(小分子)进入细胞的方式分为主动运输和被动运输(翟中和等,2011).真菌是化能异养型生物,其生命活动所需能量是通过呼吸作用氧化葡萄糖之类的有机物所获得的(贺运春,2008).真菌可以进行有氧呼吸也可以进行无氧呼吸,有氧呼吸的能量效率约是无氧呼吸的15倍(王镜岩等,2002).2.4.8节研究了a无氧、b有氧、c有氧且添加能源物质等不同条件下LYF12菌体对Pb2+的吸附.尚无证据证明LYF12可以进行无氧呼吸,即使可以,无氧条件下LYF12的ATP生产速率、产量也小于有氧条件下.同为有氧条件下,环境中添加能源物质时LYF12的ATP产量应比无能源物质添加时高.综上所述,上述3种情况下,LYF12的能量供应水平应为a<b<c.
以2.4.8节中各时刻Pb2+的吸附率为纵坐标,时间为横坐标进行作图,如图 7所示.图 7中a为无氧条件下LYF12对Pb2+的吸附率曲线;b为有氧条件下LYF12对Pb2+的吸附率曲线;c为有氧且添加葡萄糖条件下LYF12对Pb2+的吸附率曲线.无氧时,LYF12对Pb2+的吸附率最高仅可达到2.1%;仅有氧时,0~30 min内吸附率与吸附时间呈线性升高,约40 min时达到最大值,28.6%;有氧且添加能源物质时,0~10 min内,LYF12对Pb2+的吸附率和仅有氧存在时的吸附率差别不大,10~50 min,添加葡萄糖的LYF12对Pb2+的吸附率迅速升高,50~80 min增速减缓,在第80 min达到97.7%,与同浓度Pb2+培养基中LYF12对Pb2+的固定率相符(3.2节).由此可见,Pb2+进入LYF12细胞,并在细胞内固定下来的整个过程与能量供应水平密切相关.由此,可以判断Pb2+跨过细胞膜进入LYF12细胞是耗能的,可能是一个主动运输过程.当然,主动运输除需耗费能量外还需要载体蛋白的参与,在LYF12细胞膜上是否存在Pb2+的专一性载体,或者能够与其它离子竞争,借助其它离子的载体进入细胞还有待于进一步的研究.
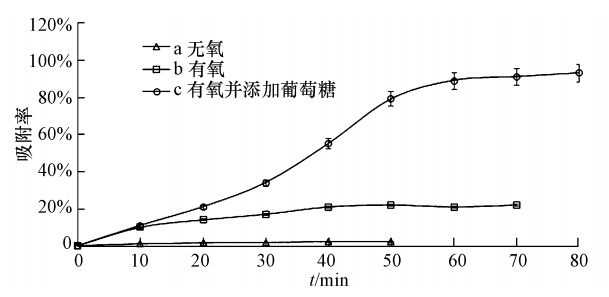 |
| 图 7 不同能量供应水平下LYF12对Pb2+的吸附率 Fig. 7 Adsorption rate of strain LYF12 to Pb2+ on different energy levels |
有研究者认为菌体对Pb2+的固定包括:菌体代谢产物对环境中Pb2+的沉淀、络合等作用和菌体对Pb2+的吸附作用(杨亮等,2012).本文2.4.7节证实:菌体吸附Pb2+后赋存于胞内、胞外等不同部位(图 6c).综上所述,微生物固定环境中的Pb2+通过2条途径,储存于3个部位:①Pb2+被微生物代谢产物沉淀、络合,沉积于培养基底部; ② 通过静电吸附或细胞表面的某些活性物质的吸附作用,Pb2+被吸附并赋存于细胞表面; ③ 通过某些生理作用,一部分被吸附于细胞表面的Pb2+被转运至细胞内部,并以矿物、集合体或其他形式储存于细胞内部.
潘蓉等发现相同条件下青霉菌和镰刀菌对Pb2+的吸附量不同,不同培养基培养的镰刀菌菌体对Pb2+的吸附量也不相同(潘蓉等,2010).尚无文献报道Pb2+被微生物吸附后,Pb2+在上述3个部位的分布、比例,该3个部位赋存Pb2+的含量、比例可能随菌种、生理状态等不同有所不同.其中,微生物细胞表面能吸附的Pb2+量与其表面活性位点的数量、密度应有直接关系,而这些活性位点在细胞表面的数量、密度在不同菌种中可能会有较大差别.
本文证实,LYF12吸附Pb2+的过程中,首先通过静电吸附或离子交换等作用将Pb2+吸附于细胞表面,之后通过某些生理、生化作用转运至细胞内部,在细胞内通过某些反应将之转化为含铅矿物集合体固定下来.以上过程中,环境中的游离Pb2+,细胞表面的Pb2+以及胞内的Pb2+应处于动态平衡状态,若Pb2+从细胞表面转运至胞内的生理、生化作用被阻断,当细胞表面活性物质对Pb2+的吸附达到饱和,细胞将停止对Pb2+的吸附.在此情况下,菌体对Pb2+的吸附量仅由其细胞表面活性物质的数量、密度决定.根据实验现象,本文3.4节推测Pb2+从LYF12胞外转移到胞内的过程可能为主动运输(或某种耗能生理作用).无氧条件下,LYF12能量供应水平较低,甚至能量供应途径缺失,Pb2+从细胞膜转移到胞内的主动运输作用(或某种耗能生理作用)将被阻断或效率大大降低.图 6a、6c显示,相对于胞内,LYF12胞外活性物质对Pb2+的吸附量很小,与图 7a曲线显示无氧条件下,LYF12对Pb2+的吸附率最高仅为2.1%相符.
本文2.4.8节研究了环境中无氧、有氧和有氧且添加能源物质等不同能量供应水平下,LYF12对Pb2+吸附率的差别,能量供应水平密切影响LYF12对Pb2+的吸附作用.许多研究者借鉴无机材料吸附Pb2+的研究方法,探索、研究微生物对Pb2+的吸附量、吸附等温曲线等(韩润平等,2000;朱一民等,2003;陈吉群,2003;顾超等,2003;潘蓉等,2010;杨亮等,2012).通过这些研究得到大量的数据,为揭示微生物固定Pb2+的作用机制奠定了基础.但是,这些研究的方法一般都是将菌体浸入一定浓度的Pb2+溶液中,然后通过测定溶液中Pb2+浓度的降低而计算出“吸附率”,不考虑菌体的能量供应水平.本文2.4.8节实验已经证实,在不同的能量供给水平下,微生物对于Pb2+的吸附率或吸附量是有极大差异的.不考虑菌体的能量供应水平或者代谢方式去研究所分离到的菌株对Pb2+的吸附,并以此为基础得到的结论可能与菌株对Pb2+的真实吸附能力是有偏差的.因为,不同于磷灰石、电气石等无机材料,微生物作为一种有机活体材料,其各种生理活动(包括吸附或固定Pb2+)与其能量代谢作用均有密切关系,只有在能量供应充足的情况下,菌株对Pb2+的吸附才能达到最高水平.
5 结论(Conclusions)1)菌株LYF12(KJ569519)经形态观察、生理生化和18S rRNA鉴定为塔宾曲霉.
2)菌株LYF12(KJ569519)在pH 2~10范围内可以生长,其最适pH值为5~6.LYF12有较强的铅耐受能力,在Pb2+浓度高达6 mmol · L-1时仍可达到约26 g · L-1的生物量.
3)菌株LYF12(KJ569519)能够将Pb2+转移到细胞内部,以含铅矿物集合体的形式固定下来.对Pb2+有较强的固定能力,在Pb2+浓度低于4 mmol · L-1时,对Pb2+的固定率可高达99%以上,在Pb2+浓度高达6 mmol · L-1时仍可达到约81%.
4)Pb2+进入LYF12细胞过程与其能量代谢密切相关,其透过细胞膜进入LYF12细胞的运输方式可能是主动运输.
| [1] | Amini M, Younesi H, Bahramifar N, et al. 2008. Application of response surface methodology for optimization of lead biosorption in an aqueous solution by Aspergillus niger[J]. Journal of Hazardous Materials, 154(1/3): 694-702 |
| [2] | Petr B. 2003. Interactions of heavy metals with white-rot fungi [J]. Enzyme and Microbial Technology, 32(1): 78-91 |
| [3] | 陈吉群. 2003. 耐铅优势菌的筛选及其吸附应用研究[D]. 大连: 大连理工大学 |
| [4] | Dursun A Y, Uslu G, Cuci Y, et al. 2003. Bioaccumulation of copper (II), lead (II) and chromium (VI) by growing Aspergillus niger [J]. Process Biochemistry, 38(12): 1647-1651 |
| [5] | 冯福建, 王兰, 虞江萍, 等. 2001. 我国铅污染的时空走势[J]. 辽宁工程技术大学学报(自然科学版), 20(6): 840-843 |
| [6] | 顾超, 何池全, 李蕾. 2003. 黑根霉菌自由细胞和固定化细胞对重金属铅的生物吸附[J]. 污染防治技术, 16(4): 205-206 |
| [7] | 韩磊, 张恒东. 2009. 铅、镉的毒性及其危害[J]. 职业卫生与伤病, 24(3): 173-178 |
| [8] | 韩润平, 石杰, 鲍改玲. 2000. 酵母菌对铅离子的生物吸附研究[J]. 河南科学, 18(1): 52-55 |
| [9] | 贺运春. 2008. 真菌学[M]. 北京: 中国林业出版社. 45-46 |
| [10] | Kumar R, Bhatia D, Singh R, et al. 2011. Sorption of heavy metals from electroplating effluent using immobilized biomass Trichoderma viride in a continuous packed-bed column [J]. International Biodeterioration & Biodegradation, 65(8): 1133-1139 |
| [11] | 李维焕, 于兰兰, 程显好, 等. 2011. 两种大型真菌菌丝体对重金属的耐受和富集特性[J]. 生态学报, 31(5): 1240-1248 |
| [12] | 刘英俊, 曹励明. 1984. 元素地球化学[M]. 北京: 科学出版社. 295-303 |
| [13] | 潘蓉, 曹理想, 张仁铎. 2010. 青霉菌和镰刀菌对重金属Cd2+、Cu2+、Zn2+和 Pb2+的吸附特性[J]. 环境科学学报. 30(3): 477-484 |
| [14] | 齐祖同. 1997. 中国真菌志-第五卷-曲霉属及其相关有性型[M]. 北京: 科学出版社. 103-105 |
| [15] | 钱存柔, 黄仪秀. 2008. 微生物学实验教程[M]. 北京: 北京大学出版社, 113-130 |
| [16] | 秦玉春, 关晓辉, 魏德洲, 等. 2005. 浮游球衣菌的分离及其对铅离子的吸附性能[J]. 东北大学学报, 26(7): 687-690 |
| [17] | 任广明, 曲娟娟. 2010. 铅抗性细菌的分离及吸附性能研究[J]. 东北农业大学学报, 41(2): 55-59 |
| [18] | Sayer J A, Kierans M, Gadd G M, et al. 1997. Solubilisation of some naturally occurring metal-bearing minerals, limescale and lead phosphate by Aspergillus niger[J]. FEMS Microbiology Letters, 154(1): 29-35 |
| [19] | 沈薇, 杨树林, 李校堃, 等. 2006. 木霉 (Trichoderma sp.)HR-1活细胞吸附Pb(Ⅱ)的机理[J]. 中国环境科学, 26(1): 101-105 |
| [20] | Wang J L, Zhan X M, Ding D C, et al. 2001. Bioadsorption of lead (II) from aqueous solution by fungal biomass of Aspergillus niger [J]. Biotechnology, 87(3): 273-277 |
| [21] | 王镜岩, 朱圣庚, 徐长法. 2002. 生物化学(下册)[M]. 北京: 高等教育出版社. 80-141 |
| [22] | 吴涓, 洪丽玉. 1999. 白腐真菌吸附铅的研究[J]. 微生物学报, 39(1): 87-90 |
| [23] | 杨金燕, 杨肖娥, 何振立. 2005. 土壤中铅的来源及生物有效性[J]. 土壤通报, 36(5): 765-773 |
| [24] | 杨亮, 郝瑞霞, 吴沣, 等. 2012. 耐受铅真菌的筛选及其对Pb2+吸附的初步研究[J]. 环境科学学报, 32(10): 2366-2374 |
| [25] | 尹利利, 臧淑艳, 侯雪敏, 等. 2013. 黑曲霉对含铅废水的生物吸附研究[J]. 沈阳化工学院学报, 27(1): 15-19 |
| [26] | 翟中和, 王喜忠, 丁明孝. 2011. 细胞生物学[M]. 北京: 高等教育出版社. 68-76 |
| [27] | 周薇, 张小平, 康纪婷. 2009. 从矿区土壤中筛选微生物对Pb2+、Zn2+吸附的研究[J]. 环境工程学报, 3(10): 1906-1911 |
| [28] | 朱一民, 周东琴, 魏德洲. 2003. Norcardia amarae菌体对水相中Pb2+的吸附特性[J]. 东北大学学报(自然科学版), 24(10): 978-981 |
| [29] | Zeng G M, Huang D L, Huang G H, et al. 2007. Composting of lead-contaminated solid waste with inocula of white-rot fungus[J]. Bioresource Technology, 98(2): 320-326 |
 2015, Vol. 35
2015, Vol. 35


