2. 龙口市水产技术推广站, 龙口 265700
2. Fisheries Technical Extension Station of Longkou, Longkou 265700
近年来,我国近海海域富营养化现象日趋严重,每到春、夏两季,有害绿潮(大型海藻藻华)频繁暴发(Khan et al,2014).大型绿藻的大量滋生及死亡分解成为水体环境的重要负荷(Chen et al,2002).在藻华暴发区域,藻体衰亡可直接影响水体pH值、溶解氧及氮磷含量,已成为一个潜在污染源(Frossard et al,2014).因此,虽然对生活和工业点源污染进行了有效控制,但水体富营养化现状却并未得到明显改善(Balasubramanian et al,2012).藻体分解过程包括机械破碎(扰动、天气或其他机制)、可溶性有机物的浸出或自溶,以及细菌和真菌作用下植物组织的分解(Brinson et al,1981).这些过程受到许多因素的影响,其中,藻体的性状及环境因素被认为是影响藻体分解速率的主要因素(Frossard et al,2014).Chuai等(2011)研究表明,温度、扰动和光照等环境因素对蓝藻分解均有显著影响.Gao等(2013a)在对硬毛藻的研究中表明,硬毛藻分解与沉积物的“源汇”作用关系密切.水文环境对水生植物的衰亡分解的影响是十分复杂的问题,目前有关藻类分解已有很多研究(Ólafsson et al,2013;Lemley et al,2014;Wyatt et al,2014),但关于不同环境因素及其交互作用对硬毛藻分解的影响报道较少.
硬毛藻是一种大型丝状绿藻,为大型海藻藻华优势种之一.硬毛藻在分类上属于绿藻门(Chlorophyta)、绿藻纲(Chlorophyceae)、刚毛藻目(Cladophorale)、刚毛藻科(Cladophoraceae).该藻在山东荣成境内的天鹅湖中常年滋生,每到春、夏季节在全湖范围内大量暴发,严重影响当地渔业生产.因此,本试验采用分解袋法,通过室内模拟探讨硬毛藻在温度、曝气和沉积物三因素作用下分解速率及藻体磷释放率的变化特征,以期为天鹅湖水体富营养化的治理和绿潮控制提供一定的科学依据.
2 材料与方法(Materials and methods) 2.1 样品采集2013年10月,在天鹅湖硬毛藻暴发区域(37°21.447′N,122°34.301′E)用抓斗式采泥器采集表层(0~10 cm)沉积物、生长良好的硬毛藻和表层湖水.样品运回实验室,沉积物去除动植物残体和砾石后,混匀冷藏(2 ℃)备用,并测定pH、磷含量等理化性质.硬毛藻去除藻体表面的附生植物,洗净后全部冷冻(-20 ℃,48 h)杀死,备用.湖水过滤备用,其基本理化性质如下:pH为8.07,盐度为31‰,总磷、可溶性磷分别为0.057 mg · L-1和0.001 mg · L-1.
2.2 试验设计根据天鹅湖湖水常年温差,设置5个温度水平:10、15、20、25、30 ℃;2个曝气水平:曝气、未曝气;2个沉积物水平:含沉积物、无沉积物.每个温度、曝气和沉积物水平组合处理,共计20个处理,每处理3个重复.
试验在透光玻璃缸(长20 cm、宽30 cm、高20 cm)中进行.硬毛藻冷冻处理后,将死亡藻体剪碎放入尼龙袋(100目,10 cm×10 cm)中,每袋装入10.00 g,每玻璃缸放入14袋; 沉积物处理:采用冷藏的沉积物2.50 kg均匀铺满玻璃缸底;曝气处理:使用固定出气量的充气泵.所有处理均在光照培养箱中进行,光照强度为100 μmol · m-2 · s-1(以photons计),光周期为12 h ∶ 12 h(光昼比),试验周期为14 d.试验过程中,每日取样,监测藻体剩余生物量、含水量及磷含量变化.
2.3 分析方法藻体含水量测定:90 ℃杀青后(30 min),60 ℃烘至恒重;藻体磷含量测定:烘干后的藻体经H2O2-H2SO4消解后,钼锑抗分光光度法测定.分解速率采用Olsen的指数衰减模型计算(Olson,1963):

式中,M0和Mt分别为藻体初始干重和分解结束后藻体干重(g),t为分解时间(d),k为分解速率(d-1).
藻体磷释放率的计算公式如下:
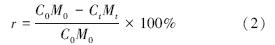
式中,C0、Ct分别为试验初始和分解结束时藻体中总磷含量(mg · g-1),M0、Mt分别为试验起始和分解结束时的藻体干重(g),t为分解时间(d),r为藻体磷释放率.
2.4 数据分析数据分析采用SPSS 19.0统计分析软件进行,数据分析之前进行方差齐性检验.采用重复测量方差分析检验3种环境因素对硬毛藻分解过程中生物量的影响.进行温度、曝气和沉积物的三因素方差分析,检验3种环境因素及其交互作用对分解速率的影响.采用Partial eta square(η2)完成各因素效应值估量,Tukey′s检验进行多重比较,以p<0.05表示差异显著.
3 结果与分析(Result and analysis) 3.1 温度、曝气和沉积物对分解过程中剩余生物量的影响温度、曝气和沉积物对藻体分解均产生了显著影响(表 1).试验结束时,各处理生物量降至0.21~0.67 g(图 1).在第6 d时,高温条件(20、25、30 ℃)下藻体的剩余生物量显著(p<0.05)低于低温条件(10、15 ℃),且生物量的降幅随温度梯度的上升而增加(图 1a),表明高温条件对藻体分解有明显促进作用.第8 d时,低温无沉积物条件下,曝气处理较未曝气处理生物量显著下降(图 1a、c);含沉积物条件下,曝气处理生物量最大降幅高出未曝气处理12.69%(图 1b、d),表明低温下曝气加速了藻体分解.试验后期,曝气对生物量影响并不明显.究其原因可能为物理碎裂在试验前期藻体分解过程中起主导作用,曝气引起的水流扰动加剧了藻体分解,后期随着藻体物理性状的改变,厌氧条件下较为活跃的异化、融溶等生化作用逐渐使曝气的影响降低(Wang et al,2012).试验末,含沉积物处理生物量最大降幅达56.01%,显著高于无沉积物处理(T检验,p<0.01),表明沉积物对剩余生物量也具有显著影响.试验后期(10~14 d),含沉积物的高温处理组中,由于藻体分解较为彻底,物理性状逐渐由独立丝状体变成黏稠胶状体,并沉入水底,表面吸附少量沉积物颗粒,致使生物量有所上升.
| 表1 重复测量方差分析检验温度、沉积物和曝气对硬毛藻生物量的影响 Table 1 Repeated measures ANOVA for effects of temperature,sediment and aeration on biomass of Chaetomorpha sp |
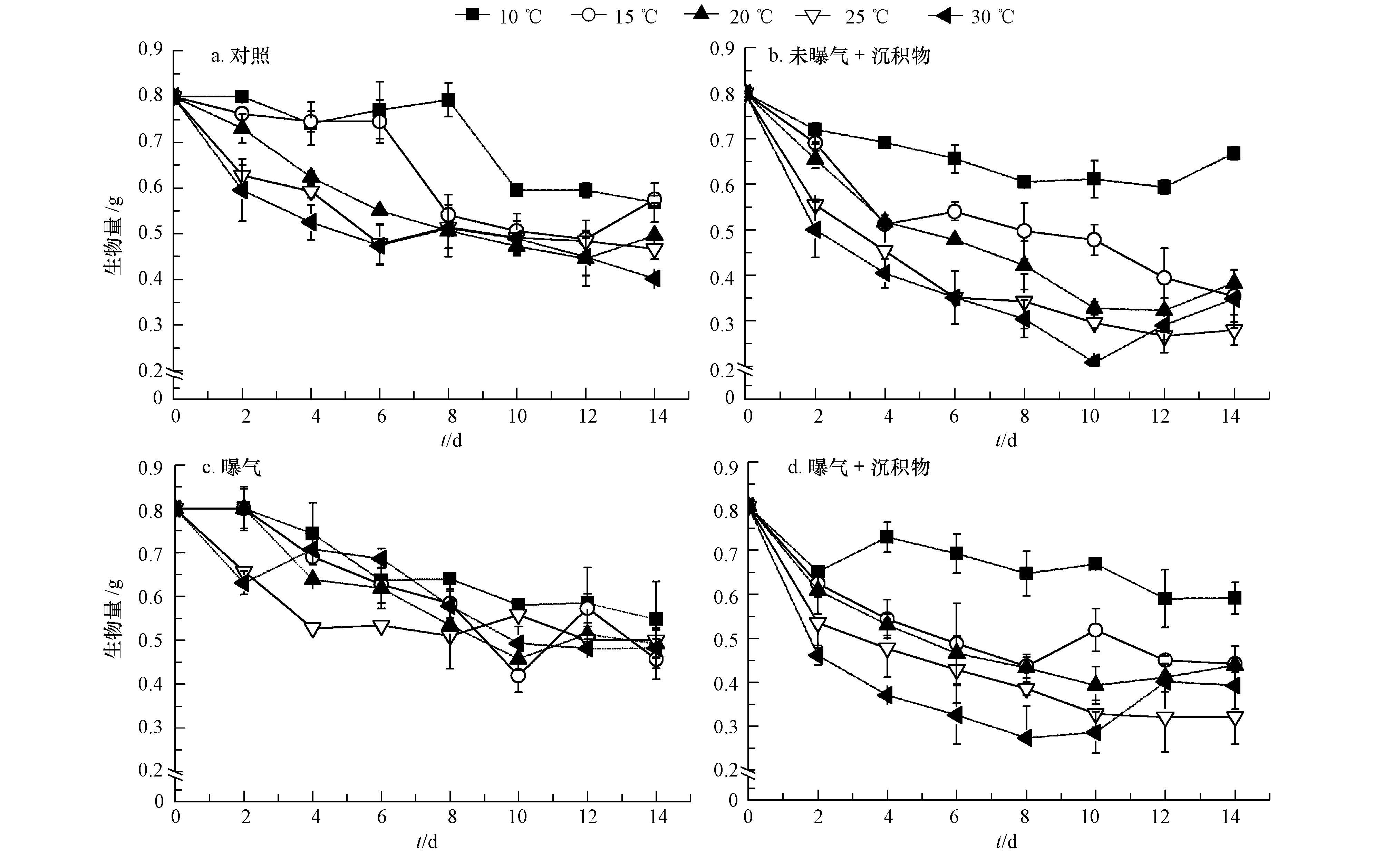 |
| 图 1 硬毛藻在不同温度、沉积物和曝气条件下生物量的动态变化 Fig. 1 Dynamic changes of biomass of Chaetomorpha sp. exposed to various temperatures,sediments and aerations |
重复测量方差分析表明(表 1),时间对藻体生物量的影响达极显著水平(p<0.01),为避免时间对其他因素协同效应的影响,故采用组间数据进行分析.未曝气条件下,不同温度含沉积物处理藻体生物量降幅依次为:30 ℃>25 ℃>20 ℃>15 ℃>10 ℃(图 1),且除10 ℃外,同一温度处理下含沉积物处理均显著低于无沉积物处理(p<0.05),表明高温和沉积物的交互作用促进了硬毛藻的分解.在低温无曝气海水中,生物量前期变化并不明显,但同样温度的曝气组生物量明显降低(图 1a、c),这是由于受到了曝气与温度的交互作用影响.各处理对藻体剩余生物量的影响效应依次为:温度>沉积物>温度×沉积物>温度×曝气>曝气>温度×沉积物×曝气>沉积物×曝气(表 1).
3.2 温度、曝气和沉积物对硬毛藻分解速率的影响在温度、曝气和沉积物三因素作用下,各处理在试验前期生物量变化幅度较明显,后期逐渐变缓(图 1),故选用试验前7 d的藻体分解速率进行方差分析.统计结果表明,温度和沉积物均对分解速率产生极显著影响,而曝气对分解速率的影响不显著(表 2).对5个温度水平进行多重比较,发现15 ℃和20 ℃水平间、25 ℃和30 ℃水平间差异不显著(Tukey′s tests,p=0.903,p=0.310),其他处理间差异达显著水平(p<0.05).当温度低于15 ℃时,硬毛藻分解缓慢;而在15~30 ℃范围内,分解速率随温度的升高基本呈增加趋势(曝气无沉积物组除外).与无沉积物处理相比,相同温度和曝气条件下,含沉积物处理分解速率均显著高于无沉积物处理(图 2).对有无沉积物处理进行独立样本T检验,结果表明,沉积物的存在显著提高了藻体分解速率(p<0.01).
除曝气与温度、温度与沉积物交互作用影响较大外(p<0.01),曝气与沉积物及三维交互作用均不显著(表 2).各因素对硬毛藻分解速率影响的效应大小依次为:温度>沉积物>温度×沉积物>温度×曝气>温度×曝气×沉积物>曝气>曝气×沉积物.
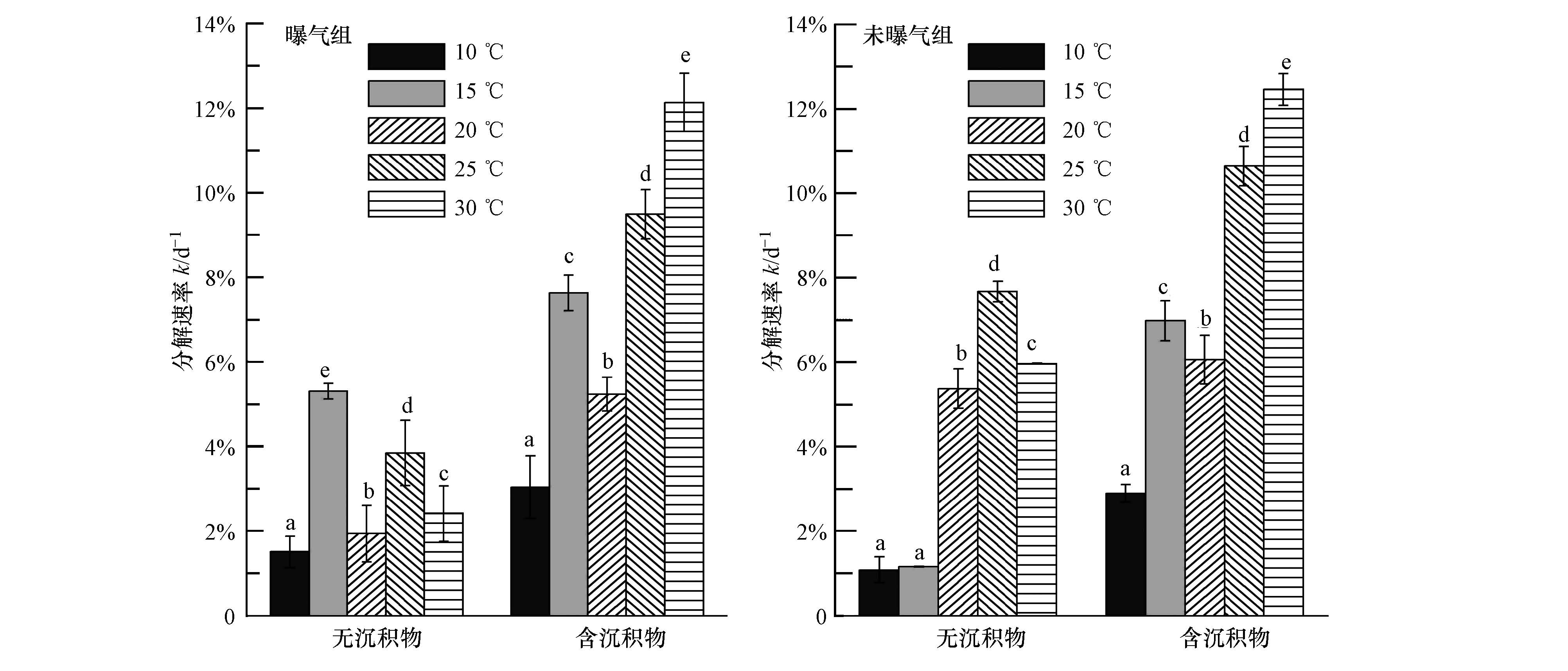 |
| 图 2 硬毛藻在不同温度、沉积物和曝气条件下的培养至7 d时的分解速率(小写字母表示在0.05水平上存在显著性差异) Fig. 2 Decomposition rate of Chaetomorpha sp. exposed to various temperatures,sediments and aerations after 7 days of decomposition |
| 表2 三因素方差分析检验温度、沉积物和曝气对硬毛藻分解速率的影响 Table 2 ANOVA for effects of temperature,sediment and aeration on decomposition rate of Chaetomorpha sp |
三因素方差分析表明,温度、曝气和沉积物对藻体磷释放率有显著影响(表 3).试验末,各处理藻体磷释放率变幅在7.88%~91.62%之间.相同温度和曝气条件下,含沉积物各处理的磷释放率均明显高于无沉积物处理(图 3),表明沉积物对藻体磷释放有明显促进作用.在30 ℃含沉积物处理中,未曝气处理的磷释放率最高为91.62%,高出曝气处理10.32%;同一温度和沉积物处理下,未曝气条件均明显低于曝气条件下的磷释放率,可见曝气不利于藻体磷释放.藻体磷释放率受温度的影响较为显著(p<0.01,η2=0.942),随温度升高,总体呈上升的趋势.
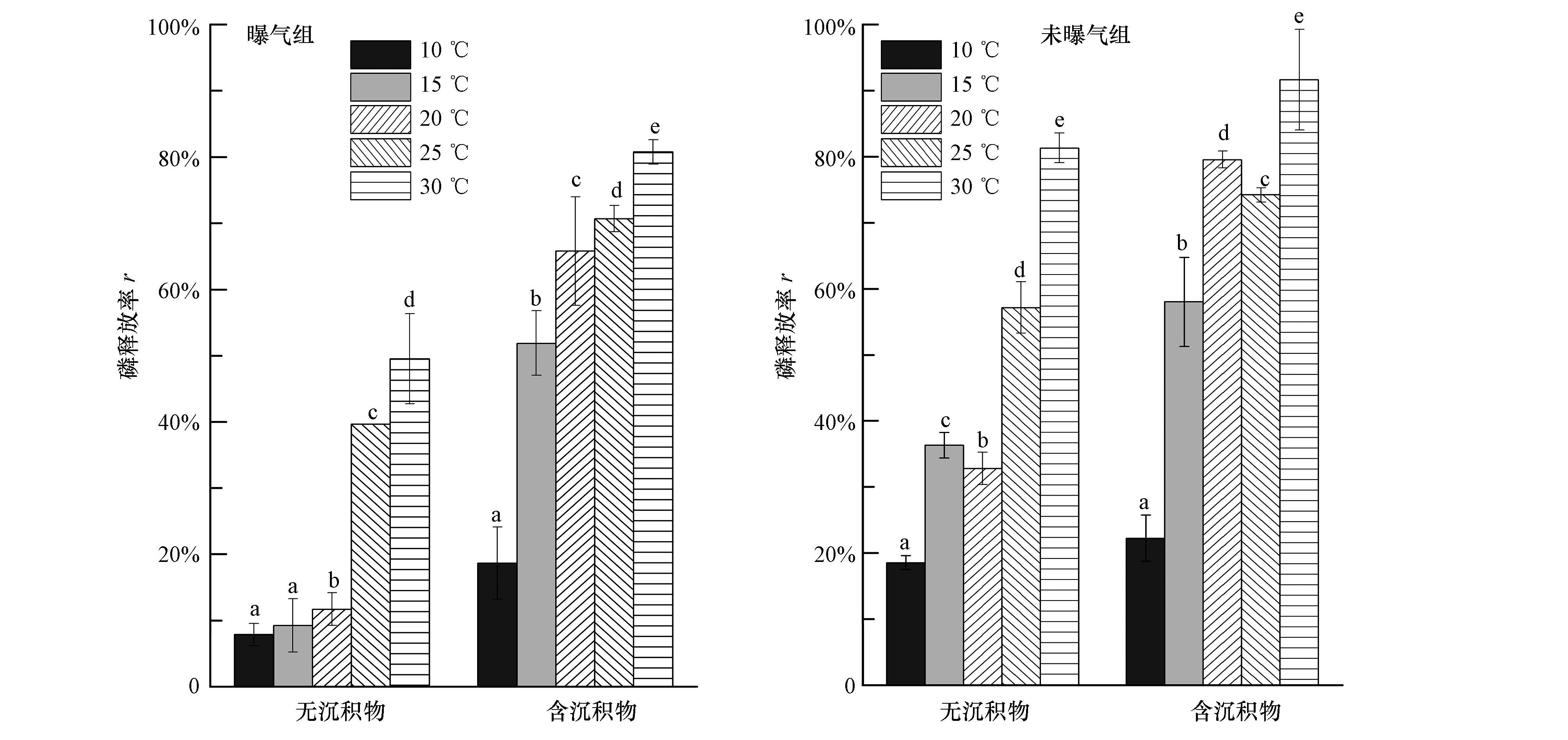 |
| 图 3 硬毛藻在不同温度、沉积物和曝气条件下分解14 d后的磷释放率 Fig. 3 Phosphorus release rate(r)of Chaetomorpha sp. exposed to various temperatures,sediments and aerations after 14 days |
温度、曝气和沉积物的交互作用对藻体磷释放率的影响同样显著.不同处理相比,含沉积物未曝气处理藻体磷释放率均大于其他处理,且不同温度处理间差异明显,表明同二维交互作用一样,三维交互作用也显著影响了释放率的变化(图 3).效应大小估计显示,不同因素作用对藻体磷释放率的影响大小依次为:曝气>温度>温度×沉积物>沉积物>温度×曝气×沉积物>温度×曝气>曝气×沉积物(表 3).
| 表3 三因素方差分析检验温度、沉积物和曝气对硬毛藻磷释放率的影响 Table 3 ANOVA for effects of temperature,sediment and aeration on phosphorus release rate of Chaetomorpha sp |
浮游藻类和水生高等植物是水生态系统中的两种重要初级生产者(Lee et al,1999),环境变化对藻体生长和分解均会产生明显影响.当藻体死亡后,失去附着和聚集能力,分布较成活藻体范围更大,因此,环境条件对分解过程影响更为显著(Deng et al,2012).本试验结果表明,硬毛藻死亡藻体在不同环境因子条件下的分解速率和磷释放率差异很大.
4.1 单一因素对硬毛藻分解和磷释放的影响硬毛藻的腐败分解包括其组织衰老和死亡后所有的物理和化学变化,其分解过程受诸多因素影响,其中温度尤为突出.Li等(2012)对马尾藻和菹草的研究表明,温度在水生植物机体分解过程中起主导作用,不同温度下水生植物分解有明显差异.这是由于温度会影响微生物活性,较高的温度有利于植物分解过程中好氧纤维素分解菌等的生长,能加快微生物分解植物残体,降低藻体剩余干物重(Thullen et al,2008;Bornette et al,2011).温度降低,微生物世代延长,碱性磷酸酶等生物活性降低,从而影响生物体内磷的释放率(Goecke et al,2013).本试验中,硬毛藻生物量随温度的上升降幅逐渐加大,在高温条件下分解速率显著高于低温条件(p<0.05),且二者藻体磷释放率最大差值高达83.74%,这与Lemley(2014)在温度对3种大型水生植物分解影响的研究结果一致.
曝气是影响藻类分解的另一因素,其对藻体磷释放的影响表现在溶解氧和水动力扰动两个方面.Genoves等(2013)研究表明,水动力扰动下,水体中有机聚合体的丰度会增加,并降低其沉降速率,增加悬浮时间.对于一些主要来源于藻体降解产生的有机聚合体,扰动会使其有机质含量和营养盐含量变化出现明显下降(李柯等,2011).Rejmánková等(2007)认为,好氧型纤维素菌对沉水植物的分解起到重要的作用,而低溶解氧将会抑制植物分解过程中重要的好氧型纤维素分解菌等的生长.同时Johnson等(2006)指出,氧的存在可有效控制有机碳的转化率,有机碳的分解在好氧条件下较迅速,而在低氧条件,有机碳只是缓慢的代谢.本试验前期(0~5 d),曝气处理硬毛藻生物量显著下降、分解速率明显高于未曝气处理现象证实了这点.而王博等(2013)对黑藻分解的研究发现,好氧条件对藻体磷释放影响不大.本试验结束时,曝气处理藻体磷释放率总体低于未曝气处理,究其原因为曝气增加了水体溶解氧含量,使磷细菌的磷释放速率小于磷吸收速率,而厌氧条件下磷细菌利用有机物释放磷,从而促进了藻体营养盐的释放(Balasubramanian et al,2012).
沉积物在硬毛藻分解过程中起到决定性作用.一方面,微生物等分解者是影响藻体分解的主要因素,其他因素多是通过影响分解者的活性发挥作用(Proia et al,2012).沉积物中含有大量的微生物和生物活性酶类,其存在能有效促进以生物降解为主的藻体分解(Goecke et al,2013).另一方面,沉积物的“汇”作用能有效吸附水体磷素(Gao et al,2013b),降低水体营养化水平,刺激磷细菌、硝化细菌及碱性磷酸酶活性,加速藻体分解.本试验结果表明,沉积物的存在明显加速了硬毛藻的分解,具体表现为:沉积物促进了藻体生物量减少,提高了藻体分解速率及磷释放率.本试验材料选用冷冻处理的硬毛藻,藻体细胞膜上的类脂蛋白复合体在冷冻中易发生破坏引起胞膜通透性的改变,使细胞内容物部分丧失(Adam et al.,2014),故试验结果可能与野外实际情况有所差异.在后期研究中,野外数据与室内模拟有待于进一步结合.
4.2 不同环境因子交互作用下硬毛藻分解及磷释放的差异一般认为,大部分水生植物经历了生长期后,进入秋、冬寒冷季节,植物体会死亡并释放出氮、磷等营养物质,造成二次污染(Alvarez et al,2006;Lill et al,2012).但本文结果显示,硬毛藻死亡藻体在低温下(10~15 ℃)腐败分解缓慢,生物量降幅较小,向水体中释放营养盐量并不大,不会直接造成水质恶化.Chimney等(2006)通过在低温下放置水生植物残体促进区域环境内反硝化作用,处理高硝氮水体,其原理与本文上述结果相符.当环境温度在20 ℃以上时,藻体分解速率会显著增加,且在沉积物的促进作用下向水体释放大量磷素.因此,硬毛藻在秋、冬季逐渐进入衰亡期时,藻体的死亡分解过程较为缓慢,大部分营养盐还保留在藻体中,向水体释放的营养盐有限,短时间内并不会对水质造成严重危害,此时应提前做好清淤工作.当湖水回暖后,风浪和沉积物的联合互作会使水体中微生物和生物酶类开始活动而加速分解,从而造成营养盐大量释放.藻体较低的分解速率可以扼制营养盐的循环,但藻体密度过大且环境适宜时,极易促进藻体厌氧分解,提高水体营养化水平(Frossard et al,2014),成为下一次藻华暴发的诱因.天鹅湖与外海相通,湖水盐度为29‰~32‰,与黄渤海海水相近,其结果可适用于临近海域.
综上所述,大型藻类的衰亡分解受环境因素的影响比较复杂,适量的植物体残留不会使水质严重恶化,其相对较小的腐烂分解速率有利于降低营养盐的循环速度,对控制水体富营养化比较有利.因此,恢复重建一定数量的藻体改善水质,修复受损的水体环境是较好的途径.但是,必须控制藻体的残留生物量,在适当时间及时加以清除,以避免过多的衰亡藻体在温度升高时大量分解,造成水质恶化.
5 结论(Conclusions)在本试验条件下,温度是影响硬毛藻初期分解的首要因素.高温条件(20~30 ℃)和沉积物存在均能促进藻体生物量明显下降、分解速率加快,低温(10~15 ℃)和曝气条件下藻体分解速率较小.温度、沉积物和曝气对硬毛藻衰亡藻体磷释放均有显著影响,高温和沉积物能有效提高藻体磷释放率,曝气可抑制藻体磷释放.当气温较高时,应及时对硬毛藻进行清理,以免因藻体分解造成水质恶化.
| [1] | Adam S, Murthy S D S. 2014. Effect of Cold Stress on Photosynthesis of Plants and Possible Protection Mechanisms//Gaur R K. Approaches to Plant Stress and their Management[M]. India: Springer. 219-226 |
| [2] | Alvarez J A, Becares E. 2006. Seasonal decomposition of Typha latifolia in a free-water surface constructed wetland[J]. Ecological Engineering, 28(2): 99-105 |
| [3] | Balasubramanian D, Arunachalam K, Das A K, et al. 2012. Decomposition and nutrient release of Eichhornia crassipes(Mart.) Solms. under different trophic conditions in wetlands of eastern Himalayan foothills[J]. Ecological Engineering, 44: 111-122 |
| [4] | Bornette G, Puijalon S. 2011. Response of aquatic plants to abiotic factors: a review[J]. Aquatic Sciences, 73(1): 1-14 |
| [5] | Brinson M M, Lugo A E, Brown S. 1981. Primary productivity, decomposition and consumer activity in freshwater wetlands[J]. AnnuRevEcol Syst, 12: 123-161 |
| [6] | Chen J N, Zhang T Z, Du P F. 2002. Assessment of water pollution control strategies: a case study for the Dianchi Lake[J]. Journal of Environmental Sciences, 14(1): 76-78 |
| [7] | Chimney M J, Pietro K C. 2006. Decomposition of macrophyte litter in a subtropical constructed wetland in south Florida (USA)[J]. Ecological Engineering, 27(4): 301-321 |
| [8] | Chuai X M, Ding W, Chen X F, et al. 2011. Phosphorus release from cyanobacterial blooms in Meiliang Bay of Lake Taihu, China[J]. Ecological Engineering, 37(6): 842-849 |
| [9] | Deng Y Y, Tang X R, Huang B X, et al. 2012. Effect of temperature and irradiance on the growth and reproduction of the green macroalga, Chaetomorpha valida (Cladophoraceae, Chlorophyta)[J]. Journal of Applied Phycology, 24(4): 927-933 |
| [10] | Frossard V, Versanne-Janodet S, Aleya L. 2014. Factors supporting harmful macroalgal blooms in flowing waters: A 2-year study in the Lower Ain River, France[J]. Harmful Algae, 33: 19-28 |
| [11] | Gao L, Zhang L H, Hou J Z, et al. 2013a. Decomposition of macroalgal blooms influences phosphorus release from the sediments and implications for coastal restoration in Swan Lake, Shandong, China[J]. Ecological Engineering, 60: 19-28 |
| [12] | Gao L, Wei Q, Fu F, et al. 2013b. Influence of outbreak of macroalgal blooms on phosphorus release from the sediments in Swan Lake Wetland, China[J]. Plant Biosystems, 147(4): 1175-1183 |
| [13] | Genovesi B, Mouillot D, Laugier T, et al.2013.Influences of sedimentation and hydrodynamics on the spatial distribution of Alexandrium catenella tamarense resting cysts in a shellfish farming lagoon impacted by toxic blooms[J]. Harmful Algae, 25: 15-25 |
| [14] | Goecke F, Thiel V, Wiese J, et al.2013.Algae as an important environment for bacteria-phylogenetic relationships among new bacterial species isolated from algae[J]. Phycologia, 52(1): 14-24 |
| [15] | Johnson S E, Angeles O R, Brar D, et al.2006.Faster anaerobic decomposition of a brittle straw rice mutant: implications for residue management[J]. Soil Biol Biochem, 38(7): 1880-1892 |
| [16] | Khan F A, Naushin F, Rehman F, et al.2014.Eutrophication: Global Scenario and Local Threat to Dynamics of Aquatic Ecosystems//Abid A A. Eutrophication: Causes, Consequences and Control[M]. Netherlands: Springer. 17-27 |
| [17] | Lee K S, Dunton K H.1999.Inorganic nitrogen acquisition in the seagrass Thalassia testudinum: Development of a whole-plant nitrogen budget[J]. Limnology and Oceanography, 44(5): 1204-1215 |
| [18] | Lemley D A, Snow G C, Human L R D.2014.The decomposition of estuarine macrophytes under different temperature regimes[J]. Water SA, 40(1): 117-124 |
| [19] | Li D M, Chen L M, Chen S L, et al.2012.Comparative evaluation of the pyrolytic and kinetic characteristics of a macroalga (Sargassum thunbergii) and a freshwater plant (Potamogeton crispus)[J]. Fuel, 96: 185-191 |
| [20] | 李柯, 关保华, 刘正文.2011.蓝藻碎屑分解速率及氮磷释放形态的实验分析[J]. 湖泊科学, 23(6): 919-925 |
| [21] | Lill J O, Salovius-Laurén S, Harju L, et al.2012.Temporal changes in elemental composition in decomposing filamentous algae (Cladophora glomerata and Pilayella littoralis) determined with PIXE and PIGE[J]. Science of the Total Environment, 414: 646-652 |
| [22] | Ólafsson E, Aarnio K, Bonsdorff E, et al.2013. Fauna of the green alga Cladophora glomerata in the Baltic Sea: density, diversity, and algal decomposition stage[J]. Marine biology, 160(9): 2353-2362 |
| [23] | Olson J S. 1963. Energy storage and the balance of producers and decomposers in ecological systems[J]. Ecology, 44(2): 322-331 |
| [24] | Proia L, Cassió F, Pascoal C, et al.2012.The Use of Attached Microbial Communities to Assess Ecological Risks of Pollutants in River Ecosystems: The Role of Heterotrophs//Helena G, Antoni G, Anita G. Emerging and Priority Pollutants in Rivers[M]. Berlin Heidelberg: Springer. 55-83 |
| [25] | Rejmánková E, Sirová D. 2007.Wetland macrophyte decomposition under different nutrient conditions: relationships between decomposition rate, enzyme activities and microbial biomass[J]. Soil Biol Biochem, 39 (2): 526-538 |
| [26] | Thullen J S, Nelson S M, Cade B S, et al.2008.Macrophyte decomposition in a surface-flow ammonia-dominated constructed wetland: Rates associated with environmental and biotic variables[J]. Ecological Engineering, 32(3): 281-290 |
| [27] | Wang C, Yu R C, Zhou M J. 2012. Effects of the decomposing green macroalga Ulva (Enteromorpha) prolifera on the growth of four red-tide species[J]. Harmful Algae, 16: 12-19 |
| [28] | 王博, 叶春, 李春华, 等. 2013.不同氧环境中黑藻腐解过程及对水体-底泥碳氮磷的影响[J]. 应用与环境生物学报, 19(3): 484-488 |
| [29] | Wyatt K H, Rober A R, Schmidt N, et al. 2014. Effects of desiccation and rewetting on the release and decomposition of dissolved organic carbon from benthic macroalgae[J]. Freshwater Biology, 59(2): 407-416 |
 2014, Vol. 34
2014, Vol. 34


