2. 西华师范大学西南野生动植物资源保护教育部重点实验室,南充 637009;
3. 四川省农业科学院蚕业研究所,南充 637000
2. Key Laboratory of Southwest China Wildlife Resources Conservation (China West Normal University),Ministry of Education,Nanchong 637009;
3. Sericultural Research Institute,Sichuan Academy of Agricultural Sciences,Nanchong 637000
随着人类活动的加剧,环境中排放的重金属污染物质日益增多,导致局部地方自然生态系统的正常功能受到了影响(Choudhary et al., 2007;何洁等,2013;史静等,2013).作为土壤重金属污染中最为普遍的铅污染,其污染问题近年来日趋严重(邵云等,2009).由于具有毒性强和不可逆等特点,铅已成为对环境最具威胁的重金属之一(Pallavi et al., 2005).当铅元素进入土壤后,不仅干扰土壤的正常功能,还影响植物的生长发育.有研究报道,植物在含铅的土壤上生长时,其光合作用、光合色素、抗氧化酶活性和细胞膜质过氧化等都会受到影响,从而抑制植物生长(刘素纯等,2006;王艳等,2007).例如,Khizar等(2013)对小麦(Triticum aestivum)的研究表明,当铅含量为60 mg · kg-1时显著抑制了小麦的生长,其株高、叶片数、根长、鲜重、生物量及光合色素等指标明显低于对照植株.同时,Piotrowska等(2010)对无根萍(Wolffia arrhiza)的研究也发现,铅浓度为207.2 mg · L-1时抑制了植株的生长,降低了光合色素.上述研究与Kabir等(2009)对杨叶肖槿(Thespesia populnea)的研究结果相一致,均说明铅能抑制植株的生长.因此,研究植物对铅污染的生理耐性与积累特性具有重要意义.
目前,国内外的一些研究已经表明,不同种类的植物对铅污染的耐性大小不一(刘秀梅等,2002;谢景千等,2010).例如,Kaznina等(2005)对禾本科植物的研究发现,铅含量为 200 mg · kg-1时不仅没有抑制植株生长,反而促进了植株叶片叶绿素含量、光合作用及生物量的增加,说明该植株在含铅土壤中能够正常生长,对铅具有较强的耐性.Begonia等(1998)研究发现,浓度为100 mg · L-1的铅能够促进印度芥菜(Brassica juncea)根系生长,并导致其生物量显著高于对照植株.同时,施翔等(2011)发现,紫穗槐(Amorpha fruticosa)、桤木(Alnus cremastogyne)和黄连木(Pistacia chinensis)3种木本植物在铅锌矿中具有较强的耐性.此外,还有研究认为,桑树(Morus alba)耐土壤重金属毒性的能力较强,能够在铅含量高达734 mg · kg-1的污染土壤中生长而没有表现出明显的受胁迫现象(谭勇壁,2008).然而,上述研究均很少涉及植物对铅污染生理耐性的性别差异.从现有文献来看,仅Han等(2013)发现喷施铅剂量为596 mg · kg-1时,青杨(Populus cathayana)雌雄幼苗的生物量和净光合速率将增加,而铅剂量为894 mg · kg-1时雌株的细胞超微结构受到的损伤比雄株大,在光合能力方面雄株比雌株表现出更强的可塑性.鉴于雌雄异株植物的雌雄个体在长期进化过程中已经在生长、空间分布和适应机制等方面表现出明显差异(Renner et al., 1995),对环境胁迫的响应也迥然不同(Xu et al., 2008a; 2008b;杨鹏等,2012).据此,我们推测植物对铅的生理耐性和积累特性方面可能存在明显的性别差异.由于多数研究均报道雌株受环境的影响大于雄株(胥晓等,2007),故推测雄株对铅的生理耐性和积累特性可能大于雌株.
桑树(Morus alba L.)属于桑科(Moraceae)桑属(Morus),是一种雌雄异株植物,被广泛用于养蚕饲料、造纸用材和防风固沙等.从已有的文献来看,对桑树的研究多集中于栽培管理、品质改良、盐胁迫和干旱胁迫等方面(潘一乐,2000;鲍远胜,2011;柯裕州等,2009;任迎虹,2009),而关于其对重金属污染的生理耐性方面的研究较少,特别是从性别的角度揭示其耐铅污染差异的研究尚未见报道.因此,本文以桑树为实验材料,通过比较固定含量铅污染土壤中生长的雌雄植株在抗氧化酶活性、膜质过氧化、气体交换、色素含量、形态生长、生物量积累及重金属积累等方面的差异来验证本文的推测,以期为植物对铅污染的生理耐性研究提供参考,也为雌雄异株植物修复铅污染土壤的性别选择提供理论依据.
2 实验方法(Research methods) 2.1 实验设计实验材料为四川省农业科学研究院蚕业研究所提供的桑树雌雄植株(品种为沙2×伦109杂交实生).2013年3月1日,从雌雄母株上分别截取长短、粗细一致的2年生健康枝条按性别扦插于体积为10 L、盛有均质10 kg(干重)土壤的塑料盆内,每盆扦插1株.选用当地广泛分布的紫色土壤作为盆栽基质,土样风干后充分混匀.依据《土壤环境质量标准GB15618—1995》和四川省铅锌矿区土壤重金属概况(毛竹等,2007),设置为2个不同铅剂量处理水平,分别为0、800 mg · kg-1(以纯铅计,铅含量已超过国家环境质量三级标准,达到污染水平),以Pb(NO3)2为铅源,实验采用双因素的完全随机设计:2 性别(雄、雌)×2处理(对照、铅处理),雌雄幼苗各20株,共40株.其中,各性别中的10株用于土壤铅污染处理,另外10株用于对照处理,于7月1日开始铅处理.按照以上Pb含量进行折算,将Pb(NO3)2与去离子水配成含铅0、16 mg · mL-1的Pb(NO3)2溶液,然后按照处理水平分别把相应浓度的溶液500 mL均匀浇施到土壤基质中,且每盆浇灌到处理组桑苗的铅含量达8 g,处理组和对照组均置于温室棚内.在处理后的整个实验期间,处理组和对照组均浇灌等量的清水以保持土壤湿度.各塑料盆内套有塑料袋(土壤置于塑料袋内),盆底均置托盘以防渗漏.供试土壤的基本理化性质分析结果见表 1.
| 表1 供试土壤的基本理化性质 Table 1 Basic properties of soils in experiment |
土壤经风干过100目筛消毒后,随机选取样品,各称取0.5 g 土壤送到西南大学资源环境学院研究室测定其有机质、营养元素和pH.土壤基本理化性质分析参照文献(鲍士旦,2000)的测定方法:pH值用2.5 ∶ 1水土比(mL/g)电位法测定,土壤有机质用K2Cr2O7 外加热法测定,速效磷用NaHCO3浸提-钼锑抗比色法测定,速效钾用NH4OAc-火焰光度法测定,全N用开氏-蒸馏法测定,全P用NaOH熔融-钼锑抗比色法测定.
2.2.2 植物生理指标90 d后完全随机选取各组幼苗7株,取叶龄一致、新鲜成熟的叶片用于生理指标测定.可溶性蛋白(Pr)含量的测定采用考马斯亮蓝法(Bradford,1976);超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)比色法,以抑制NBT光氧化还原50%的酶量为一个酶活性单位(Stewart et al., 1980);丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)比色法(李合生等,2000);相对电导率使用便携式手持式电导率仪(DSS-11A,中国)进行测定(邹琦,1997);叶绿素含量测定采用Arnon法(提取液为80%丙酮)(Arnon,1949);叶片叶绿素相对含量使用手持便携式叶绿素计(SPAD-502,日本)测定,每株植物随机选取植株上部叶片10片,测定其叶绿素值后取平均值.
2.2.3 气体交换指标测定2013年8月25日上午,随机选取不同处理下雌雄植株各7株,选取植株上部第3或4片完全展开的向阳的叶片用于测定植株的气体交换特征.采用Li-6400便携式光合仪(LI-COR公司,美国)测定其净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr).测定时设置叶室温度为(26±2)℃,设定光照强度为(1800±100)μmol · m-2 · s-1,相对湿度为60%±5%,CO2浓度(370± 10)μmol-1 · mol-1.
2.2.4 形态指标的测定实验结束后对各植株的株高(Height growth,HG)、基径(Basal diameter,BD)、总叶片数(Total leaf number,TNL)进行测量.用LI-3000C便携式叶面积仪(LI-COR公司,美国)测量植株的总叶面积(Total leaf area,TLA).
2.2.5 生物量指标的测定实验结束后,将植株分别按根、茎、叶进行采收并分置于60 ℃烘箱内烘干至恒重后测定各植株的总叶干重(Total leaf dry mass,TLM)、总茎干重(Total stem dry mass,TSM)、总根干重(Total root dry mass,TRM)、总生物量(Total dry mass,TDM),并计算比叶面积(Specific leaf area,SLA)(叶面积与叶干重之比)和根冠比(Root/shoot ratio,RSR).
2.2.6 重金属Pb元素测定将各处理组内烘干至恒重的桑树雌雄幼苗的叶、茎和根系粉碎后分别过100目筛,并准确称取处理后样品0.5 g 送至西南大学资源环境学院研究室测定叶、茎和根系中的Pb含量,并计算植物的转移系数(Translocation factor,Tf)(地上部重金属含量/地下部重金属含量).
2.3 数据处理采用SPSS 19.0 统计软件进行数据分析.平均值间的比较采用单因素方差分析(one-way ANOVA);不同处理间的差异采用Duncan多重比较检验(Duncan′s multiple range test);采用多因素方差分析性别与处理间的交互作用.显著性差异水平设定为α=0. 05.
3 结果与分析(Results and analysis) 3.1 铅处理下桑树雌雄幼苗可溶性蛋白含量和超氧化物歧化酶活性的差异铅对桑树雌雄幼苗Pr含量(以鲜重计)和SOD(以鲜重计)活性的影响如图 1所示.由图 1可知,尽管在铅处理下,雌雄幼苗叶片中Pr含量和SOD活性无显著差异,但与对照相比,铅处理显著增加了桑树幼苗叶片中Pr含量(p=0.013)和SOD活性(p=0.027),且雄株增加的幅度略高于雌株,雄株的Pr含量和SOD活性增加幅度分别为17%和50%,雌株的Pr含量和SOD活性增加幅度分别为2%和16%.可见该铅剂量有利于促进桑树雄株可溶性蛋白的合成,并且雄株清除超氧化物自由基的能力高于雌株.
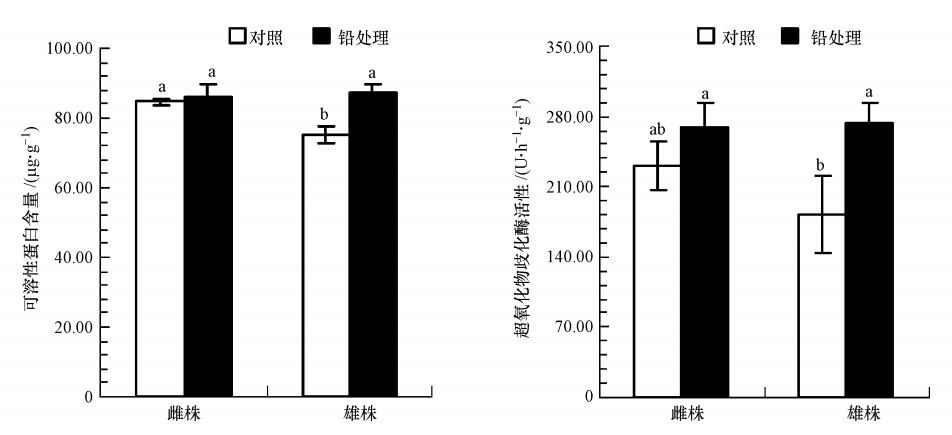 |
| 图 1 铅处理下桑树雌雄幼苗的可溶性蛋白(Pr)含量和超氧化物歧化酶(SOD)活性 Fig. 1 Soluble protein(Pr)contents and super-oxide dismutase(SOD)activity of male and female Morus alba seedlings under lead treatment |
铅对桑树雌雄幼苗MDA含量(以鲜重计)和相对电导率的影响如图 2所示.由图 2可知,与对照相比,桑树雌雄幼苗叶片中的MDA含量和相对电导率在铅处理(800 mg · kg-1)前后均无显著差异(p>0.05),且雌雄性别间也无显著差异,说明该铅剂量对桑树雌雄幼苗的细胞膜无损害作用.
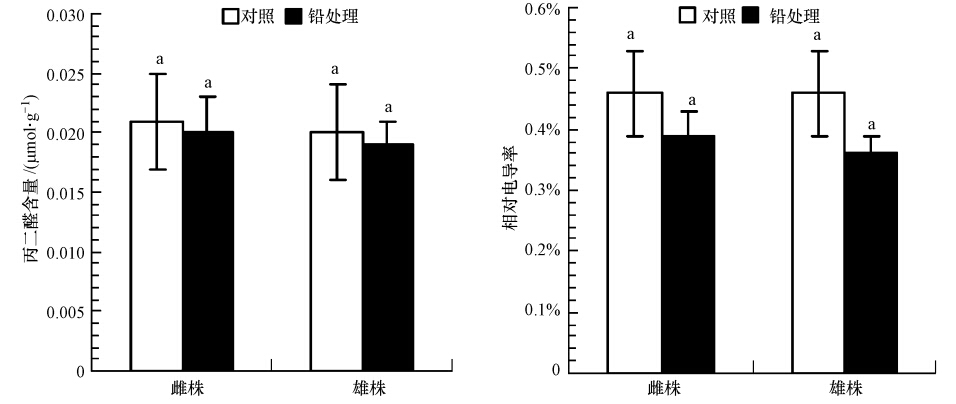 |
| 图 2 铅处理下桑树雌雄幼苗的丙二醛(MDA)含量和相对电导率 Fig. 2 Malondialdhyde(MDA)contents and relative conductivity of male and female Morus alba seedlings under lead treatment |
表 2显示了铅对桑树雌雄幼苗气体交换的影响.与对照相比,铅处理显著增加了桑树幼苗的Pn (p<0.001)、Gs (p<0.001)、Ci(p=0.046)和Tr(p<0.001).铅处理下雌雄幼苗叶片的Pn、Gs和Tr显著增加,且雄株增加的幅度显著高于雌株,雄株的Pn、Gs和Tr增加幅度分别为48%、85%和88%,雌株的Pn、Gs和Tr增加幅度分别为15%、26%和21%.对照中雌株的Pn、Gs和Tr均显著高于雄株,而铅处理下雌株的Pn和Tr则显著低于雄株.表明雌株的气体交换对铅比较敏感,雄株表现出较强的光合能力.
| 表2 铅处理下桑树雌雄幼苗的气体交换特征 Table 2 Gas exchange characteristics of male and female Morus alba seedlings under lead treatment |
铅对桑树雌雄幼苗叶绿体色素含量(均以鲜重计)的影响如图 3所示.由图 3可看出,与对照相比,铅处理显著增加了桑树幼苗的叶绿素a(p<0.001)、叶绿素b(p=0.002)、总叶绿素含量(p<0.001)及叶绿素相对含量(p<0.001),且雄株的叶绿素a、叶绿素b、总叶绿素含量及叶绿素相对含量增加幅度高于雌株.雄株的叶绿素a、叶绿素b、总叶绿素含量及叶绿素相对含量增幅分别为45%、136%、56%和17%,雌株的叶绿素a、叶绿素b、总叶绿素含量及叶绿素相对含量增幅分别为13%、62%、25%和14%.可见雄株叶绿素含量高于雌株,在该铅剂量下更有利于促进雄株叶绿素含量的增加.
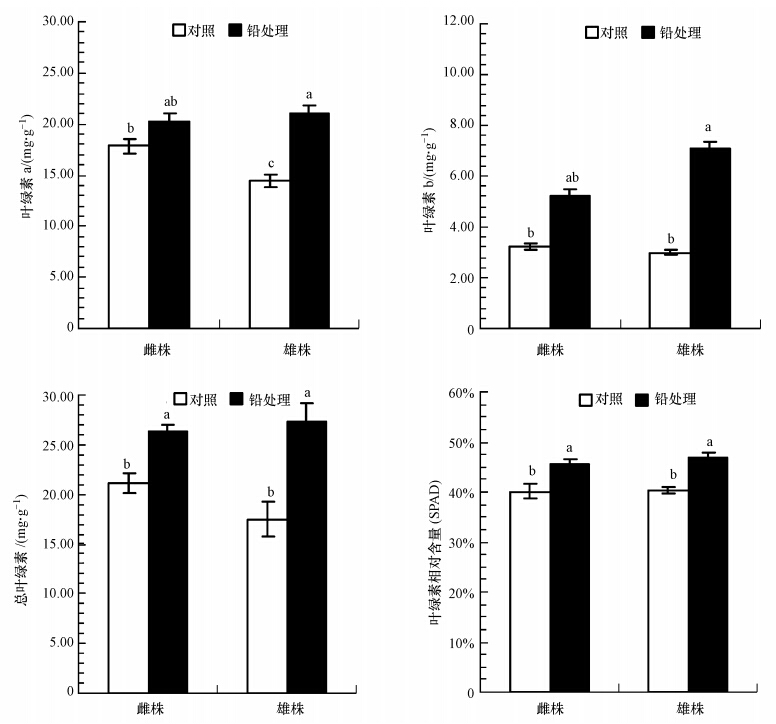 |
| 图 3 铅处理下桑树雌雄幼苗叶片的叶绿体色素含量 Fig. 3 Chlorophyll pigments content of male and female Morus alba seedlings under lead treatment |
铅对桑树雌雄幼苗形态生长的影响如表 3所示.由表 3可以看出,与对照相比,铅处理显著增加了桑树幼苗的株高(p<0.001)、基径(p<0.001)、总叶面积(p=0.022)、总叶片数(p=0.005).铅处理下雄株幼苗的株高、基径和总叶面积增加幅度高于雌株,雄株的株高、基径和总叶面积增加幅度分别为28%、21%和33%,雌株的株高、基径和总叶面积增加幅度分别为5%、12%和18%.表明雄株的茎生长速率和叶面积增长速率高于雌株,在该铅处理下更有利于促进雄株的生长.
| 表3 铅处理对桑树雌雄幼苗形态指标的影响 Table 3 Morphological index of male and female Morus alba seedlings under lead treatment |
铅对桑树雌雄幼苗生物量和根冠比的影响如表 4所示.由表 4可看出,在铅处理下,雌雄幼苗的叶生物量、茎生物量、根生物量、总生物量及根冠比无显著差异,但与对照相比,铅处理显著增加了桑树幼苗的叶生物量(p<0.001)、茎生物量(p<0.001)、总生物量(p<0.001),且雄株的增加幅度高于雌株,雄株的叶生物量、茎生物量和总生物量增加幅度分别为32%、30%和24%,雌株的叶生物量、茎生物量和总生物量增加幅度分别为21%、24%和10%.可知雄株对生物量的积累与分配能力较雌株高.
| 表4 铅处理对桑树雌雄幼苗生物量干重和根冠比的影响 Table 4 Dry biomass and root/shoot ratio(R/S)of male and female Morus alba seedlings under lead treatment |
图 4为铅在桑树雌雄幼苗体内的积累与转移情况.由图 4可看出,与对照相比,铅处理下桑树幼苗 的叶(p<0.001)、茎(p=0.006)和根系(p<0.001)对铅的积累量显著增加,且重金属铅主要积累在桑树幼苗的根部,植株地上部分富集铅含量相对较少,这有利于缓解铅对地上部分的毒害.而铅处理下的雌雄幼苗叶、茎和根系对铅的积累量和转移系数虽然无显著差异,但雄株叶片和根系对铅的积累量与转移系数略高于雌株.可见雄株积累和转移铅的潜在能力较雌株强.
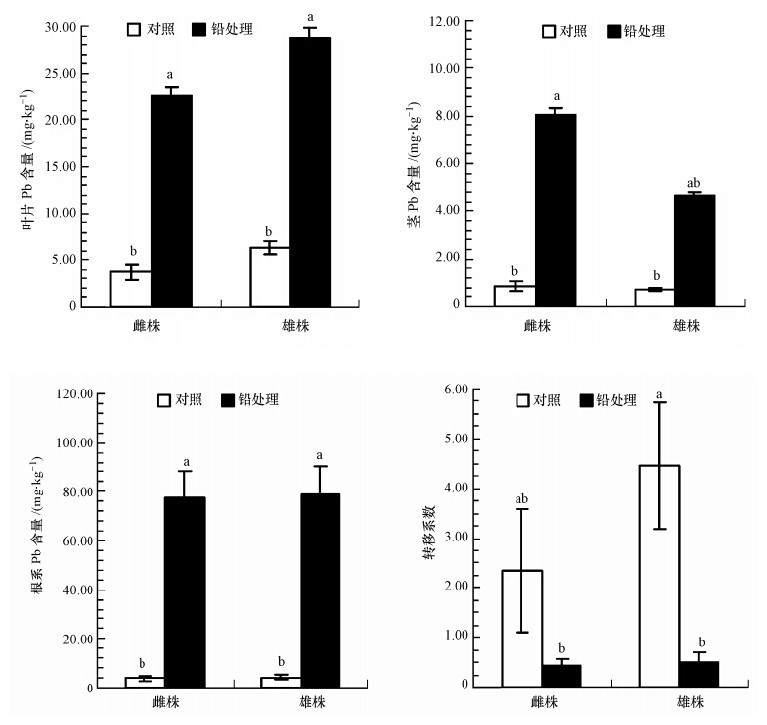 |
| 图 4 桑树雌雄幼苗的叶、茎和根系中的铅含量及转移系数 Fig. 4 Lead contents in the leaves,stems,roots and translocation factor of male and female Morus alba seedlings |
有研究表明,重金属离子进入植物体内后,会与一些化合物结合成金属络合物或螯合物,从而抑制蛋白质的合成.因此,可溶性蛋白(Pr)含量是衡量植物是否受到重金属胁迫的重要指标,Pr含量的增高有助于提高植物的抗逆性(李兆君等,2004).此外,超氧化物歧化酶(SOD)活性的变化可作为检测植物是否受重金属胁迫的另一生理指标(Rucińska et al., 1999).在低浓度重金属处理时,植物体内SOD活性受到活性氧自由基的诱导,活性上升并且参与清除自由基,故SOD活性的上升间接地反映植物对自身的一种保护机制.在本研究中发现,施铅后桑树雄株幼苗的Pr含量和SOD活性增加幅度都比雌株高(图 1),而其气体交换却并未受到任何抑制(表 1).由此说明了桑树雄株在铅处理下Pr含量和SOD活性调节的幅度可能大于雌株,并表现出比雌株更强的适应能力.另一方面,在施铅处理下,桑树雌雄幼苗的MDA含量和细胞膜透性无显著差异.由于MDA含量是植物在逆境条件下膜脂过氧化作用形成的产物,其含量的高低是衡量植物适应环境的一个重要指标,较低的MDA含量反映了该类植物对环境具有更强的抗逆性(许明丽等,2000).细胞膜透性通过相对电导率来反映,相对电导率越小,细胞膜透性越小,说明细胞膜没有受到损伤(李元等,1992).因此,在本研究中铅处理对桑树雌雄幼苗的细胞膜没有产生显著影响.此外,尽管在铅处理下雌雄植株在MDA含量和相对电导率方面无显著差异,但雄株的平均值均比雌株略低(图 2),表明其在铅污染下维持细胞膜完整性的能力可能比雌株略强,这结果与许多研究认为雄株在环境影响下具有更强的抗性相一致(Xu et al., 2008;李俊钰等,2012).
本研究发现,施铅前雄株幼苗的净光合速率低于雌株幼苗,施铅后桑树雌雄幼苗的气体交换能力不仅没有受到抑制,反而得到了促进,尤其是雄株幼苗的净光合速率(表 1).通常而言,植物光合作用强度一方面取决于气孔的开闭行为,另一方面也与参与光合作用的主要色素有关.本研究中桑树雌雄幼苗的叶绿素a、叶绿素b和总叶绿素含量显著增加,且雄株幼苗的叶绿素含量增加幅度显著高于雌株(图 3).这一结果与许多文献的结论相一致(谷绪环等,2008;周朝彬等,2005).由于叶绿素是植物进行光合作用的主要色素,在光合作用过程中具有接受和转换能力的作用,其含量高低可衡量植物衰老程度及光合作用的能力(Islam et al., 2008).因此,桑树雄株叶绿素a、叶绿素b和总叶绿素含量显著增加,反映出雄株叶片的光能转化和能量提供能力相对较强,其原因可能与重金属铅离子对雌雄植株的光合作用酶和细胞分裂酶产生激活效应具有差异有关,但还须进一步予以深入研究证明(Nyitrai et al., 2003).
生物量是衡量植物耐性的重要指标(Robinson et al., 2000;Di et al., 2003).相关研究报道,低浓度的铅对植物生长具有一定的刺激作用,能够刺激植物的株高、叶片生物量和地上部分鲜重、干重的增加.如铅处理对荞麦(Polygonum aubertii)根的生长没有毒害作用,反而表现出明显的促进作用(刘拥海等,2006).东南景天(Sedum alfredii)在202.7 mg · L-1铅浓度处理下,其根数增多,根长显著增加(熊愈辉等,2004).马蔺(Iris lacteal)在铅含量低于500 mg · kg-1处理下,其株高、根长、地上部和地下部干质量明显增加,在800 mg · kg-1铅处理下尽管马蔺株高、根长、叶片数低于对照,但差异不显著(原海燕等,2011).在本研究中,与雌株相比,施铅更促进了雄株幼苗的生长和生物量积累,具体表现为雄株的株高、基径、总叶面积、总叶片数、总叶干重、总茎干重、总根生物量和总生物量的增加幅度均高于雌株(表 2、3),从而表现出更强的耐性.究其原因,一方面可能与光合色素含量和光合能力高低相关.另一方面,可能是铅离子激活了土壤微生物的活动,使土壤养分的循环与转化得以加速,从而提高了叶片叶绿素的合成,增强了叶片光合作用,进而增加其生物量(曾路生等,2008).除此之外,还可能与实验使用的试剂Pb(NO3)2有关,硝酸根是氮肥的主要成份,植物对氮肥具有较大的生长反应.氮素是植物需求量最大的营养元素,而硝态氮是植物可吸收利用的主要氮源,其与植物很多生理过程联系密切.其中,光合作用受到植物体内氮含量的影响,而植物叶绿体的合成也需要氮素作为组成成分(刘秀杰等,2012;李静等,2012).试验中桑树雌雄幼苗的生长参数都略有增加,有可能是试验所添加的Pb(NO3)2形成了氮素营养效应,降低了铅离子在土壤中的有效质量浓度,一定程度缓解了重金属的伤害.
利用植物吸收污染土壤中的铅元素必须要了解植物对铅的吸收、转移和积累机制(Huang et al., 1996).有研究表明,植物对铅的吸收能力较低,向地上部运输的能力更低,而铅在植物的根、茎、叶各器官的积累和分布是不相同的(Arshad et al., 2008),90%以上的铅主要积累在根系,而根系也只能吸收一小部分的铅(Zimdahl et al., 1977).在本研究中,铅在雌雄幼苗体内的分布规律为根>叶>茎,根系的铅积累量高于叶片和茎的铅积累量(图 4),而雌雄幼苗的根系和叶片对铅的积累量虽无显著差异,但雄株略高于雌株,表明雄株对重金属铅的吸收和积累能力强.转移系数是指地上部重金属含量与地下部重金属含量的比值,用来评价植物将重金属从地下向地上运输和富集的能力.转移系数越大,表明重金属从根系向地上部器官转运能力越强.转移系数高于0.5,说明植物能够把大量的重金属迁移到茎叶,该类植物对重金属有较强的耐性,有利于重金属的固定(刘秀梅等,2002).本研究中,施铅后雌雄幼苗的转移系数虽无显著差异,但雄株增加幅度略高于雌株,雄株转移系数高于0.5,表明雄株对重金属铅的吸收转移能力较雌株高,具有较强的耐铅性,因此,雄株可作为固定重金属铅的参考植物.
5 结论(Conclusions)桑树雌雄幼苗在铅含量为800 mg · kg-1 的处理下仍能正常生长,且铅对雌雄幼苗的气体交换、色素含量、形态生长和生物量积累均有明显的促进作用.与雌株相比,雄株在上述指标方面增加幅度更大,从而表现出对铅具有更强的生理耐性和积累特性.由于雄株耐铅性强,生物量高,铅总积累量大且主要集中在根部,因此,研究认为,桑树雄株比雌株更有利于作为固定重金属铅和土壤修复兼顾的树种.
| [1] | Arnon D I.1949.Copper enzymes in isolated chloroplasts.Polyphenoloxidase in Beta vulgaris[J].Plant Physiology,24(1):1-15 |
| [2] | Arshad M,Silvestre J,Pinelli E,et al.2008.A field study of lead phytoextraction by various scented Pelargonium cultivars[J]. Chemosphere,71(11):2187-2192 |
| [3] | 鲍士旦.2000.土壤农化分析(第3版)[M].北京:中国农业出版社 |
| [4] | 鲍远胜.2011.桑树栽培管理技术探讨[J].安徽农学通报, 17(6):97;113 |
| [5] | Begonia G B,Davis C D,Begonia M F,et al.1998.Growth responses of Indian mustard and its phytoextraction of lead from a contaminated soil[J].Bulletin of Environmental Contamination and Toxicology,61(1):38-43 |
| [6] | Bradford M M.1976.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J].Annals of Biochemistry,72 (2):248-254 |
| [7] | Choudhary M,Jetley U K,Khan M A,et al.2007.Effect of heavy metal stress on proline,malondialdehyde,and superoxide dismutase activity in the cyanobacterium Spirulina platensis-S5[J].Ecotoxicology and Environmental Safety,66(2):204-209 |
| [8] | Di Baccio D, Tognetti R,Sebasttiani L,et al.2003.Responses of Populus deltoids×Populus nigra (Populus×euramericana) clone1-214 to high zinc concentrations[J].New Phytologist,159(2):443-452 |
| [9] | 谷绪环,金春文,王永章,等.2008.重金属Pb与Cd对苹果幼苗叶绿素含量和光合特性的影响[J].安徽农业科学,36(24):10328-10331 |
| [10] | 国家环境保护局.1995.GB 15618—1995土壤环境质量标准[M].北京:中国标准出版社 |
| [11] | Han Y, Wang L,Zhang X L,et al.2013.Sexual differences in photosynthetic activity,ultrastructure and phytoremediation potential of Pop-ulus cathayana exposed to lead and drought[J].Tree Physiology,33(10):1043-1060 |
| [12] | 何洁,高钰婷,贺鑫,等.2013.重金属Zn和Cd对翅碱蓬生长及抗氧化酶系统的影响[J].环境科学学报,33(1):312-320 |
| [13] | Huang J W,Cunningham S D.1996.Lead phytoextraction:species variation in lead uptake and translocation[J].New Phytologist,134(1):75-84 |
| [14] | Islam E,Liu D,Li T Q,et al.2008.Effect of Pb toxicity on leaf growth,physiology and ultrastructure in the two ecotypes of Elsholtzia argyi[J].Journal of Hazardous Materials,154(1/3):914-926 |
| [15] | Kabir M,Iqbal M Z,Shafiq M,et al.2009.Effects of lead on seedling growth of Thespesia populnea L.[J].Advances in Environmental Biology,56 (4):194-199 |
| [16] | Kaznina N M,Laidinen G F,Titov A F.2005.Effect of lead on the photosynthetic apparatus of annual grasses[J].Biology Bulletin, 32(2):147-150 |
| [17] | 柯裕州,周金星,卢楠,等.2009.盐胁迫对桑树幼苗光合生理及叶绿素荧光特性的影响[J].林业科学研究,22(2):200-206 |
| [18] | Khizar H B, Sehrish A,Khalid N,et al.2013.Effect of heavy metal lead stress of different concentration on wheat (Triticum aestivum L.)[J].Middle-East Journal of Science Research,14(2):148-154 |
| [19] | 李合生,孙群,赵世杰,等.2000.植物生理生化实验原理和技术[M].北京:高等教育出版社 |
| [20] | 李静,张冰玉,苏晓华,等.2012.植物中的铵根及硝酸根转运蛋白研究进展[J].南京林业大学学报(自然科学版),36(4):133-139 |
| [21] | 李俊钰,胥晓,杨鹏,等. 2012.铝胁迫对青杨雌雄幼苗生理生态特征的影响[J].应用生态学报,23(1):45-50 |
| [22] | 李元,王焕校,吴玉树.1992.镉、铁及其复合污染对烟草叶片几项生理指标的影响[J].生态学报,12(2):14-15 |
| [23] | 李兆君,马国瑞,徐建民,等.2004.植物适应重金属镉胁迫的生理及分子生物学机理[J].土壤通报,35(2):234-238 |
| [24] | 刘素纯,萧浪涛,廖柏寒,等.2006.铅胁迫对黄瓜幼苗抗氧化酶活性及同工酶的影响[J].应用生态学报,17(2):300-304 |
| [25] | 刘秀杰,宫占元.2012.植物氮素吸收利用研究进展[J].现代化农业,(8):20-21 |
| [26] | 刘秀梅,聂俊华,王庆仁.2002.6种植物对Pb的吸收与耐性研究[J].生态学报,26(5):533-537 |
| [27] | 刘拥海,俞乐,陈奕斌,等.2006.不同荞麦品种对铅胁迫的耐性差异[J].生态学杂志,25(11):1344-1347 |
| [28] | 毛竹,张世熔,李婷,等.2007.铅锌矿区土壤重金属空间变异及其污染风险评价——以四川汉源富泉铅锌矿山为例[J].农业环境科学学报,26(2):617-621 |
| [29] | Nyitrai P,Bóka K,Gáspár L,et al.2003.Characterization of the stimulating effect of low-dose stressors in maiza and bean seedlings[J].Journal of Plant Physiology,160(10):1175-1183 |
| [30] | Pallavi S,Rama S D.2005.Lead toxicity in plants[J].Toxic Metals in Plants,17(1):35-52 |
| [31] | 潘一乐.2000.桑种质资源和桑树育种的研究现状与展望[J].蚕业科学,26(S1): 1-5 |
| [32] | Piotrowska A,Bajguz A,Godlewska- ykiewicz B.2010.Changes in growth,biochemical components,and antioxidant activity in aquatic plant Wolffia arrhiza L.exposed to cadmium and lead[J].Archives of Environmental Contamination and Toxicology,58(3):594-604 |
| [33] | 任迎虹.2009.干旱胁迫对不同桑品种保护酶和桑树生理的影响研究[J].西南大学学报(自然科学版),31(4):94-99 |
| [34] | Renner S S,Ricklefs R E.1995.Dioecy and its correlates in the flowering plants[J].American Journal of Botany,82(5):596-606 |
| [35] | Robinson B H,Mills T M,Petit D,et al.2000. Natural and induced cadmium-accumulation in poplar and willow:Implications for phytoremediation[J].Plant and Soil,227(1/2):301-306 |
| [36] | Rucińska R,Waplak S,Gwó z ' d z ' E A.1999.Free radical formation and activity of antioxidant enzymes in Lupin roots exposed to lead[J].Plant Physiology and Biochemistry,37(3):187-194 |
| [37] | 邵云,柴宝玲,李春喜,等.2009.土壤添加玉米秸秆对小麦Pb毒害缓解效应[J].生态学报,29(4):2073-2079 |
| [38] | 史静,潘根兴,张乃明.2013.镉胁迫对不同杂交水稻品种Cd、Zn吸收与积累的影响[J].环境科学学报,33(10):2904-2910 |
| [39] | 施翔,陈益泰,王树凤,等.2011.3种木本植物在铅锌和铜矿砂中的生长及对重金属的吸收[J].生态学报,31(7):1818-1826 |
| [40] | Stewart R R C,Bewley J D.1980.Lipid peroxidation associated with accelerated aging of soybean axes[J].Plant Physiology,65(2):245-248 |
| [41] | 谭勇壁.2008.矿区周边重金属污染农田发展桑树种植产业的可行性研究 .南宁:广西大学 |
| [42] | 王艳,辛士刚,马莲菊,等.2007.翦股颖和高羊茅对铜、铅吸收及耐受性[J].应用生态学报,18(3):625-630 |
| [43] | 谢景千,雷梅,陈同斌,等. 2010.蜈蚣草对污染土壤中As,Pb,Zn,Cu的原位去除效果[J].环境科学学报,30(1):165-171 |
| [44] | 熊愈辉,杨肖娥,叶正钱,等.2004.东南景天对镉、铅的生长反应与积累特性比较[J].西北农林科技大学学报,32(6):101-106 |
| [45] | 许明丽,孙晓艳,文江祁.2000.水杨酸对水分胁迫下小麦幼苗叶片膜损伤的保护作用[J].植物生理学通讯,36(1):35-36 |
| [46] | 胥晓,杨帆,尹春英,等.2007.雌雄异株植物对环境胁迫响应的性别差异研究进展[J].应用生态学报,18(11):2626-2631 |
| [47] | Xu X,Zhao H X,Zhang X L,et al.2008a.Different growth sensitivity to enhanced UV-B radiation between male and female Populus cathayana [J].Tree Physiology,30(12):1489-1498 |
| [48] | Xu X,Yang F,Xiao X W,et al.2008b.Sex-specific responses of Populus cathayana to drought and elevated temperatures[J].Plant,Cell and Environment,31(6):850-860 |
| [49] | 杨鹏,胥晓.2012.淹水胁迫对青杨雌雄幼苗生理特性和生长的影响[J].植物生态学报,36(1):81-87 |
| [50] | 原海燕,郭智,黄苏珍.2011.铅污染对马蔺生长、体内重金属元素积累以及叶绿体超微结构的影响[J].生态学报,31(12): 3350-3357 |
| [51] | 曾路生,廖敏,黄昌勇,等.2008.外源铅对水稻土微生物量、微生物活性及水稻生长的影响[J].生态环境,17(3):993-998 |
| [52] | 周朝彬,胡庭兴,胥晓刚,等.2005.铅胁迫对草木樨叶中叶绿素含量和几种光合特性的影响[J].四川农业大学学报,23(4):432-436 |
| [53] | Zimdahl R L,Skoherboe R K.1977.Behavior of lead in soil[J].Environmental Science and Technology,11(13):1202-1207 |
| [54] | 邹琦.1997.植物生理生化实验原理和技术[M].北京:中国农业出版社 |
 2014, Vol. 34
2014, Vol. 34


