2. 中国海洋大学环境科学与工程学院, 青岛 266100;
3. 中国海洋大学海洋环境学院, 青岛 266100
2. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100;
3. College of Physical and Environmental Oceanography, Ocean University of China, Qingdao 266100
铁(Fe)对于海洋初级生产者是一种重要的微量元素,它是许多海洋光合生物酶系统的辅助因子,在光合作用、呼吸作用和生物固氮方面发挥着重要作用(Falkowski et al., 1998;Morel et al., 2003).在高营养盐低叶绿素(HNLC)海域,Fe可能是初级生产力的限制因素,在贫营养海域,Fe会在很大程度上影响其生产力和固氮能力(Martin et al., 1988;Boyd et al., 2007).Fe通过大气向海洋表层沉降是海洋获取Fe的重要途径之一,尤其对遥远大洋,大气沉降是其Fe元素的最主要来源(Jickells et al., 2005).沉降入海的Fe的生物可利用性很大程度上取决于其在海水中的溶解量.海水中可溶性Fe的量取决于两方面:沉降总量和溶解度.关于Fe溶解度的研究已经在世界范围内展开,根据不同报道,Fe溶解度的变化范围较大,可从0.001%到80%(Mahowald et al., 2005),这是影响溶解度的因素复杂造成的必然结果.目前,对于气溶胶中Fe溶解度控制因素的认识还存在很大不足,因此,开展对铁溶解度及其控制因素的研究具有非常重要的意义.
有关Fe溶解度的研究以往多集中在受撒哈拉沙尘影响较大的大西洋和地中海地区,很少有研究考虑亚洲沙尘.青岛位于山东半岛南端,东南濒临黄海,处于亚洲沙尘源区和华北城市群的下风带,是亚洲大陆气溶胶向西北太平洋传输的重要通道.在青岛开展气溶胶中Fe溶解度的观测研究,可为正确评价中国近海大气沉降中Fe对海洋初级生产力的贡献提供一定的参考资料.因此,本文利用2012年12月在青岛采集的31个大气气溶胶样品,分析其中总Fe和溶解态Fe的浓度,讨论Fe的溶解度及其影响因素.
2 样品采集和分析(Sample collection and analysis) 2.1 样品采集2012年12月1—31日连续采集总悬浮颗粒物(TSP)样品31个,采集地点设在中国海洋大学鱼山校区达尔文馆楼顶(36°06′N,120°33′E,海拔约65 m),采样点附近无明显工业污染源.TSP样品采用KC-1000大流量气溶胶采样器(青岛崂山电子公司)采集,每个样品采集时间为12:00至次日12:00,采样流量为1.05 m3 · min-1,采样膜为Whatman 41纤维滤膜(预先经10% HCl、1% HNO3及Milli-Q超纯水清洗).采样结束后,在洁净室中小心取下滤膜,将滤膜对折放入洁净的聚乙烯封口袋中于-20 ℃冷冻保存至分析.
采样期间同时观测大气颗粒物数浓度谱,观测仪器为HHPC-6型激光粒子计数器(美国ARTI),依据颗粒物的空气动力学直径共分为0.3、0.5、0.7、1.0、2.0和5.0 μm 6个粒径通道,采样流速为2.83 L · min-1,每15 min测定1次数浓度.
2.2 样品预处理用于总微量元素分析的样品:取一定面积样品膜放入消化罐内胆,加入2 mL浓HNO3、0.5 mL浓HF于电热板加热至滤膜溶解,冷却后组装入高效消化罐,于180 ℃消解至完全,取出内胆加热使酸完全挥发,至近干时取下冷却,残渣用2% HNO3溶解,定容后转移到样品瓶中,4 ℃下保存.
用于溶解态微量元素分析的样品:取一定面积样品膜,加入20 mL Milli-Q水(≥18.2 MΩ · cm),0 ℃下超声波萃取1 h,萃取液经0.45 μm滤膜过滤至聚四氟乙烯消解罐中,重复加入2 mL浓HNO3消解至完全,加热至近干后取下冷却,残渣用2% HNO3溶解定容,4 ℃下保存.
用于无机、有机离子分析的样品:取一定面积样品膜,加入15 mL Milli-Q水于0 ℃下超声波萃取30 min,萃取液经0.45 μm滤膜过滤后定容,转移至样品瓶中待分析.
2.3 样品分析微量元素分析:使用Agilent 7500c ICP-MS(美国安捷伦技术有限公司),仪器装配有八极杆碰撞/反应池和巴宾顿雾化器,雾化室为低记忆效应的石英双通道型,用Piltier半导体控温于(2.0±0.1)℃.氧化物指标(CCeO/CCe)为0.65%,双电荷指标(CCe2+/CCe)为2.25%.以铑(Rh)为内标元素,分析样品中的Fe、Al、V、Mn、Co、Cu、Zn、Ga、As、Rb、Sr、Cd、Cs、Ba、Pb和Bi等元素.为控制分析质量,每分析10个样品加测一与样品浓度接近的标准溶液,以确保分析结果准确.
无机离子分析:使用ICS-3000离子色谱仪(美国戴安公司)分析样品中的阳离子Na+、NH+4、K+、Mg2+、Ca2+和阴离子F-、Br-、PO3-4、Cl-、NO-2、NO3-、SO42-、乙二酸、丙二酸等.分析过程中的质量控制见文献(于丽敏等,2007;石金辉等,2010).
2.4 颗粒物的表面积、体积及气溶胶中元素的富集因子计算颗粒物的表面积(S)和体积(V)用以下公式计算:
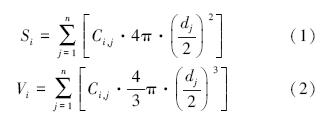
式中,Si、Vi分别为第i个气溶胶样品采集期间颗粒物的总表面积(μm2)和总体积(μm3),Ci,j为相应样品采集期间第j级颗粒物的平均数浓度,dj为第j级颗粒物的空气动力学直径(μm).
元素的富集因子(EF)用以下公式计算:
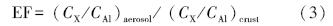
式中,(CX/CAl)aerosol代表气溶胶中元素X与Al的比值;(CX/CAl)crust代表地壳中元素X与Al的比值(Taylor,1964).
3 结果与讨论(Results and discussion) 3.1 青岛气溶胶中Fe的总浓度、溶解态浓度及其溶解度采样期间,青岛TSP样品中颗粒物浓度为44.0~224.8 μg · m-3,平均为115.0 μg · m-3,总Fe浓度为578~7723 ng · m-3,平均为3248 ng · m-3(图 1).气溶胶中总Fe与颗粒物的质量浓度变化较一致,存在良好线性关系(R2=0.73).二者的浓度高值均出现在12月2—4日,浓度低值出现在12月12—13日及26日.气团的后向轨迹分析显示,总Fe和颗粒物的浓度高值多出现在来源于北方大陆的气团,而低值多来源于近岸城市和近海.气溶胶中溶解态Fe浓度为12.8~79.7 ng · m-3,平均为43.3 ng · m-3,最高和最低浓度分别出现在12月2日和13日,与总Fe浓度高、低值出现的时间相同,但经检验Fe的溶解态浓度和总浓度之间并无统计意义上的相关关系.青岛大气气溶胶中Fe的溶解度为0.57%~4.86%,平均为1.63%.Fe溶解度最大值出现在12月12日,该样品总Fe浓度为1214 ng · m-3,接近12月各样品的最低值;最小值出现在12月5日,该样品总Fe浓度为5114 ng · m-3,处于12月各样品的较高水平.
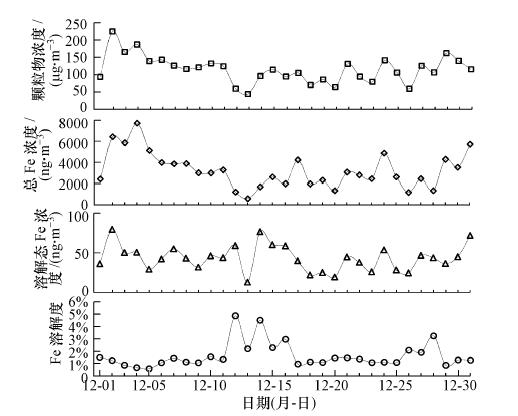 |
| 图 1 青岛大气气溶胶中颗粒物、总Fe、溶解态Fe的浓度及Fe的溶解度 Fig. 1 Temporal variation of TSP,total Fe,soluble Fe concentrations and Fe solubility in aerosols collected in Qingdao |
与世界其他地区相比(表 1),青岛气溶胶中Fe的总浓度处于中等偏高的水平,溶解度与Hsu等(2010)报道的东海沙尘期间气溶胶中Fe在纯水中的溶解度(1.4%)相近,但低于非沙尘期间Fe溶解度(7.7%).同样地,本结果与Shi等(2013)在黄海沙尘期间观测的气溶胶中Fe在酸性缓冲液中的溶解度(1.65%)相当,但远低于非沙尘期间Fe溶解度(8.76%).与2009年2—8月在黄海观测的结果相比(Zhang et al., 2013),气溶胶Fe在海水中4.3%的溶解度高于本研究以纯水为介质的观测结果.通常而言,Fe在纯水或酸性缓冲液中的溶解度要比在海水中高1~2倍(Chen et al., 2006),因此,可以推测,若在相同介质下溶解度结果相差可能会更大.Aguilar-Islas等(2010)研究报道,在西太平洋近岸Fe溶解度可达6.5%,而在北太平洋海域可达11.9%~13.1%.这些结果的差异与Fe溶出介质的选择有关,也与气溶胶来源和铁的矿物组成,以及远距离输送过程中所经历的大气过程不同等有关(Aguilar-Islas et al., 2010;Baker et al., 2010).
| 表1 世界各地大气气溶胶中Fe溶解度的比较 Table 1 Comparison of total Fe concentraions and Fe solubility in aerosols in different regions worldwide |
气溶胶中Fe溶解度随总Fe浓度增加呈规律性减小(图 2),二者之间基本呈负对数关系.总铁浓度较低时,Fe溶解度变化幅度较大.一些研究也同样发现,Fe溶解度会随着颗粒物浓度和总Fe浓度的增加而减小(Baker et al., 2006;Mendez et al., 2010;Baker et al., 2010).之前有研究指出,造成这一结果的原因可能是在萃取过程中Fe含量高的颗粒物溶解达到了饱和(Baker et al., 2006a),然而,在一些设计用来避免萃取饱和的实验中也同样得到了此类结果(Sedwick et al., 2007).Baker和Jickells(2006b)将这种总量和溶解度的关系归因于颗粒物相对表面积的大小,也就是颗粒物表面积与体积之比.众所周知,在远距离传输过程中,沙尘颗粒物浓度会随着传输时间和距离的增加而减小(Meskhidze et al., 2005),而且其平均大小也会因传输过程中粗颗粒的优先沉降而减小,颗粒物变得越小则使越大部分的体积暴露,从而更有利于其中Fe的溶解.利用观测期间同时采集的颗粒物数浓度谱数据,计算每个样品采集期间颗粒物表面积与体积之比,发现青岛气溶胶中Fe溶解度与颗粒物表面积/体积比有一定的相关关系(r=0.475,p=0.007),表明Fe溶解度与颗粒物的大小有关.
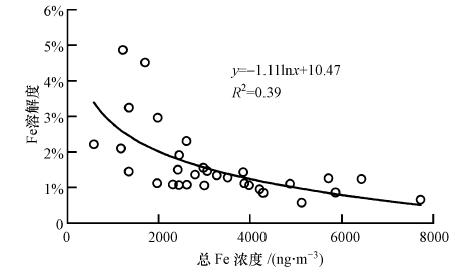 |
| 图 2 青岛大气气溶胶中总Fe浓度和Fe溶解度的关系 Fig. 2 Correlations of Fe solubility versus total iron in aerosols in Qingdao |
但Baker和Croot(2010)的研究指出,颗粒物大小的变化并不是造成溶解度随总铁浓度变化的唯一原因.Shi等(2011)通过测定撒哈拉沙尘样品不同粒径颗粒物中Fe溶解度时也发现,颗粒物大小所造成的Fe溶解度变化最多只能对大气气溶胶中Fe溶解度所存在的差异做出一小部分解释,沙尘中Fe有着难溶解的特性,未经历大气过程的沙尘颗粒中Fe的溶解度将很难超过1%(Mahowald et al., 2005;Shi et al., 2011).
3.3 气溶胶来源对Fe溶解度的影响后向轨迹常用来判断大气样品采集期间气团的来源.利用美国国家海洋和大气局(NOAA)的HYSPLIT后向轨迹模式(Draxler et al.,2012;Rolph,2012)及美国国家环境预报中心(NCEP)/国家大气研究中心(NCAR)再分析资料(NCEP/NCAR Reanalysis Data,ftp://arlftp.arlhq.noaa.gov/pub/archives/ reanalysis),计算每个样品采集期间气团在500 m处的72 h后向轨迹(计算起始时间选取每个样品采集的结束时刻),并利用HYSPLIT进行聚类分析.结果显示,气团后向轨迹大致可分为两组(图 3):第1组气团主要受到华北城市人为源(Anthropogenic-Source,AS)影响,第2组气团主要受北方沙漠地区沙尘源(Dust-Source,DS)的影响,二者占总样品数的比例分别为35.5%和64.5%.AS组中Fe溶解度平均为2.06%,DS组中的为1.36%.其中,DS组中Fe溶解度与黄海和东海沙尘期间气溶胶Fe溶解度非常接近(Hsu et al., 2010;Shi et al., 2013).Fe溶解度最高(4.86%和4.51%)的两个样品均来自AS组,12月12日样品(4.86%)气团起源自中国东北近岸城市经过黄海上空传输到达采样点,12月14日样品(4.51%)气团起源自华北城市群向北传输后穿越渤海上空到达采样点.而Fe溶解度最低(0.57%和0.66%)的两个样品均来自DS组,分别为12月4日和5日的样品,二者起源自北方大陆沙漠地区并经长距离高空传输到达采样点.显然,气溶胶中Fe溶解度与气团来源有关,但气团来源对Fe溶解度的影响可能有两方面的原因,其一是不同气团来源的气溶胶中Fe的初始来源或组成可能不同,如矿物沙尘所带来的Fe的溶解度要远低于岩粉和煤灰所带来的Fe的溶解度(Schroth et al., 2009);其二是不同气团来源的气溶胶可能经历了不同的大气过程,如气溶胶在远距离传输过程中,在云中经历的多次蒸发/凝结循环的云过程,或者与酸性污染物混合的酸化过程都可能增大Fe溶解度(Mackie et al., 2005;Bonneville et al., 2009).
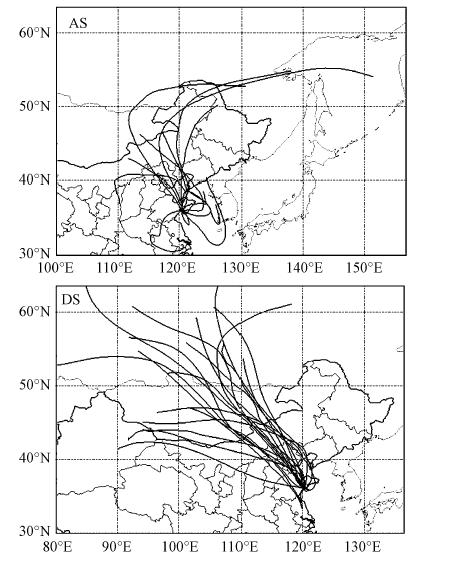 |
| 图 3 青岛采样点气团72 h后向轨迹聚类分析图(500 m高度) Fig. 3 Cluster analysis of 72 h air mass back trajectories for aerosols collected in Qingdao(height:500 m) |
富集因子(EF)常用于判断气溶胶中元素的来源,一般认为,当EF等于或接近1时,可以认为该元素为地壳源所控制,当EF越高时,人为污染源的贡献程度就越大(Chester et al., 1993).以Al为地壳源参比元素,计算青岛气溶胶中Fe的EF,结果显示其为0.96~3.24,平均为1.55,这表明青岛气溶胶中的Fe主要来自地壳源,小部分来自人为源.对AS和DS组中Fe的EF进行分析,发现两组样品的EF基本相当,分别为1.54和1.55,这表明两组样品中Fe的初始来源或组成相似.因此,两组样品溶解度的差异不是Fe的初始来源或组成造成的,而可能是气溶胶远距离迁移中的大气过程不同造成的.
3.4 酸化过程对Fe溶解度的影响大量的实验研究已经表明,Fe的溶解度在很大程度上取决于与其接触的水介质的pH(Cornell et al.,2003;Bonneville et al., 2009).气溶胶传输过程中与大气酸性污染物混合发生的酸化反应可能是增加气溶胶中Fe溶解度的重要原因之一(Meskhidze et al., 2003).一些研究也表明,过渡金属元素可以作为SO2、O3和有机污染物在云中转化的催化剂,从而改变云滴pH并最终影响Fe的溶解度(Desboeufs et al., 2001).气溶胶中的酸性离子主要为NO3-和SO42-,其前体物主要是人为酸性污染物NOx和SO2.由于海盐粒子对气溶胶中的SO42-也有一定的贡献,因此,为反映人为污染的影响需计算非海盐(nss)SO42-的浓度.根据海水中SO42-与Na+的质量比值(0.2455)及气溶胶中SO42-和Na+的质量浓度,由 [nss-SO42-]= [SO42-]- 0.2455× [Na+]计算nss-SO42-的浓度.分析青岛气溶胶中溶解态Fe与NO3-、nss-SO42-及有机酸离子之间的关系,发现溶解态Fe与无机、有机的酸性离子存在显著正相关关系(表 2).另外,在Fe溶解度最大的样品中,酸性离子(NO3-、nss-SO42-和CH3COO-)的总浓度为16.4 μg · m-3,为颗粒物质量浓度的27.6%,远高于Fe溶解度最小的样品中酸性离子的浓度和对颗粒物质量的贡献(7.4 μg · m-3,5.3%).这些结果表明大气酸化过程对青岛气溶胶中的Fe溶解度有一定影响.
| 表2 青岛大气气溶胶中溶解态Fe与酸性离子相关性分析 Table 2 Correlation analysis of acid species and soluble Fe for aerosols collected in Qingdao |
进一步分析受不同气团来源影响的气溶胶中酸性离子对Fe溶解度的影响,发现AS组和DS组样品中Fe溶解度与各酸性离子均有显著的相关关系(表 3),但AS组中的相关关系明显好于DS组,表明AS组样品可能经历了更多的大气酸化过程,这一结果与气团后向轨迹分析显示的AS组样品比DS组受到更多的人为源影响相一致.
| 表3 AS和DS组中Fe溶解度与酸性离子相关性分析 Table 3 Correlation analysis of Fe solubility and acid species both in AS and DS groups |
1)青岛大气气溶胶中总Fe和溶解态Fe的浓度分别为578~7723 ng · m-3和12.8~79.7 ng · m-3,平均分别为3248 ng · m-3和43.3 ng · m-3.气溶胶中Fe溶解度为0.57%~4.86%,平均为1.63%,与黄海、东海沙尘期间的观测结果相近,但明显低于其非沙尘期间的结果.与世界其他地区相比,观测期间青岛气溶胶中Fe溶解度处于较低水平.
2)气溶胶中总Fe与颗粒物的质量浓度呈现显著线性关系.随着气溶胶中总Fe(或颗粒物)浓度增加,Fe溶解度呈对数降低.观测期间,青岛气溶胶中Fe溶解度与颗粒物表面积/体积比有一定的相关关系,表明Fe溶解度与颗粒物的大小有关.
3)气团后向轨迹的聚类分析显示,观测期间,64.5%的气溶胶样品主要受北方沙尘源(DS)影响,35.5%的样品主要受到华北城市群等人为源(AS)影响.AS组样品中Fe溶解度平均为2.06%,约为DS组样品的1.5倍.造成两组样品Fe溶解度差异的主要原因可能是大气酸化过程,而非气溶胶中Fe的初始来源或组成.
| [1] | Aguilar-Islas A M, Wu J F, Rember R, et al. 2010. Dissolution of aerosol-derived iron in seawater: Leach solution chemistry, aerosol type, and colloidal iron fraction [J]. Marine Chemistry, 120(1/4): 25-33 |
| [2] | Baker A R, Jickells T D. 2006a. Mineral particle size as a control on aerosol iron solubility [J]. Geophysical Research Letters, 33(17): L17608, doi: 10.1029/2006GL026557 |
| [3] | Baker A R, Jickells T D, Witt M, et al. 2006b. Trends in the solubility of iron, aluminium, manganese and phosphorus in aerosol collected over the Atlantic Ocean [J]. Marine Chemistry, 98(1): 43-58 |
| [4] | Baker A R, Croot P L. 2010. Atmospheric and marine controls on aerosol iron solubility in seawater [J]. Marine Chemistry, 120(1/4): 4-13 |
| [5] | Bonnet S, Guieu C. 2004. Dissolution of atmospheric iron in seawater [J]. Geophysical Research Letters, 31(3), doi: 10.1029/2003GL018423 |
| [6] | Bonneville S, Behrends T, Van Cappellen P. 2009. Solubility and dissimilatory reduction kinetics of iron (III) oxyhydroxides: A linear free energy relationship [J]. Geochimica et Cosmochimica Acta, 73(18): 5273-5282 |
| [7] | Boyd P W, Jickells T, Law C S, et al. 2007. Mesoscale iron enrichment experiments 1993-2005: Synthesis and future directions [J]. Science, 315(5812): 612-617 |
| [8] | Chen Y, Street J, Paytan A. 2006. Comparison between pure-water-and seawater-soluble nutrient concentrations of aerosols from the Gulf of Aqaba [J]. Marine Chemistry, 101(1/2): 141-152 |
| [9] | Chester R, Murphy K J T, Lin F J, et al. 1993. Factors controlling the solubilities of trace metals from non-remote aerosols deposited to the sea surface by the ‘dry’ deposition mode [J]. Marine Chemistry, 42(2): 107-126 |
| [10] | Chuang P Y, Duvall R M, Shafer M M, et al. 2005. The origin of water soluble particulate iron in the Asian atmospheric outflow [J]. Geophysical Research Letters, 32(7), doi: 10.1029/2004GL021946 |
| [11] | Cornell R M, Schwertmann U. 2003. The Iron Oxides: Structure, Properties, Reactions, Occurrences and Uses [M]. Cambridge: John Wiley & Sons |
| [12] | Desboeufs K V, Losno R, Colin J L. 2001. Factors influencing aerosol solubility during cloud processes [J]. Atmospheric Environment, 35(20): 3529-3537 |
| [13] | Draxler R R, Rolph G D. 2012. HYSPLIT (Hybrid Single-Particle Lagrangian Integrated Trajectory) Model access via NOAA ARL READY Website [OL]. Silver Spring: NOAA Air Resources Laboratory, 2012-12-01.http://ready.arl.noaa.gov/HYSPLIT.php |
| [14] | Duvall R M, Majestic B J, Shafer M M, et al. 2008. The water-soluble fraction of carbon, sulfur, and crustal elements in Asian aerosols and Asian soils [J]. Atmospheric Environment, 42(23): 5872-5884 |
| [15] | Falkowski P G, Barber R T, Smetacek V. 1998. Biogeochemical controls and feedbacks on ocean primary production [J]. Science, 281(5374): 200-206 |
| [16] | Guerzoni S, Molinaroli E, Rossini P, et al. 1999. Role of desert aerosol in metal fluxes in the Mediterranean area [J]. Chemosphere, 39(2): 229-246 |
| [17] | Hsu S C, Lin F J, Jeng W. 2005. Seawater solubility of natural and anthropogenic metals within ambient aerosols collected from Taiwan coastal sites [J]. Atmospheric Environment, 39(22): 3989-4001 |
| [18] | Hsu S C, Wong G T F, Gong G C, et al. 2010. Sources, solubility, and dry deposition of aerosol trace elements over the East China Sea [J]. Marine Chemistry, 120(1/4): 116-127 |
| [19] | Jickells T D, An Z S, Andersen K K, et al. 2005. Global iron connections between desert dust, ocean biogeochemistry, and climate [J]. Science, 308 (5718): 67-71 |
| [20] | Kumar A, Sarin M M. 2010. Aerosol iron solubility in a semi-arid region: temporal trend and impact of anthropogenic sources [J]. Tellus B, 62(2): 125-132 |
| [21] | Mackie D S, Boyd P W, Hunter K A, et al. 2005. Simulating the cloud processing of iron in Australian dust: pH and dust concentration [J]. Geophysical Research Letters, 32(6): L06809, doi: 10. 1029/2004GL022122 |
| [22] | Mahowald N M, Baker A R, Bergametti G, et al. 2005. Atmospheric global dust cycle and iron inputs to the ocean [J]. Global Biogeochemical Cycles, 19(4): GB4025, doi: 10.1029/2004GB002402 |
| [23] | Martin J H, Gordon R M. 1988. Northeast Pacific iron distributions in relation to phytoplankton productivity [J]. Deep Sea Research (Part A. Oceanographic Research Papers), 35(2): 177-196 |
| [24] | Mendez J, Guieu C, Adkins J. 2010. Atmospheric input of manganese and iron to the ocean: Seawater dissolution experiments with Saharan and North American dusts [J]. Marine Chemistry, 120(1/4): 34-43 |
| [25] | Meskhidze N, Chameides W L, Nenes A, et al. 2003. Iron mobilization in mineral dust: Can anthropogenic SO2 emissions affect ocean productivity?[J]. Geophysical Research Letters, 30(21): 2085, doi: 10.1029/2003GL018035 |
| [26] | Meskhidze N, Chameides W L, Nenes A. 2005. Dust and pollution: a recipe for enhanced ocean fertilization?[J]. Journal of Geophysical Research: Atmospheres, 110(D3): 301, doi: 10.1029/2004JD005082 |
| [27] | Morel F M M, Price N M. 2003. The biogeochemical cycles of trace metals in the oceans [J]. Science, 300(5621): 944-947 |
| [28] | Mori I, Nishikawa M, Shimizu A, et al. 2011. Solubility of Iron in the Aerosol Collected during Kosa (Asian Dust) Events in Japan [J]. SOLA, 7A(Special-Edition): 5-8 |
| [29] | Rolph G D. 2012. Real-time Environmental Applications and Display system (READY) Website [OL]. Silver Spring: NOAA Air Resources Laboratory, http://ready.arl.noaa.gov |
| [30] | Schroth A W, Crusius J, Sholkovitz E R, et al. 2009. Iron solubility driven by speciation in dust sources to the ocean [J]. Nature Geoscience, 2(5): 337-340 |
| [31] | Sedwick P N, Sholkovitz E R, Church T M. 2007. Impact of anthropogenic combustion emissions on the fractional solubility of aerosol iron: evidence from the Sargasso Sea [J]. Geochemistry, Geophysics, Geosystems, 8(10): Q10Q06, doi: 10.1029/2007GC001586 |
| [32] | Seguret M J M, Kocak M, Theodosi C, et al. 2011. Iron solubility in crustal and anthropogenic aerosols: The Eastern Mediterranean as a case study [J]. Marine Chemistry, 126(1/4): 229-238 |
| [33] | 石金辉,张云,李瑞芃,等. 2010.东海大气气溶胶中无机氮组分的分布特征[J].环境科学, 31(12): 2835-2843 |
| [34] | Shi J H, Zhang J, Gao H W, et al. 2013. Concentration, solubility and deposition flux of atmospheric particulate nutrients over the Yellow Sea [J]. Deep Sea Research (Part II: Topical Studies in Oceanography), 97: 43-50 |
| [35] | Shi Z B, Woodhouse M T, Carslaw K S, et al. 2011. Minor effect of physical size sorting on iron solubility of transported mineral dust [J]. Atmospheric Chemistry and Physics, 11: 8459-8469 |
| [36] | Taylor S R.1964. Trace element abundances and the chondritic earth model[J]. Geochimica et Cosmochimica Acta, 28(12): 1989-1998 |
| [37] | Trapp J M, Millero F J, Prospero J M. 2010. Trends in the solubility of iron in dust-dominated aerosols in the equatorial Atlantic trade winds: Importance of iron speciation and sources [J]. Geochemistry, Geophysics, Geosystems, 11(3), doi: 10.1029/2009GC002651 |
| [38] | 于丽敏,祁建华,孙娜娜,等. 2007.南、黄海及青岛地区大气气溶胶中无机氮组分的研究[J].环境科学学报, 27(2): 319-325 |
| [39] | Zhang T R, Shi J H, Gao H W, et al. 2013. Impact of source and atmospheric processing on Fe solubility in aerosols over the Yellow Sea, China [J]. Atmospheric Environment, 75: 249-256 |
 2015, Vol. 35
2015, Vol. 35


