2. 中国科学院大学资源与环境学院, 北京 100049
2. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049
地下水砷污染是全球性环境问题,亚洲尤其严重,特别是印度和孟加拉国等南亚和东南亚国家(Smedley et al., 2002; Basu et al., 2014).《科学》杂志报道,中国有近2000万人生活在地下水源遭到砷污染的高危地区(Rodríguez-Lado et al., 2013).自然水体中,砷通常以五价或三价的无机砷形态存在,地下水中砷的浓度通常低于1 mg · L-1(Smedley et al., 2002).大量证据表明,无机砷是一种剧毒物质,急性砷中毒会导致呕吐、腹痛和腹泻,而长期接触低浓度砷也会导致严重疾病,如皮肤癌、肺癌、膀胱癌和肾癌等(Basu et al., 2014).世界卫生组织建议饮用水中的砷浓度不能高于10 μg · L-1.因此,砷污染地下水的有效处理材料与技术成为当前水处理研究的热点和难点.
目前,含砷水的处理方法主要有电絮凝、化学絮凝沉淀、离子交换、膜过滤和吸附.对于水体中低浓度砷,吸附法具有成本低和效率高的优点,是处理砷污染地下水的较理想方法(常方方等,2006; Zha et al., 2013).铁氧化物是一种高效价廉的砷吸附剂,尤其是纳米颗粒铁氧化物,具有对砷吸附速率快、选择性强、吸附容量大等优点(Zhang et al., 2013).但纳米铁氧化物粒径较小,使用后不易分离和再生,易造成二次污染,限制了其作为除砷吸附剂的广泛应用.研究表明,将纳米铁氧化物负载到高分子材料上可以克服以上缺点(Marques Neto et al., 2013),但负载在粒径较大的高分子材料上,会降低纳米粒子的吸附容量和吸附速率.
静电纺丝技术是利用高压静电场将高分子溶液制备成直径为纳米尺度的长纤维的一种技术.静电纺丝纳米纤维具有直径细、比表面积大和孔隙率高等优点(Aliabadi et al., 2013),是一种较理想的水处理材料.壳聚糖是广泛存在的天然生物高分子甲壳素的脱乙酰氨基产物,其分子链上含有丰富的氨基、羟基和羰基,对重金属离子具有较强的亲和力(Vandenbossche et al., 2013).与合成有机高分子相比,壳聚糖作为载体具有抗菌性、可降解性和原料来源丰富等优点.因此,本研究拟采用高压静电纺丝技术,制备负载有铁氧化物的壳聚糖复合纳米纤维,系统表征其结构,并评价其对水中低浓度五价砷的吸附性能.
2 实验部分(Experimental section) 2.1 试剂与仪器乙酸(HAc)、氢氧化钠(NaOH)、盐酸(HCl)、氯化钠(NaCl)、六水合三氯化铁(FeCl3 · 6H2O)、氨水(NH4 · OH)和砷酸钠(Na3AsO4 · 12H2O)均为分析纯,购自国药集团化学试剂有限公司.壳聚糖(Chitosan)购于浙江金壳生物化学有限公司.腐殖酸(Humid Acid)购于天津市光复精细化工研究所.
2.2 纳米纤维的制备在5%壳聚糖溶液中加入0.24 g FeCl3,磁力搅拌至FeCl3溶解,得到纺丝溶液;将纺丝溶液置于10 mL注射器中进行高压静电纺丝,纺丝参数如下:电压16 kV,喷丝头内径0.5 mm,纺丝液流速1.0 mL · h-1,喷丝头到接收滚筒的距离为15 cm,接收滚筒转速(3000±100)r · min-1,环境温度(30±5)℃,相对湿度50%±5%;纺丝完成后将膜置于氨气中熏蒸,然后用去离子水清洗纤维3次,于60 ℃烘箱中干燥备用.
2.3 纳米纤维微观结构表征场发射扫描电子显微镜(SEM,S-4800,日本Hitachi公司)用于观察复合纳米纤维表面的微观结构;X-射线衍射仪(XRD,X’Pert Pro,荷兰PANalytical公司)用于纳米纤维结晶相的分析.
2.4 纳米纤维吸附砷的实验称取一定质量纳米纤维,加入到盛有25 mL浓度为200 μg · L-1五价砷溶液的50 mL具塞玻璃瓶中,吸附剂投加量为0.2 g · L-1;用1 mol · L-1 NaOH或1 mol · L-1 HCl调节溶液pH;将混合液置于转速为200 r · min-1的旋转式摇床;吸附达到动态平衡后,取上清液用0.45 μm滤膜过滤,用电感耦合等离子体质谱仪(Agilent 7500cx,日本Agilent公司)检测滤液中砷浓度.
pH影响实验中砷溶液初始pH为3.0~11.3;等温线实验中砷的初始浓度为0.05 ~20 mg · L-1;动力学实验中砷的浓度为200 μg · L-1或450 μg · L-1,吸附液体积为200 mL,每个时间点取样3 mL;以腐殖酸(HA)为代表考察有机质对砷吸附的影响,HA浓度(TOC)用总有机碳分析仪(TOC-V CPH,日本SHIMADZU公司)测定;吸附剂再生实验中,将吸附砷的吸附剂浸泡于0.002 mol · L-1 NaOH溶液中脱吸附3 h后,用去离子水冲洗5遍.
3 结果与讨论(Results and discussion) 3.1 纳米纤维特性表征 3.1.1 纳米纤维表面形貌观察图 1a是所制备的的纳米纤维的扫描电镜图,可以看出,该纳米纤维连续、光滑、无串珠,纤维间孔隙多且没有粘连,这些特性将有利于吸附过程中污染物的扩散,加快吸附进程.图 1b给出了纳米纤维的直径分布,结果表明,该纤维直径为(158±24)nm,呈现较好的正态分布,表明所制备纤维具有纳米尺寸.
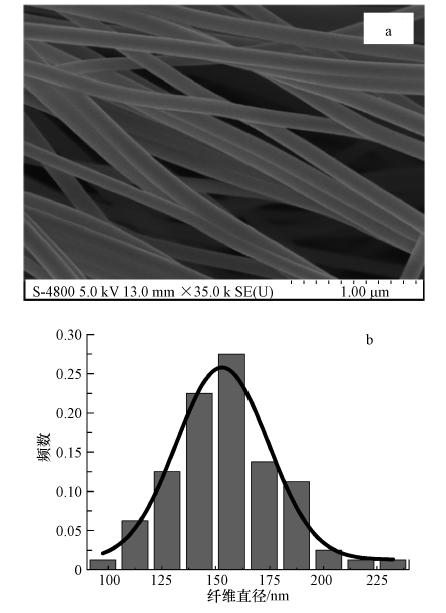 |
| 图 1 铁/壳聚糖复合纳米纤维扫描电镜图(a)和纳米纤维直径分布(b) Fig. 1 SEM images(a) and distribution of fiber diameter(b) |
图 2显示了该膜的XRD衍射图谱.在2θ为8°~24°的范围内存在3个特征峰;2θ为10°的特征峰是壳聚糖分子中—NH2的不规则衍射峰;而2θ介于12°~24°范围内的2个衍射峰与壳聚糖分子链内和链间的折叠相关(Marques Neto et al., 2013).上述衍射峰峰型平缓,表明铁/壳聚糖复合纳米纤维为不定型结构,可能是由于静电纺丝时溶剂的迅速挥发,导致壳聚糖分子来不及形成结晶.
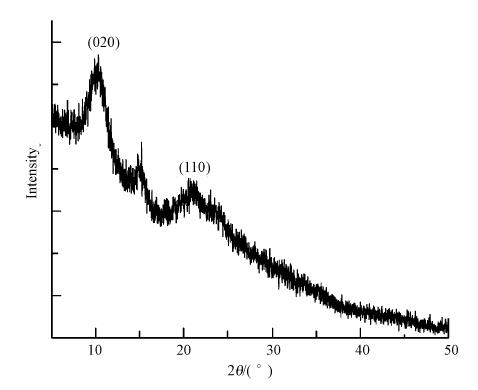 |
| 图 2 铁/壳聚糖复合纳米纤维XRD衍射图 Fig. 2 X-ray diffraction pattern of Iron/chitosan nanofiber |
溶液pH会改变污染物的存在形态和吸附剂表面荷电特性,因此,pH通常会对吸附性能造成显著影响.图 3给出了复合纳米纤维吸附剂投加前后砷溶液pH的变化,以及对砷吸附的影响结果.在酸性或中性条件下(溶液初始pH=3~7.5),纳米纤维对砷的吸附去除效率高于93%;当初始pH>7.5时,随着pH的升高,吸附率显著下降;当初始pH为11.3时,对砷没有去除效果,表明可以通过溶液pH的调整实现吸附剂的再生.本文pH的影响结果与Shan等(2013)的报导类似,该现象可能归因于吸附剂与吸附质间的静电作用力(Mahanta et al., 2013).酸性条件下,由于质子化吸附剂表面带正电(如溶液初始pH为3时,加入吸附剂后平衡pH为4.3,表明溶液中的H+被吸附到吸附剂表面,使吸附剂带正电),与带负电的砷酸根离子存在较强的静电吸引力,促进吸附的进行,吸附去除效率高;随着溶液pH的升高,吸附剂表面正电荷逐渐减少,此时吸附剂对砷的静电吸引力减弱,吸附效率降低;当溶液pH继续增大,吸附剂表面由带正电变为带负电,吸附剂与砷作用力静电斥力增强,导致吸附效率显著下降.实际地下水一般呈中性或弱碱性,在该pH条件下,铁/壳聚糖复合纳米纤维对五价砷的吸附去除效率较高.
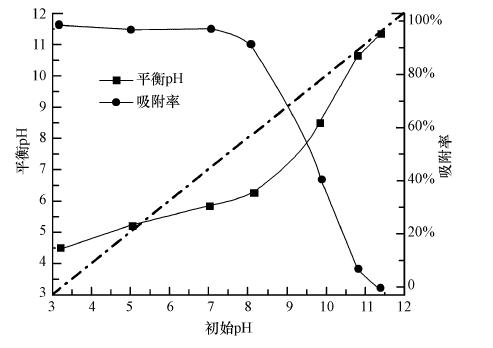 |
| 图 3 溶液pH值对铁/壳聚糖复合纳米纤维吸附砷的影响(C0= 200 μg · L-1,温度25 ℃,吸附剂投加量0.2 g · L-1) Fig. 3 Effect of solution pH on adsorption of As(V)by iron/chitosan composite nanofiber(C0= 200 μg · L-1,T=25 ℃,dosage=0.2 g · L-1) |
吸附动力学用于描述吸附剂对吸附质的吸附反应快慢.图 4给出了砷起始浓度200 μg · L-1、平衡 pH=7.0时,纳米纤维吸附砷的动力学过程.结果表明,纳米纤维对砷的吸附速率较快,50 min内的吸附量可达到平衡吸附量的87%,随后吸附速率逐渐降低,在100 min后达到动态吸附平衡,此时对五价砷的去除率为98%.当五价砷起始浓度为450 μg · L-1时,吸附平衡时间为160 min,去除率为97.5%(图 4).
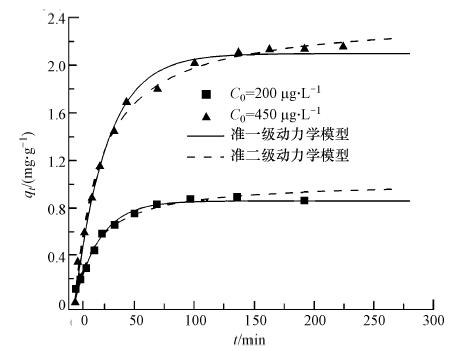 |
| 图 4 铁/壳聚糖复合纳米纤维对砷的吸附动力学(平衡pH=7.0,温度25 ℃,吸附剂投加量0.2 g · L-1) Fig. 4 Kinetics of As(V)adsorption onto iron/chitosan composite nanofiber(pH=7.0,T=25 ℃,dosage 0.2 g · L-1) |
为了更好地了解吸附动力学过程,用准一级动力学模型(1)和准二级动力学模型(2)对实验数据进行拟合.
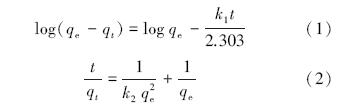
式中,t为吸附时间(min),qt表示t时刻的吸附量(mg · g-1),qe为平衡吸附量(mg · g-1),k1和k2分别是准一级(min-1)和准二级(g · mg-1 · min-1)吸附速率常数.拟合曲线及结果见图 4和表 1,结果显示,准二级动力学模型能够更好地用于描述纳米纤维对五价砷的吸附动力学过程.
| 表1 准一级和准二级动力学模型拟合结果 Table 1 Parameters of pseudo-first-order and pseudo-second-order kinetic models |
吸附等温线用于描述不同平衡浓度下吸附剂的吸附量,通过拟合可得到最大吸附容量.Langmuir方程(3)和Freundlich方程(4)是常用的描述吸附平衡的等温线数学模型(Boddu et al., 2008).
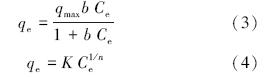
式中,qmax表示最大吸附容量(mg · g-1);Ce为平衡浓度(mg · L-1)b为Langmuir方程常数,与吸附剂、吸附质本性及温度有关,反映亲和力,b越大吸附亲和力越强; K为Freundlich常数;n为非线性因子,与吸附强度有关,n大于1表示吸附容易进行,n小于0.5表示吸附很难进行.
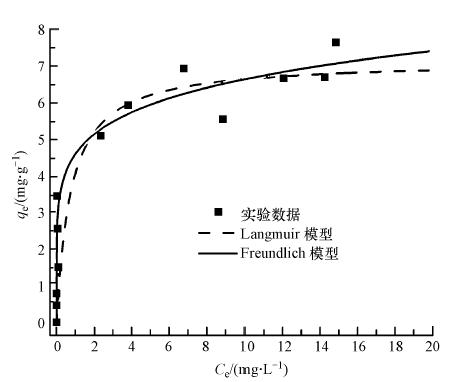
图 5给出了纳米纤维吸附五价砷的等温线实验结果.数据显示,在低浓度范围,随着平衡浓度的增加,吸附容量快速增加,表明纳米纤维对低浓度砷有很强的亲和力.在平衡pH=7.0的条件下,吸附剂可将750 μg · L-1的砷降低到10 μg · L-1以下的安全饮用水水平.
 |
| 图 5 铁/壳聚糖纳米纤维对砷的吸附等温线(平衡pH=7.0,温度25 ℃,吸附剂投加量0.2 g · L-1) Fig. 5 Adsorption isotherm of As(V)on iron/chitosan composite nanofiber(pH=7.0,T=25 ℃,dosage 0.2 g · L-1) |
等温线方程拟合结果如图 5所示,相应的方程参数列于表 2. 结果表明,Freundlich方程(R2=0.94)能更好地描述纳米纤维对五价砷的吸附等温线数据.基于Freundlich方程的假设推断,纳米纤维对砷的吸附可能为多分子层吸附,且n值等于6.32,远大于2,说明五价砷在实验条件下极易被纳米纤维吸附.根据Langmuir等温线方程的拟合结果,纳米纤维对五价砷的最大吸附量为7.1 mg · g-1.表 3给出了文献报道的壳聚糖基砷吸附剂的吸附等温线参数,与本文的铁/壳聚糖复合纳米纤维进行比较.结果说明,在pH为中性条件下,铁/壳聚糖复合纳米纤维对五价砷的最大吸附容量是未改性壳聚糖吸附剂的3~14倍(Gerente et al., 2005; Chen et al., 006),比用其它方法进行改性的壳聚糖吸附效果好(Miller et al., 2010; Horzum et al., 2013);需要强调的是,纳米纤维的吸附平衡时间明显比其它吸附剂短.上述结果表明,铁/壳聚糖复合纳米纤维在去除水中低浓度五价砷中有较好的应用前景.
| 表2 吸附等温线拟合结果 Table 2 Langmuir and Freundlich isotherm parameters of As(V)adsorption |
| 表3 壳聚糖相关吸附剂对砷的吸附效果比较 Table 3 Maximum As(V)adsorption capacity of chitosan related adsorbents reported in literature |
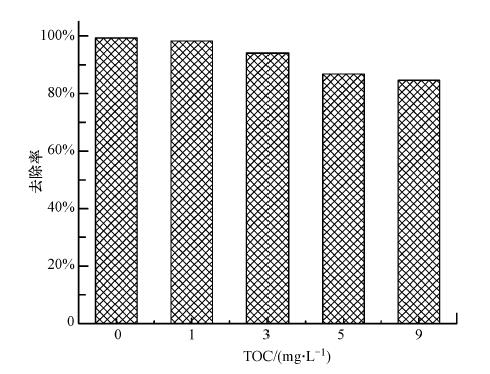
地下水成分复杂,含有多种成分,腐殖质等有机质是其中重要一类.有机质可能与砷竞争吸附剂表面的活性位点,导致吸附容量的下降.本实验以腐殖酸作为有机质代表,腐殖酸的含量用总有机碳(TOC)计,考察了其对纳米纤维吸附五价砷的影响,实验结果如图 6所示.当腐殖酸浓度(TOC)逐渐上升时,膜对砷的吸附去除效率缓慢下降;当含有1 mg · L-1 TOC时,纳米纤维对砷的去除率从99.3%稍微降低到98.3%;当TOC含量为9 mg · L-1时,吸附去除率降低到84.7%,说明高浓度的有机质会竞争纳米纤维上的吸附位点. 但通常饮用水源里的有机质含量低于2 mg · L-1,因此,该纳米纤维能够有效地应用于含有一定量有机质的砷污染地下水的处理.
 |
| 图 6 腐殖质对铁/壳聚糖复合纳米纤维吸附砷的影响(C0=200 μg · L-1,平衡pH=7.0,温度25 ℃,吸附剂投加量0.2 g · L-1) Fig. 6 Effect of humid substance on the adsorption of As(V)by Fe/chitosan composite nanofiber(C0=200 μg · L-1,pH=7.0,T= 25 ℃,dosage=0.2 g · L-1) |
可再生利用是评判一个吸附剂理想与否的重要标准.根据前面的pH影响实验,用0.002 mol · L-1的低浓度NaOH作为洗脱液对纤维进行再生,图 7所示为连续5次的吸附-脱吸附循环的实验结果.与第1次吸附-脱吸附相比,经过5次的吸附-脱吸附循环,纳米纤维对砷去除率和脱附率仍然保持在98%和99%.表明铁/壳聚糖复合纳米纤维具有很好的再生重复利用性能,而且只需低浓度的碱作为洗脱液.
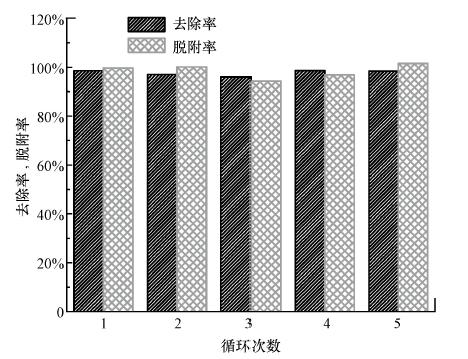 |
| 图 7 铁/壳聚糖复合纳米纤维吸附砷的再生利用(C0=200 μg · L-1,温度25 ℃,吸附剂投加量0.2 g · L-1,0.002 mol · L-1 NaOH为洗脱液) Fig. 7 Recycle of the iron/chitosan composite nanofiber(C0=200 μg · L-1,T=25 ℃,dosage 0.2 g · L-1,0.002 mol · L-1 NaOH as eluent) |
1)应用高压静电纺丝方法,成功制备了新型铁氧化物/壳聚糖复合纳米纤维吸附剂.结果显示,该纤维是无定形结构,平均直径为(158±24)nm.在偏酸性或中性条件下,该吸附剂对砷的吸附效率大于93%;且吸附反应速率快,100 min内可达到吸附平衡,吸附动力学符合准二级动力学模型.
2)该吸附剂对低浓度砷有很强吸附亲和力,中性条件下,0.2 g · L-1吸附剂可处理750 μg · L-1的砷到10 μg · L-1以下的安全饮用水水平;对砷的最大吸附容量为7.1 mg · g-1,吸附等温线可以用Freundlich模型描述.
3)较低浓度有机质对该吸附剂吸附砷的影响较小,并可用低浓度碱再生,重复利用性强.
4)该新型纳米纤维吸附剂制备方法简单,具有吸附快、吸附容量较高和易分离再生的优点,在饮用水除砷方面有较好的应用前景.需要应用吸附柱和膜过滤实验对其吸附砷的性能进行深入研究.
| [1] | Aliabadi M, Irani M, Ismaeili J, et al. 2013. Electrospun nanofiber membrane of PEO/Chitosan for the adsorption of nickel, cadmium, lead and copper ions from aqueous solution [J]. Chemical Engineering Journal, 220: 237-243 |
| [2] | Basu A, Saha D, Saha R, et al. 2014. A review on sources, toxicity and remediation technologies for removing arsenic from drinking water [J]. Research on Chemical Intermediates, 40(2): 447-485 |
| [3] | Boddu V M, Abburi K, Talbott J L, et al. 2008. Removal of arsenic (Ⅲ) and arsenic (V) from aqueous medium using chitosan-coated biosorbent [J]. Water Research, 42(3): 633-642 |
| [4] | Chen C C, Chung Y C. 2006. Arsenic removal using a biopolymer chitosan sorbent [J]. Journal of Environmental Science and Health (Part A: Toxic/Hazardous Substances and Environmental Engineering), 41(4): 645-658 |
| [5] | 常方方,曲久辉,刘锐平,等. 2006.铁锰复合氧化物的制备及其吸附除砷性能[J].环境科学学报, 26(11): 1769-1774 |
| [6] | Gerente C, McKay G, Andres Y, et al. 2005. Interactions of natural aminated polymers with different species of arsenic at low concentrations: Application in water treatment [J]. Adsorption, 11(1): 859-863 |
| [7] | Horzum N, Demir M M, Nairat M, et al. 2013. Chitosan fiber-supported zero-valent iron nanoparticles as a novel sorbent for sequestration of inorganic arsenic [J]. RSC Advances, 3(21): 7828-7837 |
| [8] | Mahanta N, Valiyaveettil S. 2013. Functionalized poly(vinyl alcohol) based nanofibers for the removal of arsenic from water [J]. RSC Advances, 3(8): 2776-2783 |
| [9] | Marques Neto J D O, Bellato C R, Milagres J L, et al. 2013. Preparation and evaluation of chitosan beads immobilized with Iron(Ⅲ) for the removal of As(Ⅲ) and As(V) from water [J]. Journal of the Brazilian Chemical Society, 24(1): 121-132 |
| [10] | Miller S M, Zimmerman J B. 2010. Novel, bio-based, photoactive arsenic sorbent: TiO2-impregnated chitosan bead [J]. Water Research, 44(19): 5722-5729 |
| [11] | Rodríguez-Lado L, Sun G F, Berg M, et al. 2013. Groundwater arsenic contamination throughout China [J]. Science, 341(6148): 866-868 |
| [12] | Shan C, Tong M P. 2013. Efficient removal of trace arsenite through oxidation and adsorption by magnetic nanoparticles modified with Fe-Mn binary oxide [J]. Water Research, 47(10): 3411-3421 |
| [13] | Smedley P L, Kinniburgh D G. 2002. A review of the source, behaviour and distribution of arsenic in natural waters [J]. Applied Geochemistry, 17(5): 517-568 |
| [14] | Vandenbossche M, Jimenez M, Casetta M, et al. 2013. Chitosan-grafted nonwoven geotextile for heavy metals sorption in sediments [J]. Reactive and Functional Polymers, 73(1): 53-59 |
| [15] | Zha F, Huang W Y, Wang J Y, et al. 2013. Kinetic and thermodynamic aspects of arsenate adsorption on aluminum oxide modified palygorskite nanocomposites [J]. Chemical Engineering Journal, 215-216: 579-585 |
| [16] | Zhang G S, Ren Z M, Zhang X W, et al. 2013. Nanostructured iron(Ⅲ)-copper(Ⅱ) binary oxide: A novel adsorbent for enhanced arsenic removal from aqueous solutions [J]. Water Research, 47(12): 4022-4031 |
 2014, Vol. 34
2014, Vol. 34


