2. 中国海洋大学环境科学与工程学院, 青岛 266100
2. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100
随着经济的快速发展和人们生活质量的提高,臭气等造成的环境问题越来越引起社会各界的广泛关注.国家标准GB14554-93中规定了8种需要控制的恶臭污染物,甲硫醇是其中之一(国家环境保护局,1994).研究表明,甲硫醇(CH3SH)是最具代表性的酸性恶臭气体之一,其嗅阈值非常低,为0.0021 ppm(Deshmukh et al., 2014).同时,CH3SH来源广泛,具有高毒、高腐蚀性、呈酸性、不易溶于水、易与金属盐结合等特征,是严重威胁人身安全、亟需治理的恶臭污染物之一.
臭气的去除方法有很多种(He et al., 2009; 殷峻等,2011; Hulea et al., 2014; Antonopoulou et al., 2014; Lebrero et al., 2014),化学吸收法(Charron et al., 2004;Couvert et al., 2006; Charron et al., 2006; Liu,2010)是其中最有效、最可靠的技术之一.而过氧化物作为环境友好型氧化剂,倍受青睐,逐渐被应用在化学吸收法中.例如,Couvert等(2006)利用H2O2作为强氧化剂氧化去除碱液吸收的CH3SH,发现H2O2可以将吸收的CH3SH降解,同时促进碱液对CH3SH的吸收.过一硫酸氢盐(PMS)、过二硫酸盐(PS)是H2O2的衍生物.本课题组曾比较了强碱性条件下(pH=12、12.5、13)H2O2、PMS、PS 3种氧化剂对CH3SH臭气的去除效果,发现相对于H2O2和PS,PMS表现出了优异的特性,CH3SH去除率可达到95%以上(杨世迎等,2013;2014).然而,大气中CO2的浓度在400 ppm左右,预计2100年将会达到1000 ppm(Ezraty et al., 2011),远远高于需要处理的CH3SH恶臭气体浓度.在强碱性条件下,吸收液不仅对CH3SH有很强的吸收能力,而且会吸收大量的CO2气体,增加NaOH的消耗(Couvert et al., 2006).
因此,本研究以H2O2作为对比,探讨在酸性、中性、碱性条件下(pH=2~13)PMS湿法吸收氧化体系对CH3SH恶臭气体的去除效果,并对降解机理进行初步研究,以期寻求一种在非强碱性条件下可以有效去除CH3SH酸性恶臭气体的方法.
2 材料与方法(Materials and methods) 2.1 实验材料甲硫醇恶臭气体(CH3SH,3000 ppm)购于大连大特气体有限公司;过一硫酸氢钾(PMS,KHSO4 · K2SO4 · KHSO5,42%KHSO5)购于上海化学试剂公司;过氧化氢(H2O2,30%);Ellman试剂(C14H8N2O8S2,99.0%)购于美国Amrecso公司;硫代硫酸钠(Na2S2O3,99.0%)、碘化钾(KI,99.0%)、硼酸(H3BO3,99.5%)、氢氧化钠(NaOH,98.0%)、浓硫酸(H2SO4,98%)购于上海化学试剂公司.
2.2 实验装置图 1为CH3SH吸收和降解装置示意图,该装置为逆流式半连续吸收塔设计,CH3SH气体与N2在混合装置中混合,由吸收塔底部连续进入,剩余气体由吸收塔顶部的甲硫醇检测器检测.吸收液在反应装置中混合,蠕动泵将其提升至吸收塔顶部,由上而下喷淋,吸收液在塔内与气体接触反应,最终重新进入反应装置中.在取样口中取样测定溶液中CH3S-浓度.本实验体系中吸收液循环使用.本实验中为避免空气中的CO2、O2可能对实验结果的干扰,以惰性气体N2作为载气.
 |
| 图 1 实验装置示意图 Fig. 1 Experimental setup of a wet scrubbing system for CH3SH removal |
为了研究pH对CH3SH吸收效果的影响,分别配制pH=2、6的酸性溶液、pH=8、9、10的弱碱性溶液(以硼酸-氢氧化钠作为缓冲)、pH=11、12、13的强碱溶液各500 mL,加入到反应液混合装置中,利用蠕动泵送入吸收塔中,并控制吸收液喷淋速度为125 mL · min-1.载气流速为1.5 L · min-1,通过质量流量计控制CH3SH的进气浓度,本研究中CH3SH进气浓度始终为60 ppm.在反应液混合装置中取样测定溶液中CH3S-的浓度.文中CCH3S表示溶液中吸收的CH3S-的浓度(g · L-1),C0(gas)表示CH3SH进气时的浓度(ppm),C(gas)表示CH3SH出气时的浓度(ppm),以(C0(gas)-C(gas))/C0(gas)表示CH3SH的吸收率,rabsorb表示CH3SH的吸收速率(g · L-1 · min-1).
2.3.2 PMS、H2O2氧化降解CH3SH实验配制不同pH的吸收液,分别将1.78×10-3 mol的PMS、H2O2加入其中,用氢氧化钠调节至吸收液初始pH,定容至500 mL,加入到反应液混合装置中.其余实验条件与吸收实验相同.
2.3.3 吸收液活化PMS、H2O2实验为探究PMS、H2O2在不同pH条件下的活化情况,分别配制不同pH条件下的PMS、H2O2吸收液500 mL(配制方法与PMS、H2O2降解CH3SH实验相同),加入锥形瓶,放入振荡反应器中,振荡速率为120 r · min-1,在规定的时间内取样测定.文中CPMS和CH2O2分别表示PMS和H2O2在溶液中的浓度(g · L-1);CPMS,0和CH2O2,0分别表示PMS和H2O2的初始浓度(g · L-1),以(CPMS,0-CPMS)/CPMS,0和(CH2O2,0-CH2O2)/CH2O2,0分别表示PMS和H2O2的活化率.
2.4 分析方法CH3SH出气浓度由甲硫醇检测器(WD.103-Q2000,北京卓川电子科技有限公司)直接检测;溶液中的CH3SNa浓度采用Ellman试剂法(Riener et al., 2002)进行检测;PMS、H2O2浓度采用碘化钾(KI)滴定法测定(Wahba et al., 1959; Wu et al., 2012);pH测定采用雷磁pHSJ-4A型分析仪.
3 结果与讨论(Results and discussion) 3.1 pH对CH3SH吸收的影响pH是化学吸收法的主要影响因素之一.CH3SH为酸性恶臭气体,当pH大于CH3SH的pKa(10.3,Muthuraman et al., 2011)时,吸收液中的CH3S-不断增加.为探究pH对化学吸收氧化CH3SH体系的影响,首先进行了pH对CH3SH吸收的影响实验.
本实验在半连续反应装置中进行,结果如图 2所示.由图 2a、b可知,在pH=2~10时,连续通入的CH3SH气体出气浓度迅速增加,同时,循环吸收液中也几乎检测不到CH3S-.由此可知,在pH小于CH3SH的pKa时,CH3SH几乎不被吸收液吸收,以气体形式溢出.在pH大于CH3SH的pKa时,随着pH的增加,CH3SH出气减少,溶液中CH3S-量不断增加.图 2c中,当pH大于CH3SH的pKa时,随着pH的增加,碱液吸收CH3SH的速率也不断增加.在强碱性条件下(pH=13),CH3SH吸收效果最好,去除率达到70%左右.然而,Couvert等(2006)研究了NaOH吸收CH3SH、H2S时CO2吸收对NaOH消耗的影响,结果表明,在pH为9.7~12时,吸收CO2消耗的NaOH占NaOH总消耗量的71%~95%,pH越大,所占比例越高.由此可知,pH越大,CH3SH的吸收效果越好,但碱液吸收CO2气体的量也越大,从而增加消耗;同时,CH3SH只是由气相转移到液相,没有达到真正的去除效果.因此,单独碱液吸收并不能成为CH3SH去除的主要方法.
 |
| 图 2 pH对CH3SH吸收的影响 Fig. 2 Effect of pH on CH3SH removal by absorption liquid |
为了探讨pH对PMS去除CH3SH恶臭气体的影响,以H2O2作为对比,进行了不同pH(2~13)条件下PMS氧化降解CH3SH气体的实验研究.其中,H2O2、PMS的浓度均为3.56×10-3 mol · L-1,实验结果如图 3、4所示.
 |
| 图 3 pH对H2O2氧化降解CH3SH的影响 Fig. 3 Effect of pH on CH3SH removal by H2O2 wet oxidation |
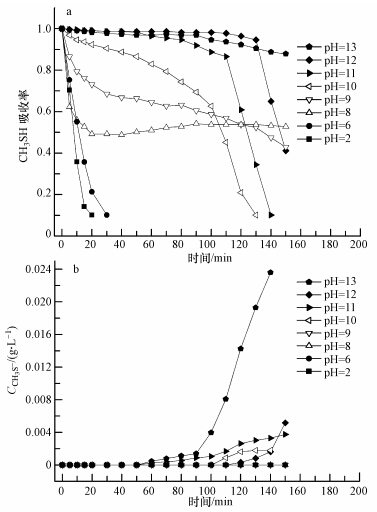 |
| 图 4 pH对PMS氧化降解CH3SH的影响 Fig. 4 Effect of pH on CH3SH removal by PMS wet oxidation |
由图 3可知,吸收液中存在H2O2时,在酸性或弱碱性条件下(pH=2~10),CH3SH出气浓度迅速增加,溶液中含有微量的CH3S-.因此,在pH小于CH3SH的 pKa时,H2O2对CH3SH几乎无去除效果,可能是因为吸收过程受到限制.在pH为12时,H2O2氧化去除CH3SH的效果明显高于只有碱液吸收时的去除效果,去除率可以稳定在66%左右.可能是由于H2O2氧化了溶液中的CH3S-,促进了CH3SH气体的去除.
由图 4可知,在酸性条件下,PMS去除CH3SH气体的效果不佳;在弱碱性条件下(pH=8、9、10),与图 3相比,PMS去除CH3SH的效果远远好于H2O2,PMS对CH3SH的去除率可以达到50%以上,而H2O2几乎对CH3SH无氧化作用.PMS在pH小于CH3SH的pKa时,也可以有效地去除CH3SH,可能是因为PMS在弱碱性条件下可能被碱液活化,产生具有更强氧化性的物质,可以直接氧化CH3SH分子.
在pH为9、10时,初始阶段PMS氧化CH3SH的效果优于pH为8时,随着去除时间的延长,降解效果变差.可能是由于pH越大时处理的CH3SH量越大,PMS的消耗越多,PMS浓度减少所致.在pH=11、12、13的强碱性条件下,PMS去除CH3SH的效果非常好,去除率可以达到95%以上.在130 min之后,PMS降解CH3SH的效果迅速变差,可能原因为吸收液中CH3S-饱和,PMS耗尽.
3.3 机理探讨CH3SH在去除过程中,在气-液相界面发生反应(1).CH3SH的pKa为10.3,当pH大于CH3SH的pKa时,反应(2)可向右进行,产生更多的CH3S-.因此,在强碱性条件下(pH=11、12、13),H2O2、PMS可以与CH3S-反应生成甲磺酸(CH3SO3H)(Couvert et al., 2006; 杨世迎等,2014),具体如反应式(3)、(4)所示.同时,促使反应(1)、(2)不断向右进行,达到连续去除CH3SH的效果.
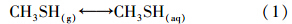


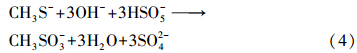
在酸性(pH=2、6)或弱碱性条件下(pH=8、9、10),CH3SH基本以分子形式存在,它的浓度与其亨利常数(在一定条件下为常数)有关.因此,只有在气液界面,通过PMS或活性物种与CH3SH分子快反应来提高传质系数,使反应(1)不断向右进行,才能实现CH3SH的吸收氧化. Lu等(2012)在pH小于CH3SH的pKa的酸性条件下(pH=3.4),利用光催化TiO2去除CH3SH气体,发现进气浓度为20 ppm时,CH3SH的去除率可接近100%.Muthuraman等(2011)研究发现,CH3SH气体可被含6.0 mol · L-1 HNO3(pH=0.3)的Ag(II)(E0=1.98 V)溶液100%吸收氧化.
由图 2、3、4可知,在弱碱性条件下(pH=8、9、10),PMS不同于H2O2,可以有效去除CH3SH分子.然而,相同pH条件下,单独吸收液对CH3SH无去除效果.非碱性条件下加入PMS,氧化去除CH3SH的效果也不明显.由此可知,碱性条件可以活化PMS,去除CH3SH气体.
为了验证碱液对PMS的活化作用,本文进行了不同pH吸收液活化PMS、H2O2的实验.如图 5所示,在300 min内,不同pH吸收液活化PMS的程度不同.酸性条件下(pH=2、6),PMS非常稳定,基本未被活化;弱碱性条件下(pH=8),PMS开始被活化.在pH为10时,PMS的活化率最大,达到80.8%;pH为11、12时的活化率变小,分别为70.2%、43.3%;在强碱条件下(pH=13),PMS较稳定,活化率较低.值得一提的是,当pH在PMS的pKa(9.4,Guan et al., 2011)附近(pH=10)时,PMS活化率最大.然而,在300 min内,H2O2基本未被活化.可能是因为PMS是由SO3取代H2O2中的一个H而形成,具有不对称结构,由于SO3的吸电子作用,使PMS中的O—O键中电子云向SO3一侧的氧原子偏移,使H一侧的氧原子带部分正电荷,易受到亲核试剂的攻击而产生活性物种(Betterton et al., 1990; Yang et al., 2010).
 |
| 图 5 不同pH吸收液对PMS、H2O2的活化作用 Fig. 5 Activation of PMS or H2O2 at different pH values |
PMS可以被过渡金属、紫外光、碱液等条件活化,可能产生SO- ·4、·OH、O- ·2等自由基(式(5))(Furman et al., 2010; Guan et al., 2011; 相青青,2012).由此可推测,PMS在弱碱性条件下被活化可能产生SO- ·4、·OH、O- ·2等活性物种,PMS或活性物种可能与分子状态的CH3SH(aq)在气液界面可直接发生快速界面反应,从而使CH3SH得以降解.
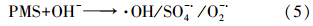
综上,在本实验条件下,不同pH范围时,PMS湿法化学吸收典型含硫恶臭气体CH3SH遵循着不同的规律,具体如图 6所示.
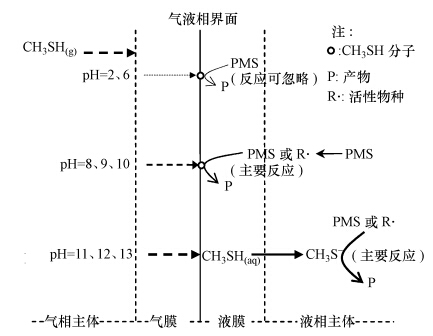 |
| 图 6 不同pH条件下PMS去除CH3SH示意图 Fig. 6 Schematic diagram of CH3SH removal by PMS at different pH values |
1)在酸性条件下(pH=2、6),PMS吸收降解CH3SH的效果不明显;在强碱性条件下(pH=11、12、13),PMS去除CH3SH的效果非常好,去除率可以达到95%以上;在弱碱性条件下(pH=8、9、10),PMS不同于H2O2,可以有效降解CH3SH.在pH=8时,PMS可有效去除50%以上的CH3SH气体.因此,在pH小于CH3SH的pKa的弱碱性条件下去除CH3SH气体是可行的.
2)弱碱性条件下(pH=8、9、10)PMS降解CH3SH的可能的机理为:PMS或活性物种直接氧化气液界面的CH3SH分子.因此,弱碱性条件下PMS产生的活性物种及其与CH3SH的反应机理研究,将是PMS湿法化学吸收氧化技术脱除恶臭气体的一个研究方向.
| [1] | Antonopoulou M, Evgenidou E, Lambropoulou D, et al. 2014. A review on advanced oxidation processes for the removal of taste and odor compounds from aqueous media [J]. Water Research, 53: 215-234 |
| [2] | Betterton E A, Hoffmann M R. 1990. Kinetics and mechanism of the oxidation of aqueous hydrogen sulfide by peroxymonosulfate [J]. Environmental Science and Technology, 24(12): 1819-1824 |
| [3] | Charron I, Feliers C, Couvert A, et al. 2004. Use of hydrogen peroxide in scrubbing towers for odor removal in wastewater treatment plants [J]. Water Science and Technology, 50(4): 267-274 |
| [4] | Charron I, Couvert A, Laplanche A, et al. 2006. Treatment of odorous sulphur compounds by chemical scrubbing with hydrogen peroxide-stabilisation of the scrubbing solution [J]. Environmental Science and Technology, 40(24): 7881-7885 |
| [5] | Couvert A, Charron I, Laplanche A, et al. 2006. Treatment of odorous sulphur compounds by chemical scrubbing with hydrogen peroxide-Application to a laboratory plant [J]. Chemical Engineering Science, 61(22): 7240-7248 |
| [6] | Deshmukh S, Jana A, Bhattacharyya N, et al. 2014. Quantitative determination of pulp and paper industry emissions and associated odor intensity in methyl mercaptan equivalent using electronic nose [J]. Atmospheric Environment, 82: 401-409 |
| [7] | Ezraty B, Chabalier M, Ducret A, et al. 2011. CO2 exacerbates oxygen toxicity [J]. EMBO Reports, 12(4): 321-326 |
| [8] | Furman O S, Teel A L, Watts R J. 2010. Mechanism of base activation of persulfate [J]. Environmental Science and Technology, 44(16): 6423-6428 |
| [9] | Guan Y H, Ma J, Li X C, et al. 2011. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system [J]. Environmental Science and Technology, 45(21): 9308-9314 |
| [10] | 国家环境保护局. 1994. GB 14554-93 恶臭污染物排放标准[S].北京:中国标准出版社 |
| [11] | He C, Li X Z, Sharma V K, et al. 2009. Elimination of sludge odor by oxidizing sulfur-containing compounds with ferrate(VI) [J]. Environmental Science and Technology, 43(15): 5890-5895 |
| [12] | Hulea V, Huguet E, Cammarano C, et al. 2014. Conversion of methyl mercaptan and methanol to hydrocarbons over solid acid catalysts–A comparative study [J]. Applied Catalysis (B: Environmental), 144: 547-553 |
| [13] | Lebrero R, Gondim A C, Pérez R, et al. 2014. Comparative assessment of a biofilter, a biotrickling filter and a hollow fiber membrane bioreactor for odor treatment in wastewater treatment plants [J]. Water Research, 49: 339-350 |
| [14] | Liu T X, Li X Z, Li F B. 2010. Development of a photocatalytic wet scrubbing process for gaseous odor treatment [J]. Industrial & Engineering Chemistry Research, 49(8): 3617-3622 |
| [15] | Lu N, Yu H T, Su Y, et al. 2012. Water absorption and photocatalytic activity of TiO2 in a scrubber system for odor control at varying pH [J]. Separation and Purification Technology, 90: 196-203 |
| [16] | Muthuraman G, Chung S J, Moon I S. 2011. The combined removal of methyl mercaptan and hydrogen sulfide via an electro-reactor process using a low concentration of continuously regenerable Ag(Ⅱ) active catalyst [J]. Journal of Hazardous Materials, 193: 257-263 |
| [17] | Riener C K, Kada G, Gruber H J. 2002. Quick measurement of protein sulfhydryls with Ellman's reagent and with 4,4'-dithiodipyridine [J]. Analytical and Bioanalytical Chemistry, 373(4/5): 266-276 |
| [18] | Wahba N, Asmar M F E, Sadr M M E. 1959. Iodometric method for determination of persulfates[J]. Analytical Chemistry, 31(11): 1870-1871 |
| [19] | Wu T T, Englehardt J D. 2012. A new method for removal of hydrogen peroxide interference in the analysis of chemical oxygen demand [J]. Environmental Science and Technology, 46(4): 2291-2298 |
| [20] | 相青青.2012.碱活化过一硫酸盐及其在处理染料废水中的应用研究[D].武汉:中南民族大学. 31-33 |
| [21] | Yang S Y, Wang P, Yang X, et al. 2010. Degradation efficiencies of azo dye Acid Orange 7 by the interaction of heat, UV and anions with common oxidants: persulfate, peroxymonosulfate and hydrogen peroxide [J]. Journal of Hazardous Materials, 179(1/3): 552-558 |
| [22] | 杨世迎,王雷雷,冯琳玉,等. 2013.过二硫酸盐降解碱液吸收的甲硫醇恶臭[J].环境科学, 34(11): 4178-4185 |
| [23] | 杨世迎,王雷雷,冯琳玉,等. 2014. 湿式洗涤/过氧化物氧化法脱除甲硫醇恶臭气体: H2O2、过二硫酸盐、过一硫酸氢盐的比较[J]. 环境化学, 33(1): 81-86 |
| [24] | 殷峻,许文锋. 2011.生物滤塔处理含氨气体的长期运行研究[J].环境科学学报, 31(3): 636-641 |
 2014, Vol. 34
2014, Vol. 34


