2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006;
3. 华南理工大学生物科学与工程学院, 广州 510006
2. The Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006;
3. College of Bioscience and Bioengineering, South China University of Technology, Guangzhou 510006
焦化废水是煤在高温干馏、煤气净化及副产品回收和精制过程中产生的一类典型工业有机废水,其水质构成受原煤性质、焦化工艺、副产品回收方式等因素的影响(韦朝海等,2011).任源等(2007)通过对焦化废水水质组成进行分析,发现焦化废水的原水中基本不含磷酸盐及其他磷的化合物,原水中的COD ∶ N约为12,表明富氮缺磷及生物利用过程的营养失衡是焦化废水的基本特征之一(韦朝海,2012).根据核外电子排布的不同,氮元素在自然界中的存在价态包括-3、0、+1、+2、+3、+4、+5,多种价态决定了含氮化合物形态的多样性.在焦化废水生物处理过程中,含氮化合物可以作为微生物生长的营养成分,但部分含氮化合物,如氰化物、硫氰化物及大分子含氮杂环化合物等则表现出对微生物的毒性抑制和惰性抑制(Sharma et al.,2012;李媛媛等,2010).
焦化废水处理中常见的脱氮工艺主要包括A/O、A2/O、A/O2等.其中,A/O工艺是生物脱氮的最基本流程,好氧池中NH+4-N发生硝化反应被氧化为NO-2-N和NO-3-N,通过对污泥和上清液回流及调控实现前置反硝化,从而达到脱氮的目的(Kim et al.,2008).针对焦化废水可生化性低、反硝化段可能存在碳源不足等问题,在A/O工艺基础上增加一个厌氧段形成A2/O工艺,通过厌氧酸化将大分子难降解有机物转化为小分子有机物,提高可生化性,为缺氧反硝化提供碳源(Li et al.,2003).A/O2工艺则是在A/O工艺基础上增加一个好氧段,实现有机物与氨氮的分段去除,可以承受更高的氨氮负荷(韦朝海等,2007).除此以外,短程硝化反硝化、同步硝化反硝化及厌氧氨氧化等新型脱氮工艺,根据预测可能具有巨大的应用潜力,但工艺的稳定性尚处于摸索和实验阶段,大规模投入工程应用的实例还没有.
随着环境水体水质的富营养化程度不断加剧,污(废)水中含氮化合物的排放标准也相应提高.2012年开始实行的《炼焦化学工业污染物排放标准》(GB16171—2012),将氨氮、氰化物的排放限值由原来的15 mg · L-1、0.5 mg · L-1降低到10 mg · L-1、0.2 mg · L-1,排放要求有所提高,并增加了总氮的排放限值(20 mg · L-1),意味着研究含氮化合物各种形态在处理过程中的变化十分必要.而现行工艺难以实现总氮达标排放的目标,因此,迫切期待焦化废水处理新工艺的出现.
基于此,本文以调试阶段的金牛天铁集团焦化废水处理工程O/H/O生物三相流化床组合工艺为研究对象,分别检测原水与生物出水中含氮化合物的种类与形态,并检测生物工艺O1、H、O2反应器中无机氮及部分有机氮化合物的浓度,计算各污染物的去除率及去除负荷,判断工艺的有效性.通过分析反应器中含氮化合物的转化及其条件的影响关系,了解各种形态含氮化合物的转变与利用,寻求总氮减排的有效途径.
2 工程设计与运行工况(Design and operating condition) 2.1 工程介绍该焦化废水处理工程是与金牛天铁集团建设的年产330×104 t的焦炭生产工艺相配套而建设,其废水来源主要包括蒸氨废水、煤气水封水、脱硫废液和厂区生活污水.根据焦化废水流量数据及污染物指标,该工程设计的生物系统上水流量为200 m3 · h-1,设计进水水质及处理要求见表 1.
| 表1 设计进水水质及处理要求 Table 1 Design qualities and aims of coking wastewater |
根据废水特点和环保要求,设计了气浮除油预处理、O/H/O生物处理、混凝沉淀与臭氧氧化深度处理的组合工艺,主要工艺流程如下:焦化废水先通过隔油池,回收大部分的重油后进入气浮分离池,将分离的泡沫和油污在催化氧化反应器中氧化分解,随后废水进入集水调节池均衡水质水量.经过预处理的废水进入生物处理系统,生物处理系统是由基于污泥原位分离的内循环好氧生物三相流化床耦合组成的高负荷工艺与以脱氮为目标的水解/好氧流化床组合工艺串连而成的O1/H/O2工艺.其中,O1/H是一个高效的有机污染物去除体系,充分发挥了好氧流化床对有机污染物高效去除的特点,能最大限度地降低污染物浓度,然后进入完全流态化的水解流化床反应器,通过水解酸化作用提高残余有机污染物的可生化性能,为二级好氧流化床进一步降解有机污染物创造条件;H/O2组合成一个高效的生物脱氮工艺,通过强制硝化反硝化,实现高效脱氮目的,还能减少对碱的消耗,节约运行成本.经过预处理的焦化废水在高效生物处理系统中难降解的有机污染物和氨氮都得到有效降解和转化,生物系统出水经混凝沉淀去除悬浮物和胶体成分后,再经臭氧氧化,实现水质达标排放.
2.2 设计与运行参数由于实际运行过程中,进水COD为5000~6000 mg · L-1,比设计值高;焦化废水原水流量约为110 m3 · h-1,加上其他来水,总量低于140 m3 · h-1,实际生物上水流量约160 m3 · h-1.生物系统各单元设计与运行参数见表 2.
| 表2 生物系统各单元设计与运行参数 Table.2 Design and operating parameters of the biological system in each reactor |
取样方法:采样时间为2011年7月19日至8月18日,分别采集原水、调节池、一级好氧池、水解池、二级好氧池及外排水水样,经简单的过滤沉淀后,置于4 ℃冰箱保存,并于12 h内分析各项监测指标.采样现场同时测定pH值、溶解氧、温度等数据.采样期间连续3 d的水样经萃取后进行GC/MS分析.
分析方法:pH值、溶解氧、温度、COD、挥发酚、总氰、硫化物、NH+4-N、NO-3-N、NO-2-N、总氮均参照《水和废水监测分析方法(第4版)》测定.硫氰化物采用铁离子显色分光光度法(潘霞霞等,2009)测定.水样的萃取方法及GC/MS分析条件参照文献(张万辉等,2012).
2.4 评价方法各污染物指标去除率、去除负荷的计算方法如下:
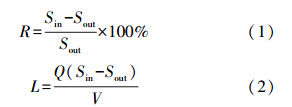
各类含氮化合物占总氮比例的计算方法如下:

充分了解焦化废水原水中含氮化合物的种类与形态,控制生物降解过程的碳氮比值及动力学约束的氮元素形态转变,可以作为工程设计的依据.煤中含氮官能团的主要存在形态包括吡咯型氮(50%~80%)、吡啶型氮(20%~40%)和季氮(0~20%),同时还有少量的吡啶酮和芳香胺基的氮结构(刘海明等,2004).煤热解过程中,由于存在热分解反应与多相反应的结合,以较弱共价键与碳原子结合的小分子量含氮支链受热后随挥发分一起进入气相,生成HCN、NH3或者以吡啶、吡咯等形式残留于焦油中(Pels et al.,1995).挥发分和焦油中的含氮物质进一步受热发生气固、液固、气液之间的复杂反应,含氮化合物之间相互转化,如吡咯氮转化为吡啶氮,季氮转化为吡啶氮,HCN与煤中的硫合成硫氰化物等.焦化生产的热过程中,含氮化合物转移到被蒸发的水汽中,经冷凝后形成焦化废水.根据检测,本研究焦化废水原水中可以检出的含氮化合物如表 3所示.
| 表3 焦化废水原水中的主要含氮化合物 Table.3 The nitrogen compounds contained in the raw water |
NH+4-N、氰化物、硫氰化物、NO-2-N、NO-3-N构成焦化废水原水中的无机氮化合物.NH+4-N的浓度为80.4~116.7 mg · L-1,氰化物的浓度为35.0~48.6 mg · L-1,硫氰化物的浓度为567.4~643.1 mg · L-1,分别占总氮的33.6%、7.5%和40.4%;NO-2-N、NO-3-N在原水中的浓度分别低于3.0 mg · L-1和0.05 mg · L-1,两者的总量约为1%.焦化废水原水中的有机氮化合物基本可归纳为胺类、有机腈类及含氮杂环化合物,共122种,转换为总氮的浓度低于50 mg · L-1.可检测出含氮杂环化合物76种,其中,喹啉浓度为10.07~12.17 mg · L-1,异喹啉浓度为2.86~4.23 mg · L-1;有机腈类22种,其中,2-氨基氰苯的浓度为0.24~0.33 mg · L-1;胺类化合物14种,其中,苯胺的浓度为31.23~59.03 mg · L-1.通过上述分析可知,焦化废水中的总氮由各种形态含氮化合物组成,形态多样性决定了降解过程的复杂性,要实现工程目标,有必要研究各组分的降解特性.
3.1.2 生物出水中的含氮化合物经过生物处理,含氮化合物一部分转移到污泥相中,一部分以N2和N2O的形式转移到大气中,残余组分留在生物出水中.焦化废水生物出水中的有机氮化合物如表 4所示,可以看出,酰胺类为主要的新生成有机氮化合物,可能来源于有机腈类化合物降解的中间产物(Baxter et al.,2006).生物出水中的有机氮化合物减少为32种,表达为总氮的浓度约为1 mg · L-1,经过O/H/O生物工艺,即生物的氧化/还原/氧化过程,焦化废水中的含氮化合物从多组分与多种形态转化为NO-2-N、NO-3-N等高价状态,NO-2-N、NO-3-N所占比例从1%增加到70%,体现了生物处理过程中各种含氮化合物的归趋作用.
| 表4 焦化废水生物出水中有机氮化合物的存在情况 Table.4 The nitrogen compounds contained in the biological treatment effluents |
从采样时间内水质平均值数据及其变化(表 5)可以分析O/H/O生物工艺各工艺段的处理效果.数据显示,采用生物三相流化床O/H/O组合工艺处理金牛天铁集团焦化废水,可以在设计负荷条件下稳定运行,生物处理出水平均COD、挥发酚、NH+4-N、氰化物、硫化物浓度分别为265.1、0.25、12.7、0.63、0.46 mg · L-1.挥发酚、硫化物、NH+4-N等污染物指标能达到直接排放标准的要求,COD、氰化物经后续的混凝与臭氧氧化处理后达到《污水综合排放标准》(GB8978—1996)第二类污染物最高允许排放浓度一级标准的要求.
| 表5 各工艺段主要水质指标平均值数据 Table.5 Average value of main characteristics in different biological processes |
从表 5可以看出,生物进水总氮略有下降,这是由于在预处理阶段加入了硫酸亚铁,Fe2+与氰化物形成亚铁蓝(Fe[Fe(CN)6])、铁蓝(Fe4[Fe(CN)6]3)沉淀引起的,这与生物进水中氰化物浓度的下降相对应.两级好氧段中总氮的去除量分别为115.8 mg · L-1和59.9 mg · L-1,好氧段内总氮去除的原因可以归结如下:①好氧微生物按照BOD ∶ N ∶ P约为100 ∶ 5 ∶ 1的比例利用废水中的含氮化合物作为氮源,合成自身细胞物质,水相中的总氮转移到污泥相中;②在实际工程中,反应器内部存在局部的缺氧区,好氧池内的同步硝化反硝化得以实现;③系统中存在好氧反硝化菌,在好氧条件下进行反硝化,将NH+4-N直接转化为N2O(王薇等,2007);④少量的氨分子在曝气过程中被逸散.
生物处理过程中各类含氮化合物占总氮的比例如图 1所示.在焦化废水处理的全过程中,无机氮化合物是总氮的主要贡献者,所占比例均高于 75.0%.原水中,无机氮化合物占总氮的比例为82.5%,其中以硫氰化物和氨氮为主.一级好氧流化床中,相对于难降解的有机氮化合物,微生物优先降解挥发酚、氰化物和硫氰化物等,反应器内几乎没有硝化作用发生,氰化物和硫氰化物所占比例下降为1.1%和23.4%,有机氮和氨氮的比例相应上升到24.1%和49.4%.水解流化床中,有机氮化合物水解释放出氨氮,致使氨氮比例上升到71.4%,而有机氮化合物比例降至2.2%.二级好氧流化床中,氰化物和硫氰化物被好氧生物氧化,发生硝化作用,硝态氮是生物出水中总氮的主要贡献者,所占比例超过75.0%.
 |
| 图 1 生物处理过程中各类含氮化合物在总氮中的组成特征 Fig. 1 The composition of the nitrogen compounds during biological treatment processe |
生物过程中影响含氮化合物转化及总氮去除的因素包括pH、HRT、溶解氧、污泥龄与污泥浓度、碳氮比、硝化液回流比、氧化还原电位等.针对原水总氮含量高于300 mg · L-1的焦化废水,若要达到新国标中规定的20 mg · L-1总氮排放限值,需要强化一级好氧反应器使之实现局部硝化反应,并且二级好氧段实现完全硝化,以回流比必须大于1 ∶ 1的运行条件,保证水解反应器内短程反硝化反应的高效进行,并以N2的形式逸出.两者的结合,需要在反应器水力停留时间与回流比的取值中求得优化.为实现水解反应器中的短程反硝化,需要追求一级好氧反应器条件的精密控制,使部分低价含氮化合物转化为NO-2-N.为充分发挥微生物同化作用对总氮的去除作用,避免微生物进入内源呼吸期,细胞溶胞再次向水中释放出总氮,需要严格控制各反应池污泥停留时间,定期排泥.为保证硝化反硝化过程的顺利进行,需要在二级好氧反应器中提供足够的溶解氧、水解反应器中提供充足的可利用碳源.上述发生的总氮减排过程可以被分解为3个不同功能的反应器内实现.
3.2.2 一级好氧流化床实际工程中流化床的设计结构主要包括三段导流筒及三相分离区.流化床内三段导流筒使流体实现三重循环,强化了流化床的混合传质性能(韦朝海等,2001);流化床两侧设置的三相分离区使固液分离后的活性污泥由分离区底部斜壁自吸入主反应器的降流区内,避免出水带走菌胶团,保证反应器内的微生物量并实现污泥减量化.一级好氧流化床以空气作为动力,实现反应器内废水与微生物之间良好的混合和传质,其作用主要是最大限度地降低有机污染物浓度.运行过程中需要保证充足的曝气量,以实现流态化操作,提供溶解氧,同时需要投加磷盐作为微生物生长的营养元素.
文献(Fallon et al.,1991)报道,氰化物和硫氰化物都可以在好氧和厌氧条件下被微生物降解,但氰化物在厌氧条件下降解速率较慢,硫氰化物的厌氧降解一般是在硝酸盐存在的条件下进行的(Grigor′eva et al.,2009).图 2为氰化物和硫氰化物在一级好氧流化床的运行数据,可以看出,在HRT为40 h、溶解氧控制在1~3 mg · L-1的情况下,一级好氧流化床氰化物和硫氰化物进水浓度为19.0~36.1 mg · L-1和482.4~672.1 mg · L-1,出水浓度分别为3.3~4.2 mg · L-1和87.8~309.1 mg · L-1,去除率达85.6%和67.5%.在O/H/O生物处理系统中,设计一级好氧流化床以去除酚类等有机污染物为主,在酚类进水浓度在902~1100 mg · L-1 的情况下,出水挥发酚平均浓度为11.6 mg · L-1,平均去除负荷为0.54 kg · m-3 · d-1. 因此,一级好氧流化床可实现氰化物、硫氰化物与酚类的同步降解,并且酚类的降解优先.
 |
| 图 2 一级好氧流化床硫氰化物、氰化物的处理效果 Fig. 2 Routine monitoring value of thiocyanate and cyanide in O1 |
从表 3可以看出,焦化废水中的有机腈类化合物都是带苯环的芳香族腈.与脂肪族腈相比,芳香族腈更难降解(曾虹燕等,2008).一般将有机腈类化合物与氰化物、硫氰化物统称为含氰化合物,因此,有机腈类化合物的降解行为与氰化物、硫氰化物表现出一定的相似性,主要在好氧段进行.一级好氧段中有机腈类化合物的生物降解主要有两种途径:第一种途径是在腈水解酶催化作用下,有机腈化合物水解成相应的酸和氨氮;第二种途径是有机腈化合物首先水解成对应的氨基化合物,然后再进一步水解成对应的酸和氨氮,这两步分别由腈水合酶和酰胺酶催化进行(Baxter et al., 2006).
苯胺是焦化废水中主要的胺类化合物,一级好氧出水的苯胺浓度为28.0~33.1 μg · L-1,转化率高达99.8%.苯胺好氧降解主要有两种代谢途径,即邻位(ortho)和间位(meta)代谢途径,分别由邻苯二酚-1,2-双加氧酶(Xiao et al.,2009)和邻苯二酚-2,3-双加氧酶(Liu et al.,2002)催化.这两种途径都是先将苯胺氧化成邻苯二酚,释放出NH3.当苯胺氧化为邻苯二酚之后,邻位代谢途径是在两个羟基之间开环,产生琥珀酸和乙酰辅酶A,间位代谢途径则在其中一个羟基的旁侧切割邻苯二酚,产生丙酮酸和乙醛.
3.2.3 水解流化床水解流化床依靠好氧过程排出的尾气或少量氮气的搅拌作用及泵的水力条件实现均匀流态化,其主要作用是通过水解酸化改变有机物的局部分子结构,将大分子有机物转变为易降解的小分子化合物,同时对回流硝化液实现厌氧反硝化.运行过程中需要投加碱,中和水解产生的有机酸,并维持pH值在6.5~7.5之间,为微生物的厌氧反硝化提供条件.
总氰和硫氰化物浓度在水解阶段略有下降.本课题组对生物系统中微生物群落的高通量测序结果显示,水解流化床中存在Thiobacillus sp.的微生物,这可能与水解流化床中总氰和硫氰化物的降解有关.水解流化床中通过水解酸化将大分子有机物转变为小分子化合物,氮元素以氨氮的形式释放到水中,水解出水氨氮平均浓度为85.9 mg · L-1.
经水解单元处理后,出水中喹啉和异喹啉的浓度分别为3.02~3.67 mg · L-1和1.46~2.05 mg · L-1,浓度显著下降.大部分的含氮杂环化合物属于难降解有机物,多环比单环更难降解,这可能是空间位阻效应增加、成环原子电子云密度减小和疏水性增大所造成的.对于含氮杂环化合物而言,环的开环裂解是它们在生物降解过程中的一个主要的步骤(何苗等,1997).在好氧条件下,由于好氧微生物开环酶系统的脆弱及不发达,阻止了杂环化合物及多环芳烃的降解.而厌氧微生物对于环的裂解具有不同于好氧菌的代谢过程,而且所涉及的开环酶系也完全不同于好氧微生物.说明水解单元对焦化废水中含氮化合物的降解具有不可替代的优越性.
3.2.4 二级好氧流化床二级好氧流化床的设计结构与一级好氧流化床类似,其作用主要是与水解流化床联合进行硝化反硝化脱氮.由于硝化菌对环境的变化敏感,为保证硝化反应的正常进行,运行过程中需要满足溶解氧的要求,同时需要保持足够的碱度.
氰化物和硫氰化物在二级好氧流化床有很好的降解效果,生物出水中氰化物和硫氰化物的平均浓度分别为0.63 mg · L-1和7.4 mg · L-1,去除率达82.3%和95.7%.值得注意的是,与挥发酚、硫化物等指标相比,生物出水中氰化物仍未达到直接排放标准的要求.这是因为焦化废水原水中含有多种金属离子(任源等,2007),加上预处理阶段加入了硫酸亚铁作为混凝剂,使废水中的部分氰化物形成了稳定的金属氰络合物.这些金属氰络合物,特别是铁氰络合物具有热力学稳定性,微生物降解利用铁氰的速率比自由氰慢(Akcil,2003).
一级好氧流化床对有机碳源的充分降解保证了二级好氧流化床内竞争性碳源大量减少,为硝化细菌的培养和选择性增殖提供了良好的环境.图 3为二级好氧段NH+4-N、NO-x-N的浓度变化.二级好氧流化床氨氮进水平均浓度为85.9 mg · L-1,出水NO-x-N平均浓度为47.7 mg · L-1,表现出良好的硝化效果.该阶段主要的硝化产物为NO-3-N,但从第25 d开始,硝化产物以NO-2-N为主,结合其他污染物指标进行分析,发现此时二级好氧进水中硫氰化物浓度急剧升高,并维持在200 mg · L-1以上,硫氰化物对完全硝化过程有抑制作用,导致亚硝氮的积累.
 |
| 图 3 二级好氧流化床NH+4-N、NO-x-N的变化 Fig. 3 NH+4-N,NO-x-N concentrations of influent and effluent in O2 |
1)O/H/O生物工艺对焦化废水具有良好的处理效果,在总HRT=64 h条件下,生物进水COD、挥发酚、硫化物、氰化物和氨氮平均值分别为4876、987、20.4、26.2和90.4 mg · L-1时,去除率分别达94.6%、99.9%、97.7%、97.6%和89.4%,体现了工艺的高负荷与总氮去除的高效、稳定性,出水符合《污水综合排放标准》(GB8978—1996)第二类污染物最高允许排放浓度一级标准的要求.
2)焦化废水中的含氮化合物存在多组分和多种形态,主要包括NH+4-N、氰化物、硫氰化物、NO-2-N、NO-3-N 5种无机氮化合物和有机腈类、胺类、含氮杂环化合物3类有机氮化合物.在焦化废水处理全过程中,无机氮化合物是总氮的主要贡献者,所占比例均高于75.0%,其中,在原水中以硫氰化物和氨氮为主,在生物出水中则以硝态氮为主.
3)在O/H/O生物工艺中,氰化物、硫氰化物、有机腈类、胺类的转化主要在两级好氧段内进行,含氮杂环化合物的降解主要在水解段发生,NH+4-N的转化主要发生在二级好氧段,即合理的工艺及优化的运行参数可以实现含氮化合物的分质去除.
4)影响含氮化合物转化及总氮去除的因素包括pH、HRT、溶解氧、污泥龄与污泥浓度、碳氮比、硝化液回流比、氧化还原电位等.新国标中规定了总氮的排放限值为20 mg · L-1,而本工程调试阶段出水总氮为40~65 mg · L-1,表明总氮指标的减排需要借助于更深入的含氮化合物降解动力学的理解,思考水质变化冲击,需要通过反应器的精确设计、工艺运行条件的逻辑优化与严格的操作管理来实现.
| [1] | Akcil A.2003.Destruction of cyanide in gold mill effluents: biological versus chemical treatments[J].Biotechnology Advances, 21(6): 501-511 |
| [2] | Baxter J, Cummings S P.2006.The current and future applications of microorganism in the bioremediation of cyanide contamination[J].Antonie van Leeuwenhoek, 90(1): 1-17 |
| [3] | Fallon R D, Cooper D A, Speece R, et al.1991.Anaerobic biodegradation of cyanide under methanogenic conditions[J].Applied and Environmental Microbiology, 57(6): 1656-1662 |
| [4] | Grigor'Eva N V, Smirnova Y V, Dulov L E.2009.Thiocyanate decomposition under aerobic and oxygen-free conditions by the aboriginal bacterial community isolated from the waste water of a metallurgical works[J].Microbiology, 78(4): 402-406 |
| [5] | 何苗, 张晓健, 瞿福平, 等.1997.杂环化合物好氧生物降解性能与其化学结构相关性的研究[J].中国环境科学, 17(3): 8-11 |
| [6] | Kim Y M, Park D, Jeon C O, et al.2008.Effect of HRT on the biological pre-denitrification process for the simultaneous removal of toxic pollutants from cokes wastewater[J].Bioresource Technology, 99(18): 8824-8832 |
| [7] | Li Y M, Gu G W, Zhao I, et al.2003.Treatment of coke-plant wastewater by biofilm systems for removal of organic compounds and nitrogen[J].Chemosphere, 52(6): 997-1005 |
| [8] | 李媛媛, 潘霞霞, 邓留杰, 等.2010.A/O1/H/O2工艺处理焦化废水硝化过程的实现及其抑制[J].环境工程学报, 4(6): 1231-1237 |
| [9] | 刘海明, 张军营, 郑楚光, 等.2004.煤中吡咯型和吡啶型氮热解稳定性研究[J].华中科技大学学报(自然科学版), 32(11): 13-15 |
| [10] | Liu Z, Yang H, Huang Z, et al.2002.Degradation of aniline by newly isolated, extremely aniline-tolerant Delftia sp. AN3[J].Applied Microbiology Biotechnology, 58(5): 679-682 |
| [11] | 潘霞霞, 李媛媛, 黄会静, 等.2009.焦化废水中硫氰化物的生物降解及其与苯酚、氨氮的交互影响[J].化工学报, 60(12): 3089-3096 |
| [12] | Pels J R, Kapteijn F, Moulijn J A, et al.1995.Evolution of nitrogen functionalities in carbonaceous materials during pyrolysis[J].Carbon, 33(11): 1641-1653 |
| [13] | 任源, 韦朝海, 吴超飞, 等.2007.焦化废水水质组成及其环境学与生物学特性分析[J].环境科学学报, 27(7): 1094-1100 |
| [14] | Sharma N K, Philip L, Bhallamudi S M.2012.Aerobic degradation of phenolics and aromatic hydrocarbons in presence of cyanide[J].Bioresource Technology, 121: 263-273 |
| [15] | 王薇, 蔡祖聪, 钟文辉, 等.2007.好氧反硝化菌的研究进展[J].应用生态学报, 18(11): 2618-2625 |
| [16] | 韦朝海, 吴锦华, 吴超飞, 等.2001.新型内构件内循环三相流化床氧传递特性的研究[J].中国环境科学, 21(6): 28-31 |
| [17] | 韦朝海, 贺明和, 吴超飞, 等.2007.生物三相流化床A/O2组合工艺在焦化废水处理中的工程应用[J].环境科学学报, 27(7): 1107-1112 |
| [18] | 韦朝海, 朱家亮, 吴超飞, 等.2011.焦化行业废水水质变化影响因素及污染控制[J].化工进展, 30(1): 225-232 |
| [19] | 韦朝海.2012.煤化工中焦化废水的污染、控制原理与技术应用[J].环境化学, 31(10): 1465-1472 |
| [20] | Xiao C B, Ning J, Yan H, et al.2009.Biodegradation of Aniline by a Newly Isolated Delftia sp.XYJ6[J].Chinese Journal of Chemical Engineering, 17(3): 500-505 |
| [21] | 曾虹燕, 姜和, 雷光辉, 等.2008.高效降氰菌群的构建及降解特性[J].环境工程学报, 2(4): 487-492 |
| [22] | 张万辉, 韦朝海, 吴超飞, 等.2012.焦化废水中有机物的识别、污染特性及其在废水处理过程中的降解[J].环境化学, 31(10): 1480-1486 |
 2014, Vol. 34
2014, Vol. 34


