2. 北京工业大学环境与能源工程学院, 北京 100124
2. College of Environmental and Energy Engineering, Beijing University of Technology, Beijing 100124
氮氧化物(NOx)不仅作为一次污染物危害人体健康和生态系统,也是导致酸雨、光化学烟雾和雾霾的主要前驱体物质.2012年我国排放NOx共计2337.8×104 t.其中,以火电和工业炉窑烟气为主的工业废气NOx排放量达1658.1×104 t,占总排放量的70.9%(全国环境统计公报,2012).火电和工业炉窑烟气中既含有NOx又含有SO2,其中大型火电锅炉烟气主要采用氨选择性催化还原脱硝+湿法脱硫净化工艺,分别借助气-固催化和气-液吸收过程在两个完全不同的反应器内实现;对于中小型锅炉烟气,这种串联工艺路线存在投资和运行费用偏高、占地面积大和运行维护要求严等问题.因此,利用液相吸收既脱除SO2又脱除NOx被认为是非常实用的技术.
烟气中的NOx主要以水溶性差的NO形式存在,为了实现高效脱除,需要先氧化为NO2.借助低温等离子体或臭氧可实现气相氧化NO(罗宏晶等,2010;Yamamoto et al., 2003;魏林生等,2008);利用KMnO4、H2O2、Fe(II)-EDTA、ClO2和NaClO2等氧化性水溶液可实现液相氧化NO(Fang et al., 2013;Liu et al., 2010;Chien et al., 2009;Jin et al., 2006;Sada, et al., 1978;赵毅等,2008).其中,液相氧化吸收脱硫脱硝技术已有一些工程应用案例,但迄今尚未解决高效且经济运行的问题,部分已建工程或不计氧化剂消耗量,以高昂的运行费用实现烟气达标排放,或只在调试和检测验收时投加氧化剂,其余时段达不到设计的去除效率.出现上述问题的根本原因在于烟气组分与吸收液组分之间的相互作用复杂,目前尚缺乏针对气液相组成和工艺参数对NO氧化和NOx脱除效率影响的系统研究,对各因素的影响规律缺乏深刻认识.
从理论上分析,气相SO2浓度和液相氧化还原能力是影响NO氧化及NOx吸收脱除的主要因素.为此,本文主要考察这些因素,即气相SO2浓度、NaClO2和Na2SO3投加量以及pH值对NO氧化及其脱除的影响,旨在为优化工艺运行参数、降低脱硫脱硝费用提供指导.
2 材料与方法(Materials and methods)实验装置由烟气模拟系统、反应系统及烟气分析系统3部分组成,如图 1所示.
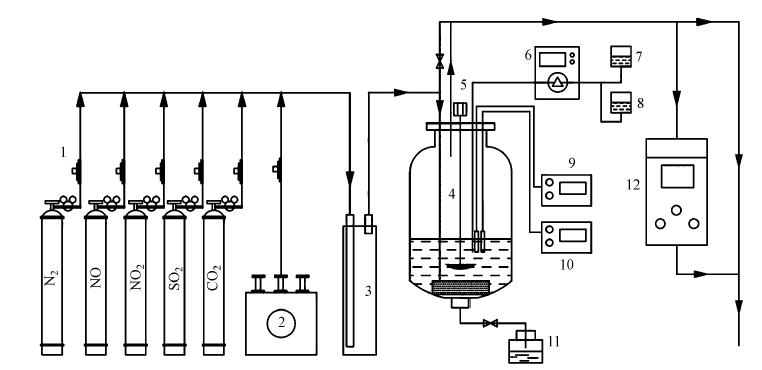 |
| 图 1 实验装置示意图(1. 标准气钢瓶;2. 洁净空气发生器;3. 缓冲混合罐;4. 鼓泡反应器;5.搅拌器;6. 蠕动泵;7. NaOH溶液;8. NaClO2/ Na2SO3水溶液;9.ORP仪;10. pH仪;11. 溢流槽;12. 烟气分析仪) Fig. 1 Schematic diagram of the experimental set-up(1. Gas cylinders,2. Clean air generator,3. Mixing chamber,4. Bubble reactor,5. Agitator,6. Syringe pump,7. NaOH solution,8. NaClO2/ Na2SO3 solution,9. ORP detector,10. pH detector,11.Overflow tank,12. Flue gas analyzer) |
实验在常温常压下进行.模拟烟气基本组成为N2+12%CO2+6%O2,根据实验需要,添加SO2、NO和NO2.其中,空气由洁净空气发生器提供,其他气体(包括部分N2)由钢瓶气提供,气体流量借助质量流量控制器调节,总气量为4 L · min-1.各路气体先在缓冲罐中混合均匀,然后进入鼓泡反应器,通过浸没于反应器底部的曝气头曝气后,在机械搅拌器作用下实现与液体的充分接触.
实验中,为模拟实际吸收条件并对吸收过程起缓冲作用,以浓度为0.2 mol · L-1的Na2SO4水溶液作为初始液相组分,氧化剂使用浓度为0.05 mol · L-1的NaClO2水溶液,模拟湿法脱硫的循环吸收液使用浓度为1 mol · L-1的Na2SO3水溶液,实验通过1 mol · L-1的NaOH水溶液调节pH值.反应器中液体体积为2 L.氧化或吸收前后SO2、NO和NO2浓度采用烟气分析仪(Testo350,德国)检测.
3 结果与讨论(Results and discussion) 3.1 液相NaClO2氧化NO性能考察 3.1.1 气相SO2浓度对NO氧化的影响在不调控pH值、NaClO2水溶液投加量为300 μL · min-1、模拟烟气不含NO2、NO浓度为240×10-6(V/V)的条件下,考察气相SO2浓度分别为0、70×10-6(模拟脱硫后烟气)和700×10-6(模拟脱硫前烟气)时,反应器出口NO、NO2和SO2浓度,以及吸收液pH和ORP值随反应时间的变化,结果如图 2所示.
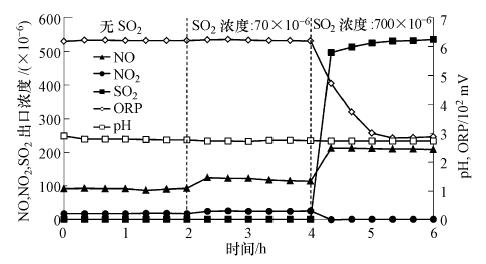 |
| 图 2 气相SO2浓度对NO氧化的影响 Fig. 2 Effect of SO2 concentration on NO oxidation |
可以看出,在NaClO2氧化作用下,气相不含SO2时,出口NO浓度降为100×10-6左右;当气相SO2浓度分别增至70×10-6和700×10-6时,NO浓度分别跃升至120×10-6和220×10-6.显然,这是由于SO2更易被吸收液吸收,并与NaClO2反应竞争消耗NaClO2,使得氧化NO的NaClO2量减少所致.当气相SO2浓度过高(700×10-6)时,由于吸收液很快趋于饱和,SO2出口浓度迅速升高,吸收液ORP值也由于液相S(IV)浓度升高而迅速降低.从图 2还可看出,出口NO2浓度显著低于NO浓度减少量,表明部分NO氧化后即被吸收脱除,而不是以NO2形式排出.另外,初始吸收液pH值为5.5,当加入NaClO2后迅速下降为2.6,而后基本保持稳定,这是由于氧化NO所生成的NO2被吸收,从而酸化吸收液所致.
以上结果表明,当烟气中同时存在NO和SO2时,投加的NaClO2氧化剂会优先氧化SO2.考虑到SO2不需氧化即可高效脱除,为了避免其竞争消耗氧化剂,降低氧化药剂费用,SO2吸收脱除与NO氧化应在两个不同的反应器(区)中进行,尽可能降低进入氧化器(区)的SO2浓度.
3.1.2 NaClO2投加量对NO氧化的影响在不调控pH值、模拟烟气不含NO2、SO2和NO浓度分别为70×10-6和240×10-6的条件下,考察NaClO2投加量分别为0、150、300、600 μL · min-1时,反应器出口NO、NO2和SO2浓度,以及吸收液pH和ORP值随反应时间的变化,结果如图 3所示.
 |
| 图 3 NaClO2投加量对NO氧化的影响 Fig. 3 Effect of NaClO2 dosage on NO oxidation |
可以看出,不投加NaClO2时,出口NO浓度与进口浓度相当,这表明Na2SO4吸收液对NO几乎无氧化和脱除效果.NaClO2投加量为150 μL · min-1时,尽管吸收液ORP值升至540 mV,但出口NO浓度与不投加NaClO2时基本相同,即NO未被氧化和吸收,而SO2出口浓度有所降低.这表明投加量较低时,NaClO2优先被溶解的SO2所消耗并促进了SO2的吸收.当NaClO2投加量增至300 μL · min-1时,吸收液ORP值升至590 mV,反应器出口NO浓度降至120×10-6,NO去除率达到50%.与此同时,反应器出口检测到约20×10-6的NO2,未检测到SO2.上述结果表明,NaClO2投加量足够大时,投加的NaClO2不仅能促进SO2的氧化和吸收,还能氧化NO,生成的NO2一部分被吸收而脱除,另一部分从反应器出口排出(Deshwal et al., 2008);继续增大NaClO2投加量至600 μL · min-1时,吸收液ORP值略有升高,而反应器出口NO浓度再次显著下降,NO2浓度略有升高.此外,初始吸收液pH值为5.5,通气加入NaClO2后迅速下降为2.6左右,而后基本保持稳定,这是由于氧化NO所生成的NO2和烟气中的SO2被吸收所致.由此可见,氧化剂投加量显著影响NO去除率.工程实际中,若不计运行费用,可以通过调整氧化剂投加量,控制反应器出口NOx浓度.
3.1.3 液相pH值对NO氧化的影响在NaClO2投加量为300 μL · min-1、模拟烟气不含NO2、SO2和NO浓度分别为70×10-6和240×10-6的条件下,考察液相pH值分别为2.5~3、3.5~4、5.5~6和7.5~8.0时,反应器出口NO、NO2和SO2浓度,以及ORP随反应时间的变化,结果如图 4所示.
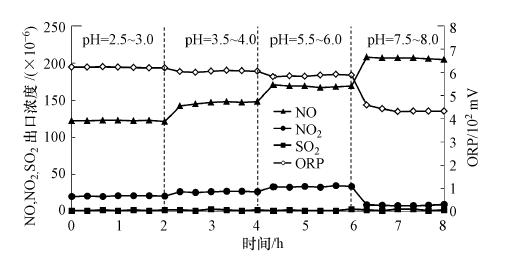 |
| 图 4 液相pH值对NO氧化的影响 Fig. 4 Effect of pH values on oxidation of NO with NaClO2 |
可以看出,出口SO2浓度几乎不受pH影响.但是,pH值每提升一个水平,出口NO浓度相应增大一个水平.也就是说,低pH值更有利于NO氧化,这是由于在酸性条件下,NaClO2溶液具有更高的氧化性.实验中还注意到,当pH值过低(<2.5)时,NaClO2会转化为ClO2,造成ClO2逸出,引起二次污染.
从图 4还可看出,出口NO2浓度随pH增大而降低,这可能是由于pH增大,NaClO2的氧化性减弱,NO被氧化后生成NO2量减少(Brogren et al., 1998).另一方面,高的pH值也有利于NO2吸收.当pH=7.5~8时,出口NO浓度上升至210×10-6左右,表明此情况下几乎不发生NO氧化反应.因此,实际运行时,为了兼顾NO氧化和防止ClO2逸出,吸收液pH值最好控制在弱酸性条件.
3.2 液相Na2SO3吸收NOx性能考察 3.2.1 气相SO2浓度对水吸收脱除NOx的影响以水作为吸收液,在不调控吸收液pH和ORP、模拟烟气中NO和NO2浓度分别为80×10-6和160×10-6的条件下,考察气相SO2浓度分别为0、70×10-6和700×10-6时,出口NO和NO2浓度,以及吸收液pH和ORP随吸收时间的变化,结果如图 5所示.
 |
| 图 5 气相SO2浓度对水吸收脱除NOx的影响 Fig. 5 Effect of SO2 concentration on removal rate of NOx in water |
可以看出,当气相中不含SO2时,随着吸收进行,出口NO2浓度稳定在78×10-6左右,而出口NO浓度高于进口浓度80×10-6,维持在100×10-6左右.这是因为NO2的吸收按反应(1)进行,生成HNO3和HNO2(顾永祥和谭天恩,1990).与此同时,生成的HNO2又按反应(2)分解,生成NO(Thomasand Vanderschuren, 1997).当气相存在SO2时,反应器出口NO和NO2浓度略有降低,尤其是NO,表明SO2的存在有助于NO和NO2的吸收脱除.其中,NO2吸收得到强化的原因可能是气相SO2被水吸收后,液相S(IV)浓度升高,从而促进了NO2的吸收脱除,如反应(3)和(4)所示(Littlejohn et al., 1993).出口NO浓度降低则是因为HNO2与S(IV)发生反应(5),减少了反应(2)向NO的转化(Shen and Rochelle,1998).
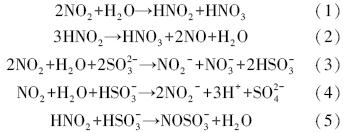
实验还考察了NO、NO2的存在对SO2吸收脱除的影响.结果表明,NO对SO2吸收脱除影响不大,但当气相不含NO2时,SO2出口浓度会迅速上升,这表明NO2的存在反过来也有利于SO2的吸收脱除,这是由于吸收的NO2消耗液相S(IV),从而促进气相SO2的溶解.
3.2.2 液相中Na2SO3投加量对脱除NOx的影响在吸收液初始pH值控制在5.5,模拟烟气中不含SO2,NO和NO2浓度分别为80×10-6和160×10-6的条件下,考察Na2SO3加入速率分别为1、2、3、4 mL · min-1时,出口NO和NO2浓度以及吸收液pH和ORP随吸收时间的变化,结果如图 6所示.
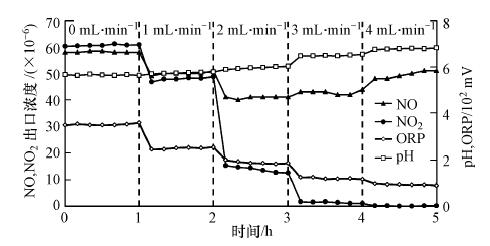 |
| 图 6 Na2SO3投加量对NOx吸收脱除的影响 Fig. 6 Effect of Na2SO3 dosage on NOx removal rate |
可以看出,不投加Na2SO3时,出口NO和NO2浓度都降至60×10-6以下.这表明当控制pH值在5.5~6.0时,有利于NO和NO2的吸收.与水吸收不同,随着液相Na2SO3投加量增大,出口NO2浓度逐渐下降,最后几乎全部被吸收.与此同时,当Na2SO3投加量低于3 mL · min-1时,出口NO浓度也随Na2SO3投加量增大而降低,这可能是NO与NO2共吸收所致.从图 6还可看出,当Na2SO3投加量高于3 mL · min-1时,出口NO浓度转而上升,这可能是因为高S(IV)浓度下,NO2优先与S(IV)发生快速氧化还原反应,使得与NO发生共吸收的NO2量降低.
在pH为5.5~6,Na2SO3还原剂的加入量为3 mL · min-1,模拟烟气中不含SO2,NO和NO2浓度分别为80×10-6和160×10-6的条件下,进一步考察同时通入NO和NO2、单独通入NO2和单独通入NO时,出口NO和NO2浓度随吸收时间的变化规律,结果如图 7所示.
 |
| 图 7 NO2共存对NO吸收脱除的影响 Fig. 7 Synergetic effect of NO2 on NO removal |
可以看出,当气相有足够高浓度NO2共存时,NO吸收效率可维持在50%左右,NO2的吸收效率达到95%以上;气相NO的存在对Na2SO3吸收NO2无明显影响.但气相不存在NO2时,NO几乎不被吸收.这表明NO的吸收脱除必须有NO2共存才能发生.正因为如此,可以借助共存NO2促进NO吸收脱除.
4 结论(Conclusions)1)SO2与NO共存于烟气时,SO2会优先与NaClO2反应,消耗氧化剂,从而降低NO氧化率.考虑到预先脱除SO2的综合费用远低于SO2和NO同步氧化与吸收,优选的工艺路线是高效脱除SO2后,再氧化NO并吸收脱除NOx.
2)降低pH值有利于NO氧化,但过低的pH值会导致NaClO2分解为ClO2,NO的氧化宜在弱酸性条件下进行.
3)NO2共存会导致部分NO被Na2SO3溶液同步吸收脱除.不过,过高的Na2SO3浓度会导致NO共脱除量降低.SO2的存在能促进NO2吸收脱除.
| [1] | Brogren C, Karlsson H T, Bjerle I. 1998. Absorption of NO in an aqueous solution of NaClO2[J]. Chemical Engineering & Technology, 21(1): 61-70 |
| [2] | Chien T W, Hsueh H T, Chu B Y, et al. 2009. Absorption kinetics of NO from simulated flue gas using Fe(Ⅱ)-EDTA solutions[J]. Process Safety and Environmental Protection, 87(5): 300-306 |
| [3] | Deshwal B R, Jin D S, Lee S H, et al. 2008. Removal of NO from flue gas by aqueous chlorine-dioxide scrubbing solution in a lab-scale bubbling reactor[J]. Journal of Hazardous Material, 150(3): 649-655 |
| [4] | Fang P, Chen C P, Wang X M, et al. 2013. Simultaneous removal of SO2, NO and Hg0 by wet scrubbing using urea+KMnO4 solution[J]. Fuel Processing Technology, 106(2): 645-653 |
| [5] | 顾永祥, 谭天恩. 1990. 氢氧化钠水溶液吸收氧化氮传质-反应过程[J]. 高校化学工程学报, 4(2): 157-167 |
| [6] | 国家环境保护部2012年全国环境统计公报. 2013[EB/OL]. http://zls.mep.gov.cn/hjtj/nb/2012tjnb/201312/t20131225_265556.Htm |
| [7] | Jin D S, Deshwal B R, Park Y S, et al. 2006. Simultaneous removal of SO2 and NO by wet scrubbing using aqueous chlorine dioxide solution[J]. Journal of Hazardous Material, 135(1/3): 412-417 |
| [8] | Littlejohn D, Wang Y Z, Chang S G. 1993. Oxidation of aqueous sulfite ion by nitrogen dioxide[J]. Environmental Science & Technology, 27(10): 2162-2167 |
| [9] | Liu Y X, Zhang J, Sheng C D, et al. 2010. Simultaneous removal of NO and SO2 from coal-fired flue gas by UV/H2O2 advanced oxidation process[J]. Chemical Engineering Journal, 162(3): 1006-1011 |
| [10] | 罗宏晶, 朱天乐, 王美艳. 2010. 非热等离子体强化碱液吸收脱除烟气中NO和Hg0的研究[J]. 环境科学, 31(6): 1682-1687 |
| [11] | Sada E, Kumazawa H, Kudo I, et al. 1978. Absorption of NO in aqueous mixed solutions of NaClO2 and NaOH[J]. Chemical Engineering Science, 33(3): 315-318 |
| [12] | Shen C H, Rochelle G T. 1998. Nitrogen dioxide absorption and sulfite oxidation in aqueous sulfite[J]. Environmental Science & Technology, 32(13): 1994-2003 |
| [13] | Thomas D, Vanderschuren J. 1997. Modeling of NOx absorption into nitric acid solutions containing hydrogen peroxide[J]. Industrial and Engineering Chemistry Research, 36(8): 3315-3322 |
| [14] | 魏林生, 周俊虎, 王智化, 等. 2008. 臭氧氧化结合化学吸收同时脱硫脱硝的研究-石灰石浆液吸收特性理论分析[J]. 动力工程, 28(1): 112-116 |
| [15] | Yamamoto T, Rajanikanth B S, Okubo M, et al. 2003. Performance evaluation of nonthermal plasma reactors for NO oxidation in diesel engine exhaust gas treatment[J]. IEEE Transactions on Industry Applications, 39(6): 1608-1613 |
| [16] | 赵毅, 刘凤, 赵音, 等. 2008. 亚氯酸钠溶液同时脱硫脱硝的热力学研究[J]. 化学学报, 66(15): 1827-1832 |
 2014, Vol. 34
2014, Vol. 34


