2. 天普大学市政与环境工程系, 费城, 宾州, 19122, 美国
2. Department of Civil and Environmental Engineering, Temple University, Philadelphia, Pennsylvania 19122, United States
随着现代工业对石油及其加工产品使用量的增加,在石油的开采、精炼、运输、燃烧过程中产生了大量的有毒有机污染物(王春明,2007).多环芳烃(Polycyclic Aromatic Hydrocarbons,简称PAHs)便是其中一类最常见的、广泛分布于土壤中的疏水性难降解的有机化合物(罗雪梅等,2004).由于PAHs水溶性差,辛醇-水分配系数高,脂溶性也特别好,使其在动物尤其是人类的各种器官、皮肤中很容易积累,并可以通过食物链在生物体内富集,对人体具有潜在危害性(邹德勋等,2006).此外,PAHs特有的 “三致”效应(致畸、致癌、致突变),更使其不得不成为人类关注的焦点.目前,研究者们尝试各种物理(Dhenain et al., 2009)、化学(Ferrarese et al., 2008)、生物(Hansen et al., 2004)以及它们的联合方法(Zheng et al., 2007)来修复多环芳烃污染土壤和地下水.这些修复方法的主要原理是通过增加有机污染物在液相的溶解度从而使他们从污染土壤中解吸出来.其中,表面活性剂增效修复技术(surfactant-enhanced remediation,SER)已成为一种非常有潜力的有机物土壤污染修复技术.它主要是利用表面活性剂溶液对疏水性有机污染物的增溶作用来促进吸附在土壤粒子上的有机污染物解吸及溶解、并最终迁移出土壤环境,使土壤得以修复.大量研究表明,表面活性剂浓度超过临界胶束浓度(Critical Micelle Concentration,CMC)时,能使PAHs的溶解度显著提高(Rouse et al., 2008).而且,表面活性剂还可以影响PAHs与微生物的相互作用从而促进微生物修复多环芳烃污染土壤.陈来国等(陈来国和冉勇,2004)提出利用表面活性剂增加土壤溶液中 PAHs的溶解度和解吸速率,来提高生物可利用性,从而提高 PAHs污染土壤的修复效率.
近年来,研究者们对应用混合表面活性剂来修复多环芳烃污染土壤具有极大的兴趣.混合表面活性剂体系比各单一表面活性剂具有更低的CMC值,而且其Km(胶束相-水相分配系数)也比各单一表面活性剂高,为多环芳烃提供了更好的分配环境,因此混合表面活性剂能更有效的提高对多环芳烃的污染修复效率.而且混合表面活性剂体系强化生物修复,可以提高生物修复效率,是PAHs污染土壤修复的研究热点.周文军等(Zhou and Zhu, 2004)进行了阴离子-非离子混合表面活性剂溶液对芘在水中的溶解度的影响的研究,结果阴离子-非离子混合表面活性剂对芘的增溶有很大潜力.Paria and Yuet(2006)发现各种离子-非离子表面活性剂体系对萘的增溶效果低于理想值.冯少良等(2003)比较研究了单一表面活性剂及它们的混合体系对多种多环芳烃的增溶作用及其机理,研究表明混合表面活性剂对多环芳烃的增溶能产生显著的协同作用.
综上所述,表面活性剂通过调控PAHs在土壤上的吸附和脱附行为在控制和修复土壤及地下水PAHs污染中具有巨大的应用前景.国内外学者在表面活性剂对多环芳烃污染土壤修复方面已经进行了不少有意义的研究和探索.但是已有的研究主要集中在传统表面活性剂.而传统表面活性剂往往具有毒性、二次污染、价格高等问题,因此寻找经济、有效、环保的新型表面活性剂将成为未来应用表面活性剂修复多环芳烃污染土壤的研究热点及重点.新型双子表面活性剂与生物表面活性剂因其高效性、环境友好性等特点被广泛关注.目前用双子表面活性剂和生物表面活性剂修复污染土壤已有一些研究,但是对于两者在修复效果上的比较还未见报道.此外混合表面活性剂对污染土壤强化修复的影响研究还亟待加强.
因此,本文系统研究比较了新季铵盐型Gemini阳离子表面活性剂[C12H25N+(CH3)2(CH2)3-N+(CH3)2C12H25 · 2Br﹣](简写CG12-3-12)、生物表面活性剂鼠李糖脂(Rhamnolipid,阴离子表面活性剂)、普通非离子表面活性剂TX-100以及它们的混合体系对多环芳烃菲和芘的增溶效果,通过计算与比较临界胶束浓度(CMC)、摩尔增溶率(MSR)和增溶的标准自由能ΔGs0,评价了3种不同类型表面活性剂及它们的混合体系对菲和芘的增溶能力.本实验的结果将为选择和应用双子表面活性剂与鼠李糖脂来修复多环芳烃污染土壤、地下水等提供理论依据.
2 实验材料和方法(Materials and methods) 2.1 主要实验材料及仪器TX-100(非离子型表面活性剂),纯度大于99%,购于sigma公司;季铵盐型Gemini表面活性剂CG12-3-12(阳离子表面活性剂),纯度大于98%,购于中科院成都有机化学研究所;鼠李糖脂(Rhamnolipid,阴离子生物表面活性剂),纯度大于90%,购于湖州紫金生物技术公司,该鼠李糖脂主要有单糖和双糖组成(结构见图 1),比率是单糖比双糖 1 : 2.本实验所用的多环芳烃为菲和芘,纯度大于98%,购于A Johnson Matthey Company.所选3种表面活性剂和菲、芘的分子结构及性质见表 1和表 2.其他化学试剂包括:NaN3(分析纯)、NaCl(分析纯)、NaHCO3(分析纯)、甲醇(色谱纯)均购于北京化学试剂公司.
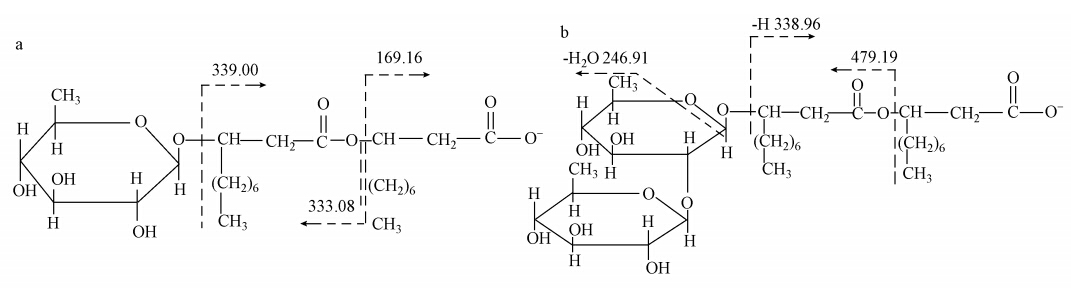 |
| 图 1 鼠李糖脂的结构(a. 单鼠李糖脂;b. 双鼠李糖脂) Fig. 1 Structures of mono-rhamnolipid and di-rhamnolipid |
| 表1 表面活性剂的性质参数 Table 1 Properties of surfactants used in the experiment |
| 表2 多环芳烃的性质参数 Table 2 Properties of PAHs used in the experiment |
实验仪器包括BZY-2全自动表面张力仪(上海恒平仪器仪表厂),HZQ-F160振荡培养箱(中国哈尔滨市东联电子技术开发有限公司),Sigma2-16PK台式高速冷冻离心机(北京卓明贸易有限公司),Agilent1200型高效液相色谱仪及工作站(安捷伦科技有限公司).
2.2 实验方法 2.2.1 表面张力测定分别配制一系列浓度的单一表面活性剂,以及它们等摩尔混合的溶液(TX-100/CG12-3-12、TX-100/Rhamnolipid).静置1 h,然后测其表面张力,测量的准确性为±0.1 mN · m-1.以表面活性剂浓度对数值与其相应的表面张力值作图(图 2),曲线中折点处对应的浓度即为该表面活性剂的临界胶束浓度(CMC).
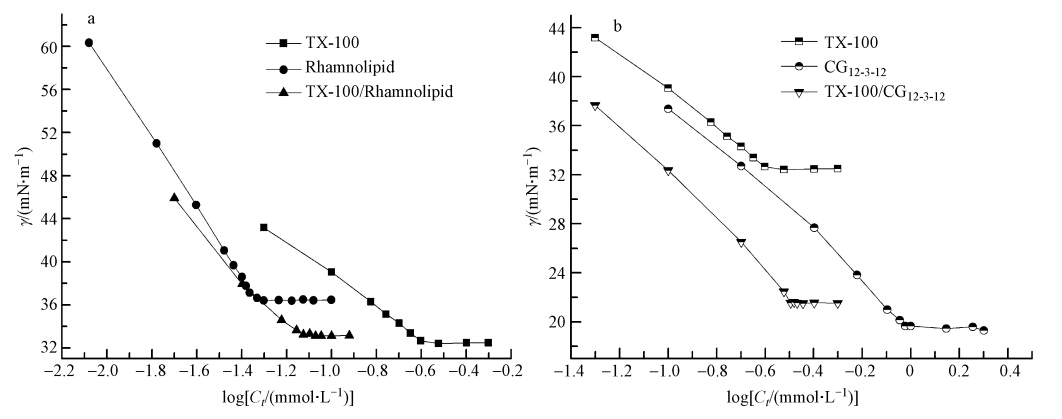 |
| 图 2 各表面活性剂体系的表面张力γ对logC曲线图(a. TX-100与鼠李糖脂的单一及混合溶液;b.TX-100与CG12-3-12的单一及混合溶液) Fig. 2 Variation of the surface tension value(γ)versus the total surfactant concentration of all surfactant systems(Ct)(a. single and mixed rhamnolipid and TX-100 surfactant; b. single and mixed CG12-3-12 and TX-100 surfactant) |
配置一系列不同浓度的单一或混合的表面活性剂溶液,同时加入0.01 mol · L-1的NaCl以保证溶液的离子强度和质量比为0.01%的NaN3来抑制微生物的生长,用15 mmol · L-1 NaHCO3调pH为6.8.称取足够量的菲或芘置于20 mL的具塞玻璃瓶中,同时加入10 mL不同浓度的表面活性剂溶液.样品瓶密封后在(25±1)℃,200 r · min-1条件下振荡培养48 h.取出静置一段时间后在5000 r · min-1下离心30 min.取上清液通过0.25 nm的滤膜,用HPLC法来测定菲或芘的浓度.
2.2.3 HPLC分析方法HPLC所用色谱柱为反相C18柱,检测器为荧光检测器,测定条件为:流速:1.0 mL · min-1;流动相:甲醇 : 水=80 : 20;柱温:30 ℃.菲的激发波长和发射波长分别为244 nm和360 nm;芘为334 nm和385 nm.HPLC的最低检测限为0.5 μg · kg-1.
3 结果与讨论(Results and discussion) 3.1 表面活性剂的表面性能实验测得各单一及混合表面活性剂溶液的表面张力曲线和临界胶束浓度分别列于图 2和表 3.由图 2可以看出,在达到CMC后,两种混合的表面活性剂溶液的表面张力值分别介于两种单一表面活性剂之间,同时在相同表面张力下,混合表面活性剂浓度低于各单一表面活性剂的浓度这是由于两种表面活性剂的相互作用,会增强其胶束性能.因此,TX-100/CG12-3-12与TX-100/Rhamnolipid混合表面活性剂在降低表面张力效率方面都能够产生协同效应.
| 表3 各表面活性剂体系的表面活性数据及热力学参数1) Table 3 Surface activity data and thermodynamic parameter of the surfactant systems at 25 ℃1) |
表 3列出了由Clint(Clint,1975)理想混合模型方程计算出的理想临界胶束浓度CMCmi、根据Rubingh理论(Rubingh and Mittal, 1979)计算出的相互作用参数βm,混合胶束中组分的摩尔分数X1m、X2m以及活度系数f1、f2.可以看出实验所得所有单一表面活性剂的临界胶束浓度CMCexp与文献值基本相一致.而混合表面活性剂体系的CMCexp却不同于CMCmi.TX-100/CG12-3-12混合系统的CMCexp小于CMCmi,而TX-100/Rhamnolipid混合系统的CMCexp大于CMCmi,这说明TX-100/CG12-3-12混合溶液和TX-100/Rhamnolipid的混合溶液都不符合理想混合溶液的性质.这与魏佳等(Wei et al., 2011)得出的结论相同.
由表 3可清楚的看出,本实验中βm的值均为负,进一步证明两组混合表面活性剂体系均显示出协同效应,这与图 2相符.而TX-100/CG12-3-12体系的βm的负值(-0.9878)大于TX-100/Rhamnolipid体系(-0.4136),说明TX-100/CG12-3-12体系的CMCexp相对于CMCmi有更大的负偏差.由于实验所用CG12-3-12属于阳离子表面活性剂,TX-100与CG12-3-12表现出的较强的协同效应可能由于阳离子和非离子的胶团的亲水基之间的离子偶极吸引力代替了阳离子头之间强大的静电排斥力,或者是因为两者混合稀释弱化了阳离子之间的静电排斥作用和非离子之间的弱空间排斥作用(Zhou and Rosen, 2003).
体系中的物理化学性质可以由胶束在形成过程中能量的变化反映出来(赵国玺,2003).为了从能量的角度来讨论胶束中分子间的相互作用大小,在相分离模型的基础上推导出胶束形成的热力学参数(Rosen et al., 1982):
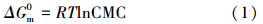
比较混合体系中各组分的Xmi与fi值,可以看出Xmi与fi值与各组分的CMC呈负相关.例如:TX-100/CG12-3-12混合体系中CG12-3-12的CMC大于TX-100的CMC,而CG12-3-12活度fi要比TX-100小36.76%,在混合胶束中的摩尔分数Xmi也小于TX-100;同样在TX-100/Rhamnolipid体系中,Rhamnolipid的CMC小于TX-100的CMC,其Xmi与fi比TX-100大.从胶束形成的吉布斯自由能ΔGm0来看,在TX-100/CG12-3-12混合体系中,ΔGm0顺序为CG12-3-12>TX-100/CG12-3-12>TX-100,说明TX-100/CG12-3-12混合胶束比CG12-3-12更易形成.而对于TX-100/Rhamnolipid混合体系,吉布斯自由能ΔGm0的顺序为TX-100>TX-100/Rhamnolipid>Rhamnolipid,这与鼠李糖脂的活度要比TX-100大26.13%,在混合胶束中的摩尔分数也大于TX-100相符.比较两混合体系的吉布斯自由能,可见,TX-100与鼠李糖脂比与CG12-3-12更容易形成混合胶束.
3.2 单一表面活性剂对菲和芘的增溶由文献可知纯水中菲和芘的溶解度分别为6.6×10-3、6.4×10-4 mmol · L-1(25 ℃),溶解度非常低.CG12-3-12、Rhamnolipid、TX-100对于这两种多环芳烃都有一定的增溶作用,在表面活性剂液相浓度大于临界胶束浓度(CMC)时,增溶作用显著.之前已有研究表明双子表面活性剂和生物表面活性剂对有机物的增溶效率比传统表面活性剂高(吴应琴等,2010 ;Wei et al., 2011).在本实验中,菲和芘的表观溶解度随表面活性剂浓度的变化曲线(图 3)也证明了这一点.例如:当3种表面活性剂CG12-3-12、Rhamnolipid、TX-100浓度均为5 CMC时,水中菲和芘的溶解度分别增大118.18、2.86、4.69和453.13、1.53、4.52倍.CMC是表面活性剂的一个重要性质参数,也在一定程度上影响有机污染物的增溶度.通常认为,表面活性剂的CMC值越低,对有机污染物的增溶性就越好.但由图 3可以明显看出在表面活性剂浓度相同且大于CMC时,3种表面活性剂对菲和芘的增溶性大小顺序为: CG12-3-12>Rhamnolipid> TX-100,这说明CMC的降低也不能代表增溶能力的绝对增加.换句话说,CMC值并不能有效地测量表面活性剂的增溶能力.因此,研究各表面活性剂的增溶能力就需要对单一及混合表面活性剂体系对PAHs的增溶做进一步的评估和比较.
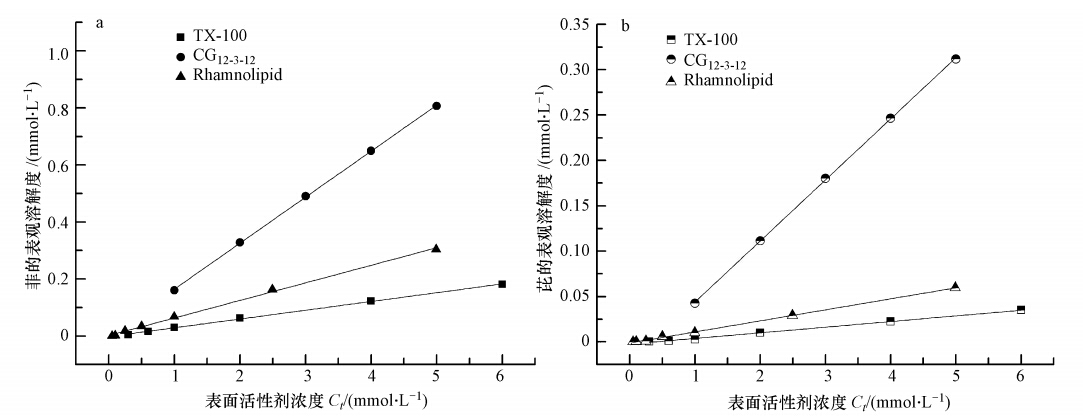 |
| 图 3 单一表面活性剂对PAHs的增溶曲线 Fig. 3 Solubility enhancement of PAHs by single surfactants |
摩尔增溶比(MSR)是描述增溶能力的参数,它表示特定表面活性剂对某一溶质增溶能力的有效性(Edwards et al., 1991):
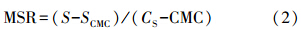
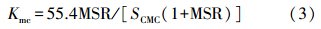
| 表4 各表面活性剂体系菲和芘的MSR,logKmc,ΔGs0值1) Table 4 Molar solubilization ratio(MSR),logKmc,ΔGs0of Phenanthrene and Pyrene in various single and mixed micellar systems at 25 ℃ |
根据MSR值,各单一表面活性剂对菲和芘的增溶能力顺序都是:CG12-3-12 >Rhamnolipid>TX-100,这说明CG12-3-12对菲的增溶度比另两种表面活性剂都高,这可能是因为其独特的双离子头基更容易形成胶束或者形成的胶束尺寸比普通的表面活性剂大,使其具有更大的增溶容量(Ghosh,2001).
由表 4可以看出,对于菲和芘的增溶,3种单一表面活性剂中双子CG12-3-12的MSR最大,但是Kmc却是最小,这是由于Kmc是一个关于MSR和SCMC的函数,而CG12-3-12的SCMC(0.1604)比Rhamnolipid(0.0004)和TX-100(0.0036)大很多,使得其Kmc值小于两者.生物表面活性剂鼠李糖脂对多环芳烃增溶能力较TX-100高很多,不仅是由于它们具有较低的CMC,而且鼠李糖脂的亲水亲油平衡值(HLB)为11(郭利果等,2009),远小于TX-100的HLB值18.7(Bai et al., 1998),因此其对憎水性有机物具有较强的乳化增溶能力.Doong等(Doong and Lei, 2003)也认为,表面活性剂对多环芳烃的增溶能力的大小与HLB值负相关.Bai等(Bai et al., 1998)研究认为,鼠李糖脂对多环芳烃增溶能力与其胶束结构特性有关,鼠李糖脂同系物的一些分子中含有两个疏水烷基,这些碳链占据较大的空间,导致鼠李糖脂可能会形成内径较大的圆柱状或棒状的胶束,从而能够容纳更多的多环芳烃分子.
3.3 混合表面活性剂对菲和芘的增溶图 4为两种混合表面活性剂对菲和芘的增溶曲线.从图 4中可以明显看出TX-100/CG12-3-12与TX-100/Rhamnolipid混合体系都较相对应的单一表面活性剂TX-100、CG12-3-12、Rhamnolipid有更好的增溶能力.并且由表 4可见随着混合体系TX-100浓度的增加MSR也增加,说明TX-100加入到CG12-3-12或鼠李糖溶液中,TX-100混合的浓度越大对多环芳烃增溶的有效性越好.因此,阴-非离子混合表面活性剂体系、阳-非离子表面活性剂体系对PAHs都能产生显著的协同增溶作用.
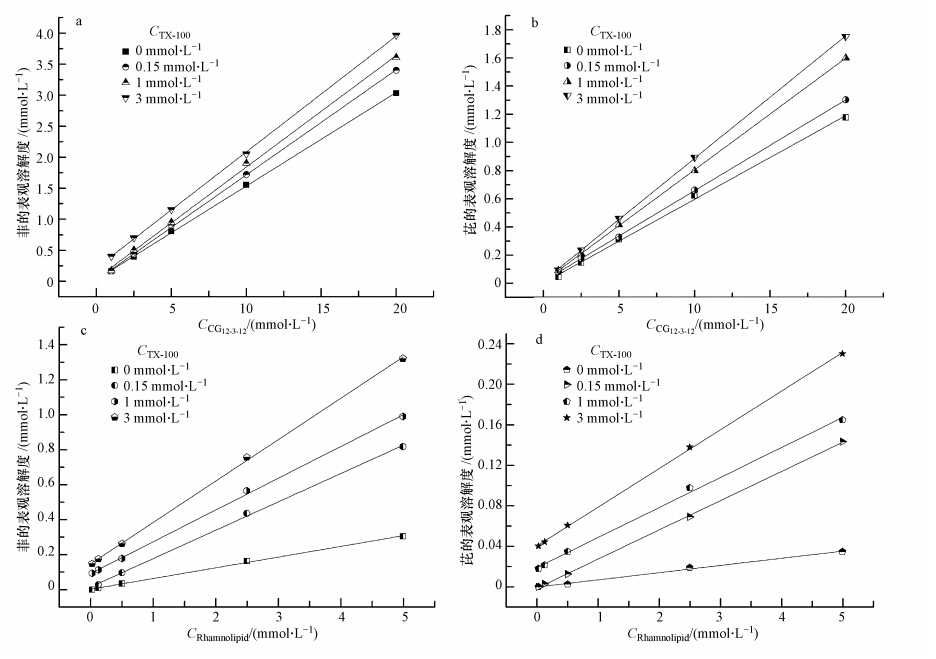 |
| 图 4 两种混合表面活性剂体系对PAHs的增溶(a. TX-100/CG12-3-12混合体系对菲的增溶;b. TX-100/CG12-3-12混合体系对芘的增溶;c. TX-100/Rhamnolipid混合体系对菲的增溶;d.TX-100/Rhamnolipid混合体系对芘的增溶) Fig. 4 Solubility enhancement of PAHs by two mixed-surfactant systems(a. solubilization of phenanthrene by TX-100/CG12-3-12 systems; b. solubilization of pyrene by TX-100/CG12-3-12 systems; c. solubilization of phenanthrene by TX-100/Rhamnolipid systems; d. solubilization of pyrene by TX-100/Rhamnolipid systems) |
为进一步比较各体系的MSR,将不同TX-100浓度时,TX-100/CG12-3-12和TX-100/Rhamnolipid混合体系对菲和芘的增溶MSR与未加入TX-100时的MSR相比的倍数作图(图 5).可以发现,当加入TX-100溶液浓度为0.15~3 mmol · L-1时,TX-100/CG12-3-12混合体系对菲和芘的增溶MSR分别是未加入TX-100之前的1.02~1.16和1.08~1.46倍;TX-100/Rhamnolipid混合体系对菲和芘的增溶MSR分别是未加入TX-100之前的2.63~3.84和2.34~3.11倍.说明TX-100/Rhamnolipid混合体系对菲和芘的增溶能力的提高要整体大于TX-100/CG12-3-12混合体系.这个结论同样也可以由两混合体系的胶束相/水相间的分配系数Kmc值看出,TX-100/Rhamnolipid混合体系的Kmc均比TX-100/CG12-3-12混合体系大,说明TX-100/Rhamnolipid混合体系对菲和芘的增溶的有效性更好.这可能是TX-100与鼠李糖脂比与CG12-3-12更容易形成混合胶束的原因(3.1节所得结论).
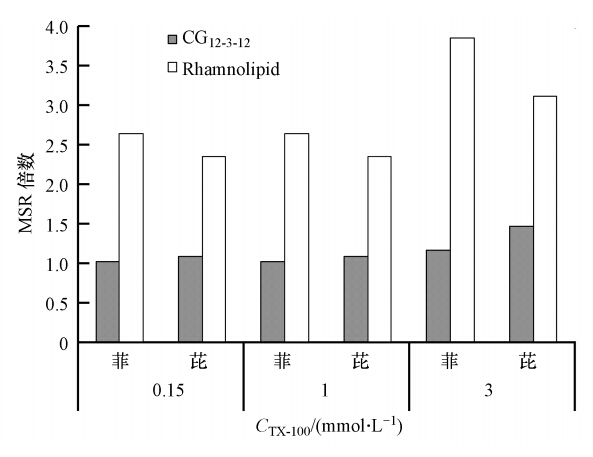 |
| 图 5 混合体系与单一表面活性剂的MSR的比值随TX-100浓度变化图 Fig. 5 Proportion of MSR in mixture and single surfactant in different concentrations of TX-100 system |
表面活性剂对PAHs的增溶的标准自由能ΔGs0(Mehta et al., 2009):
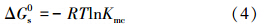
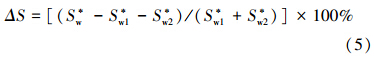
通过计算得出TX-100/CG12-3-12(CG12-3-12浓度为5 mmol · L-1,TX-100浓度为0.15、1、3 mmol · L-1)对菲和芘的协同增溶作用分别为相同浓度的单一TX-100 、CG12-3-12表面活性剂溶解度之和的1.12、1.14、1.29和1.05、1.32、1.40倍(表 5),随着TX-100浓度的增加而增加,这与比较TX-100/CG12-3-12混合体系的MSR有相同的结论.而对TX-100/Rhamnolipid混合体系,Rhamnolipid浓度为0.5 mmol · L-1,当TX-100浓度为1 mmol · L-1时混合协同增溶作用分别为相同浓度的单一TX-100 、Rhamnolipid溶解度之和的倍数最大,且此时ΔS也最大,说明在Rhamnolipid浓度为0.5 mmol · L-1时,混合体系中TX-100添加浓度为1 mmol · L-1,两种表面活性剂的协同作用最大.
| 表5 混合表面活性剂对PAHS的协同增溶程度 Table 5 Synergistic solubilization of PAHs by mixed surfactants |
1)TX-100/CG12-3-12与TX-100/Rhamnolipid混合表面活性剂在降低表面张力效率方面都能够产生协同效应.但是两种混合溶液都不符合理想溶液的性质.TX-100/CG12-3-12体系的CMCexp相对于CMCmi有更大的负偏差.由两混合体系的吉布斯自由能ΔGm0,可以看出,TX-100与鼠李糖脂比与CG12-3-12更容易形成混合胶束.
2)双子表面活性剂和生物表面活性剂对有机物的增溶效率比传统表面活性剂高,当浓度大于CMC时,3种表面活性剂对菲和芘的增溶性大小顺序为: CG12-3-12>Rhamnolipid> TX-100.
3)TX-100/CG12-3-12与TX-100/Rhamnolipid混合体系都较相对应的单一表面活性剂TX-100、CG12-3-12、Rhamnolipid有更好的增溶能力.TX-100/Rhamnolipid混合体系对菲和芘的增溶效果高于TX-100/CG12-3-12混合体系.
| [1] | Bai G Y, Brusseau M L, Miller R M. 1998. Influence of cation type, ionic strength, and pH on solubilization and mobilization of residual hydrocarbon by a biosurfactant[J]. Journal of Contaminant Hydrology, 30(3/4): 265-279 |
| [2] | 陈来国, 冉勇. 2004. 多环芳烃生物修复中的表面活性剂[J]. 生态环境, 13(1): 88-91 |
| [3] | Clint J H. 1975. Micellization of mixed nonionic surface active agents[J]. Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases, 71: 1327-1334 |
| [4] | Dhenain A, Mercier G, Blais J F, et al. 2009. Combined column and cell flotation process for the treatment of PAH contaminated hazardous wastes produced by an aluminium production plant[J]. Journal of Hazardous Materials, 165(1/3): 394-407 |
| [5] | Doong R A, Lei W G. 2003. Solubilization and mineralization of polycyclic aromatic hydrocarbons by Pseudomonas putida in the presence of surfactant[J]. Journal of Hazardous Materials, 96(1): 15-27 |
| [6] | Edwards D A, Luthy R G, Liu Z B. 1991. Solubilization of Polycyclic aromatic hydrocarbons in micellar nonionic surfactant solutions[J]. Environmental Science & Technology, 25(1): 127-133 |
| [7] | 冯少良. 2003. 混合表面活性剂对多环芳烃的增溶作用机理及影响因素[D] 杭州: 浙江大学. 2-8 |
| [8] | Ferrarese E, Andreottola G, Oprea I A. 2008. Remediation of PAH-contaminated sediments by chemical oxidation[J]. Journal of Hazardous Materials, 152(1): 128-139 |
| [9] | Ghosh S. 2001. Surface chemical and micellar Properties of binary and ternary surfactant mixtures (cetyl Pyridinium chloride, Tween-40, and Brij-56) in an aqueous medium[J]. Journal of Colloid and Interface Science, 244(1): 128-138 |
| [10] | Gruen D W R. 1985. A model for the chains in amphiphilic aggregates 2. Thermodynamic and experimental comparisons for aggregates of different shape and size[J]. The Journal of Physical Chemistry, 89(1): 153-163 |
| [11] | 郭利果, 苏荣国, 梁生康, 等. 2009. 鼠李糖脂生物表面活性剂对多环芳烃的增溶作用[J]. 环境化学, 28(4): 510-514 |
| [12] | Hansen L D, Nestler C, Ringelberg D, et al. 2004. Extended bioremediation of PAH/PCP contaminated soils from the POPILE wood treatment facility[J]. Chemosphere, 54(10): 1481-1493 |
| [13] | 罗雪梅, 刘昌明, 何孟常. 2004. 土壤与沉积物对多环芳烃类有机物的吸附作用[J]. 生态环境, 13(3): 394-398 |
| [14] | Mehta S K, Chaudhary S, Kumar R, et al.2009. Facile Solubilization of organochalcogen compounds in mixed micelle formation of binary and ternary cationic-nonionic surfactant mixtures[J]. The Journal of Physical Chemistry B, 113(20): 7188-7193 |
| [15] | Paria S, Yuet P K. 2006. Solubilization of naphthalene by pure and mixed surfactants[J]. Industrial & Engineering Chemistry Research, 45(10): 3552-3558 |
| [16] | Rosen M J, Cohen A W, Dahanayake M, et al. 1982. Relationship of structure to properties in surfactants 10. surface and thermodynamic properties of 2-dodecyloxypoly(ethenoxyethanol)s, C12H25(OC2H4)xOH, in aqueous solution[J]. The Journal of Physical Chemistry, 86(4): 541-545 |
| [17] | Rouse J D, Morita T, Furukawa K, et al. 2008. Solubilization of mixed polycyclic aromatic hydrocarbon systems using an anionic surfactant[J]. Colloids and Surfaces (A: Physicochemical and Engineering Aspects), 325(3): 180-185 |
| [18] | Rubingh D N, Mittal K L. 1979. Solution chemistry of surfactants[M]. Now York: Springer. 337-350 |
| [19] | 王春明. 2007. 多环芳烃降解菌分离、降解特性及在稠油微生物采油中的应用研究[D]. 成都: 四川大学 |
| [20] | Wei J, Huang G H, Yu H, et al. 2011. Efficiency of single and mixed Gemini/conventional micelles on solubilization of phenanthrene[J]. Chemical Engineering Journal, 168(1): 201-207 |
| [21] | 吴应琴, 陈慧, 王永莉, 等. 2010. 生物表面活性剂对多环芳烃增溶行为的研究[J]. 环境科学与技术, 33(S2): 122-124 |
| [22] | Yu H, Huang G H, Wei J, et al. 2011. Solubilization of mixed polycyclic aromatic hydrocarbons through a rhamnolipid biosurfactant[J]. Journal of Environmental Quality, 40(2): 477-483 |
| [23] | Zana R. 1996. Critical micellization concentration of surfactants in aqueous solution and free energy of micellization[J]. Langmuir, 12(5): 1208-1211 |
| [24] | 赵国玺. 2003. 表面活性剂作用原理[M]. 北京: 中国轻工业出版社. 225-246; 263; 272 |
| [25] | Zheng X J, Blais J F, Mercier G, et al. 2007. PAH removal from spiked municipal wastewater sewage sludge using biological, chemical and electrochemical treatments[J]. Chemosphere, 68(6): 1143-1152 |
| [26] | Zhou Q, Rosen M J. 2003. Molecular interactions of surfactants in mixed monolayers at the air/aqueous solution interface and in mixed micelles in aqueous media: The regular solution approach[J]. Langmuir, 19(11): 4555-4562 |
| [27] | Zhou W J, Zhu L Z. 2004. Solubilization of pyrene by anionic-nonionic mixed surfactants[J]. Journal of Hazardous Materials, 109(1/3): 213-220 |
| [28] | 朱利中, 冯少良. 2002. 混合表面活性剂对多环芳烃的增溶作用及机理[J]. 环境科学学报, 22(6): 774-778 |
| [29] | 邹德勋, 骆永明, 滕应, 等. 2006. 多环芳烃长期污染土壤的微生物强化修复初步研究[J]. 土壤, 38(5): 652-656 |
 2015, Vol. 35
2015, Vol. 35


