温室气体排放量的增加是导致全球变暖的主要原因,其中,N2O是三大温室气体之一,其增温潜力是CO2的296倍(IPCC,2007).农业活动是N2O的主要来源,占人类活动N2O排放量的84%(Smith et al., 2008),其中,农田N2O排放量占我国N2O总排放量的73.9%(国家发展和改革委员会,2004).因此,如何减少农田中N2O的排放成为当前重要的科学课题之一.
生物碳是一种在完全或部分缺氧的条件下,经热解使有机物碳化所产生的一类高度芳香化的难溶性固态物质(Lehmann et al., 2009),具有含碳量高、结构稳定、孔隙结构发达、比表面积大等特性(陈再明等,2013).其作为添加剂应用于土壤可以提高碳汇(Marris,2006;Lehmann,2007;Woolf et al., 2010),改善土壤状况,增加土壤肥力,提高农作物产量(Lehmann et al., 2006;Asai et al., 2009).此外,一些研究也表明,生物碳可显著减少N2O的排放(Zhang et al., 2010;Spokas et al., 2009;Wang et al., 2013).例如,Spokas等(2009)研究了16种生物碳的添加对土壤N2O排放的影响,结果显示,除去本身含氮量比较高的一种生物碳促进了N2O的释放外,其余15种生物碳基本都抑制了N2O的释放;Zhang等(2010)研究发现,当生物碳以10 t · hm-2和40 t · hm-2的比例添加到未施用肥料的水稻土壤中,N2O排放通量降低了21%~28%;Wang等(2013)也得出芦竹生物碳可减少农业土壤中N2O释放的结论.然而,目前关于生物碳对土壤N2O排放影响机制的研究还很少.因此,本文通过“解剖”的方式,即将生物碳分离成碳骨架和浸提液的形式,考察生物碳整体、碳骨架和浸提液分别施加到水稻田土壤中对N2O排放通量的影响,从而分析生物碳影响土壤N2O排放的潜在机制.
2 材料与方法(Materials and methods) 2.1 土壤的采集与生物碳的制备土壤样品采集于广州市华南农业大学实验基地一年两熟的水稻田(23°03′22.6″N,113°22′55″E,海拔300 m),挖取上层0~10 cm深度的土壤,自然风干后,过2 mm筛,去除可见根和石头.该水稻田土壤的粘粒、粉粒和砂粒组成分别为30%、46%和24%,质地属壤土.
生物碳原料为散养鸡场的粪便,自然风干后,磨碎过2 mm筛,放入温度为105 ℃的烘中箱干燥至恒重,然后置于马弗炉中,以5 ℃ · min-1的升温速率将炉温升至550 ℃.在此温度下制得的鸡粪生物碳综合性能较高(包括pH、营养元素、有机质含量等都较高)(Hossain et al., 2011).升至设定温度后厌氧热解1 h,关闭马弗炉,待炉温降到室温后再将烧好的固体产物取出,最后用研磨机将固体产物研磨成粒径<2 mm的粉末,即制得实验添加用的生物碳.本研究使用家禽粪便烧制生物碳,是因为其含有较丰富的营养物质(Gaskin et al., 2008; Mullen et al., 2010),对于研究与硝化和反硝化过程相关的N2O排放变化具有一定的代表性.
参照Jones等(2011)的方法,通过将生物碳反复淋洗的方式得到浸提液和碳骨架.将5 g生物碳放于离心管中,加15 mL去离子水,用旋涡振荡器振荡1 min混匀,然后在恒温振荡器中以200 r · min-1振荡1 h,取出后置于离心机以5000 r · min-1离心15 min,过滤得一次浸提液.再次加入15 mL去离子水,重复上述操作,得二次浸提液.合并两次浸提液,过0.22 μm滤膜得到生物碳浸提液,其中主要含一些水溶性成分.将制备浸提液余下的生物碳置于大烧杯(1 L)中,加入大量去离子水,用玻璃棒搅拌5 min后用磁力搅拌器搅拌15 min,静置1 h后,用雷磁DDS-11A数显电导率仪测定滤液电导率(EC),重复上述操作数次直至滤液电导率小于50 μS · cm-1.然后将过滤留下的生物碳风干48 h,得到反复浸提干净的生物碳,即碳骨架.
2.2 实验设计实验设置4种处理:土壤(对照,S)、土壤+生物碳(SB)、土壤+生物碳浸提液(SBE)、土壤+碳骨架(SBC).生物碳与碳骨架的添加量都为5%(质量分数),浸提液按下面设定的土壤含水量添加到土壤中.每种处理设置24个重复.在恒温(25.0 ± 0.2)℃及70%的土壤充水孔隙度(WFPS)条件下进行为期90 d的培养实验.土样具体培养方法为:称取100 g风干土或风干土与生物碳的混合物,混匀后装入内径7.832 cm、高11.75 cm的500 mL棕色瓶中铺平压实.为了减小加水引起的脉冲效应及稳定土壤中的微生物活性,所有样品均在低于其目标含水量20%的湿度下预培养2 d.正式采样开始前12 h,再用注射器均匀加入蒸馏水达到预定的土壤含水量(添加生物碳浸提液的处理用浸提液调节至预定含水量).为保证土壤含水量稳定,在瓶口封一层保鲜膜,并用针扎10个小孔,保证通气性,同时尽量减少空气流通以降低蒸发量,每周固定时间通过质量的差值添加等量的蒸馏水,使土壤保持所设定的含水量.
在90 d的培养实验期间内,采气8次,每次3个重复.用密封注射器在培养期的第1、7、14、28、42、56、70、90 d采集棕色瓶中的气体,以测定N2O的变化速率.采气时先将保鲜膜揭去,让棕色瓶完全暴露于大气1 min,然后用含有气体采样橡胶塞隔垫(岛津进样隔垫,浅黄色)的密封盖密闭棕色瓶,并涂上凡士林保证装置密闭性.用注射器分别于封盖后的第0和60 min抽取8.00 mL气样,并且立刻把针头插进橡皮塞防止气样受污染,所有气样于12 h内测试完成.取掉橡胶塞瓶盖,重新覆盖上保鲜膜继续培养.实验前随机抽取采气装置5套进行气密性检验,气密性达100%.同时,在培养期的第1、7、14、28、42、56、70、90 d时,对各处理中采气后的3个重复试验的土样进行破坏性采样,以测定该培养阶段样品的pH、土壤有机碳(SOC)和NO-3浓度.
2.3 分析与计算N2O组分测试使用气相色谱仪(Shimadzu GC 2014,Japan),条件设置如下:柱温80 ℃,ECD检测器280 ℃,保留时间6.6 min,载气为高纯氮气,载气总流量4.0 mL · min-1,柱流量0.5 mL · min-1.根据测定数据,按照以下公式计算出N2O气体通量:
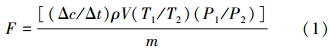
式中,F为N2O气体通量(μg · kg-1 · h-1),V为棕色试剂瓶的容积(L),m为棕色瓶所装风干土的质量(g),Δc/Δt是气体在观测时间内浓度随时间变化的直线斜率(ppm · h-1),ρ为标准状态下气体的密度(N2O:1.964×103 g · m-3),T1为标准状态下气体的绝对温度(273 K),T2为棕色瓶内气体的实际绝对温度(K),P1为标准状态下气体的压强(1.013×105Pa),P2为棕色瓶内气体的实际气压(Pa).
不同培养时间土样的pH值,以1 ∶ 5(W ∶ V,g · mL-1)的土水比,用旋涡振荡器振荡1 min混匀并静置30 min后,直接用pH计玻璃电极(Mettler-Toledo)进行测定.土壤有机质(SOC)含量采用重铬酸钾容量法-稀释热法测定.NO-3-N浓度的测定采用紫外分光光度法,从不同培养时间各处理的土壤样品中准确称取5.00 g于50 mL离心管,加入25 mL 1 mol · L-1 KCl溶液,在转速100 r · min-1的摇床振荡120 min,取出后用冷冻离心机在4 ℃以3000 r · min-1离心10 min,过滤得上清液.吸取1.00 mL上清液于比色管中,定容至10 mL,加入1 mL显色剂(0.2 mL盐酸与0.8 mL氨基磺酸胺),摇匀后用酶标仪(Bio-Tek,USA)在220 nm与275 nm波长处进行比色测定.用冷场扫描电镜(SEM)对生物碳进行不同放大倍数的扫描实验,分析其微观分布构造,通过红外光谱对烧制的生物碳进行有机官能团分析.
所测得的pH值、SOC、NO-3和N2O浓度数据用Excel进行基础数据处理,并且用均值±标准差的形式来表示;运用SPSS 18.0软件进行ANOVA分析,以及相关性分析和配对t检验,检验处理间各指标的影响显著性、相关性和差异性.
3 结果(Results) 3.1 土壤和生物碳的性质如图 1所示,鸡粪生物碳表面具有很多结构性褶皱折叠纹理,使其具有较高的孔隙率和较大的比表面积.从生物碳的红外光谱(图 2)可以看出,鸡粪生物碳的化学结构复杂,官能团众多,既含有芳环结构基团(如芳胺等),也有脂肪族类化合物,说明其表面结构性质相对比较稳定.
 |
| 图 1 鸡粪生物碳的冷场扫描电镜图(a.1000倍,b.10000倍) Fig. 1 Scanning electron micrographs of manure biochar at 1000(a) and 10000(b)times of magnification |
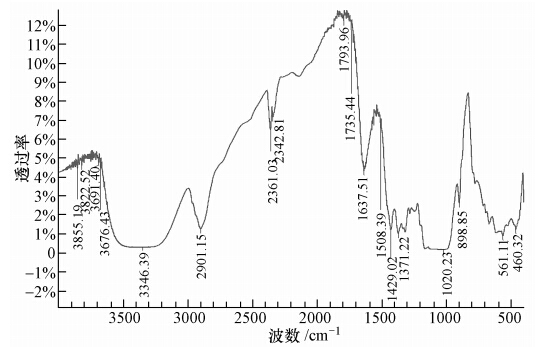 |
| 图 2 鸡粪生物碳的红外光谱图 Fig. 2 FTIR spectra of manure biochar |
鸡粪生物碳和水稻田土壤的一些理化指标如表 1所示.由表可知,华南地区的水稻土偏酸性,而鸡粪生物碳的pH值比水稻土高3.57,呈碱性;鸡粪生物碳的含碳量为11.74%,远高于水稻土的本底含量碳;生物碳的氮元素含量是水稻土的6.73倍,无机态氮中NO-3-N含量是水稻土的1.35倍,NH+4-N含量相对于水稻土而言基本可以忽略,表明生物碳中的N元素主要以有机态的形式存在;生物碳的硫酸根离子含量比水稻土中的含量高约50%;氢元素含量和C/N两者相差不大.
| 表 1 土壤和生物碳的基本理化性质 Table 1 Physical and chemical properties of the soil and biochar used in the experiments |
如图 3所示,所有处理条件下的土壤pH值在培养前14 d内下降趋势明显,而14 d后基本保持在某一稳定值.这可能是由于在培养初期,土壤微生物活性较大,分解有机质产生的酸及释放的CO2比较多,之后随着营养物质的逐渐消耗,微生物的活性受到影响并最终趋于稳定状态.对比各种处理条件下土壤pH值的变化可发现,添加生物碳与碳骨架的两种处理,在整个培养周期内的pH值变化情况基本保持一致,且都比空白土样高出1左右.而添加浸提液的处理对土壤pH值影响不大,仅在培养的最初阶段略高于空白土样.
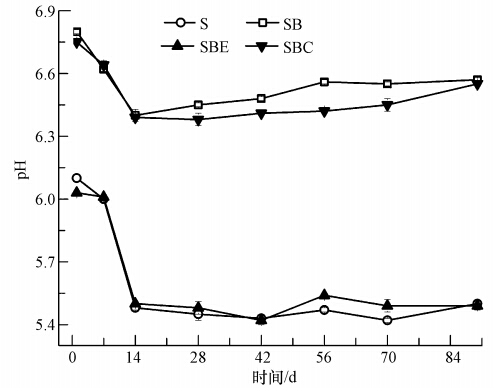 |
| 图 3 各处理不同培养时间下pH值的变化 Fig. 3 Soil pH values in the different treatments |
土壤有机质是土壤理化性质的一个重要指标,可影响微生物的硝化过程,尤其是反硝化作用,进而影响N2O的排放.不同培养阶段的土壤有机碳(SOC)含量结果如图 4所示,随着培养时间的推移,SOC的含量缓慢下降,在后期趋于平稳.在无外源营养物质输入的情况下,土壤中微生物的生命活动逐渐消耗土壤中有限的SOC,从而使SOC含量降低.4种添加处理的SOC含量基本呈现出“生物碳>碳骨架>浸提液≈空白对照”的规律(p<0.05).其中,添加生物碳处理的SOC含量仅略高于添加碳骨架的处理,但经这两种处理的土壤SOC都显著高于添加浸提液和作空白对照的土壤,并且添加浸提液的处理仅在刚开始培养时(前7 d)高于空白,在随后培养周期的采样测定中二者基本保持一致.
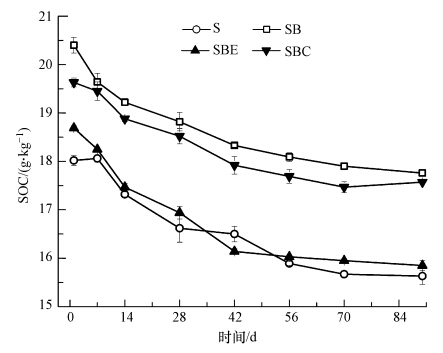 |
| 图 4 各处理土壤有机碳含量变化 Fig. 4 Soil organic carbon contents in the different treatments |
NO-3是硝化过程的产物也是反硝化过程的底物,检测各处理条件下的NO-3含量,可以了解土壤硝化和反硝化过程的变化.从图 5可看出,在整个培养周期内,各处理条件下的土壤NO-3含量均呈现出先增加后降低的趋势,且在培养的第7~14 d内,NO-3含量上升显著,这可能与底物中有机质含量降低,反硝化作用减弱,使硝化作用产生的NO-3未被完全利用而导致积累有关.对比分析3种不同的处理,在培养前期(1~28 d),添加生物碳与添加碳骨架处理的土壤NO-3含量都显著高于空白土壤(p<0.05),而添加浸提液的处理与空白相比无明显差异.
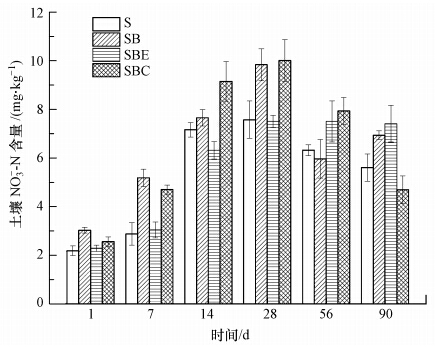 |
| 图 5 各处理土壤NO-3-N浓度的变化 Fig. 5 Soil nitrate concentration changes in the different treatments |
土壤N2O排放通量的变化如图 6所示,各添加处理条件下的N2O释放速率随着培养时间的推移均呈现明显下降的趋势,而且在培养的第7~14 d内下降速率最快,14 d后各处理间的N2O排放通量无明显差别.对比分析不同添加处理条件下N2O的排放情况可发现,添加生物碳与碳骨架的两个处理在培养前期(前7d)都显著抑制了N2O的排放,最高均可达80%,但在培养中后期(14 d后),两种处理对土壤N2O排放基本无影响.第1 d和第7 d的测定结果显示,添加浸提液的处理显著促进N2O的排放.
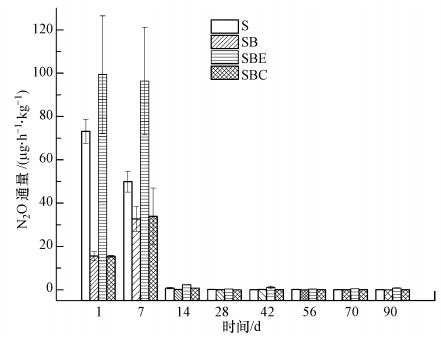 |
| 图 6 不同处理的N2O排放通量变化 Fig. 6 Nitrous oxide flux in different treatments |
根据土壤N2O的产生和排放机理,添加生物碳能够减少土壤N2O排放的原因是其抑制了土壤中的硝化作用或者反硝化作用.在本研究设定的土壤含水量状况下(70%WFPS),土壤中氧气的扩散受到限制,故反硝化作用是土壤N2O产生的主要途径(Dalal et al., 2003;Bateman et al., 2005),因此,生物碳的添加主要抑制了土壤的反硝化过程.
生物碳和碳骨架的添加在短期内可显著抑制土壤N2O的释放,且作用相当.因此,生物碳对土壤N2O的抑制作用主要归因于其物理结构(碳骨架)的作用.碳骨架性质稳定,可生化性差,但其独特的结构可改变土壤的理化性质,即提高土壤pH、SOC及吸附性等,从而影响土壤中微生物的活性及N2O的排放,具体分析如下.
土壤中营养物质的可利用性和微生物活性都会随着pH值的升高而增强(DeLuca et al., 2009),添加生物碳和碳骨架的处理均使土壤pH上升了1,使原来偏酸性的土壤更接近于中性,pH值升高时会显著促进N2O还原酶的活性,使反硝化作用产生的N2O大部分转化为N2释放(Taghizadeh-Toosi et al., 2011).这正如结果所示,土壤pH值的升高导致N2O排放通量的降低.
土壤反硝化是一个异养过程,土壤有机碳含量的多少及可利用性会显著影响反硝化活性(Hofstra et al., 2005).碳骨架处理的土壤有机碳含量仅略低于生物碳处理,说明生物碳的物理结构对土壤有机碳含量的提高起到了主要作用,这是由于生物碳本身是一种以有机碳为主要成分的富碳物质.不过,这些土壤有机碳不能有效地促进反硝化过程,这主要是因为生物碳中的有机质大部分以难被微生物降解的烃类物质存在,可在土壤中留存上百年(Lehmann et al., 2006);另外,碳骨架巨大的比表面积和表面氧化所增强的土壤阳离子交换能力,使土壤中更多的有机质被吸附(Cheng et al., 2006),降低了土壤本底有机碳被微生物利用的可能性.同时也吸附硝化和反硝化作用的底物(NH+4、NO-3)及产物(N2O)等(Clough et al., 2010;Steiner et al., 2010),从而抑制N2O的产生和排放.
与添加生物碳和碳骨架的两种处理相反,添加浸提液的处理在培养前期显著促进了N2O的排放,这主要是浸提液中的水溶性有机质促进了土壤微生物的活性,增强了反硝化作用(Dalal et al., 2003).虽然生物碳的可溶性化学成分显著促进了土壤N2O的排放,但生物碳整体却表现出抑制N2O排放的作用,且碳骨架抑制N2O的排放效果与生物碳整体相当.这说明碳骨架不仅可以吸附土壤中可能转化为N2O的物质,还可以有效地固持生物碳自身所含有的化学物质,使其不能释放到土壤中从而抑制N2O的释放.
随着土壤中有限的资源(SOC、NH+4及NO-3等)逐渐被消耗,土壤硝化和反硝化作用受到限制,因此,经过较长时间的培养(14 d后),各处理间的N2O排放通量无明显差别.
5 结论(Conclusions)本文通过“解剖”的方式,即将生物碳分离成碳骨架和浸提液的形式,探讨了生物碳对土壤N2O排放的影响机理.结果发现,直接将生物碳或者碳骨架施加到土壤中,在短期内显著抑制了N2O的排放,以浸提液的形式施加到土壤中,则在短期内显著促进了N2O的排放.生物碳对土壤N2O排放的抑制作用主要归因于生物碳的物理结构,其独特的结构可提高土壤pH,巨大的比表面积和阳离子交换能力不仅可以吸附土壤中营养物质、NH+4及NO-3等,还可以有效地固持生物碳中所含有的化学物质,阻碍其释放到土壤中,从而抑制N2O的排放.
| [1] | Asai H, Samson B K, Stephan H M, et al. 2009. Biochar amendment techniques for upland rice production in Northern Laos: 1. Soil physical properties, leaf SPAD and grain yield [J]. Field Crops Research, 111(1/2): 81-84 |
| [2] | Bateman E J, Baggs E M. 2005. Contributions of nitrification and denitrification to N2O emissions from soils at different water-filled pore space [J]. Biology and Fertility of Soils, 41(6): 379-388 |
| [3] | Cheng C H, Lehmann J, Thies J E, et al. 2006. Oxidation of black carbon by biotic and abiotic processes [J]. Organic Geochemistry, 37(11): 1477-1488 |
| [4] | 陈再明, 陈宝梁, 周丹丹. 2013. 水稻秸秆生物碳的结构特征及其对有机污染物的吸附性能 [J]. 环境科学学报, 33(1): 9-19 |
| [5] | Clough T J, Bertram J E, Ray J L, et al. 2010. Unweathered wood biochar impact on nitrous oxide emissions from a bovine-urine-amended pasture soil [J]. Soil Science Society of America Journal, 74(3): 852-860 |
| [6] | Dalal R C, Wang W, Robertson G P, et al. 2003. Nitrous oxide emission from Australian agricultural lands and mitigation options: a review [J]. Soil Research, 41(2): 165-195 |
| [7] | DeLuca T H, MacKenzie M D, Gundale M J. 2009. Biochar Effects on Soil Nutrient Transformation//Lehmann J, Joseph S. Biochar for Environmental Management: Science and Technology[M]. London, UK: Earthscan. 251-270 |
| [8] | Gaskin J W, Steiner C, Harris K, et al. 2008. Effect of low-temperature pyrolysis conditions on biochar for agricultural use [J]. Transactions of the ASABE, 51(6): 2061-2069 |
| [9] | 国家发展和改革委员会. 2004. 中华人民共和国气候变化初始国家信息通报 [M]. 北京: 中国计划出版社 |
| [10] | Hofstra N, Bouwman A F. 2005. Denitrification in agricultural soils: summarizing published data and estimating global annual rates [J]. Nutrient Cycling in Agroecosystems, 72(3): 267-278 |
| [11] | Hossain M K, Strezov V, Chan K Y, et al. 2011. Influence of pyrolysis temperature on production and nutrient properties of wastewater sludge biochar [J]. Journal of Environmental Management, 92(1): 223-228 |
| [12] | IPCC. 2007. Climate Change 2007: Mitigation of Climate Change: Contribution of Working Group III to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change [M]. Cambridge, United Kingdom: Cambridge University Press. 63-67 |
| [13] | Jones D L, Murphy D V, Khalid M, et al. 2011. Short-term biochar-induced increase in soil CO2 release is both biotically and abiotically mediated [J]. Soil Biology & Biochemistry, 43(8): 1723-1731 |
| [14] | Lehmann J, Gaunt J, Rondon M. 2006. Biochar sequestration in terrestrial ecosystems-a review [J]. Mitigation and Adaptation Strategies for Global Change, 11(2): 395-419 |
| [15] | Lehmann J. 2007. A handful of carbon [J]. Nature, 447(7141): 143-144 |
| [16] | Lehmann J, Joesph S. 2009. Biochar for Environmental Management: Science and Technology [M]. London: Earthscan Ltd |
| [17] | Marris E. 2006. Putting the carbon back: black is the new green [J]. Nature, 442(7103): 624-626 |
| [18] | Mullen C A, Boateng A A, Goldberg N M, et al. 2010. Bio-oil and bio-char production from corn cobs and stover by fast pyrolysis [J]. Biomass and Bioenergy, 34(1): 67-74 |
| [19] | Smith P, Martino P, Cai Z, et al. 2008. Greenhouse gas mitigation in agriculture [J]. Philosophical Transactions of the Royal Society of London (Series B: Biological Sciences), 363(1492): 789-813 |
| [20] | Spokas K A, Reicosky D C. 2009. Impacts of sixteen different biochars on soil greenhouse gas production [J]. Annals of Environmental Science, 3(1): 179-193 |
| [21] | Steiner C, Das K C, Melear N, et al. 2010. Reducing nitrogen loss during poultry litter composting using biochar [J]. Journal of Environmental Quality, 39(4): 1236-1242 |
| [22] | Taghizadeh-Toosi A, Clough T J, Condron L M, et al. 2011. Biochar incorporation into pasture soil suppresses in situ nitrous oxide emissions from ruminant urine patches [J]. Journal of Environmental Quality, 40(2): 468-476 |
| [23] | Wang Z Y, Zheng H, Luo Y, et al. 2013. Characterization and influence of biochars on nitrous oxide emission from agricultural soil [J]. Environmental Pollution, 174: 289-296 |
| [24] | Woolf D, Amonette J E, Street-Perrott F A, et al. 2010. Sustainable biochar to mitigate global climate change [J]. Nature Communications, 1(5), 1-9 |
| [25] | Zhang A F, Cui L Q, Pan G X, et al. 2010. Effect of biochar amendment on yield and methane and nitrous oxide emissions from a rice paddy from Tai Lake plain, China [J]. Agriculture, Ecosystems & Environment, 139(4): 469-475 |
 2014, Vol. 34
2014, Vol. 34


