研究发现,人工湿地基质中含有较多的铁、铝氧化物时,有利于生成溶解度很低的磷酸铁或磷酸铝,从而提高对磷的去除效率(袁东海等,2004),因此为了提高人工湿地磷去除效率,富含氧化铁的基质经常被选用,如废钢渣等(李晓东等,2007).但铁是比较活跃的变价元素,形态和价态易受环境条件变化,固体的铁可通过酸性解离、还原解离或络合解离而溶解,其中,Fe3+通常又很快形成氢氧化铁而沉积,迁移性较弱,而Fe2+迁移性则较强(贾国东和钟佐,1998);但在厌氧环境中,Fe3+可在微生物作用下被还原为Fe2+(Straub et al., 2001;曲东等,2003),增强迁移性.因此,pH和氧化还原条件的变化可能会导致湿地土壤中铁的溶出,间隙水中亚铁离子增加(唐罗忠等,2005;陈庆锋等,2011).
水平潜流人工湿地,特别是处理富含有机物污水的系统内,通常具有多样化的氧化还原环境,典型的如根系区域,由于根系泌氧通常处于氧化态,而远离根系区域,由于有机物降解通常处于厌氧状态(付融冰等,2008);因此使用富含铁基质的水平潜流人工湿地系统,在实际运行时,基质中的铁可能会由于理化环境条件影响,发生解离并以亚铁离子形式溶出,导致间隙水亚铁离子浓度变化,但目前还较少被关注,对其进行深入研究有助于进一步探讨实际运行的人工湿地系统中污染物的去除机制.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 植物的采集和种植本试验采用的湿地植物为香蒲属(Typha orientalis Presl.)阔叶香蒲种(Typha latifolia),采自华南农业大学校园湿地,扩大培养和移植方式参见文献(曹雪莹等,2012).
2.1.2 基质的采集与配置本试验采用的混合基质,主要成分为河砂和铁砂.河砂粒径范围:1~2 mm,呈中性,主要成分为SiO2,购自广州珠江边砂厂.铁砂是铁矿石废粉料,粒径范围:0.8~1.0 mm,呈碱性,主要成分为Fe2O3和氧化钙,购自广西铁矿.铁砂和河砂百分比分别为4% ∶ 96%(体积比),混匀后成为富含氧化铁混合基质,pH保持在7.5~8.0范围,略偏碱性.此外,混合基质中还添加1 kg富含各种湿地微生物的水稻土以提供微生物种源.
2.2 实验处理装置与运行条件 2.2.1 试验装置试验采用的人工湿地规模为:长×宽×高=2 m×1 m×0.5 m,基质充填高度为45 cm,两端15 cm填入碎石(粒径范围3~5 cm)分别作为布水集水区,中间部分填入混合基质,外部框架由PVC板焊接成.
2.2.2 污水组成与水力运行条件禽畜养殖废水是人工湿地处理的主要农业污水类型,也是较典型的富含有机物的污水,由于本实验场地位于大学校园内,且系统长时间连续运行,使用实际养殖废水较困难.而晒干的鸡粪富含有机物,质量较轻,购买运输较方便,经过加入自来水厌氧水解酸化后,污水成分与禽畜养殖废水相似,可生化性很好,因此,实验系统初始(2011年9月至2012年6月),采用的是干鸡粪水解酸化后配置的人工污水.2012年7月至12月,为了避免禽流感的潜在危害,污水改用化学药品配制(配方主要组成:淀粉,200 mg · L-1;NH4Cl,74 mg · L-1;Na2HPO4,21.9 mg · L-1;NaHCO3,10 mg · L-1),其主要水质指标与干鸡粪配水接近.污水储存于配水池中,每2天配制1次,由于露天放置,水中各污染物有不同程度降解,因此进入实验系统污水各水质指标随气温等波动,具体见表 1.
| 表 1 进入实验系统污水主要污染物指标范围 Table 1 Characteristics of the wastewater fed into the experimental wetland |
系统在2011年9月份开始移栽香蒲,同时通入配制污水,运行期间,2012年广州冬季1~2月份,因香蒲地上部分枯萎,间断通入污水维持湿地内部水位在出水口附近(无出水),其余时间,水力负荷为0.1 m3 · m-2 · d-1,水平潜流式运行,采用水泵将污水抽进系统布水区,在出水区距地面40 cm处设置出水口.其中,水泵进水管加装60目滤网,以过滤较大的颗粒物.
2.3 样品采集与监测本研究样品取样监测在2012年3月份(香蒲新的幼苗开始萌发)开始直到2012年12月份.分析检测指标如下:
(1)进出水:每7 d采集进水、出水样品,测定TP、TN、NH+4-N、COD.
(2)选取湿地前、中、后,上、中、下共9个位点的间隙水进行监测分析,前、中、后分别距进水端25 cm、100 cm、175 cm,上层取样位点设在基质表面下10cm处,中层设在基质表面下25 cm处,下层设在基质表面下40 cm处(位点分布如图 1).每月15日对湿地内部9个位点的间隙水利用便携式氧化还原电位仪和pH计(上海雷磁)进行在线监测,测定后取水样,分析其中亚铁浓度.
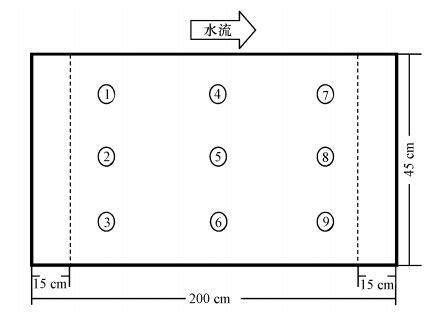 |
| 图 1 系统略图及取样点图 Fig. 1 Longitudinal section of the wetland and distribution of sampling site |
在线监测和取样利用自制的前部穿孔的管状取样器(图 2)进行,每个位点在线监测时,先将取样器底部插入相应位置,该位点间隙水逐渐通过底部透水孔渗入,待取样管水位稳定后,将测定仪探头深入取样器底部,每次测定时,由于取样器和测定仪对监测位点的扰动,pH和ORP受到影响,在线监测仪探头伸入初始读数通常不稳定,需30~60 min才能达到稳定,但可以保持较长时间(>1 h),因此稳定后数据基本可以较准确的反映位点的pH和ORP,为节省时间和避免频繁干扰,每次测定未将探头取出进行重复测定,每个位点pH和ORP均是在稳定20 min后只读取1个稳定数据,在线测定后每个位点通过取样针抽取3个重复水样.
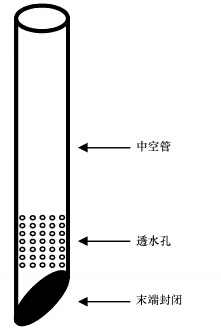 |
| 图 2 自制水样采集器图 Fig. 2 Man-made device for water sample collection |
采回来的水样,马上进行监测,各指标分析方法参考《水质分析方法国家标准汇编》(1996).
3 研究结果(Results) 3.1 实验系统污水处理效果实验期间,系统对污水COD和TP的去除率较高,分别达到62.60%和80.00%;氨氮、总氮平均去除率比较低,分别为13.25%和43.45%;水平潜流人工湿地中,有机物既可被好氧降解也可被厌氧降解,因此对于有机物含量较高的污水,如禽畜养殖废水,COD的去除率也能达到较高的水平,而新运行的人工湿地,基质的磷吸附功能未被消耗,因此磷去除率通常很高(Vymazal,2009);而湿地内部可能由于氧供应不足,氨氮氧化率较低,特别是有机物含量高时更易受影响,进而影响总氮的去除.
3.2 间隙水亚铁离子的变化特征图 3显示湿地系统内部各位点间隙水的亚铁浓度.间隙水亚铁浓度范围为8.23~462.86 mg · L-1,远高于进水浓度,因此亚铁离子应该是产生于系统内部.从监测数据来看,系统不同部位和时间亚铁离子浓度差异均较大.深度上,中下部位点亚铁离子浓度较高,显著高于上部位点;而污水沿程来看,处于底部的前部位点3和后部位点9的亚铁离子浓度则普遍高于处于中部的7位点,特别是在春季和秋季.从季节来看,气温较高的6—9月普遍低于其他季节,其中7月各位点平均浓度最低,可能是由于7月植物生长旺盛,根氧化力强(袁大刚等,2012),亚铁离子极易被水中的溶解氧氧化沉积,湿地上层位点由于植物根系泌氧作用,导致水中溶氧比较高,使得亚铁离子被氧化而浓度降低,而在温度较高的季节,植物生长旺盛,根系泌氧量较高,导致系统内部氧化性区域较大,从而使得亚铁离子的浓度相对较低.
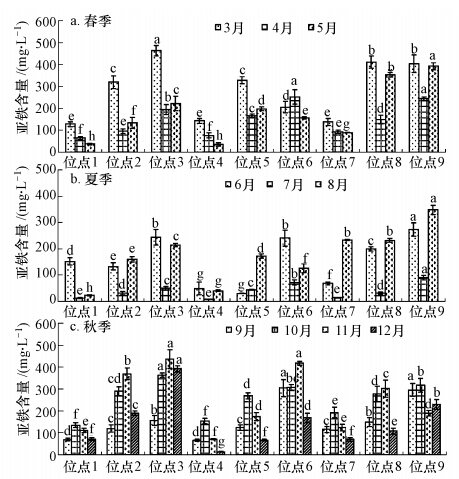 |
| 图 3 人工湿地内部各位点水样在不同运行时间的亚铁浓度(注:图中表示同一运行时期在不同区域的显著性比较(n=3),其中同系列柱形图上具有相同字母的表示差异不显著(DMRT法,p=0.05).) Fig. 3 Fe2+ concentration of pore water in different months and areas of the wetland |
这些结果表明,研究系统内部间隙水大量亚铁离子产生于系统内部,浓度分布与空间位置及季节温度有关.
3.3 湿地内部环境条件变化特征 3.3.1 不同位点间隙水氧化还原电位变化特征如图 4所示,人工湿地内部各位点处的ORP在-236~40 mV之间,虽然变化范围较大,但几乎所有位点均为负值,这表明整个湿地内部大部分区域处于厌氧状态.应该是污水中较高含量有机物厌氧降解所致.但不同位点间变化范围较大,上层要高于中下部,3月份1号、2号、3号3个位点ORP从-210 mV逐渐降低到-222 mV,同样位于湿地中部4号~6号位点,和后部的7号~9号位点也分别呈现递减趋势;污水沿程方向来看,3月份,同属上层的1号、4号、7号位点从-210逐渐升高到-94 mV,中层和底层位点也均随沿程呈现递增趋势,湿地后部升高幅度较大.其他月份各位点也基本有相同的特点:在沿程方向上逐渐升高,水深方向呈现降低趋势,这与亚铁离子浓度变化相反.同一位点,不同季节间ORP出现波动较大,气温较高的夏季更高,也与亚铁离子浓度变化相反.
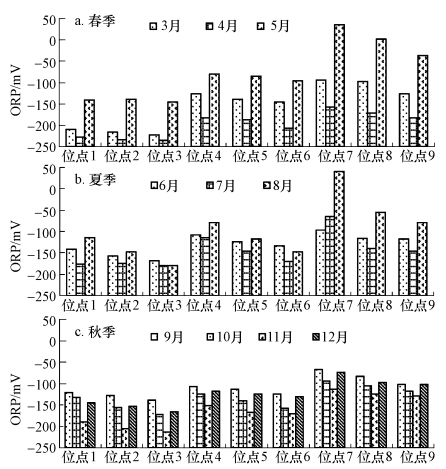 |
| 图 4 人工湿地内部各位点在不同运行时间的ORP对比 Fig. 4 ORP of pore water in different months and areas of the wetland |
不同位点和时间系统内部间隙水ORP变化,主要是受污水有机物降解和根系泌氧及大气富氧影响.人工湿地内部主要由植物根系泌氧提供水中溶氧,提供的溶氧量比较低,特别是根系分布不充分的中下部,污水有机物大量降解,使得溶氧快速消耗,从而呈现厌氧状态,导致间隙水ORP较低,上部由于植物根系分布较发达,氧供应较高(付融冰等,2008),因此有机物降解引起的ORP下降较低.而植物生长受气温影响,气温较高的夏季,生长旺盛,根系泌氧量较高,有机物厌氧降解程度相对较低,进而ORP下降较低.污水沿程方向上,ORP逐渐升高应该与污水有机物浓度下降有关.
对比ORP和亚铁离子随深度和季节变化,表明两者具有相反趋势,即氧化还原电位低的条件下,亚铁离子浓度较高,这表明亚铁离子的产生及浓度受ORP影响,ORP较低的中下部很可能是系统内部亚铁离子产生的主要部位.
3.3.2 不同位点间隙水pH变化特征由图 5可知,研究人工湿地系统内部各位点的pH在6.44~7.97之间,变化范围不大,且基本在中性范围内.具体来看,各位点之间仍略有不同,在水深方向上,从前部1号到3号、中部4号到6号位点、后部7号到9号位点都呈现随深度递增趋势;污水沿程方向来看,同属上层的1号、4号、7号位点pH从7.31逐渐降低到7.05,中层和下层位点,也均随着沿程有递减趋势.这与植物生长、基质特性及微生物对污染物代谢有关,系统充填的混合基质本身pH略偏碱性(可达8),上部植物根系大量生长及呼吸代谢作用会向水中释放CO2,氨氮的硝化(刘树元等,2010)及亚铁离子的氧化都会产生H+,从而使污水pH降低,因此上部位点pH偏低,而下部位点植物根系未能达到,并且有机物厌氧反应生成OH-,加之偏碱性基质,因此间隙水pH会较高;不同时间,各位点pH值也有变化,其中在春季3、4、5月份波动较大,其他季节变化相对平稳,可能由于广州春季气温变化较大,进而影响植物与微生物的代谢反应,相应间隙水pH受影响.
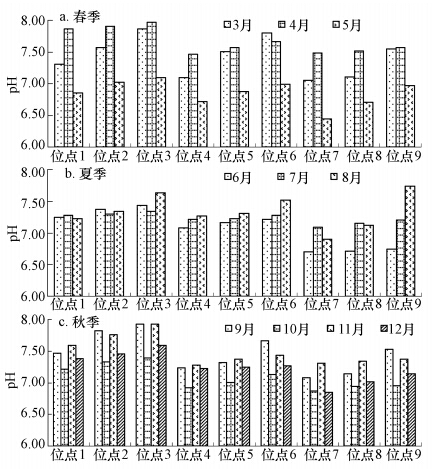 |
| 图 5 人工湿地内部各位点在不同运行时间的pH值 Fig. 5 pH of pore water in different months and areas of the wetland |
总体来看,湿地系统内呈现的厌氧条件和大量产生的亚铁离子并未对间隙水pH产生较大影响,在各种生物及化学反应的影响下,整个系统仍维持在中性范围.
4 讨论(Discussion) 4.1 亚铁离子溶出原因及影响因素分析研究结果来看,湿地内部间隙水中较高浓度亚铁是由内部产生的,应该来自于基质中铁的溶出.从pH监测结果表明,系统内部pH基本在6.5以上,这个pH范围并不利于氧化铁酸解离(张锡辉,1999;贾国东和钟佐,1998),因此亚铁离子应该是更多来源于其他方式的解离.除了酸解离外,氧化铁特别是三价铁可络合解离,即有机化合物分子上的羟基和羧基与铁能形成表面络合物,从而将固态的三价铁转化为溶解性的铁(Winkelmann et al., 1987;姜明等,2006);而溶解态三价铁离子则极易在铁异化还原菌作用下被小分子有机酸还原,同时有机酸被降解(黎慧娟和彭静静,2012;迟光宇等,2007); 此外,腐殖酸等物质也可以作为电子穿梭载体,在pH中性条件下,促进固态三价铁氧化物被微生物异化还原(Chen et al., 2003).本研究系统污水中含有大量的易生物降解有机物,在厌氧条件下极易水解为小分子有机酸,ORP监测结果表明,研究系统内部,特别是中下层ORP在-100 mV以下,表明这些位点处于严格的厌氧状态;而铁异化还原菌往往普遍存在于水稻田等淹水厌氧环境中(曲东等,2003),系统构建时添加水稻土,为系统中铁异化还原菌提供了来源,而随着脱落植物根系组织、死亡微生物细胞等厌氧分解,腐殖酸也会在系统逐渐生成.因此,实验研究系统中下层厌氧区域完全具备固态三价铁被还原溶出的条件,间隙水中大量出现的亚铁离子很可能是由于基质中氧化铁被还原并溶出的产物.
以上分析也表明,人工湿地基质中固态氧化铁转变化亚铁离子溶出,厌氧和小分子有机物是2个重要的引发条件.与氧和硝酸盐氮比,三价铁的氧化还原电位较低(王维奇等,2009),需要较强的厌氧还原条件下才能被还原,唐罗忠等(2005)对森林湿地研究表明,ORP在-100 mV以下,土壤中亚铁离子开始大量出现,从本研究结果来看,系统中下层ORP处于-50 mV 到 -150 mV之间,可见,在人工湿地中,ORP在 -100 mV左右是一个能引发基质中大量三价铁的还原溶出的厌氧条件.厌氧状态主要是由于污水中所携带的大量有机物生物降解导致的,有机物厌氧水解形成的小分子有机酸,则是三价铁异化还原最易利用的底物(曲东等,2003),而生活污水、禽畜养殖污水等都富含易水解酸化有机物,因此,对这些污水处理的人工湿地使用富含氧化铁基质时,间隙水中会出现较高浓度的亚铁离子.此外,pH对土壤微生物铁异化还原过程影响会随土壤组成而不同,对酸性红壤为主的水稻土的研究(徐丽娜等,2009)表明,pH低于6以下不影响还原过程,而唐罗忠等(2005)研究发现对于南京附近森林湿地土壤,pH在6.5以下,亚铁离子基本没有溶出.本研究系统采用基质偏碱性,但由于污水、植物、微生物作用,整个系统pH基本保持在中性范围,因此基质碱性并没有影响亚铁离子溶出.
4.2 亚铁离子溶出对主要污染物去除的影响亚铁离子在中性条件下能够快速被水中的氧氧化(贾国东和钟佐,1998),这可能是上层亚铁离子含量低的原因;但另一方面,亚铁的化学氧化也会和NH+4-N氧化竞争水中的氧,NH+4-N是生物催化氧化,速率较慢,很难和亚铁化学氧化竞争,因此,氨氮的硝化会受到影响,进而影响后续反硝化过程,这也可能是系统中氨氮、总氮去除率较低的原因之一.
潜流湿地系统下部,氧被消耗后,有机物可被其他氧化性物质降解.通常湿地土壤环境中,除了氧外,还有硝酸盐氮、三价铁和四价锰,都可以作为有机物氧化的电子受体,这些电子受体被消耗后,则是产甲烷的有机物厌氧降解发生(王维奇等,2009).本研究,间隙水中大量亚铁应该来自于络合解离的三价铁还原,与此伴随的是有机物的氧化降解,因此,三价铁被还原所消耗有机物可能是本研究中污水有机物厌氧降解的一个最重要途径.另一方面,在人工湿地内,有机物若被厌氧降解为甲烷,由于系统的开放性,甲烷无法被有效收集利用,排放到大气则具有严重的温室效应,因此从整体环境效益角度看,应该禁止该过程在人工湿地内发生.研究表明,有三价铁存在,铁异化还原菌与产甲烷菌竞争电子供体,从而有效抑制产甲烷过程发生(姜明等,2006),因此使用含铁基质的人工湿地系统,铁离子还原溶出既有助于有机物的厌氧降解又有利于抑制甲烷的排放,具有双重的环境效应.
但基质中的固体铁氧化物对污水中磷具有吸附沉积作用,其溶出可能会降低基质颗粒磷吸附功能.尽管溶出亚铁离子也可和无机磷酸根离子发生化学沉淀反应而除磷(侯艳玲,2010),但其发生反应的最佳pH约在8左右(张萌等,2012),本系统中间隙水pH范围在6.50~7.97之间,大部分位点不在最优范围,因此溶出亚铁离子除磷效率可能不高,同时由于潜流人工湿地系统内部间隙水是处于流动状态,处于系统后端位置溶出的亚铁离子可能来不及和磷反应就随出水流出系统,在本研究中,系统出水孔处呈现明显的棕红色,可能是由于出水携带大量亚铁离子被氧化所致,因此,亚铁离子的流失也在一定程度上,降低了系统磷去除潜力.
综上所述,使用含铁基质人工湿地系统处理富含有机物污水时,亚铁离子溶出可能会对氨氮、有机物和磷的去除都产生一定的影响,如何进行优化调控还需深入研究.
5 结论(Conclusions)1)人工湿地内部供氧不足,使得其处理富含有机物污水时,系统内部各位点氧化还原电位下降,本研究系统运行期间ORP范围在-236~40 mV之间,多数位点ORP均为负值,表明整个湿地内部大部分区域处于厌氧状态.不同位点间变化范围较大,总体来看,在沿程方向是逐渐升高的,沿水深方向逐渐降低,气温较高夏季整体较高.
2)湿地系统基质中的氧化铁,伴随污水有机物大量厌氧降解,可大量溶出并被还原为亚铁离子进入间隙水,本研究系统运行中,间隙水亚铁离子浓度范围为8.23~462.86 mg · L-1结合pH和ORP的分布特征可以得知,间隙水中亚铁离子应是基质中铁氧化物特别是三价铁氧物络合和还原解离共同产物.
3)有机物降解导致厌氧环境条件出现,是亚铁离子大量生成的重要条件,其浓度变化受到ORP变化影响,具有与ORP变化趋势相反的特点,即ORP高的条件下,亚铁离子浓度则较低.
4)人工湿地内部大面积厌氧区域和大量亚铁离子产生,并没有较大改变间隙水pH,研究系统pH变化范围在6.44~7.97之间,基本维持在中性范围内,但不同位点间有一定变化.
| [1] | 曹雪莹, 种云霄, 余光伟, 等.2012. 人工湿地不同区域基质磷含量的差异分析[J]. 环境科学学报, 33(11): 4033-4039 |
| [2] | Chen J, Gua B H, Royer R A, et al. 2003. The roles of natural organic matter in chemical and microbial reduction of ferric iron [J]. The Science of the Total Environment, 307(1/3): 167-178 |
| [3] | 陈庆锋, 单保庆, 马君健, 等. 2011. 暴雨型湿地孔隙水中铁锰的时空变化特征[J]. 环境科学, 32(5): 1340-1345 |
| [4] | 迟光宇, 张兆伟, 陈欣, 等. 2007. 土壤Fe(Ⅲ)异化还原机理及影响因素研究进展[J]. 生态学杂志, 26(12): 2075-2080 |
| [5] | 付融冰, 朱宜平, 杨海真, 等. 2008. 连续流湿地中DO、ORP状况及与植物根系分布的关系[J]. 环境科学学报, 28(10): 2036-2041 |
| [6] | 侯艳玲. 2010. 城市污水处理厂化学除磷工艺优化运行与控制系统研究[D]. 北京: 清华大学 |
| [7] | 贾国东, 钟佐. 1998. 铁的环境地球化学综述[J]. 环境科学进展, 7(5): 74-84 |
| [8] | 姜明, 吕宪国, 杨青. 2006. 湿地铁的生物地球化学循环及其环境效应[J]. 土壤学报, 43(3): 493-499 |
| [9] | 黎慧娟, 彭静静. 2012. 异化Fe(Ⅲ)还原微生物研究进展[J]. 生态学报, 32(5): 1633-1642 |
| [10] | 李晓东, 孙铁珩, 李海波, 等. 2007. 人工湿地除磷研究进展[J]. 生态学报, 27(3): 1226-1232 |
| [11] | 刘树元, 阎百兴, 王莉霞. 2010. 人工湿地中氨氮反应与pH 变化关系的研究[J]. 水土保持学报, 24(3): 243-246 |
| [12] | 曲东, 张一平, Schnell S, 等. 2003. 水稻土中铁氧化物的厌氧还原及其对微生物过程的影响[J]. 土壤学报, 33(6): 858-863 |
| [13] | 邵兴华, 章永松, 林咸永, 等. 2006. 三种铁氧化物的磷吸附解吸特性以及与磷吸附饱和度的关系[J]. 植物营养与肥料学报, 12(2): 208-212 |
| [14] | Straub K L, Benz M, Schink B. 2001. Iron metabolism in anoxic environments at near neutral pH[J]. FEMC Microbiology Ecology, 34(3): 181-186 |
| [15] | 苏玲, 林咸永, 章永松, 等. 2001. 水稻土淹水过程中不同土层铁形态的变化及对磷吸附解吸特性的影响[J]. 浙江大学学报(农业与生命科学版), 27(2): 124-128 |
| [16] | 唐罗忠, 生原喜久雄, 户田浩人. 2005. 湿地林土壤的Fe2+, Eh及pH值的变化[J]. 生态学报, 25(1): 103-107 |
| [17] | Vymazal J. 2009. The use constructed wetlands with horizontal sub-surface flow for various types of wastewater [J]. Ecological Engineering, 35(1): 1-17 |
| [18] | 王维奇, 曾从盛, 仝川. 2009. 控制湿地甲烷产生的主要电子受体研究进展[J]. 地理科学, 29(2): 300-306 |
| [19] | Weber K A, Achenbach L A, Coates J D. 2006. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction[J]. Nature Reviews Microbiology, 4(10): 752-764 |
| [20] | Winkelmann G, van der Helm D, Neilands J B. 1987. Iron Transport in Microbes, Plants and Animals[M]. Germany: VCH Publishers |
| [21] | 徐丽娜, 李忠佩, 车玉萍. 2009. 淹水厌氧条件下腐殖酸对红壤中铁异化还原过程的影响[J]. 环境科学, 30(1): 221-226 |
| [22] | 袁大刚, 谭海燕, 程伟丽, 等. 2012. 川西漂洗水稻土亚铁时空分布对土地利用/覆被变化的响应[J]. 水体保持学报, 26(1): 128-135 |
| [23] | 袁东海, 景丽洁, 张孟群, 等. 2004. 几种人工湿地基质净化磷素的机理[J]. 中国环境科学, 24(5): 614-617 |
| [24] | 张萌, 邱琳, 于晓晴, 等. 2012. 亚铁盐除磷工艺的优化研究[J]. 中国环境科学, 32(7): 1223-1227 |
| [25] | 张锡辉. 1999. 铁在饮用水水源中的循环转化[J]. 给水排水, 25(11): 18-22 |
 2014, Vol. 34
2014, Vol. 34


 , 余光伟, 梁羽乔, 李俊
, 余光伟, 梁羽乔, 李俊