微藻作为一种最具有潜力的新型可再生生物质能源,具有光合效率高、零净碳值、易培养、生长周期短、油脂含量高、环境适应性强等优点(Chisti,2007;Rittmann,2008; 毛书端等,2012).目前微藻的培养方式大多采用悬浮态培养,但这种培养方式所获得的微藻生物量产率较低,采收时脱水能耗高,限制了微藻生物能源技术的大规模应用(Stephens et al., 2010). 因此,可有效提高生物反应器单位体积生物量的细胞固定化技术被广泛关注. 微藻的生物膜固定化培养模式具有操作稳定性高、生物量密度大、采收方便节能等优点,且能与废水处理相耦合,相比悬浮态微藻培养具有更大优势(黄国兰等,2000; Johnson et al., 2010; Christenson et al., 2011; Ozkan et al., 2012; Liu et al., 2013). Johnson等(2010)对Chlorella sp.静态沉降于聚苯乙烯泡沫材料表面并在光照条件下利用有机废水进行生长的状况进行了研究,发现微藻可在载体表面形成生物膜,且将生物膜直接刮下即可收获藻产品. Liu等(2013)也成功将微藻细胞固定于滤膜表面,并研究了光照强度对微藻吸附培养的影响. Ozkan等(2012)设计了一种新型微藻生物膜光生物反应器,利用静态沉降的方式成功将Botryococcus braunii吸附于混凝土板上,其研究结果表明,相较于开放池式培养,该培养方式每培养1 kg藻生物量可减少45%的水消耗和99.7%的藻生物质脱水能耗.
生物膜形成时,首先要求悬浮的细胞通过对流、扩散、重力作用和布朗运动等方式运动到载体表面附近,然后通过细胞在固体基质表面的吸附和分裂、增殖,才能最终形成成熟的生物膜(Walker et al., 2007). 因此,在藻细胞的生物膜固定化培养过程中,强化细胞吸附对于保证生物膜的高效形成和生长具有重要的意义. 研究人员以细菌为对象在相关领域已开展了部分研究工作.例如,Medilanski等(2002)研究了表面粗糙度对细菌吸附的影响,结果表明,较大的载体表面粗糙度能够促进微生物吸附. Katsikogianni等(2010)研究发现,培养液流速明显影响了细菌细胞的吸附速率和吸附密度. 但目前关于藻细胞在固体基质表面的吸附及生物膜固定化培养方面的相关研究工作较少(Sekar et al., 2004; Irving et al., 2011; Ozkan et al., 2011),针对藻细胞在固体基质表面的强化吸附等研究还未见相关文献报道.
基于此,本文在平板式光生物反应器内以普通小球藻为对象,系统研究载体表面粗糙度、藻细胞接种量、培养液pH值和液体流量对小球藻细胞在固体基质表面吸附特性的影响,分析藻细胞在固体基质表面吸附的强化措施,以期为微藻固定化培养技术的发展和应用提供实验指导.
2 材料和方法(Materials and methods) 2.1 藻种预培养普通小球藻(Chlorella vulgaris,FACHB-31)购自中国科学院水生生物研究所淡水藻种库. 藻种在无菌操作下转接入经高压灭菌(121 ℃、20 min)冷却后的SE(Brostol′s solution)培养基中,以Na2CO3作为碳源,在SGZ-310B型光照培养箱中进行培养.培养条件为培养温度(26±2)℃,光照强度3000 lx,每天定时摇瓶3次,培养过程中严格防止杂菌的污染. 所使用培养基的成分为(g · L-1):NaNO3 0.25,K2HPO4 0.075,MgSO4·7H2O 0.098,CaCl2·2H2O 0.025,KH2PO4 0.175,NaCl 0.025,FeCl3·6H2O 0.05,Na2CO3 0.2,另外,EDTA-Fe 1.0 mL · L-1,A5 solution 1.0 mL · L-1,土壤提取液 40 mL · L-1.
2.2 反应器及实验系统平板式光生物反应器结构示意图如图 1所示.为了便于在线观测,反应器(143 mm×52 mm×9 mm,长×宽×高)均采用PMMA有机玻璃制作.小球藻细胞吸附的基底载体为载玻片,实验中将其嵌入反应器内的凹槽(76 mm×26 mm,长×宽)中,并使载玻片上表面与反应器流道表面平行. 反应器上方设置盖板,盖板两端分别开有Φ 6 mm的通孔作为液相进出口,反应器内液体流道容积为3.016 mL,尺寸为116 mm×26 mm×1 mm(长×宽×高). 将反应器接入 如图 2所示的实验装置系统,储液瓶中的藻液先经蠕动泵驱动流入缓冲器,再经流量控制阀后注入反应器中,从反应器流出的液体再回到储液瓶中完成循环. 缓冲器设置液体溢流回路,以保证缓冲器中液面高度恒定. 实验前,流量控制阀需进行流量标定. 整个实验过程中,显微镜光源光照强度约为100 μmol · m-2 · s-1,环境温度与恒温水浴温度均控制在26 ℃.
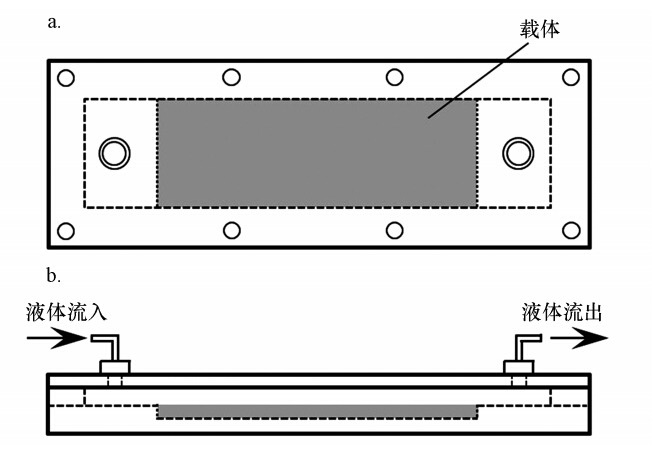 |
| 图 1 平板式光生物反应器结构示意图(a. 俯视图;b.正视图) Fig. 1 Sketch of flat plate photo-bioreactor |
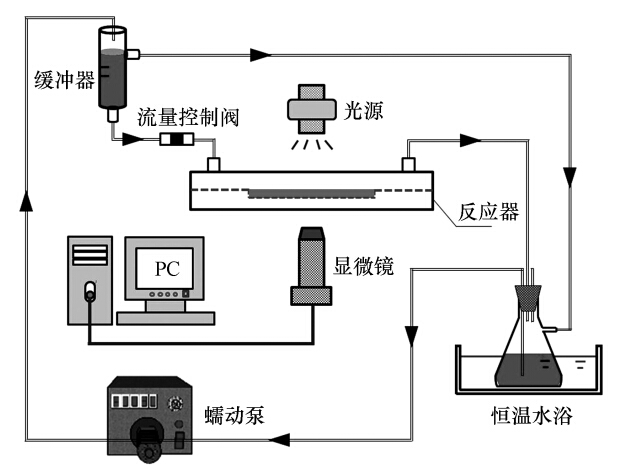 |
| 图 2 实验装置系统图 Fig. 2 Schematic diagram of the testing system |
实验前,将5块载玻片浸入浓NaOH溶液中水浴加热一段时间,取出后分别用不同型号的砂纸对载玻片表面进行打磨,得到具有不同表面粗糙度的载玻片.分别在各载玻片表面中心附近均匀选取5个点进行标记,作为实验测试和显微镜观察点,同时利用Dektak 150型表面轮廓仪测试各载玻片的表面粗糙度. 将打磨后的载玻片及未打磨的光滑载玻片分别固定于反应器凹槽中,连接好实验系统. 每次实验启动前,反应器和所有连接装置均用福尔马林消毒,并用经高压灭菌后的蒸馏水清洗干净. 完成消毒后,接种藻细胞,用于接种的普通小球藻处于对数期. 调节蠕动泵和流量控制阀使反应器进口处藻液液体流量达到设定值. 以下实验中,若无特殊说明,接种藻细胞浓度为5×106cells · mL-1,液体流量为2.60 mL · min-1,培养基pH值为7. 通过显微镜对载玻片上各标记点处吸附的藻细胞进行在线拍照记录,获得藻细胞吸附速率和细胞吸附密度最大的载体,并作为后续实验的载体材料,且后续实验也严格按照上述操作步骤进行操作.
2.4 分析方法及仪器设备实验中显微镜所观察到的图像信息通过计算机软件Image-Pro Insight进行采集,其中,显微镜放大倍数为20倍,利用图像数据处理软件Image-Pro Plus进行细胞计数,计算出同一时刻5个标记点吸附藻细胞数量的平均值作为该时刻载玻片表面单位面积的藻细胞吸附数量(cells · mm-2). 吸附速率定义为单位时间内藻细胞在载体表面附着的数量,表示藻细胞在载体表面附着的快慢程度.
实验过程中,采用GL-21M型冷冻离心机进行藻细胞离心提取;液体pH值采用SevenEasy S20型pH计进行测量;液体流动驱动采用BT100-1L型蠕动泵;用倒置荧光显微镜(IX81,OLYMPUS,日本)进行观察并利用与显微镜配套的CCD(Retiga-4000DC,Q-IMAGING公司,美国)拍照;光源光照强度采用FZ-A型辐照计测量.
3 结果与分析(Results and analysis) 3.1 载体表面粗糙度对小球藻细胞吸附的影响载体表面粗糙度是影响微生物是否能够在其表面快速吸附并且实现后期生长及成膜的关键因素之一(方芳等,2005). 实验主要测试了5种不同粗糙度的载体表面(表 1)对藻细胞吸附特性的影响.
| 表1 不同载玻片的平均表面粗糙度 Table 1 Average surface roughness of glass slides polished by different s and papers |
载体表面粗糙度(Ra)对普通小球藻吸附的影响如图 4所示.由图可知,各载玻片表面藻细胞吸附密度随时间进行逐渐增大,然后逐渐趋于稳定. 这是由于随着藻液流入反应器中,藻细胞通过对流、扩散、重力作用和布朗运动等方式连续不断地传递并吸附到载体表面,并不断积累所导致(Walker et al., 2007). 在相同运行时间内,随着载体表面粗糙度增大,藻细胞的吸附速率加快,吸附密度也增大. 在实验进行2 h时,5个样品载玻片表面和光滑载玻片表面的藻细胞吸附密度平均值依次分别约为2720、2280、2130、2019、1898、1269 cells · mm-2,1#载玻片表面藻细胞吸附密度是光滑载玻片表面的2.14倍. 这是因为粗糙表面从形貌上具有孔洞、裂缝等(图 3),不仅可以为微藻提供更大的附着面积,还可以对附着其中的微藻起到保护屏蔽的作用,减少外界水力剪切对微藻的冲刷,为微藻提供相对静止的流体动力环境(Carlen et al., 2001; 方芳等,2005; Cao et al., 2009). 因此,粗糙度Ra为1.200 μm的载玻片表面吸附的藻细胞密度最大.后续实验所用载玻片均采用粗糙度Ra为1.200 μm的1#载玻片.
 |
| 图 3 粗糙度Ra=1.200 μm的载玻片表面吸附小球藻细胞前后的ESEM图比较(a. 吸附前,b.吸附后) Fig. 3 Comparisons of ESEM images of glass slide surface with surface roughness Ra=1.200 μm between pro- and post-adhesion of Chlorella vulgaris |
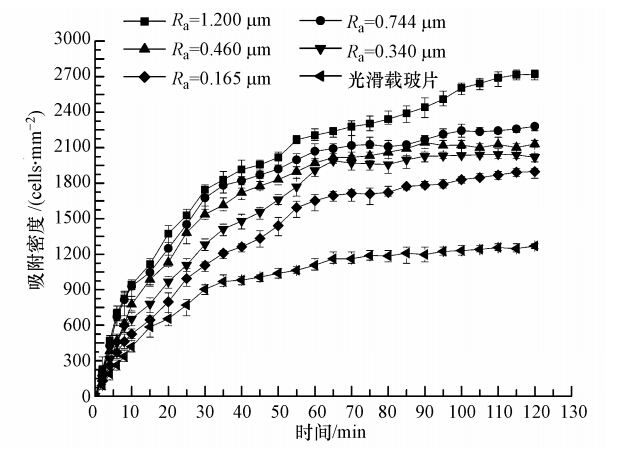 |
| 图 4 载体表面粗糙度对普通小球藻细胞吸附的影响 Fig. 4 Effect of surface roughness on adhesion of Chlorella vulgaris |
接种量对小球藻细胞吸附性能的影响如图 5所示,其中,接种量分别为5×105、5×106、5×107 cells · mL-1. 从图中可以看出,在接种后10 min内,基质表面藻细胞吸附密度随时间的变化最快,随着接种时间的进行,载体表面藻细胞的吸附密度趋于相对平缓的趋势. 这表明接种初期普通小球藻细胞在载体表面的吸附速率在整个实验进程中表现为最快,后期吸附密度的平缓增加则是由于藻细胞存在的生长周期所致. 值得指出的是,藻细胞接种量对其初期吸附速率产生极大的影响. 藻细胞接种量的增大极大地提高了其在载体表面的初期吸附速率,接种量为5×107 cells · mL-1时的初期吸附速率相比其他两种条件分别提高4.83倍和1.44倍. 这是因为随着藻细胞接种量的增大,单位时间内流入反应器的藻细胞数量增多,在其它条件保持一致的情况下,藻细胞在载体表面的吸附效果得到加强(Sekar et al., 2004). 但藻细胞后期吸附速率的增幅相对较小,并且由于存在着膜厚度的临界值,接种10 min后的载体表面吸附密度逐渐趋于平缓. 藻细胞接种量的增大最终导致总体吸附密度显著增加. 接种后60 min,藻细胞接种量为5×105、5×106、5×107 cells · mL-1时,载玻片表面所吸附的藻细胞数量平均值分别为701、2205、3244 cells · mm-2.
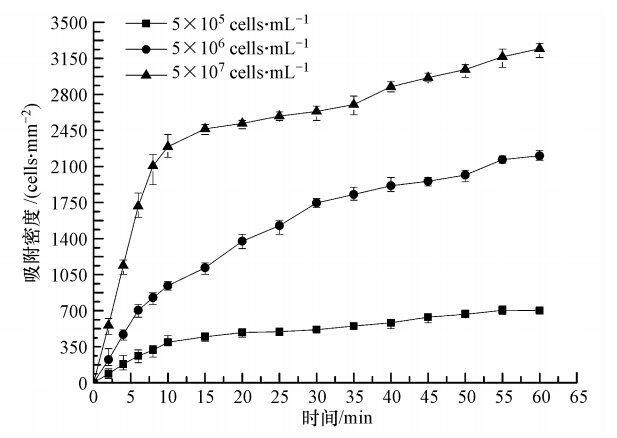 |
| 图 5 接种量对普通小球藻细胞吸附的影响 Fig. 5 Effect of inoculation amount on adhesion of Chlorella vulgaris |
培养液pH值大小对微藻的吸附和生长都有着重要影响,而pH值在6~9范围内最适合微藻生长(Sekar et al., 2004). 本实验利用0.1 mol · L-1 NaOH溶液和0.1 mol · L-1 HCl溶液调节培养液的pH值,研究了不同培养液pH值(pH=3~10)对普通小球藻在载体表面吸附特性的影响,实验结果如图 6所示.
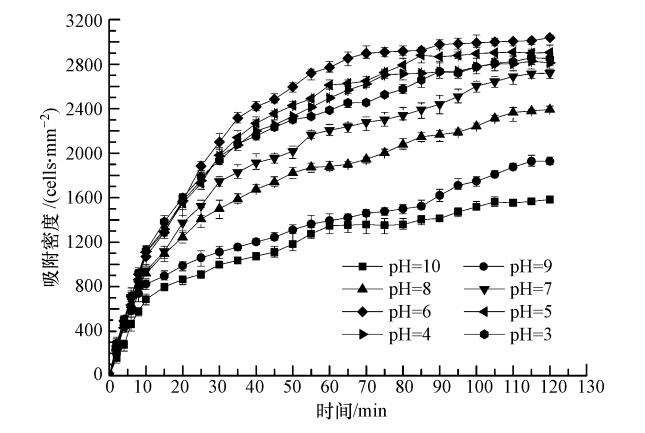 |
| 图 6 培养液pH值对普通小球藻细胞吸附的影响 Fig. 6 Effect of medium pH value on adhesion of Chlorella vulgaris |
从图中可以看出,接种后2 h,随培养液pH值的升高,藻细胞在载体表面的吸附密度平均值呈现先增加后下降的趋势,当培养液pH值为6时,得到最大的藻细胞吸附密度,为3039 cells · mm-2. 这是因为藻细胞表面存在能够电离的官能团,如羟基、羧基和氨基,而溶液不同的pH值会影响这类官能团的电离特性,从而影响藻细胞表面的带电特性(Bitton et al., 1980; Shen et al., 2014).当溶液pH值为6时,引起藻细胞表面羧基的电离被抑制,而氨基的电离被增强,使藻细胞表面的负电荷性被削弱且更接近于零电荷点,因此,藻细胞更容易吸附在载体表面. 当培养液pH值在3~5范围内变化时,随着pH值的上升,藻细胞在载体表面的吸附密度差别不大,但培养液pH值为5时藻细胞的吸附效果比pH值为3和4时的吸附效果好,这表明酸性藻液对普通小球藻藻细胞在载体表面的吸附密度影响较小. 当培养液pH值在7~10范围内变化时,随着pH值上升,藻细胞在载体表面的吸附速率迅速下降,吸附密度减小. 这是由于碱性的培养液易导致藻细胞表面带电特性发生改变,使藻细胞易发生絮凝成团(Vandamme et al., 2013),这不仅影响细胞在反应器载体表面的吸附,并且还导致已被吸附的细胞发生脱落. 因此,培养液pH值为6左右是本实验中最利于普通小球藻在所选载体表面吸附和作为后期生长研究的最佳条件.
3.4 液体流量对小球藻细胞吸附的影响反应器进口液体流量不仅影响悬浮藻细胞在随流体运动过程中所受到的各种作用力,还影响反应器内液体对载体表面吸附细胞剪切力的大小(Roosjen et al., 2005),因此,液体流量对藻细胞在固体表面的吸附效果具有重要影响. 本实验中流量参数分别设定为0、0.33、0.65、1.30、2.60、3.90 mL · min-1,实验结果如图 7所示.
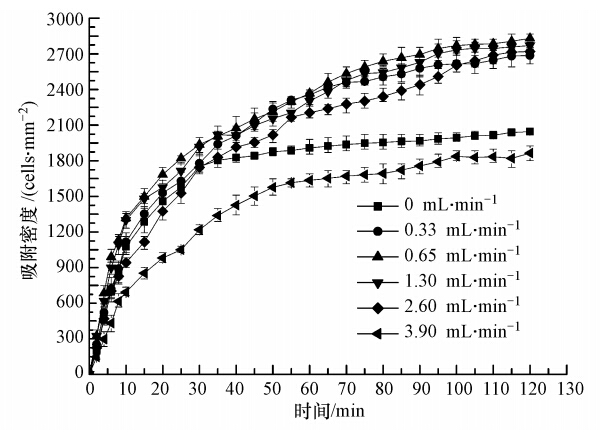 |
| 图 7 液体流量对普通小球藻细胞吸附的影响 Fig. 7 Effect of flow rate on adhesion of Chlorella vulgaris |
从图中可以发现,当液体流量为0 mL · min-1时,吸附密度在接种初期快速增大,但接种30 min后,藻细胞吸附密度趋于稳定. 这是由于静止溶液中藻细胞主要依靠重力和自身迁移能力完成向载体表面的吸附,接种一定时间后,溶液中含有的藻细胞已基本沉积并吸附于载体表面. 随着液体流量的增加,接种初期的吸附速率逐渐有所提高,但提高幅度不大;藻细胞吸附密度随着时间的进行持续增加. 这说明藻液流动增强了藻细胞的运动,加速了藻细胞向载体表面的迁移,而低流速所导致的剪切力影响尚不显著,且藻液流动又增加了藻细胞总量,使得其吸附密度在后期继续得以增加. 当液体流量为0.65 mL · min-1时,藻细胞在载体表面的吸附密度平均值达到最大,为2831 cells · mm-2. 当液体流量继续增大时,无论是初期吸附速率还是后期吸附密度均逐渐降低,特别是大液体流量下(3.90 mL · min-1),其吸附密度下降至1864 cells · mm-2,甚至低于静止溶液时的吸附速率和吸附密度总量. 这是因为在较高液体流量下,流体流动所导致的横向迁移大于藻细胞向载体表面的迁移,降低了藻细胞在载体表面的吸附机率,同时流动对载体表面藻细胞的剪切力也接近或大于了藻细胞的吸附力(田鑫等,2009),容易造成已吸附藻细胞的脱离,这都导致了藻细胞吸附密度的降低. 以上结果表明,较低液体流量下的藻细胞吸附要优于静态流体下的吸附,但相比培养基pH值的影响而言,液体流量对藻细胞吸附性能的影响较小.
4 结论(Conclusions)本文针对微藻固定化培养技术中微藻在固体基质表面的吸附特性问题,研究了载体表面粗糙度、藻细胞接种量、培养液pH值和液体流量对小球藻在固体基质表面吸附特性的影响. 结果表明:在所设计的平板式生物反应器实验系统中,藻细胞在各载体表面的吸附密度随时间进行呈先增大后逐渐趋于平缓的趋势;载体表面粗糙度Ra在0~1.200 μm范围内变化时,随着载体表面粗糙度Ra的增大,普通小球藻细胞吸附效果逐渐增强;随着藻液中藻细胞接种量的增大,普通小球藻在载体表面附着越快,吸附密度越大;当培养液pH值为6左右或液体流量为0.65 mL · min-1时,小球藻在载体表面吸附密度达到最大. 各参数对藻细胞吸附密度影响的重要程度依次为藻细胞接种量、培养基pH值、液体流量.
| [1] | Bitton G, Marshall K C. 1980. Adsorption of Microorganisms to Surfaces[M]. New York: John Wiley and Sons, Inc |
| [2] | Cao J,Yuan W Q,Pei Z J,et al. 2009. A preliminary study of the effect of surface texture on algae cell attachment for a mechanical-biological energy manufacturing system[J]. Journal of Manufacturing Science and Engineering,131(6): 064505 |
| [3] | Carlen A,Nikdel K,Wennerberg A,et al. 2001. Surface characteristics and in vitro biofilm formation on glass ionomer and composite resin[J]. Biomaterials,22(5): 481-487 |
| [4] | Chisti Y. 2007. Biodiesel from microalgae[J]. Biotechnology Advances,25(3): 294-306 |
| [5] | Christenson L,Sims R. 2011. Production and harvesting of microalgae for wastewater treatment,biofuels,and bioproducts[J]. Biotechnology Advances,29(6): 686-702 |
| [6] | 方芳,龙腾锐,郭劲松,等. 2005. 多孔填料表面物理特性对生物膜附着的影响[J].工业用水与废水,35(6): 1-4 |
| [7] | 黄国兰,孙红文,宋志慧,等.2000.固定化藻类的生理特征和对染料的脱色能力研究[J].环境科学学报,20(4): 445-449 |
| [8] | Irving T E,Allen D G.2011.Species and material considerations in the formation and development of microalgal biofilms[J].Applied Microbiology and Biotechnology,92(2): 283-294 |
| [9] | Johnson M B,Wen Z Y.2010.Development of an attached microalgal growth system for biofuel production[J].Applied Microbiology and Biotechnology,85(3): 525-534 |
| [10] | Katsikogianni M G,Missirlis Y F.2010.Interactions of bacteria with specific biomaterial surface chemistries under flow conditions[J].Acta Biomaterialia,6(3): 1107-1118 |
| [11] | Liu T Z,Wang J F,Hu Q,et al.2013.Attached cultivation technology of microalgae for efficient biomass feedstock production[J].Bioresource Technology,127: 216-222 |
| [12] | 毛书端,张小平,兰永辉,等.2012.废水营养比对固定化藻菌去除污染物的影响及动力学研究[J].环境工程学报,6(5): 1525-1530 |
| [13] | Medilanski E,Kaufmann K,Wick L Y,et al.2002.Influence of the surface topography of stainless steel on bacterial adhesion[J].Biofouling,18(3): 193-203 |
| [14] | Ozkan A,Berberoglu H.2011.Adhesion of Chlorella Vulgaris on hydrophilic and hydrophobic surfaces[C]. ASME 2011 International Mechanical Engineering Congress and Exposition.New York: American Society of Mechanical Engineers.169-178 |
| [15] | Ozkan A,Kinney K,Katz L,et al.2012.Reduction of water and energy requirement of algae cultivation using an algae biofilm photobioreactor[J].Bioresource Technology,114: 542-548 |
| [16] | Rittmann B E.2008.Opportunities for renewable bioenergy using microorganisms[J].Biotechnology and Bioengineering,100(2): 203-212 |
| [17] | Roosjen A,Boks N P,van der Mei H C,et al.2005.Influence of shear on microbial adhesion to PEO-brushes and glass by convective-diffusion and sedimentation in a parallel plate flow chamber[J].Colloids and Surfaces B: Biointerfaces,46(1): 1-6 |
| [18] | Sekar R,Venugopalan V P,Satpathy K K,et al.2004.Laboratory studies on adhesion of microalgae to hard substrates[J].Hydrobiologia,512(1/3): 109-116 |
| [19] | Shen Y,Xu X,Zhao Y,et al.2014.Influence of algae species,substrata and culture conditions on attached microalgal culture[J].Bioprocess and Biosystems Engineering,37(3): 441-450 |
| [20] | Stephens E,Ross I L,King Z,et al.2010.An economic and technical evaluation of microalgal biofuels[J].Nature Biotechnology,28(2): 126-128 |
| [21] | 田鑫,廖强,党楠,等.2009.营养及水力条件影响光合细菌生物膜生长特性实验[J].中国生物工程杂志,29(4): 67-72 |
| [22] | Vandamme D,Foubert I,Muylaert K.2013.Flocculation as a low-cost method for harvesting microalgae for bulk biomass production[J].Trends in Biotechnology,31(4): 233-239 |
| [23] | Walker J T,Marsh P D.2007.Microbial biofilm formation in DUWS and their control using disinfectants[J].Journal of dentistry,35(9): 721-730 |
 2014, Vol. 34
2014, Vol. 34


