2. 上海市水产养殖工程技术研究中心, 上海 201306;
3. 上海高校知识服务平台上海海洋大学水产动物遗传育种中心(ZF1206), 上海 201306;
4. 嘉兴大祺生物能源有限公司, 嘉兴 314006
2. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306;
3. Shanghai University Knowledge Service Platform, Shanghai Ocean University Aquatic Animal Breeding Center (ZF1206), Shanghai 201306;
4. Jiaxing Daqi Biological Energy Co., LTD, Jiaxing 314006
随着畜禽养殖业规模化生产及国务院审议通过《畜禽规模养殖污染防治条例(草案)》,畜禽养殖场污水的高效无害化处理日显重要.采用沼气池厌氧处理是当前对畜禽养殖污水最常见的处理方式(黎良新和周丛钜,2007),但从沼气池中排出的沼液中富含氮磷等营养素,直接排放到天然水体中仍然会引起水体严重富营养化.将沼液直接归田然后通过农作物吸收是当前沼液最主要的处理方式.然而在农村城镇化建设的背景下,沼液直接归田也存在受季节影响、单位面积处理效率低、所需配套农田面积大等问题.因此,仍需寻找高效的沼液安全利用途径.
利用藻类的吸收、富集和降解作用,可有效对污水进行处理.早在1957年,Oswald等(1957)提出利用藻类去除污水中氮磷的可行性,之后应用微藻处理生活污水和工业污水的研究不断深入(Woertz et al., 2009;Kim et al., 2010;严国安和谭智群,1995;Chevalier and DelaNoüe,1985;González et al., 1997;Hammouda et al., 1995).Tam和Wong(1989)证实了蛋白核小球藻(Chlorella pyrenoidosa)和栅藻(Scenedesmus sp.)在污水二级处理中具有良好的氮、磷的去除效果,经7 d处理即可去除污水中2/3以上的氮磷.董俊德等(1999)研究表明小颤藻(Oscillatoria tenuis)和两栖颤藻(O. amphibia)对污水的无机磷去除率高,而对硝态氮的处理能力较差;极大螺旋藻(Spirulina masima)则能去除较多的硝态氮.Martınez等(2000)研究了温度和搅拌形式对斜生栅藻(Scenedesmus obliquus)在二级城市污水中的脱氮除磷能力,发现在25 ℃和磁搅拌的情况下,磷的最大去除效率可达98%,氨氮的去除率可达到100%.李川等(2009)发现固定化的蛋白核小球藻(Chlorella pyrenoidosa)对人工污水中NH+4-N的去除效率最好,而鱼腥藻(Anabaena sp.)对NO-3-N的去除率高.刘林林等(2014)对15株微藻在猪场养殖污水中的氮磷净化能力及其细胞营养分析后发现多棘栅藻(Scenedesmus spinosus)SHOU-F8是猪场养殖污水净化耦合微藻生物柴油生产的合适藻株.上述研究表明,微藻对污水氮磷的净化效果受藻种、培养条件及污水中氮磷的形态与浓度等因素影响.
利用微藻净化猪场养殖污水的研究已见较多报道(张国治和姚爱莉,2000;Godos et al., 2010;刘林林等,2014),但利用微藻净化猪场养殖污水中的氮磷并耦合微藻高附加值产品生产的研究较少.狭形小桩藻(Characium angustum)是一种淡水绿藻,属于绿球藻目(Chlorococcales),小桩藻科(Characiaceae),小桩藻属(Characium),广泛分布于包括污水在内的多种类型的水体中,但目前对这种微藻尚未见有应用研究.本文在实验室条件下研究了狭形小桩藻对猪场养殖污水的净化效果及其细胞营养组成特点,以期为狭形小桩藻后续在污水净化中的应用积累资料.
2 材料与方法(Materials and methods) 2.1 试验材料试验用猪场养殖污水取自浙江嘉兴余新镇敦好农牧有限公司的养猪场.养殖污水经过沼气池厌氧发酵及露天氧化塘沉淀处理后,用于本试验.试验用原污水及其经过高压灭菌或有效氯消毒后的水质指标如表 1所示.
| 表1 试验用猪场养殖污水的水质状况 Table 1 Water parameters of experimental piggery sewage |
本试验所用狭形小桩藻取自上海海洋大学微藻种库,藻种分离自一生活污水排污沟,采用f/2培养液逐级扩培后用于本试验.
2.2 试验方法 2.2.1 不同接种浓度下狭形小桩藻对高压灭菌污水的处理效果将预先扩培的同一批次的狭形小桩藻,离心收集藻细胞,然后将收集的细胞分别接种到经高压灭菌的猪场养殖污水中.设定3个接种密度:200×104,400×104,600×104 cells · mL-1.实验在1 L的三角烧瓶中进行,每个处理3个平行.微藻在光照培养箱中进行培养,温度27 ℃,光照1800 lx,光照周期24 h/0 h(L : D).每天定时摇瓶,隔天用血球计数板计数藻细胞密度并测定培养水体中氮、磷变化情况.试验持续23 d.试验结束时离心收集藻细胞,分析细胞蛋白含量及脂肪酸组成.
2.2.2 污水预处理方法对狭形小桩藻去除氮磷效果的影响在不同接种浓度试验的基础上,选择600×104 cells · mL-1的接种浓度,比较狭形小桩藻在高压灭菌的猪场养殖污水及有效氯消毒(200 ppm)并中和的猪场养殖污水中的生长及其对氮磷去除效果.其培养方法及检测处理同2.2.1节.
2.3 指标检测用血球计数板测定藻细胞密度,并根据公式K =(lnNt-lnN0)· t-1计算相对生长率,其中,N0为培养初始藻细胞密度(cells · mL-1),Nt为培养t d后的藻细胞密度(cells · mL-1),t为培养时间(d).
用0.45μm滤膜过滤藻液,然后参照水和废水监测分析方法(第4版)(国家环境保护总局,2002)测定滤液中氮磷水平.总氮测定采用碱性过硫酸钾消解紫外分光光度法;氨态氮测定采用纳氏试剂分光光度法;硝态氮测定采用紫外分光光度法;总磷测定采用钼酸铵分光光度法.
氮磷去除率r的计算公式:

藻细胞蛋白含量的测定参照福林-酚测蛋白法(Lowry et al., 1951)进行;藻细胞脂肪酸含量的测定参照(Griffiths et al.,2010; Huang et al., 2013)进行;微藻脂肪酸甲酯的理论烷基值参照(Piloto-Rodríguez et al., 2013)的方法进行计算.
2.4 数据的统计分析结果以平均值±标准差表示,采用PASW.Statistics.18.0软件进行方差分析并作Duncan多重比较,p<0.05,表示差异显著.
3 结果(Results) 3.1 不同处理组狭形小桩藻生长状况不同接种浓度下狭形小桩藻的生长如图 1所示.在23 d的培养期间,200×104 cells · mL-1、400×104 cells · mL-1、600×104 cells · mL-1(灭菌)和600×104 cells · mL-1(消毒)组藻的相对生长率分别为0.120、0.104、0.092和0.097.经方差分析可知,200×104 cells · mL-1组藻细胞相对生长率显著高于其他组(p<0.05),藻细胞密度由初始的210×104 cells · mL-1增长到3284×104 cells · mL-1.400×104 cells · mL-1组藻细胞相对生长率显著高于600×104 cells · mL-1,其藻细胞密度由初始的419×104 cells · mL-1增长到4649×104 cells · mL-1.然而最终细胞培养密度以600×104 cells · mL-1(消毒)组最高,为5828×104 cells · mL-1,显著高于其他组;600×104 cells · mL-1(灭菌)组次之,200×104 cells · mL-1组最终细胞培养密度最小.
 |
| 图 1 不同处理组狭形小桩藻在猪场养殖污水中的生长曲线 Fig. 1 Growth curves of Characium angustum cultured in piggery sewage under different treatments |
由图 2可以看出,600×104 cells · mL-1(消毒)组狭形小桩藻对猪场养殖污水的总氮去除率最高,为90.05%,显著高于其他各组(p<0.05),试验结束时水体总氮含量为2.69 mg · L-1.400×104 cells · mL-1组和600×104 cells · mL-1(灭菌)组的总氮去除率分别为55.54%和64.32%.200×104 cells · mL-1组的去除率为41.68%,试验结束时水体总氮含量为18.11 mg · L-1.可以看出,600×104 cells · mL-1(消毒)组狭形小桩藻对猪场养殖污水中的总氮去除效果最好.
 |
| 图 2 不同处理组狭形小桩藻对猪场养殖污水中总氮的去除效果 (注:实线表示总氮去除率,虚线表示水体中总氮含量) Fig. 2 Total nitrogen removal efficiency of Characium angustum in piggery sewage under different treatments (Note: The solid lines show the total nitrogen removal rate,dashed lines show total nitrogen content in the water) |
由图 3以看出,各处理组的狭形小桩藻对猪场养殖污水的氨态氮的去除率均很高,在96%以上.经23 d培养后,各处理组污水氨态氮的含量均降低为0.40 mg · L-1左右,符合地表水环境质量标准的Ⅱ类水标准,说明狭形小桩藻对猪场养殖污水中的氨态氮有较好的去除效果.从图 3还可知,600×104 cells · mL-1(消毒)组在接种第5天,水体氨态氮就达到了最大去除率,600×104 cells · mL-1(灭菌)组在第15天达到最大去除率,400×104 cells · mL-1组在第19天达到最大去除率,而200×104 cells · mL-1组在第23天达到最大去除率.表明污水中氨态氮的去除速率与狭形小桩藻的接种密度呈正相关.
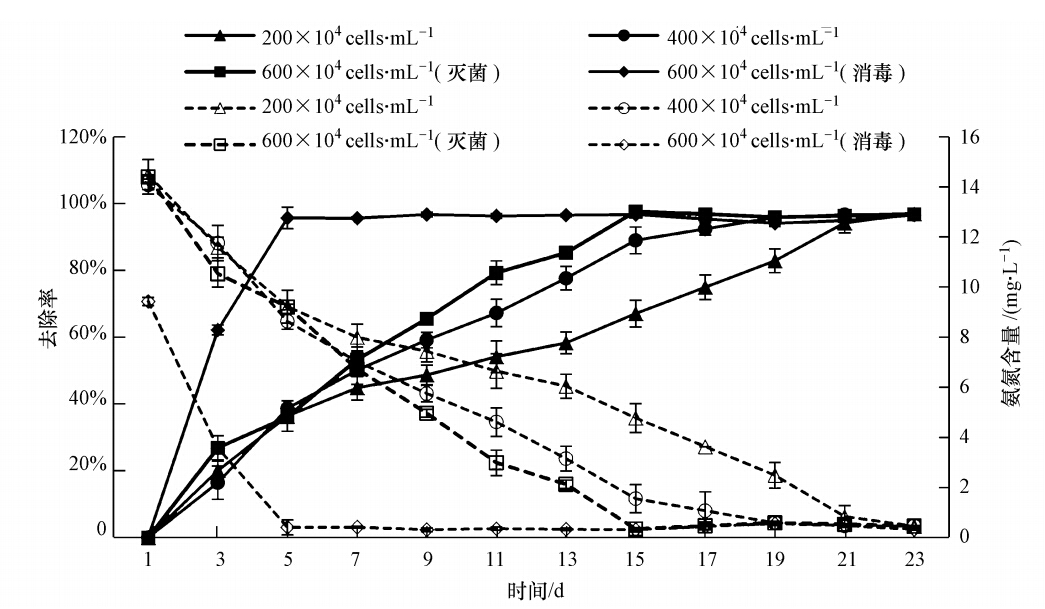 |
| 图 3 不同处理组狭形小桩藻对猪场养殖污水中氨态氮的去除效果 (注:实线表示氨氮去除率,虚线表示水体中氨氮含量) Fig. 3 Ammonia nitrogen removal efficiency of Characium angustum in piggery sewage under different treatments (Note: The solid lines show the ammonia nitrogen removal rate,dashed lines show ammonia nitrogen content in the water) |
600×104 cells · mL-1(消毒)组狭形小桩藻对猪场养殖污水硝态氮去除率最高,为98.20%,显著高于其他3组(p<0.05),试验结束时水体中硝态氮的含量仅为0.31 mg · L-1.200×104 cells · mL-1组狭形小桩藻对猪场养殖污水中的硝态氮的处理效果最差,去除率仅为3.98%,水中硝态氮的残留量仍然达到14.22 mg · L-1(图 4).
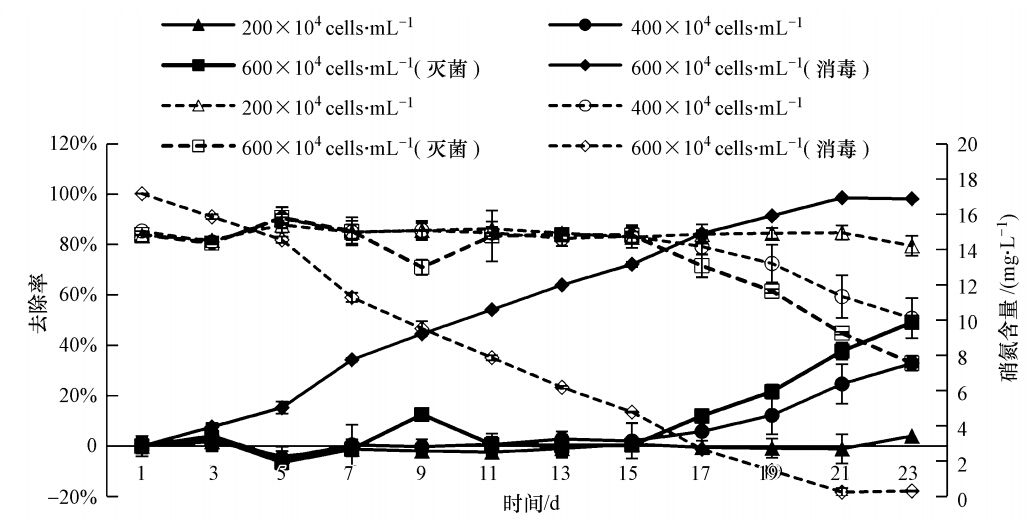 |
| 图 4 不同处理组狭形小桩藻对猪场养殖污水中硝态氮的去除效果 (注:实线表示硝氮去除率,虚线表示水体中硝氮含量) Fig. 4 Nitrate nitrogen removal efficiency of Characium angustum in piggery sewage under different treatments (Note: The solid lines show the nitrate nitrogen removal rate,dashed lines show nitrate nitrogen content in the water) |
不同处理组狭形小桩藻对猪场养殖污水的总磷去除率都很高,均在90%以上(图 5).试验结束时,400×104 cells · mL-1组、600×104 cells · mL-1(灭菌)组和600×104 cells · mL-1(消毒)组水体中总磷含量降到0.1 mg · L-1左右,符合地表水环境质量标准的Ⅱ类水标准,200×104 cells · mL-1组总磷含量降到0.18 mg · L-1,也达到地表水环境质量标准的Ⅲ类水标准.
 |
| 图 5 不同处理组狭形小桩藻对猪场养殖污水中总磷的去除效果 (注:实线表示总磷去除率,虚线表示水体中总磷含量) Fig. 5 Total phosphorus removal efficiency of Characium angustum in piggery sewage under different treatments (Note: The solid lines show the total phosphorus removal rate,dashed lines show total phosphorus content in the water) |
利用猪场养殖污水培养的各组狭形小桩藻的细胞蛋白含量无显著差异(p>0.05),600×104 cells · mL-1(消毒)组藻细胞蛋白含量稍低,为30.94%(表 2).
| 表2 利用猪场养殖污水培养的狭形小桩藻的细胞蛋白含量(干重) Table 2 The protein content of Characium angustum cultivated in piggery sewage(dry weight) |
由表 3可以看出,16 : 0、16 : 4n3、18 : 1n9、18 : 3n3和18 : 4n3是狭形小桩藻的主要脂肪酸,尤其是亚麻酸(18 : 3n3)含量,在25.65%~31.13%之间.各处理组狭形小桩藻藻细胞中多不饱和脂肪酸(PUFA)含量均很高,在50%以上.在相同接种密度下,与高压灭菌组污水相比,经有效氯消毒污水培养的藻细胞中饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA)含量增加,PUFA含量减少.根据其脂肪酸组成,各组狭形小桩藻脂肪酸甲酯的理论烷基值CN介于44.72~47.06之间.
| 表3 利用猪场养殖污水培养的狭形小桩藻藻细胞脂肪酸含量 Table 3 Fatty acid composition of Characium angustum cultivated in piggery sewage |
本研究发现在经高压灭菌的污水中,狭形小桩藻的生长性能随着藻细胞接种密度的升高而降低,但对污水中氮磷的去除率随藻细胞接种密度的升高而升高,接种密度为600×104 cells · mL-1时对污水中总氮总磷的去除率较两个低接种密度组高,这与许多学者研究的高接种密度的藻细胞去除氮磷营养物效率较低密度组好是一致的(Lavoie et al., 1985;Deand Ni Eidhin,1988).Tam和Wong(1989)报道利用不同接种浓度的蛋白核小球藻和栅藻对沉淀的污水和活性污水进行处理,结果表明高接种密度的微藻对污水处理效果比低接种密度的好,在3 d内对沉淀的污水的氨氮去除率分别达到91.5%和96.5%.这为以后处理猪场养殖污水提高微藻接种密度来提高对污水的净化效率提供了有力依据.
3种不同接种密度的狭形小桩藻对高压灭菌污水的氨态氮去除率都较高,说明狭形小桩藻对猪场养殖污水的氨态氮有较好的利用率.Ip等(1982)研究表明氨氮浓度超过50 mg · L-1会抑制藻细胞的生长,本研究中氨氮浓度14 mg · L-1左右,没有超过这个范围,因此可以满足藻细胞生长.经过狭形小桩藻的处理,3组污水中的氨态氮浓度均降低到0.5 mg · L-1以下,达到了地表水环境质量标准的Ⅱ类标准(GB3838—2002).从对氨态氮去除的时间来看,接种密度为600×104 cells · mL-1的藻细胞在第15天就将氨态氮降低到最低水平(0.34 mg · L-1),接种密度为400×104 cells · mL-1的藻细胞在第19天将氨态氮降低到较低水平(0.60 mg · L-1),说明了藻细胞接种密度越大,达到最大去除率的时间越短,进而说明提高微藻接种密度可提高对污水的净化效率.Lau等(1995)对不同接种浓度下小球藻对初级城市污水的处理结果也表明,高接种浓度能提高小球藻对污水的净化速度.
本研究还发现,当猪场养殖污水中氨态氮浓度降到较低水平后,狭形小桩藻对污水中硝态氮的去除效果才有明显提高(图 3,图 4).表明所用的狭形小桩藻优先利用水体中的氨态氮,当氨态氮耗尽或降低至一极低水平时,才开始利用水体中硝态氮,这与Przytocka等(1984)研究结果是一致的.不同接种浓度下狭形小桩藻对猪场养殖污水中总磷的去除率都很高,去除率均在90%以上,经微藻处理后的养殖污水中总磷的水平均降低到0.2 mg · L-1以下,达到了地表水环境质量标准的Ⅱ-Ⅲ类标准(GB3838—2002).
本研究中所用的猪场养殖污水采用高压灭菌和有效氯消毒(再用硫代硫酸钠中和)两种预处理方式.两种预处理方式均对污水中的氮形态和水平产生一定变化.与原污水相比,经高压灭菌污水的总氮由35.5 mg · L-1降低为31.0 mg · L-1,氨态氮浓度由17.0 mg · L-1降至14.0 mg · L-1,而硝态氮浓度由14.0 mg · L-1升至15.0 mg · L-1.说明高压灭菌过程中污水中的部分氨态氮有逸出,另有少部分转变成硝态氮.而经有效氯处理后的污水,总氮由35.5 mg · L-1降低为27.1 mg · L-1,氨态氮浓度由17.0 mg · L-1大幅下降9.4 mg · L-1,硝态氮浓度由14.0 mg · L-1升至17.2 mg · L-1.说明经过次氯酸钠处理后污水中有较多的氨态氮逸出或转化成了硝态氮,这与有效氯的强氧化性及高pH有关.
在相同的接种浓度600×104 cells · mL-1下,有效氯消毒组狭形小桩藻的生长及其对猪场养殖污水的净化效果均比高压灭菌组好,对猪场养殖污水的总氮和硝态氮去除率分别为90.05%和98.19%,显著高于高压灭菌组.这一方面可能与高压灭菌处理的污水中总氮及氨态氮水平较有效氯消毒处理组高有关,另一方面也与微藻生长所需的某些生理活性物质经高压灭菌后遭到破坏有关.
本研究发现利用猪场养殖污水培养的狭形小桩藻的蛋白含量与接种密度无显著相关性,表明试验条件下接种密度不影响养殖狭形小桩藻的蛋白含量,各处理组藻细胞蛋白含量均在30%以上,达到蛋白源饲料标准(王道尊等,2004).由狭形小桩藻的脂肪酸组成分析可知,其藻细胞中含有丰富的亚麻酸(18 : 3n3)(表 3).王铭等(2006)研究表明,绿藻类的四列藻和小球藻的亚麻酸含量分别占总脂肪酸含量的19.70%和24.95%,而8种金藻门及硅藻门的种类亚麻酸含量均很低.蒋霞敏和郑亦周(2003)研究发现小球藻、亚心形扁藻和盐藻的亚麻酸含量分别占总脂肪酸含量的30.13%、25.57%和30.07%.亚麻酸是陆生动物及淡水鱼类的必需脂肪酸,这是因为淡水鱼类缺乏将油酸(18 : 1n9)转化为亚麻酸所必须的Δ15 去饱和酶(Sargent et al., 2002).淡水鱼饲料中缺乏亚麻酸,将会降低其生长速度及抗感染胁迫的能力(吕耀平等,2007).由于狭形小桩藻细胞中含有丰富的PUFA,导致其脂肪酸甲酯的理论烷基值都较低.根据美国生物柴油标准,生物柴油烷基值最低不得低于47(Wadumesthrige et al.,2008).因此,利用猪场养殖污水培养的狭形小桩藻不适合作为微藻生物柴油的原料,但可以作为水产动物的饲料蛋白源或饲料添加剂.
5 结论(Conclusions)狭形小桩藻能在猪场养殖污水中生长,高的接种密度有利于对污水中氮磷的净化,且狭形小桩藻优先利用猪场养殖污水中的氨态氮后利用硝态氮.因此,可利用狭形小桩藻净化猪场养殖污水并耦合生产富含亚麻酸等n-3系列多不饱和脂肪酸(n-3PUFA)的饲料添加剂或饲料蛋白源.
| [1] | Chevalier P, De la Noüe J. 1985. Wastewater nutrient removal with microalgae immobilized in carrageenan[J]. Enzyme and microbial Technology, 7(12): 621-624 |
| [2] | De la Noüe J, Ni Eidhin D. 1988. Improved performance of intensive semicontinuous cultures of Scenedesmus by biomass recirculation[J]. Biotechnology and Bioengineering, 31(5): 397-406 |
| [3] | 董俊德, 吴伯堂, 黄羽庭. 1999. 微藻在污水中的除磷脱氮作用[J]. 热带海洋, 18(1): 52-58 |
| [4] | Godos I D, Vargas V A, Blanco S, et al. 2010. A comparative evaluation of microalgae for the degradation of piggery wastewater under photosynthetic oxygenation[J]. Bioresource Technology, 101(14): 5150-5158 |
| [5] | González L E, Cañizares R O, Baena S. 1997. Efficiency of ammonia and phosphorus removal from a colombian agroindustrial wastewater by the microalgae Chlorella vulgaris and Scenedesmus dimorphus[J]. Bioresource Technology, 60(3): 259-262 |
| [6] | Griffiths M J, Van Hille R P, Harrison S T L. 2010. Selection of direct transesterification as the preferred method for assay of fatty acid content of microalgae[J]. Lipids, 45(11): 1053-1060 |
| [7] | 国家环境保护总局. 2002.水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社. 236-246, 255-284 |
| [8] | Hammouda O, Gaber A, Abdelraouf N. 1995. Microalgae and wastewater treatment[J]. Ecotoxicology and Environmental Safety, 31(3): 205-210 |
| [9] | Huang X X, Huang Z Z, Wen W, et al. 2013. Effects of nitrogen supplementation of the culture medium on the growth, total lipid content and fatty acid profiles of three microalgae (Tetraselmis subcordiformis, Nannochloropsis oculata and Pavlova viridis)[J]. Journal of Applied Phycology, 25(1): 129-137 |
| [10] | Ip S Y, Bridger J S, Chin C T, et al. 1982. Algal growth in primary settled sewage: the effects of five key variables[J]. Water Research, 16(5): 621-632 |
| [11] | 蒋霞敏, 郑亦周. 2003. 14种微藻总脂含量和脂肪酸组成研究[J]. 水生生物学报, 27(3): 243-247 |
| [12] | Kim J, Lingaraju B P, Rheaume R, et al. 2010. Removal of ammonia from wastewater effluent by Chlorella Vulgaris [J]. Tsinghua Science and Technology, 15(4): 391-396 |
| [13] | Lau P S, Tam N F Y, Wong Y S. 1995. Effect of algal density on nutrient removal from primary settled wastewater[J]. Environmental Pollution, 89(1): 59-66 |
| [14] | Lavoie A, De la Noüe J. 1985. Hyperconcentrated cultures of Scenedesmus obliquus: A new approach for wastewater biological tertiary treatment[J]. Water Research, 19(11): 1437-1442 |
| [15] | 李川, 薛建辉, 赵蓉, 等. 2009. 4种固定化藻类对污水中氮的净化能力研究[J]. 环境工程学报, 3(12): 2185-2188 |
| [16] | 黎良新, 周丛钜. 2007. 沼液分层综合利用技术[J]. 农业环境与发展, 24(1): 45-46 |
| [17] | 刘林林, 黄旭雄, 危立坤, 等. 2014. 15株微藻对猪场养殖污水中氮磷的净化及其细胞营养分析[J]. 环境科学学报, 34(8):1986-1994 |
| [18] | Lowry O H, Rosebrough N J, Farr A L, et al. 1951. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 193(1): 265-275 |
| [19] | 吕耀平, 成永旭, 吴旭干. 2007. 水产养殖中亚麻酸应用的研究进展[J]. 水产科技情报, 34(2):68-72 |
| [20] | Martınez M E, Sánchez S, Jiménez J M, et al. 2000. Nitrogen and phosphorus removal from urban wastewater by the microalga Scenedesmus obliquus [J]. Bioresource Technology, 73(3): 263-272 |
| [21] | Oswald W J, Gotaas H B, Golueke C G, et al. 1957. Algae in waste treatment [J]. Sewage and Industrial Wastes, 29(4): 437-457 |
| [22] | Piloto-Rodríguez R, Sánchez-Borroto Y, Lapuerta M, et al. 2013. Prediction of the cetane number of biodiesel using artificial neural networks and multiple linear regression[J]. Energy Conversion and Management, 65: 255-261 |
| [23] | Przytocka-Jusiaka M, Duszotaa M, Matusiaka K, et al. 1984. Intensive culture of Chlorella vulgaris/AA as the second stage of biological purification of nitrogen industry wastewaters[J]. Water Research, 18(1): 1-7 |
| [24] | Sargent J R, Tocher D R, Bell J G. 2002. The lipids// Halver J E ed. Fish Nutrition (2nd ed)[M]. San Diego: Academic Press. 181-257 |
| [25] | Tam N F Y, Wong Y S. 1989. Wastewater nutrient removal by Chlorella pyrenoidosa and Scenedesmus sp.[J]. Environmental Pollution, 58(1): 19-34 |
| [26] | Wadumesthrige K, Smith J C, Wilson J R, et al. 2008. Investigation of the parameters affecting the cetane number of biodiesel[J]. Journal of the American Oil Chemists' Society, 85(11): 1073-1081 |
| [27] | 王道尊, 刘永发, 徐寿山, 等. 2004. 渔用饲料实用手册[M]. 上海: 上海科学技术出版社. 57-70 |
| [28] | 王铭, 刘然, 徐宁. 2006. 13 种微藻的脂肪酸组成分析[J]. 生态科学, 25(6): 542-544 |
| [29] | Woertz I, Feffer A, Lundquist T, et al. 2009. Algae grown on dairy and municipal wastewater for simultaneous nutrient removal and lipid production for biofuel feedstock[J]. Journal of Environmental Engineering, 135(11): 1115-1122 |
| [30] | 严国安, 谭智群. 1995. 藻类净化污水的研究及其进展[J]. 环境科学进展, 3(3): 45-54 |
| [31] | 张国治, 姚爱莉. 2000. 藻类对猪粪厌氧废液的净化作用[J]. 西南农业学报, 13(S1): 105-112 |
 2014, Vol. 34
2014, Vol. 34


