2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
多环芳烃(PAHs)是一类有毒、有害、难降解的有机污染物质,以苯并[a]芘为代表的多环芳烃对生物和人类具有致畸、致癌、致突变等毒害作用.近几十年来,PAHs的污染以及带来的生态效应已引起了国际社会的广泛关注.PAHs主要经过工业废水、生活污水、大气沉降的输入进入水体环境.由于具有疏水亲脂的特性,PAHs 倾向于吸附在溶解相的有机质中,随水流迁移,同时也易于附着在悬浮颗粒物上,最终沉降到水底沉积物中,或被水生生物吸收而富集在体内,并有可能通过食物链传递最终危害人体健康.国外尤其是发达国家对PAHs的环境行为已经进行了大量的调查研究(Cailleaud et al., 2007; Lammel et al., 2009; Haftka et al., 2010).
改革开放以来经济的快速发展,带来了日趋严重的环境污染问题,对区域生态环境和人体健康造成了不利的影响.工农业的迅猛发展和人口爆炸似的增长,大量工业废水、生活污水、废气未经有效处理直接排放,导致珠江三角洲的水环境污染日益恶化,其中珠江广州河段已成为毒害性有机污染物的高风险区.因此,系统地对珠江三角洲河流中多环芳烃的污染状况进行研究是非常必要的.对于珠三角地区水体中PAHs 的研究主要集中在珠江及其邻近的海域.罗孝俊等(2008)研究了珠江河口及近海表层水体中PAHs时空分布及其在水体及颗粒相中的分配及其控制因素,结果发现该区域水体中多环芳烃浓度春季高于夏季,并且PAHs在颗粒相及水相中的分配系数(Kp)随颗粒有机碳含量、水体盐度增加而增加,随悬浮颗粒物含量增加而减少;马骁轩等(2007)测定了珠江上游的两条重要支流西江、北江水体悬浮颗粒物中多环芳烃和有机氯农药的含量和来源,结果发现这两条河流中多环芳烃的来源主要为石化燃料的燃烧与排放.王继忠等(Wang et al., 2008)测定了珠江三角洲八大入海口多环芳烃的分布和分配,结果发现该区域水体中多环芳烃的浓度处于中等水平,并且对其来源分析发现珠江八大入海口水体中PAHs是成岩和燃烧两种不同情况下共同作用的结果.
虽然前人已经对珠江三角洲水体中有机污染物开展过一些研究工作,但是这些研究时间都较早,并且主要集中于珠江正干、西江与河口,对另外一个重要支流东江的研究较少,本研究通过对春夏两季珠江广州河段和东江东莞河段表层水体中的PAHs的分析,对该区域PAHs的时空分布、分配行为进行了研究,有助于我们对这两个河段水体中PAHs的污染状况有个重新定位;并且探讨了富营养化程度对PAHs在表层水体中固液分配的影响,珠江三角洲地区是我国富营养化程度较高的区域,是人类活动影响剧烈的典型水域,从不同的角度对其进行深入研究颇具代表性,也具有重要的实际意义.
2 材料与方法(Materials and methods) 2.1 样品采集采样点如图 1所示.样品分别于2011年4月及2011年9月采自珠江广州河段及东江东莞河段.用潜水泵采集河流表层水(水深0~0.5 m),置于干净的10 L棕色瓶中并加入适量的叠氮化钠(水样中浓度约200 mg · L-1)以防止PAHs降解,另外用500 mL棕色瓶取表层水并立刻加入1%的碳酸镁悬浊液,用于叶绿素a的测定.
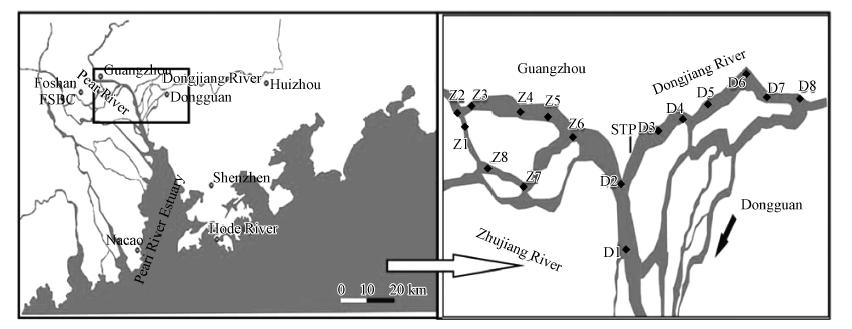 |
| 图 1 珠江三角洲表层水样采样点分布图(D1:新沙港;D2:广浚码头;D3:广深高速;D4:广深大道;D5:白鹤洲;D6:仙村;D7:关海口;D8:石龙; Z1:鹤洞大桥;Z2:白鹅潭;Z3:江湾大桥;Z4:广州大桥;Z5:东浦大桥;Z6:黄埔港;Z7:番禺大桥;Z8:洛溪大桥) Fig. 1 Map of sampling locations in the Pearl River Delta |
立即用电子pH计(MP511,上海)在原位测定水样的盐度、电导率和pH等水化学数据;水样经Whatman玻璃纤维滤膜过滤(GF/G,0.7 μm,Ф47 mm),置于冷库4 ℃保存,载有颗粒物的滤膜用铝箔纸包好,密封后冷冻保存(-20 ℃).样品的基本情况列于表 1.
| 表1 春夏两季珠江三角洲所采集水样的各项基本参数 Table 1 Major hydrochemical properties of water samples collected from the Pearl River Delta |
本实验所用的二氯甲烷及丙酮为国产分析纯,经过全玻璃蒸馏系统的二次蒸馏后使用.甲醇(HPLC级)和正己烷(HPLC级)购自Merck公司,乙酸乙酯为sigma试剂,实验用水为二次蒸馏水.玻璃纤维滤膜购自Whatman(GF/F,0.7 μm),使用前经450 ℃灼烧4 h,ENVI-C18 SPE 柱(500 mg,6 mL)购自Supelco公司.硅胶(80~100目)和中性氧化铝(100~200目)用二氯甲烷索氏抽提72h.分析纯无水硫酸钠在450 ℃下灼烧4 h待用.分析用玻璃器皿每次使用前用5‰的铬酸洗液浸泡,放置4 h 后清洗,再在450 ℃下灼烧4 h 后使用.
用于定量的16种PAHs混合标样及5种氘代回收率指示物(萘-D8,二氢苊-D10,菲-D10,-D12和苝-D12)购自UltraScientific公司(North Kingston,RI,USA).
2.2.2 样品前处理对水样采用GF/F(Whatman,0.7 μm)玻璃纤维滤膜过滤收集悬浮颗粒物(颗粒相),并分离出溶解相.采用Envi-C18(500 mg,6 mL)固相萃取柱对PAHs进行富集.先依次用5 mL甲醇、5 mL去离子水以及5 mL 水-甲醇溶液(98 ∶ 2)活化SPE柱,然后将4L加了回收率指示物的水样以8~10 mL · min-1的流速通过SPE柱,再用5 mL去离子水洗柱.SPE柱真空干燥20~30 min 后依次用5 mL乙酸乙酯洗脱3次,洗脱液经无水Na2SO4脱水后浓缩至0.1 mL,进行气相色谱-质谱分析.
富集了颗粒物的滤膜冷冻干燥后称重,加入一定量的萘-d8,二氢苊-d10,菲-d10,-d12和苝-d12作回收率指示物,用二氯甲烷索氏提取48 h.将抽提液旋转蒸发至 1 mL,加入 10 mL正己烷进行溶剂置换,浓缩为约1 mL,将浓缩液液经过由 6 cm 氧化铝和12 cm 硅胶所组成的色谱柱进行净化.然后以溶剂淋洗,将淋洗液旋转蒸发至 1 mL,以柔和氮气定容至0.1 mL,进行气相色谱-质谱分析.
2.2.3 色谱条件在HP-6890/5975气相色谱质谱联用系统上以选择离子扫描方式对PAHs进行测定.色谱柱为30 m的DB-5 石英毛细管色谱柱(30 m×0.32 mm×0.25 μm),质谱采用70 eV 的电子轰击源(EI).色谱升温条件如下:进样口温度为280 ℃,柱温60 ℃开始,以10 ℃ · min-1的速度升温到200 ℃,然后以2 ℃ · min-1的速度升温到214 ℃,以5 ℃ · min-1的速度升温到255 ℃,并且保持2 min,最后以20 ℃ · min-1的速度升温到290 ℃,并且保存12 min.载气为高纯氦,流速1 mL · min-1.样品分析时进样1 μL,无分流进样.
2.2.4 质量控制与质量保证本实验以美国 EPA 的 QA/QC 控制样监控,并且每10个样品增加1个方法空白和一个标样.PAHs回收率测定使用样品加标回收率,加标回收率为50.9%~122.7%.方法空白总PAHs的检出率为10 ng · L-1.最后结果经回收率校正和空白扣除.
2.2.5 有机碳(OC)和叶绿素a的分析每个样品各取出10 mL 滤液,调其pH至中性,利用TOC-VCPH 分析仪(岛津)测定其溶解性有机碳(DOC)含量,每个样品测定3次,取其平均值.
富集了颗粒物的滤膜冷冻干燥后,用稀盐酸反复润湿滤膜除去碳酸盐,再用蒸馏水吸取盐酸,60 ℃烘干保存于干燥器中.测定前将滤膜放置烘箱中105 ℃恒温烘干至恒重,利用元素分析仪CHNS(Vario EL ⅢElementar,Germany),乙酰苯胺Ace(C8H9NO)外标法测定TOC.每个样品重复测定两次,结果取其平均值.
采样后样品放在荫凉处,每升水样需加1 mL 1%碳酸镁悬浮液,以防止酸化引起色素溶解.回实验室后取约500 mL水样过0.45 μm的醋酸纤维滤膜,吸滤,过滤器内无水分后,继续抽吸几min,然后将滤膜用90%的丙酮(体积比为1比9的水/丙酮溶液)浸泡提取24小时.然后4000 r · min-1下离心20min,分离,将上清液倒入比色管中,再加入少量90%丙酮,悬浮后再一次离心,两次离心液合并入比色管中.若滤膜的绿色未洗脱出来,可再加丙酮洗涤并离心,直到滤膜绿色全部洗脱出来为止.将上清液定容至10 mL.以90%的丙酮为参比,测定750 nm、663 nm、645 nm、630nm下的吸光度值,根据文献中公式测定叶绿素a的浓度(Greenberg et al.,1998).
3 结果与讨论(Results and discussion) 3.1 多环芳烃的浓度水平和分布由于萘-d8较低的回收率,本研究主要报道了15种优控多环芳烃.图S1(见附录,详见《环境科学学报》网站www.actasc.cn或中国知网www.cnki.net下载PDF全文,下同)显示了多环芳烃在珠江广州河段和东江东莞河段水体中的时空分布状况.
由图 S1可见,本区域水体中多环芳烃总量在春夏两个季节存在一定的差异.春季所采集样品中,溶解态多环芳烃总浓度位于14.0~83.1 ng · L-1之间,平均值为32.5 ng · L-1,夏季样品溶解态多环芳烃总浓度位于15.2~48.1 ng · L-1之间,平均值为26.3 ng · L-1;而春季样品颗粒相中PAHs的浓度范围为129~404 ng · L-1,平均浓度为221 ng · L-1,夏季样品颗粒相中PAHs的浓度范围为8.75~98.1 ng · L-1,平均浓度为40.1 ng · L-1.在春季样品中溶解相和颗粒相多环芳烃的浓度高于在夏季样品中的浓度.春夏两季多环芳烃浓度的差异可能是由以下原因造成的,首先,由于春季水-气交换的结果(Park et al., 2002),低环数PAHs具有较高的蒸汽压,由于春季温度较低,大气中呈气态形式存在的低环数PAHs以水-气交换方式大量进入水体,从而导致水体中PAHs含量较高;其次,夏季强烈的阳光照射可能造成多环芳烃光降解反应强烈,使其浓度降低;第三,由于夏季雨水充沛,再悬浮作用增强,使得部分表层沉积物再次进入颗粒相中,同时在雨水的作用下,部分表层土壤被带入河流中形成悬浮颗粒物,这些新形成的悬浮颗粒物中PAHs含量一般要低于春季长期存在的悬浮颗粒物.
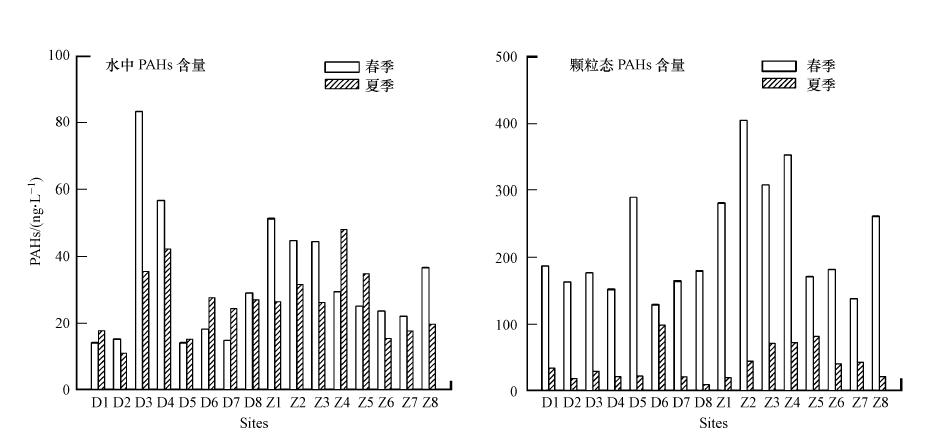 |
| 图 S1 珠江三角洲表层水体中多环芳烃在春夏两季的空间分布 Fig. S1 Spatial distribution of PAHs in the surface water samples from the Pearl River Delta in spring and summer |
珠江广州河段自白鹅潭(Z2)以下分为前航道(Z3、Z4、Z5)和后航道(Z1、Z8、Z7),二者汇合进入黄埔航道(Z6)(图 1).由春季的结果来看,溶解态PAHs在前航道和后航道中含量相当,浓度范围分别为24.9~44.3 ng · L-1和21.9~51.3 ng · L-1;而颗粒态PAHs情况则不同,前航道含量普遍高于后航道,浓度范围分别为170.6~351.7 ng · L-1和137.3~261.4 ng · L-1.而从夏季的结果来看,溶解态PAHs含量在前航道略高于后航道,浓度范围分别为26.1~48.1 ng · L-1和17.6~26.4 ng · L-1;颗粒态PAHs与春季结果相同,前航道含量普遍高于后航道,浓度范围分别为70.5~81.3 ng · L-1和19.5~42.6 ng · L-1.分析其原因,可能是由于前航道横穿工业发达、人口稠密的广州市区,沿岸有众多排污口排放大量工业废水和生活污水;后航道流经工业发达而人口相对稀疏的芳村和番禺,接纳生活污水相对较少,从而导致颗粒态PAHs含量较前航道偏低.
东江东莞河段的样品自石龙(D8)采集自北干流(D3-D7),并且与珠江回合至狮子洋(D1、D2).由图S1可以看出,在该河段的大多数采样点,多环芳烃的浓度随季节变化有同步的增减趋势.溶解态PAHs从上游到下游污染物浓度呈递减趋势,春夏两季溶解态的最高值出现在广深大道(D3)和广深高速(D4),这主要是由于D3、D4 除了受麻涌的工业区影响外,还分别接纳来自广州南岗工业区和广州经济开发区的污水以及污水处理厂(图 1,STP为广州开发区污水处理厂)的出水,由此可以将这两个区域视为点源污染,在后面相关性分析中,排除这两个区域(图 2中圈出的点);而颗粒态PAHs的含量从上游到下游相差不大,分布比较均匀,这主要与两岸工业废水和生活污水无规则的排放以及新鲜河水的汇入有关,春夏两季颗粒态PAHs的最高值分别出现在D5、D6区域,可能由于增江在此汇入,带入了新的污染源.
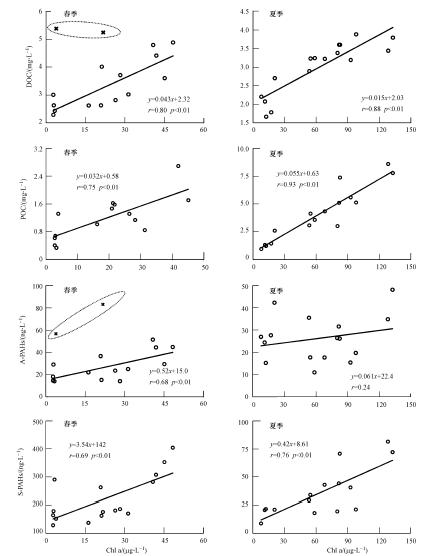 |
| 图 2 珠江三角洲水样中叶绿素a(Chl a)分别与有机碳(DOC和POC)以及多环芳烃(A-PAHs和S-PAHs)含量之间的相关性(椭圆中圈出的点偏离程度超出浓度范围的一个标准差,可以将其视为点源污染,讨论相关性时未考虑在内) Fig. 2 Correlations of Chl a with DOC,POC,dissoved PAHs(A-PAHs), and particulate PAHs(S-PAHs)in the Pearl River Delta,respectively(The ellipse encloses the point-source samples not included in the correlation analysis) |
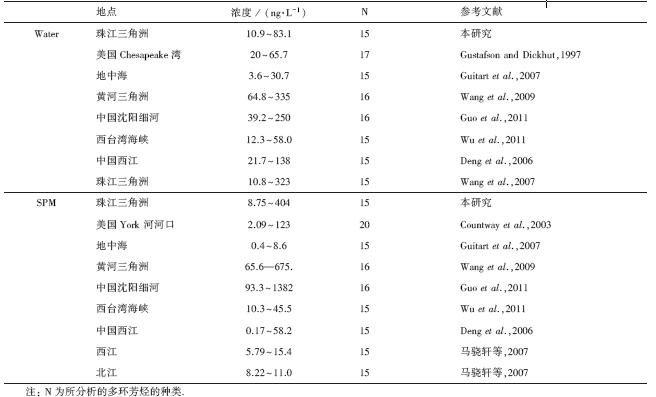
与国内外一些水域的分析结果相对比(见附录中表S1),珠江广州河段与东江东莞河段水体中多环芳烃的含量范围与美国Chesapeake湾(Gustafson and Dickhut,1997)、西台湾海峡(Wu et al., 2011)、西江(Deng et al., 2006)以及珠江三角洲水体(Wang et al., 2007)中PAHs含量相近,明显高于西江和北江(马骁轩等,2007)、地中海(Guitart et al., 2007)等地的含量,低于黄河三角洲(Wang et al., 2009)以及沈阳市细河(Guo et al., 2011)等地区的含量.
| 表S1 不同研究区域水样中多环芳烃的污染状况 Table S1 Summary of total PAHs (ng·L-1) in water and SPM from various estuary and coastal regions |
影响水体及颗粒物中PAHs含量的一个重要因素就是河水中水溶性有机碳(DOC)及悬浮颗粒态有机碳(POC)的含量.颗粒物中有机碳含量随站位地理位置的差异及季节的变化而不同,总体表现为夏季高于春季.夏季样品中,有机碳含量为5.03%到22.01%,春季样品中有机碳含量范围为1.59%到14.6%.有机碳含量的这种季节变动可能是由于珠江水环境中浮游动植物的含量不同所造成的.
已有大量研究表明,有机碳含量对多环芳烃的分布和归宿起着非常重要的作用(Guo et al., 2009; Smith et al., 2011; Li et al., 2012).分别对春夏两季样品中DOC、POC与溶解态PAHs,颗粒态PAHs进行回归分析(见附录中图图 S2),可以发现春季样品中,有机碳与PAHs总量具有很好的正相关关系,而夏季样品中,DOC与溶解态PAHs几乎没有相关性,说明DOC含量对于夏季溶解态PAHs总量的分布来说,并不是一个决定性因素.
 |
| 图 S2 珠江三角洲水样中溶解有机碳(DOC)与溶解态多环芳烃(A-PAHs)含量之间、颗粒态有机碳(POC) 与颗粒态多环芳烃(S-PAHs) 含量之间的相关性 Fig. S2 Correlations of DOC with dissolved PAHs (A-PAHs), and with particulate PAHs (S-PAHs) in water samples from the Pearl River Delta |
另外无论是春季还是夏季,叶绿素a与DOC及POC均呈现显著的正相关关系(图 2),说明藻类有机碳在研究区域碳库组成中起到非常重要的作用.已有的研究表明,将叶绿素的浓度乘以系数25,所得的值即为藻类来源的有机碳的浓度(Taipale et al., 2007).将其应用于本区域,结果表明,春季除个别采样点外,藻类有机碳含量占POC总量的7.35%~40.00%,平均占24.70%,夏季藻类有机碳占POC总量的20.00%~66.70%,平均占36.20%,由此可以发现,藻类有机碳确实是该区域有机碳的一个主要来源.
Chl a的含量作为富营养化程度的一个重要指标,也表明富营养化可能对PAHs的分布起到重要作用.对两个季节样品中Chl a含量与溶解态PAHs及颗粒态PAHs含量分别进行回归分析,结果如图 2所示.春季样品中,Chl a含量与溶解态PAHs及颗粒态PAHs总含量均呈现出显著的相关性,说明藻类有机碳是水体中PAHs分布的决定性因素之一;而夏季样品中,Chl a含量与颗粒态PAHs相关系数 r=0.76,两者间还具有较好的相关性,而与溶解态PAHs的相关系数r=0.24,已基本上不存在相关性了;这一结果与以上论述的DOC和溶解态PAHs的的相关关系相一致.这说明当夏季浮游生物含量较高并且生长迅速时,藻类有机碳对溶解态PAHs的分布的影响不大,其主要作用体现在对颗粒态PAHs的分布的影响上.有研究表明(Countway et al., 2003),水体中自养型浮游植物可能起到一个“生物泵”作用,将低环数多环芳烃泵入到表层颗粒物中.Chl a含量与颗粒态PAHs总量的正相关性也表明该区域内浮游生物的生物泵作用对PAHs的分布起到了一定的贡献.
3.3 多环芳烃在颗粒相与水相中的分配有机质对非水极性有机污染物的吸附是影响其分布、归宿、生物有效性、健康风险的最重要影响因素之一.常用来表征该吸附作用的参数为有机碳分配系数Koc,其公式表述如下:Koc=qe/focCe,而logKoc= alogKow+ b,由此可得到:
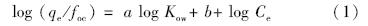
其中,qe/foc为有机碳归一化浓度(线性回归曲线斜率),qe(ng · g-1)和Ce(ng · mL-1)分别为平衡态固相和液相浓度.
由图 3可以看出,不论春季还是夏季PAHs总有机碳归一化浓度与它们的辛醇-水系数均呈现显著的正相关关系,并且由图中方程可以发现该结果与之前研究所得珠江流域的分配相一致(Luo et al., 2004; Deng et al., 2006).由此可见,有机质对 PAHs的吸附作用确实控制着其在水-颗粒相中的分配作用.根据前人的研究发现(Voice et al., 1983; Schrap et al., 1995),无论是室内的实验研究还是野外的实地测定,多环芳烃的分配都受到颗粒物浓度的影响.颗粒物浓度增加,分配系数随之降低,这主要是因为随着颗粒物浓度的增加,胶体形式存在的有机质含量增加,从而使溶解态多环芳烃增加.
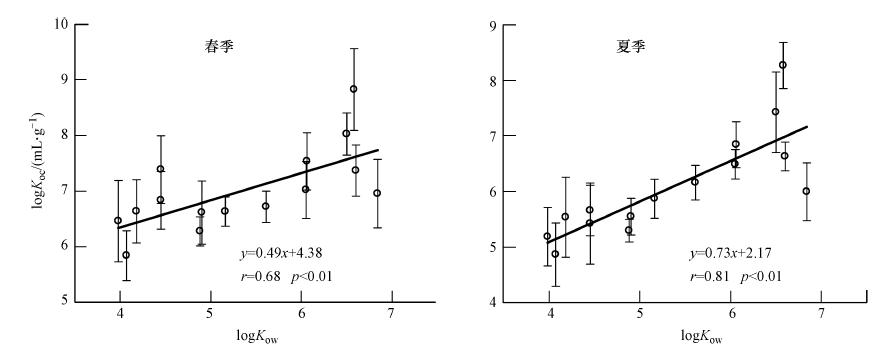 |
| 图 3 珠江三角洲不同季节水样中logKow与logKoc的相关性 Fig. 3 Correlations between logKow and logKoc for PAHs in water samples from the Pearl River Delta |
PAHs在水相和颗粒物中的分配被认为是一个吸附和解吸附的动力学过程.由图 3中线性自由能方程可以发现此处得到的方程斜率夏季高于春季,这可能与多环芳烃的非平衡吸附有关.春季藻类有机质及悬浮颗粒物含量较低,PAHs需要一定的时间达到在颗粒物上的吸附平衡;而夏季藻类生长旺盛,藻类有机质和悬浮颗粒物含量均高于春季,多环芳烃更倾向于吸附在颗粒态上,并且经过长期固液分配,多环芳烃在固液两相中的分配趋于平衡.由此也可以推断珠江广州河段和东江东莞河段水体中PAHs在春夏两季是由水相向颗粒相中迁移.
3.4 表层水中PAHs的来源分析多环芳烃的同分异构体比值法被广泛地应用于诊断不同环境介质中PAHs的来源.通常运用于来源解析的多环芳烃异构体包括分子量为178、202、228及276的这几组化合物.但是,由于低分子量的同分异构体(如分子量为178)在环境中稳定性较差,容易发生光降解,用这类化合物来判断PAHs的来源可能误差较大(Zhang et al., 2005).因此,本研究只采用了分子量为202、228和276这3类同分异构体化合物的比值来判断PAHs的来源.即荧蒽/202(Flu/202),苯并[a]蒽/228(BaA/228)和茚并芘/276(InP/276).
一般来说,Flu/202的比值小于0.4 则意味着石油污染来源,大于0.5 则主要是煤和生物质燃烧来源,介于两者之间则意味着液体燃料的燃烧来源(Budzinski et al., 1997).BaA/228 的比值小于0.2、表明石油排放来源,大于0.35 则主要是燃烧来源,而位于0.2 与0.35 之间则可能是石油污染与燃料燃烧的混合来源.InP/276 比值小于0.2 表明主要是石油排放来源,大于0.5 则主要是煤和生物质燃烧来源,介于两者之间为液体燃料燃烧来源(Yunker et al., 2002).
由于水体样品以及悬浮物中的PAHs经过多次分配,如果分别计算溶解相及颗粒相中的不同化合物的比值,其比值往往改变较大,因此本研究中运用比值法来判断研究水体中PAHs来源时,用相应化合物在水相与颗粒相中的和(水相+颗粒相)来计算相应的比值(Wang et al., 2007).根据上面的指示来源的指标,分别计算了不同季节珠江广州河段及东江东莞河段表层水体中各指标的值,作多环芳烃来源的诊断图,如图 4所示.
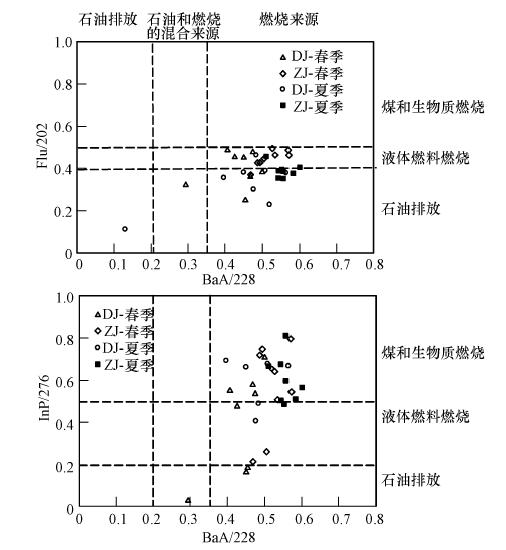 |
| 图 4 珠江三角洲不同季节水体中多环芳烃的来源诊断图 Fig. 4 Plots of PAHs isomer pair ratios for source identification |
从多环芳烃同系物比值来看(图 4),珠江三角洲表层水体中PAHs主要来源于液体燃料、煤和生物质燃烧.并且在春夏两季无明显差别.
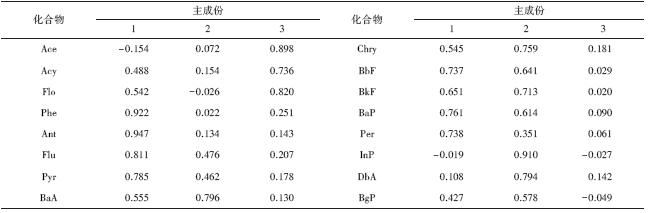
为了在PAHs来源的定性分析的基础上取得定量化的结果,这里进一步对水体中PAHs的浓度进行了主成分(PCA)分析,得到3个主因子,列于附录中表S2 .
| 表S2 珠江三角洲水体中PAHs浓度的主因子分析结果 Table S2 Rotated component matrix of particulate individual PAHs compounds in the Pearl River Delta |
附表S2中主成分1贡献40.4%的整体方差,在菲、蒽、荧蒽、芘及苝等化合物上有明显的高值,除苝外,这些成分主要是燃煤和植物燃烧来源的多环芳烃(Zhang et al.,2012),因此主成分1主要指示燃煤和植物燃烧来源.主成分2贡献30.7%的整体方差,在苯并[a]蒽、 、苯并[b]荧蒽、苯并[k]荧蒽、茚并[1.2.3]芘、二苯并[a,h]蒽上有显著的高值.苯并[a]蒽、 、苯并[b]荧蒽、苯并[k]荧蒽都是炼焦来源的多环芳烃,而茚并[1.2.3]芘、二苯并[a,h]蒽可以用来指示汽车尾气来源(Harrison et al., 1996),因此主成分2主要代表了炼焦及汽车尾气来源的多环芳烃.主成分3贡献14.2%的整体方差,在苊、苊烯、芴等低分子量多环芳烃上有显著的高值,这些成分主要是石油排放来源的多环芳烃(Grimmer et al., 1983),因此主成分3可以用来指示石油排放来源.
将所得因子进行多元线性回归分析,得各因子对PAHs浓度的贡献,如图 5所示.综合来看,PAHs的主要来源——燃煤和植物燃烧来源、炼焦及汽车尾气来源、石油排放对所研究区域中PAHs的贡献比例分别为40.4%、58.4%和2.2%,其中,燃烧来源的PAHs占整体的98.8%,与前述PAHs来源的定性分析的结果一致.
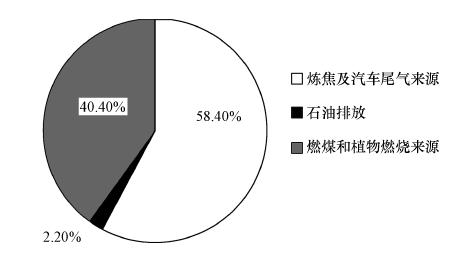 |
| 图 5 不同来源的PAHs对珠江三角洲水体中PAHs的贡献比例 Fig. 5 Average contributions of different sources to the total loading of PAHs in surface water of the Pearl River Delta |
综上所述,结合多环芳烃同系物比值法和主成分分析(PCA)的结果可以得出,珠江广州河段及东江东莞河段水体中PAHs主要来源于石化燃料、煤和生物质的混合燃烧,并且其来源没有明显的季节变化.
4 结论(Conclusions)珠江广州河段及东江东莞河段所采集的水样中,多环芳烃总量在春夏两个季节存在一定的差异;溶解相和颗粒相多环芳烃浓度在春季样品中高于夏季样品.有机质含量及富营养化程度对PAHs的分布具有重要作用.由多环芳烃在水/颗粒物间的有机碳归一化分配系数(logKoc)与辛醇/水分配系数(logKow)间的线性自由能方程发现,春夏两季该区域PAHs在固液两相中的分配是一个由水相向颗粒相吸附的过程,并且夏季PAHs更趋于达到在颗粒物上的吸附平衡.多环芳烃来源分析的结果表明,珠江广州河段及东江东莞河段水体中PAHs主要来源于石化燃料、煤和生物质的混合燃烧,并且在春夏两季均无明显差别.
| [1] | Budzinski H, Jones I, Bellocq J, et al. 1997. Evaluation of sediment contamination by polycyclic aromatic hydrocarbons in the Gironde estuary[J]. Marine Chemistry, 58(1/2): 85-97 |
| [2] | Cailleaud K, Forget-Leray J, Souissi S, et al. 2007. Seasonal variations of hydrophobic organic contaminant concentrations in the water-column of the Seine Estuary and their transfer to a planktonic species Eurytemora affinis (Calanoida, copepoda) (Part 1: PCBs and PAHs)[J]. Chemosphere, 70(2): 270-280 |
| [3] | Countway R E, Dickhut R M, Canuel E A. 2003. Polycyclic aromatic hydrocarbon (PAH) distributions and associations with organic matter in surface waters of the York River, VA Estuary[J]. Organic Geochemistry, 34(2): 209-224 |
| [4] | Deng H M, Peng P A, Huang W L, et al. 2006. Distribution and loadings of polycyclic aromatic hydrocarbons in the Xijiang River in Guangdong, South China[J]. Chemosphere, 64(8): 1401-1411 |
| [5] | Greenberg A E, Clescerl L S, Eaton A D 1998. Standard Methods for the Examination of Water and Wastewater (20th ed)[M]. Washington, DC: American Public Health Association |
| [6] | Grimmer G, Jacob J, Naujack K W. 1983. Profile of the Polycyclic Aromatic-Compounds from Crude Oils 3. Inventory by Gcgc Ms-Pah in Environmental Materials[J]. Fresenius Zeitschrift Fur Analytische Chemie, 314(1): 29-36 |
| [7] | Guitart C, Garcia-Flor N, Bayona J M, et al. 2007. Occurrence and fate of polycyclic aromatic hydrocarbons in the coastal surface microlayer[J]. Marine Pollution Bulletin, 54(2): 186-194 |
| [8] | Guo W, He M C, Yang Z F, et al. 2009. Distribution, partitioning and sources of polycyclic aromatic hydrocarbons in Daliao River water system in dry season, China[J]. Journal of Hazardous Materials, 164(2/3): 1379-1385 |
| [9] | Guo W, He M C, Yang Z F, et al. 2011. Aliphatic and polycyclic aromatic hydrocarbons in the Xihe River, an urban river in China's Shenyang City: Distribution and risk assessment[J]. Journal of Hazardous Materials, 186(2/3): 1193-1199 |
| [10] | Gustafson K E, Dickhut R M. 1997. Distribution of polycyclic aromatic hydrocarbons in southern Chesapeake Bay surface water: Evaluation of three methods for determining freely dissolved water concentrations[J]. Environmental Toxicology and Chemistry, 16(3): 452-461 |
| [11] | Haftka J J H, Govers H A J, Parsons J R. 2010. Influence of temperature and origin of dissolved organic matter on the partitioning behavior of polycyclic aromatic hydrocarbons[J]. Environmental Science and Pollution Research, 17(5): 1070-1079 |
| [12] | Harrison R M, Smith D J T, Luhana L. 1996. Source apportionment of atmospheric polycyclic aromatic hydrocarbons collected from an urban location in Birmingham, UK[J]. Environmental Science & Technology, 30(3): 825-832 |
| [13] | Lammel G, Klanova J, Kohoutek J, et al. 2009. Observation and origin of organochlorine compounds and polycyclic aromatic hydrocarbons in the free troposphere over central Europe[J]. Environmental Pollution, 157(12): 3264-3271 |
| [14] | Li H, Ran Y. 2012. Distribution and bioconcentration of polycyclic aromatic hydrocarbons in surface water and fishes [J]. The Scientific World Journal, 2012: 632910, doi: 10.1100/2012/632910 |
| [15] | Luo X J, Mai B X, Yang Q S, et al. 2004. Polycyclic aromatic hydrocarbons (PAHs) and organochlorine pesticides in water columns from the Pearl River and the Macao harbor in the Pearl River Delta in South China[J]. Marine Pollution Bulletin, 48(11/12): 1102-1115 |
| [16] | 罗孝俊, 陈社军, 麦碧娴, 等. 2008. 多环芳烃在珠江口表层水体中的分布与分配[J]. 环境科学, 29(9): 2385-2391 |
| [17] | 马骁轩, 冉勇, 孙可, 等. 2007. 珠江水系两条重要河流水体中悬浮颗粒物的有机污染物含量[J]. 生态环境, 16(2): 378-383 |
| [18] | Park J S, Wade T L, Sweet S T. 2002. Atmospheric deposition of PAHs, PCBs, and organochlorine pesticides to Corpus Christi Bay, Texas[J]. Atmospheric Environment, 36(10): 1707-1720 |
| [19] | Schrap S M, Haller M, Kopperhuizen A. 1995. Investigating the influence of incomplete separation of sediment and water on experimental sorption coefficients of chlorinated benzenes[J]. Environmental Toxicology and Chemistry, 14(2): 219-228 |
| [20] | Smith K E C, Thullner M, Wick L Y, et al. 2011. Dissolved organic carbon enhances the mass transfer of hydrophobic organic compounds from nonaqueous phase liquids (NAPLs) into the aqueous phase[J]. Environmental Science & Technology, 45(20): 8741-8747 |
| [21] | Taipale S, Kankaala P, Jones R I. 2007. Contributions of different organic carbon sources to Daphnia in the pelagic foodweb of a small polyhumic lake: Results from mesocosm (DIC)-C-13-additions[J]. Ecosystems, 10(5): 757-772 |
| [22] | Voice T C, Rice C P, Weber W J. 1983. Effect of solids concentration on the sorptive partitioning of hydrophobic pollutants in aquatic systems[J]. Environmental Science & Technology, 17(9): 513-518 |
| [23] | Wang J Z, Guan Y F, Ni H G, et al. 2007. Polycyclic aromatic hydrocarbons in riverine runoff of the pearl river delta (China): Concentrations, fluxes, and fate[J]. Environmental Science & Technology, 41(16): 5614-5619 |
| [24] | Wang J Z, Nie Y F, Luo X L, et al. 2008. Occurrence and phase distribution of polycyclic aromatic hydrocarbons in riverine runoff of the Pearl River Delta, China[J]. Marine Pollution Bulletin, 57(6/12): 767-774 |
| [25] | Wang L L, Yang Z F, Niu J F, et al. 2009. Characterization, ecological risk assessment and source diagnostics of polycyclic aromatic hydrocarbons in water column of the Yellow River Delta, one of the most plenty biodiversity zones in the world[J]. Journal of Hazardous Materials, 169(1/3): 460-465 |
| [26] | Wu Y L, Wang X H, Li Y Y, et al. 2011. Occurrence of polycyclic aromatic hydrocarbons (PAHs) in seawater from the Western Taiwan Strait, China[J]. Marine Pollution Bulletin, 63(5/12): 459-463 |
| [27] | Yunker M B, Macdonald R W, Vingarzan R, et al. 2002. PAHs in the Fraser River basin: a critical appraisal of PAH ratios as indicators of PAH source and composition[J]. Organic Geochemistry, 33(4): 489-515 |
| [28] | Zhang K, Liang B, Wang J Z, et al. 2012. Polycyclic aromatic hydrocarbons in upstream riverine runoff of the Pearl River Delta, China: An assessment of regional input sources[J]. Environmental Pollution, 167: 78-84 |
| [29] | Zhang X L, Tao S, Liu W X, et al. 2005. Source diagnostics of polycyclic aromatic hydrocarbons based on species ratios: A multimedia approach[J]. Environmental Science & Technology, 39(23): 9109-9114 |
 2014, Vol. 34
2014, Vol. 34