土壤与地下水的重金属污染是目前备受关注的环境问题之一.随着工业的发展,重金属的排放量逐年增加,大量的重金属离子通过土壤向地下水层入渗,造成了严重的地下水重金属污染(姜楠等,2008;张华等,2009),其中,以铬的污染最为严重.铬在自然界中主要以三价和六价两种价态存在,六价铬毒性大、迁移能力强,而三价铬毒小、迁移能力弱(白利平等,2009).因此,铬污染处理的研究热点主要集中在如何将六价铬转化成三价铬,而对三价铬的稳定化则被忽视.
向含水层中注入碱形成反应带,是修复重金属污染地下水的方法之一.Mg(OH)2作为碱,能够沉淀除去对环境造成危害的Ni2+、Cd2+、Mn2+、Cr3+、Pb2+等重金属离子(郭如新,2010;陈旭耀,2009;冯雪冬等,2009;Guo et al., 2013;Kameda et al., 2009).而且Mg(OH)2和其他碱性物质(NaOH、KOH、Ca(OH)2)相比具有以下优点:Mg(OH)2的溶解度很低,18 ℃时每100 g水中的溶解量仅为0.0009 g,注入到地下环境后,能够在地下环境中长期存在,缓慢释放OH-,对酸性地下水具有长时间的pH缓冲能力;而且很多重金属的氢氧化物在高pH值的环境中会重新溶解,如Cr(OH)3在pH值高于12的环境中会重新溶解,而Mg(OH)2悬浮液的pH值在10~11之间,不会使已经沉淀的重金属重新溶解.若将Mg(OH)2用于地下水处理,在地下环境中形成反应带,需要减小Mg(OH)2的颗粒大小,增强悬浮液的稳定性与流动性.研究表明,表面活性剂会对Mg(OH)2颗粒大小产生显著的影响(黄述州等,2012;刘延雷等,2007;郑敏珠等,2008;Kumari et al., 2010;赵桂欣,2005;刘有智等,2013;吴士军,2010),而且能显著增加Mg(OH)2悬浮液的稳定性.因此,本文用Mg(OH)2与表面活性剂混合制备Mg(OH)2悬浮液,对改性Mg(OH)2的性质、粒度等进行表征,并对其去除Cr3+污染地下水的效果进行研究.
2 材料与方法(Materials and methods) 2.1 胶体氢氧化镁的制备取2 g Mg(OH)2粉末于250 mL锥形瓶中,加入100 mL蒸馏水,加入表面活性剂(吐温80、SDS及吐温80与SDS复配剂),磁力搅拌混合均匀,制得Mg(OH)2悬浮液.
2.2 沉降体积测试取50 mL制得的Mg(OH)2悬浮液移入50 mL具塞比色管中,摇匀后静置.读取不同时间样品悬浮液的体积,样品悬浮液的体积分数按以下公式计算(周大鹏等,2009):
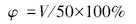
为了研究改性Mg(OH)2对Cr3+的去除效果,在实验室条件下模拟受Cr3+污染的地下水环境,通过在蒸馏水中添加Cr3+配制Cr3+污染地下水(浓度范围为10~70 mg · L-1),整个反应在低温(10 ℃)、密闭不透光的条件下进行.
Mg(OH)2浓度对Cr3+去除的影响:在Cr3+浓度为20 mg · L-1条件下,改变Mg(OH)2悬浮液的浓度,浓度梯度分别为0、10、20、30、40、60、80、100 mg · L-1.在120 r · min-1的条件下振荡24 h,离心取上清液,测量pH值和Cr3+浓度.
Cr3+浓度对去除效果的影响:在Mg(OH)2浓度为40 mg · L-1条件下,改变Cr3+的浓度,浓度梯度分别为0、10、20、30、40、50、60、70 mg · L-1.在120 r · min-1的条件下振荡24 h,离心取上清液,测量pH和Cr3+浓度.
3 结果与讨论(Results and discussion) 3.1 表面活性剂对Mg(OH)2悬浮液稳定性的影响表 1为吐温80、SDS、吐温80与SDS复配(质量比1 ∶ 1)分别在0.4 g · L-1与1.0 g · L-1浓度下,3种改性Mg(OH)2悬浮液静置3 h后悬浮液的体积分数.由表 1可知,低浓度的吐温80比高浓度的吐温80改性效果好,3 h后悬浮液体积分数分别为50%和28%.这是因为吐温80是非离子型表面活性剂,与在Mg(OH)2的结合是包覆作用,吐温80的浓度达到0.4 g · L-1时已可以包覆Mg(OH)2,过量的吐温80易发生桥连效应,增加Mg(OH)2的沉降.SDS在浓度较小时改性效果很差,增加SDS的浓度,改性效果增加,3 h后悬浮液体积分数分别为22%和96%.这是由于SDS是阴离子表面活性剂,以键能作用吸附在Mg(OH)2表面.当SDS浓度较低时,吸附在Mg(OH)2胶体颗粒上的SDS分子较少,改性效果较弱;增加SDS的浓度,吸附在Mg(OH)2胶体上的SDS分子增加,改性效果增强.与单独的吐温80或SDS相比,吐温80与SDS复配后对Mg(OH)2的改性效果最好,短时间内,无论低浓度还是高浓度情况下悬浮液都没有分层.
| 表1 表面活性剂种类及浓度对氢氧化镁的改性效果 Table 1 The modification effect of type and concentration of surfactants on magnesium hydroxide |
为确定复配表面活性剂的最佳浓度,设置不同浓度梯度的复配表面活性剂进行实验,结果见图 1.由图 1可知,随着表面活性剂浓度的增加,Mg(OH)2悬浮液的体积先增加、后下降.说明复配表面活性剂有最佳浓度范围,过多或过少都会影响改性效果.适量的表面活性剂可以起到两方面作用:第一,被吸附在Mg(OH)2颗粒表面的表面活性剂可降低颗粒的表面能,防止Mg(OH)2颗粒间的接触和团聚;第二,表面活性剂对Mg(OH)2有乳化、分散的作用,能够使Mg(OH)2颗粒在水中均匀分散.因此,综 合表面活性剂的用量、效果,选择表面活性剂的总
 |
| 图 1 不同浓度表面活性剂条件下氢氧化镁悬浮液体积随时间的变化 Fig. 1 Variation of the magnesium hydroxide suspension volume with time under different surfactant concentration |
浓度为0.4 g · L-1,吐温80与SDS的配比为1 ∶ 1,占Mg(OH)2质量的2%.
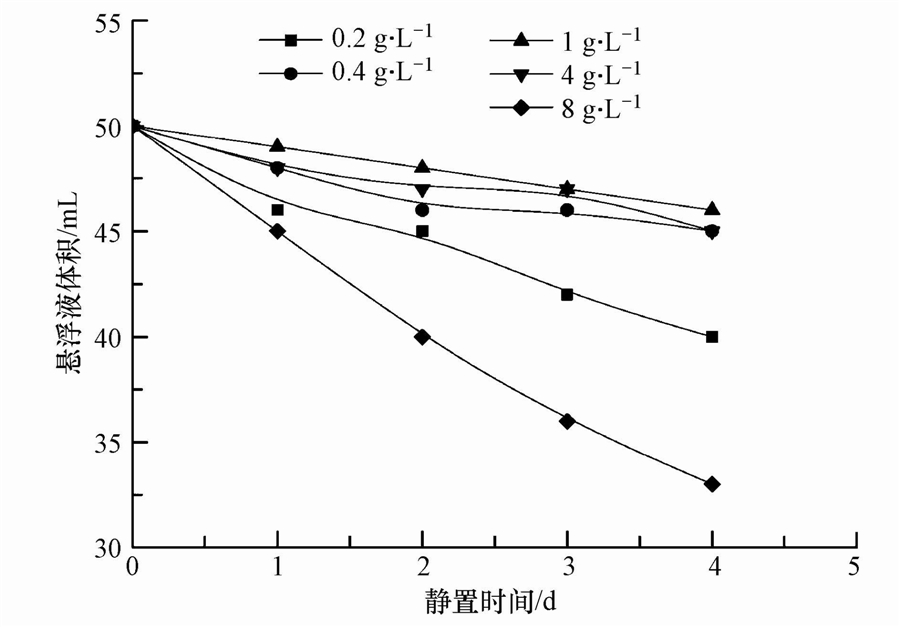
3.2 复配表面活性剂改性Mg(OH)2性质表征将改性Mg(OH)2悬浮液与未改性Mg(OH)2悬浮液放到显微镜下观察,结果如图 2所示.由图可知,改性的Mg(OH)2分散性好,团聚少,而未改性的Mg(OH)2颗粒则发生了严重的团聚,说明表面活性剂能有效阻止Mg(OH)2颗粒的团聚.
 |
| 图 2 未改性(a)与改性(b)氢氧化镁的显微镜照片(×1000倍) Fig. 2 Unmodified(a) and modified(b)magnesium hydroxide magnified 1000 times on microscope |
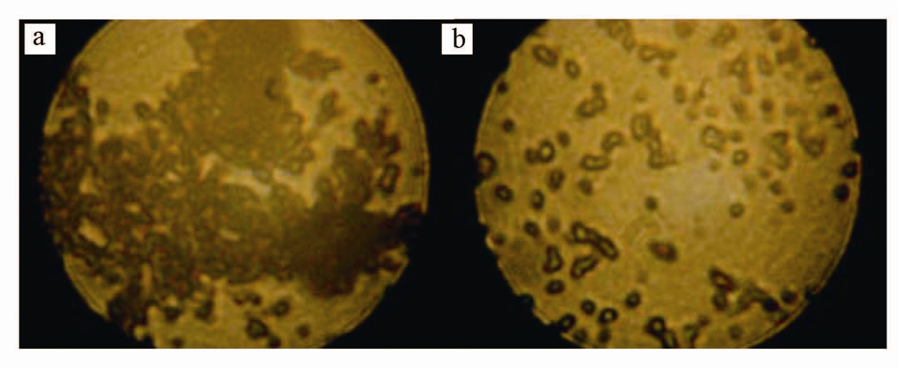
将改性Mg(OH)2进行粒度分析,结果见图 3.由图可知,改性Mg(OH)2粒径较小,0.6~8.4 μm的颗粒占82.41%,颗粒大小在微米级范围.改性Mg(OH)2粒径小,不易团聚沉降,悬浮液的稳定性与流动性都有所增强.
 |
| 图 3 改性氢氧化镁的粒度分析 Fig. 3 Particle size analysis of modified magnesium hydroxide |
当pH大于5.6时,Cr3+在水中就可沉淀.因此,理论上可以通过向地下环境中注入Mg(OH)2,调节地下水pH的方法,修复受Cr3+污染的含水层.另外,改性的Mg(OH)2粒径小,比表面积较大,能够有效吸附污染水体中的铬(翟德伟等,2007).
实验结果显示,Mg(OH)2浓度对Cr3+的去除效果有明显影响(图 4).Mg(OH)2浓度为10 mg · L-1时,出水pH值为5.01,Cr3+的去除率仅为10.5%;当Mg(OH)2的浓度为40 mg · L-1时,出水pH值为6.71(图 5),Cr3+的去除率达到了99.8%.20 mg · L-1 Cr3+溶液的pH值为4.2,这是因为Cr3+有很强的水解作用,会产生H+使水溶液呈酸性.因此,Mg(OH)2需要先中和H+,提高体系的pH.结合图 4、图 5可知,当pH值超过5.6时,去除率达到了80%以上.由此可见,当Mg(OH)2的浓度较小时,Cr3+去除效果较差,随着Mg(OH)2浓度的增加,Cr3+的去除率会迅速增加.
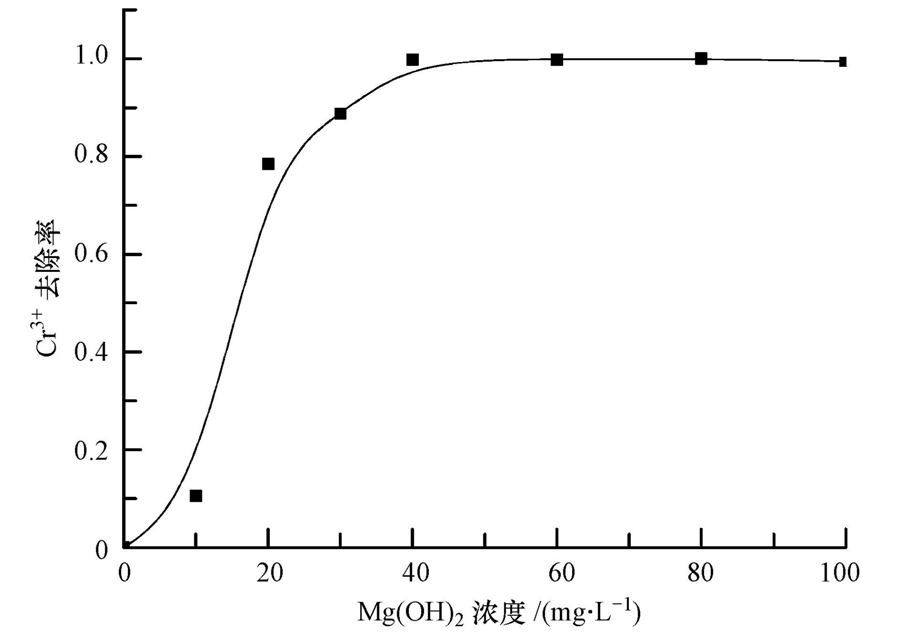 |
| 图 4 氢氧化镁浓度对去除率的影响 Fig. 4 Variation of disposal efficiency with different magnesium hydroxide concentration |
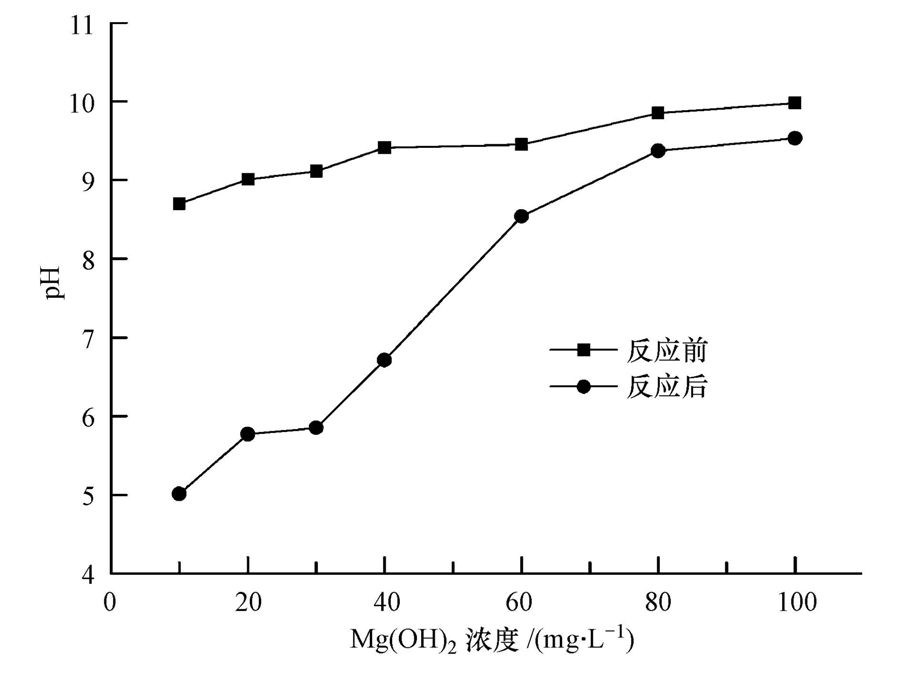 |
| 图 5 不同浓度氢氧化镁体系反应前后的pH值 Fig. 5 The variations of pH over the magnesium hydroxide concentration in reaction systems |
固定Mg(OH)2的用量为40 mg · L-1,改变Cr3+的浓度,Cr3+的去除效果如图 6所示.当Cr3+浓度小于30 mg · L-1时,Mg(OH)2过量,Cr3+去除率很高,在80%以上.当Cr3+的浓度超过30 mg · L-1时,水溶液的pH值会逐渐降低,稳定在3.5左右(图 7).表明中和H+所消耗的Mg(OH)2逐渐增加,用于沉淀Cr3+的Mg(OH)2逐渐减少,Cr3+的去除率与去除量都会下降.因此,在处理铬污染地下水过程中,必需保证Mg(OH)2过量.
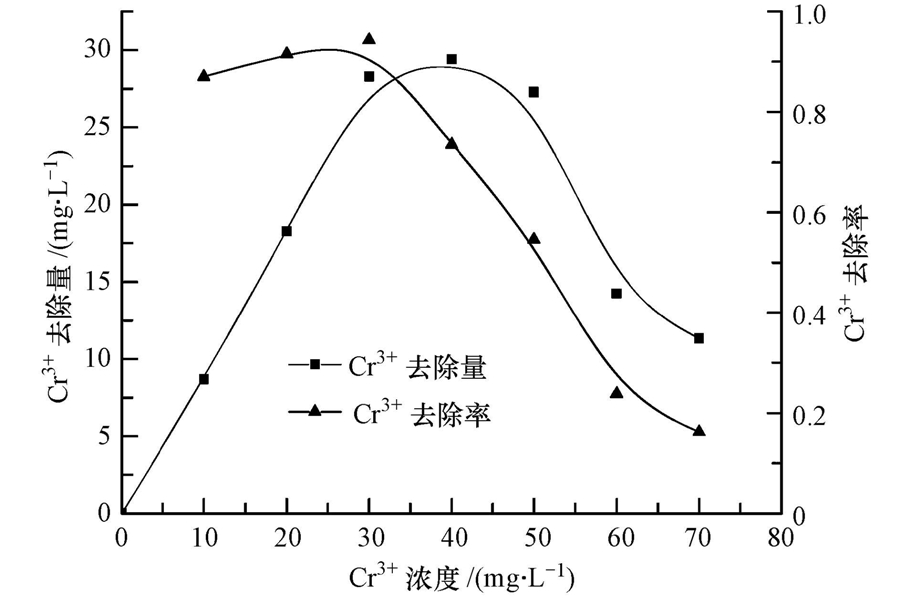 |
| 图 6 Cr3+浓度对去除效果的影响 Fig. 6 The impact of t Cr3+ concentration on the removal efficiency |
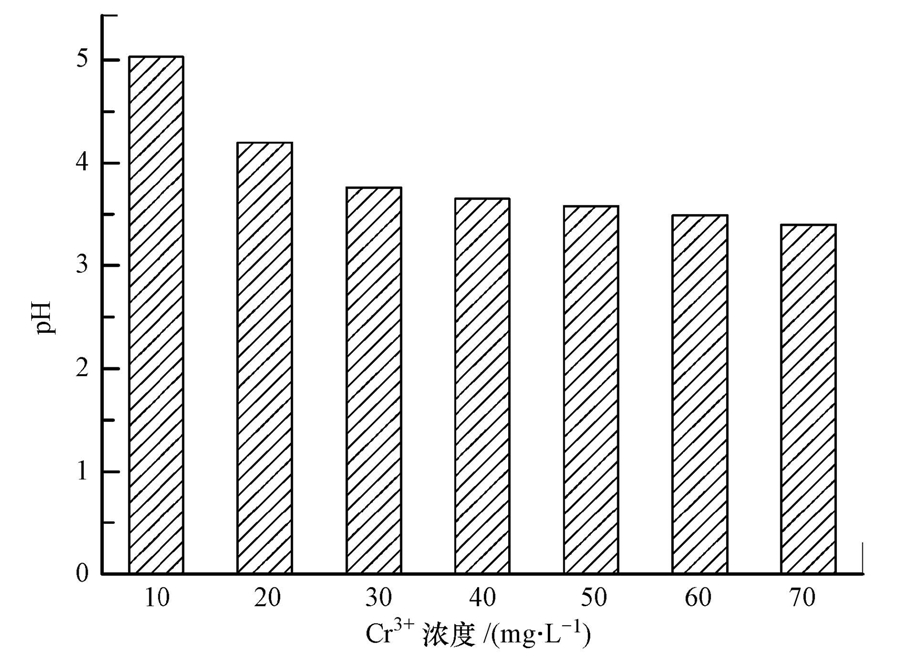 |
| 图 7 不同浓度Cr3+的pH值 Fig. 7 The pH value of different concentrations of Cr3+ |
Mg(OH)2与Cr3+的理论反应为:3Mg(OH)2+2Cr(NO3)3→2Cr(OH)3+3Mg(NO3)2.Mg(OH)2与反应的Cr3+的物质的量比为3 ∶ 2,质量比为1.673 ∶ 1.实验中反应的质量比约为1.333 ∶ 1,两者接近,说明改性Mg(OH)2对Cr3+的去除主要为沉淀反应作用.但实验测量值比理论值要小一些,定量的Mg(OH)2对Cr3+的最大去除量要比沉淀反应算出来的理论值多一些,说明Mg(OH)2对Cr3+还存在吸附或者共沉淀作用.共沉淀主要有3种形式:表面吸附、包藏、生成混晶.其中,包藏需要较大的沉淀剂浓度,在反应中Mg(OH)2的浓度并不高,小于100 mg · L-1.混晶的生成需要阳离子具有相同的电荷或者结构相似,镁和铬既不是同族,元素位置也不相邻,不太容易形成混晶.Mg(OH)2颗粒容易吸附溶液中的阳离子,故表面吸附较容易发生.这类共沉淀与Mg(OH)2对Cr3+的吸附作用在本质上是一样的,这也解释了在图 4中Mg(OH)2的浓度仅为20 mg · L-1,而去除率却能达到78.4%.
4 结论(Conclusions)1)复配的表面活性剂用量少、对Mg(OH)2的改性效果好.吐温80与SDS的复配比为1 ∶ 1,最佳浓度为0.4 g · L-1时,制备出的Mg(OH)2悬浮液颗粒小,不易团聚,静置3 h不分层沉淀.
2)改性Mg(OH)2处理Cr3+污染地下水时,先中和H+,使水体的pH值升高,再使铬转化为沉淀.
3)Mg(OH)2与Cr3+阳离子的反应既有沉淀作用,又有吸附作用,以沉淀反应作用为主.
| [1] | 白利平,王业耀. 2009. 铬在土壤及地下水中迁移转化研究综述[J].地质与资源, 18(2): 144-148 |
| [2] | 陈旭耀. 2009. 氢氧化镁在重金属离子废水中的应用探析[J].科技资讯, (6): 115-115 |
| [3] | 冯雪冬,马艳飞,卢杰. 2009. 氢氧化镁对重金属离子铜锌的吸附特性研究[J].金属矿山, (11): 132-135 |
| [4] | 郭如新. 2010.氢氧化镁在工业废水处理中应用研究进展[J].精细与专用化学品, 18(4): 42-47 |
| [5] | Guo X, Lu J, Zhang L. 2013. Magnesium hydroxide with higher adsorption capacity for effective removal of Co(II) from aqueous solutions[J]. Journal of the Taiwan Institute of Chemical Engineers, 44(4): 630-636 |
| [6] | 黄述州,董海波. 2012. SDS/MAP复配表面活性剂改性纳米氢氧化镁作用机理研究[J].无机盐工业, 44(6): 20-23 |
| [7] | 姜楠,王鹤立,廉新颖. 2008.地下水铅污染修复技术应用与研究进展[J].环境科学与技术, 31(2): 56-60 |
| [8] | Kameda T,Takeuchi H,Yoshioka T.2009.Preparation of organic acid anion-modified magnesium hydroxides by coprecipitation: A novel material for the uptake of heavy metal ions from aqueous solutions[J]. Journal of Physics and Chemistry of Solids, 70(7): 1104-1108 |
| [9] | Kumari L,Li W Z,Kulkarni S, et al.2010. Effect of surfactants on the structure and morphology of magnesium borate hydroxide nanowhiskers synthesized by hydrothermal route[J]. Nanoscale Research Letters, 5(1): 149-157 |
| [10] | 刘延雷,于水军,李娟,等. 2007.超细氢氧化镁阻燃剂的超声制备[J].无机盐工业, 39(9): 20-23 |
| [11] | 刘有智,冯霞,申红艳,等. 2013.表面活性剂对氢氧化镁制备的影响[J].无机盐工业, 45(7): 28-30 |
| [12] | 吴士军. 2010.纳米氢氧化镁阻燃剂的制备研究[J].应用化工, 39(6): 834-836; 839 |
| [13] | 翟德伟,陈爱民,倪哲明. 2007.纳米氢氧化镁合成及用于含铬废水处理的研究[J].科技通报, 23(1): 141-145 |
| [14] | 张华,鲁梦胜,李功振,等. 2009.徐州市北郊工业区浅层地下水重金属污染研究[J].安徽农业科学, 37(9): 4179-4180; 4188 |
| [15] | 赵桂欣. 2005. 微细氢氧化镁的制备方法与应用[J].中国西部科技, (12): 59; 63 |
| [16] | 郑敏珠,卢晗锋,刘华彦,等. 2008. 表面活性剂水热改性氢氧化镁表面性质[J].无机盐工业, 40(7): 16-18 |
| [17] | 周大鹏,杜志平,赵永红,等. 2009. 脂肪醇聚氧乙烯醚羧酸钠改性纳米氢氧化镁性能研究[J].无机盐工业, 41(3): 25-27 |
 2014, Vol. 18
2014, Vol. 18


