随着染料工业的发展,其生产废水已成为主要的水体污染源.印染废水具有颜色深,COD、BOD值较高,组成复杂多变,分布面广等特点(周琪和赵由才,2005).目前常用的处理印染废水的方法都有不同的局限性(Jiang et al., 2014),如化学沉淀法处理印染废水会产生大量的难以处理的泥渣,生物法虽然运行成本低,但不能使染料废水完全脱色,且对微生物有毒副作用.而吸附法作为一种重要的物理化学方法,在处理包括印染废水的有机物污染废水中有着广泛的应用(Panic and Velickovic,2014).但常规的吸附材料大多存在吸附容量低和选择性差等缺点(Lee et al., 2007).如活性炭吸附在水处理中应用已有多年,然而在回收分离特定污染物时,活性炭由于对水中大部分有机污染物具有广谱的吸附效果,而不能有效地分离提纯目标污染物.特别是在处理水中低浓度的目标污染物时,由于存在其它污染物的竞争吸附作用,而难以实现对目标污染物的有效去除.因此,寻找和制备选择性吸附剂对去除水中污染物具有重要的研究意义.以MCM-41为代表的介孔分子筛具有稳定的SiO2 ·结构及较高的比表面积,是一种理想的选择性吸附材料,而改性后的有序介孔材料能够显示出改性前所不具备的特性,在化工催化等领域得到研究者们的关注,但在环境水处理方面的研究尚少(Katok et al., 2006).因此,本文以Ni改性的介孔氧化硅材料MCM-41为选择性吸附剂,用于吸附水中目标污染——甲基蓝.考察Ni/MCM-41对水中甲基蓝的吸附条件及动力学行为,探求合适的处理工艺条件及吸附机理.
2 实验方法(Experimental) 2.1 吸附剂合成以十六烷基三甲基溴化铵(CTAB)为模板剂,九水合硅酸钠为硅源,在强碱性条件下合成介孔分子筛MCM-41.具体方法为:称取Na2SiO3·9H2O 24.42 g置于250 mL烧杯中,加入73 mL去离子水,35 ℃恒温搅拌直至硅酸钠完全溶解.量取一定量2 mol · L-1的H2SO4缓慢加入上述的溶液中,调节pH值为11,继续搅拌30 min;称取7.28 g十六烷基三甲基溴化铵溶于25 mL去离子水中,加入上述溶液,再继续搅拌30 min,然后将所得溶胶转入200 mL带聚四氟乙烯内衬的反应釜中,于145 ℃水热晶化48 h.所得白色固体经洗涤至中性后,在鼓风干燥箱中80 ℃干燥8 h,转入马弗炉中以2 ℃ · min-1的升温速率在空气气氛下550 ℃焙烧5 h,得到MCM-41介孔分子筛.利用等体积浸渍法,以MCM-41为载体,Ni(NO3)2·6H2O为Ni源制备Ni/MCM-41.将载体MCM-41在80 ℃下真空干燥10 h.取一定量载体,浸入经负载量计算1%的硝酸镍溶液中,超声分散90 min后于80 ℃干燥,用马弗炉在550 ℃煅烧3 h(升温速率为2 ℃ · min-1),得到Ni/MCM-41粉末.本实验所用药品均为分析纯,由上海国药化学试剂有限公司生产.
2.2 分析方法X-射线粉末衍射(XRD)在D-MAX 2200 VPC(Rigaku,Japan)型衍射仪上测定(Cu靶K射线,λ=0.15418 nm,管电压40 kV,管电流30 mA,小角扫描范围1.0°~8.0°,扫描速度1 ° · min-1).HY24调速多用恒温振荡器;721分光光度计;800型离心沉淀器;PHS23C型酸度计;英国 Malvern 公司Zeta型电位仪;日本JEOL公司JEM-2100型透射电镜;美国IRIS Intrepid IIXSP公司原子发射光谱仪.
2.3 实验方法在一组100 mL碘量瓶中,分别加入20 mL、50 mg · L-1的甲基蓝溶液,再分别加入准确称量20 mg的Ni/MCM-41,在给定温度下,以150 r · min-1振荡一定时间.把溶液倒入离心管中离心或进行过滤操作取上层清液或滤液,测定其中甲基蓝的残留量(甲基蓝的分析采用分光光度法,最大吸光波长为600 nm),计算Ni/MCM-41对甲基蓝的吸附去除率.
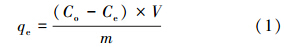
图 1为MCM-41及Ni/MCM-41的小角度XRD图.由图可见,样品在2.2°(100)出现了较强的衍射峰,对应MCM-41二维六方结构的(100),以及在3.8°(110)和4.4°(200)出现了两个较弱的衍射峰,说明MCM-41较高的有序性,这与Katok等(2006)文献报道相一致.Ni/MCM-41也具有这个峰,且结构相似,表明经过负载后,Ni/MCM-41保持了MCM-41的微观结构.
 |
| 图 1 MCM-41及Ni/MCM-41的小角XRD谱图 Fig. 1 Low angle XRD pattern of MCM-41 and Ni/MCM-41 |
图 2为MCM-41和Ni/MCM-41分子筛的TEM照片.由图 2可见,所有样品都具有一维的长程有序的六方孔道结构,有利于有机物分子接近吸附剂表面的活性位点.另外,Ni/MCM-41分子筛表面没有发现镍的氧化物颗粒存在,说明镍已经成功负载在MCM-41分子筛骨架.
 |
| 图 2 MCM-41(a)和Ni/MCM-41(b)吸附剂TEM照片 Fig. 2 TEM images of(a)MCM-41 and (b)Ni/MCM-41 |
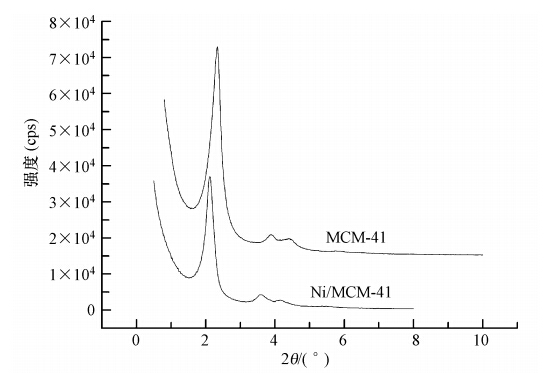
吸附剂的投加量是在吸附研究中的一个重要参数,因为吸附剂的投加量决定了吸附剂的吸附量.如图 3所示,甲基蓝的吸附量初始随Ni/MCM-41投加量(从5 mg至20 mg)的增加而增加.当Ni/MCM-41投加量达到20 mg,甲基蓝的吸附量达到最大值(36.86 mg · g-1).然而,当Ni/MCM-41投加量进一步增加至40 mg 时,对甲基蓝的吸附量迅速下降到12.11 mg · g-1.在较低的吸附剂投加量时,表面的金属位点尚未完全达到饱和,从而导致了较高的吸附能力.但是在较高的吸附剂投加量时,Wang等(2006)认为具有高能量的表面金属位点被低能量的位点占用,表面活化能迅速下降,从而导致较低的吸附能力.此外,Aksu和Kabasakal(2004)认为较高的投加量将会提高吸附剂颗粒之间碰撞的概率,并因此产生吸附剂的凝聚,导致总表面积的减少和增加了扩散路径的长度,这两者都将导致对甲基蓝的吸附能力的降低.因此,20 mg为最佳Ni/MCM-41投加量,在后续实验中以其作为吸附剂投加量的代表.
 |
| 图 3 Ni/MCM-41投加量对甲基蓝去除率的影响 Fig. 3 Effect of adsorbent dosage on removal of methyl blue |
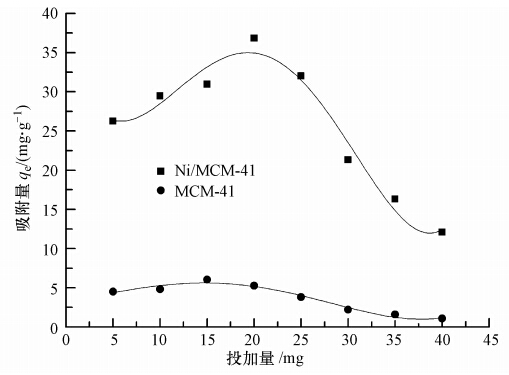
甲基蓝从溶液到 Ni/MCM-41介孔氧化硅表面的被吸附,需要3个基本过程:甲基蓝分子从水溶液中扩散到介孔氧化硅颗粒外表面的液膜上,甲基蓝分子通过液膜扩散后进入介孔氧化硅的孔道中,甲基蓝分子与介孔氧化硅的表面发生作用,从而产生有效吸附.从开始吸附到达到平衡,需要一定的时间,这与吸附剂的颗粒形状、孔道结构、孔壁表面性质、对吸附质的吸附力等有关.图 4是Ni/MCM-41吸附剂对甲基蓝的去除率随时间变化的曲线图.由图可知,Ni/MCM-41吸附剂对甲基蓝的吸附速率都较快,前15 min 的对甲基蓝去除率达到了 70%以上,且不到 30 min 吸附基本达到饱和.这是因为吸附剂的孔道均一且有序,这有利于吸附质在孔道中的传质扩散(Ai and Jiang, 2010).另一方面,迅速吸附速率可能主要归因于吸附剂表面的金属活性位点和甲基蓝间的静电作用(Liu et al., 2013).
 |
| 图 4 吸附时间对甲基蓝去除率的影响 Fig. 4 Effect of contact time on removal of methyl blue |
溶液 pH 是影响吸附过程的重要参数之一,吸附剂和吸附质的物理化学性质会随溶液的 pH 值改变而变化,进而影响吸附过程.溶液的 pH 值不同,水的离子化程度就会不一样,溶解在其中的甲基蓝的形态与性质、氧化硅表面的羟基等基团等都会发生改变.实验中考察了pH从2.0到10.0对Ni/MCM-41吸附染料的影响,结果如图 5所示.Ni/MCM-41对甲基蓝最大去除率在pH等于6附近,然后随着酸度或碱度的提高,去除率逐渐减少.这是因为在强酸强碱条件下,破坏了吸附剂的有序介孔结构,导致整个吸附剂结构崩塌,所以在中性条件(6<pH<7)下,出现较好的吸附效果.另一方面在强酸强碱下,如表 1所示,吸附剂的活性组分Ni大量溶出,在中性条件下,出现较少的Ni溶出.而且甲基蓝是碱性染料,甲基蓝分子的磺酸根端带负电,由于在弱酸性环境下,可与带正电荷的Ni/MCM-41吸附剂表面形成化学键,在一定程度上促进了甲基蓝的吸附.所以pH等于6呈现最佳吸附效果.
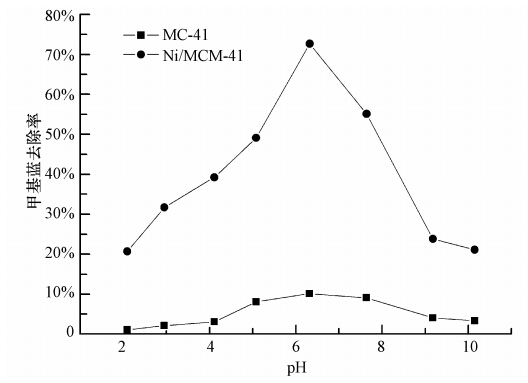 |
| 图 5 溶液 pH 值对甲基蓝去除率的影响 Fig. 5 Effect of pH on removal of methyl blue |
| 表1 溶液pH值对Ni/MCM-41吸附甲基蓝的Ni溶出的影响 Table 1 Effect of solution pH on Ni leaching in the process of methyl blue adsorption on Ni/MCM-41 |
研究不同温度下(5,25,50和80 ℃)对 Ni/MCM-41吸附甲基蓝的影响如图 6所示,从图中可以看出,随着温度的升高,Ni/MCM-41对甲基蓝的吸附量增加,说明吸附过程是吸热过程.Zhang等(2012)认为由于温度升高提高了甲基蓝分子在溶液与吸附剂表面的流动性,从而提高了活性位点的可利用性,进而增加更多的吸附剂表面的吸附位点.
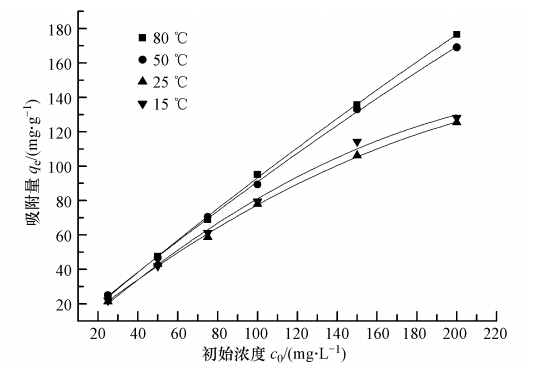 |
| 图 6 温度对甲基蓝去除率的影响 Fig. 6 Effect of temperature on removal of methyl blue |
(1)Langmuir吸附等温式
对于理想的单分子层吸附,Langmuir(等温吸附模型)方程(Juang et al., 2006)可表示为:
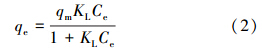
(2)Freundlieh吸附等温式
Freundlich方程(Wang et al., 2006)一般形式为:

(3)Dubinin-Radushkevich吸附等温式
Dubinin-Radushkevich吸附等温式(Qin et al., 2007)的形式为:
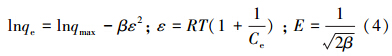
为了研究甲基蓝的吸附等温线,求出Ni/MCM-41对甲基蓝的最大吸附量,对不同初始浓度甲基蓝的吸附情况作了研究.在25 ℃下,达到吸附平衡后,测量溶液中甲基蓝的浓度,计算其在Ni/MCM-41吸附剂上的吸附量,并依式(2)、式(3)和式(4),得图 7.甲基蓝在溶液中被Ni/MCM-41吸附时,吸附量都是随着平衡浓度的增大而增加.当甲基蓝的平衡浓度越来越大时,吸附量的变化幅度越来越小,浓度达到某一个定值后,其吸附量就不再增加了,即达到了Ni/MCM-41的最大吸附量值,吸附趋于饱和.对于固液体系的吸附行为,常用Langmuir,Freuulich,Dubinin-Radushkevich吸附等温式来描述,对实验数据进行线性回归,可以得到相应的参数,结果列于表 2.
| 表2 Ni/MCM-41吸附甲基蓝等温吸附方程的参数 Table 2 Isotherm parameters for adsorption of methyl blue on Ni/MCM-41 |
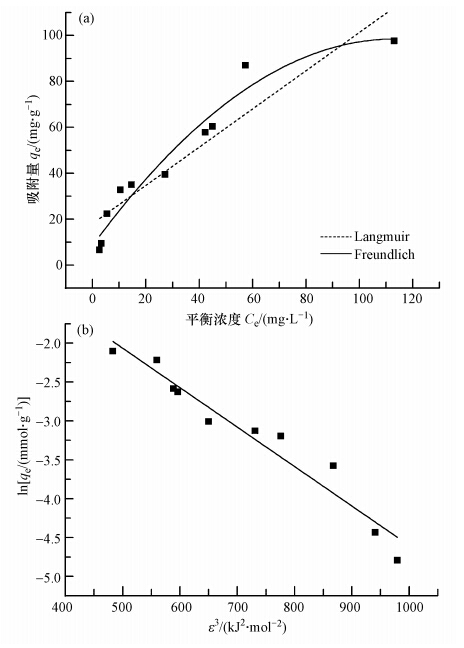 |
| 图 7 Ni/MCM-41对甲基蓝的 Langmuir和Freuulich吸附等温线(a); Dubinin-Radushkevich吸附等温线(b) Fig. 7 Langmuir & Freuulich(a) and Dubinin-Radushkevich(b)equilibrium isotherms of methyl blue adsorption on Ni/MCM-41 |
由表 2看出,Ni/MCM-41对甲基蓝的吸附较好的符合Freuulich和Dubinin-Radushkevich等温吸附模型,线性相关系数达到0.9以上.通过Dubinin-Radushkevich等温吸附方程中,可计算出特征能E为13.91 kJ · mol-1.当E >16 kJ · mol-1,可判断吸附过程为化学吸附;当E < 8 kJ · mol-1,可判断吸附过程为物理吸附;当8 kJ · mol-1< E<16 kJ · mol-1时,Juang 等(2006)和Qin等(2007)认为可判断吸附过程为静电作用.由此,可初步推断Ni/MCM-41吸附甲基蓝的机理为静电作用.
3.8 吸附机理探讨Zeta 电位可以用来描述固液界面的表面电位情况.Ni/MCM-41和MCM-41的 Zeta 电位变化如图 8(a)所示.从图中可以看出,Ni/MCM-41的等电点(pHZPC)在5.5,MCM-41的等电点(pHZPC)在2.28.当 pH<pHZPC时,Ni/MCM-41表面带正电,当 pH>pHZPC时,Ni/MCM-41表面带负电.
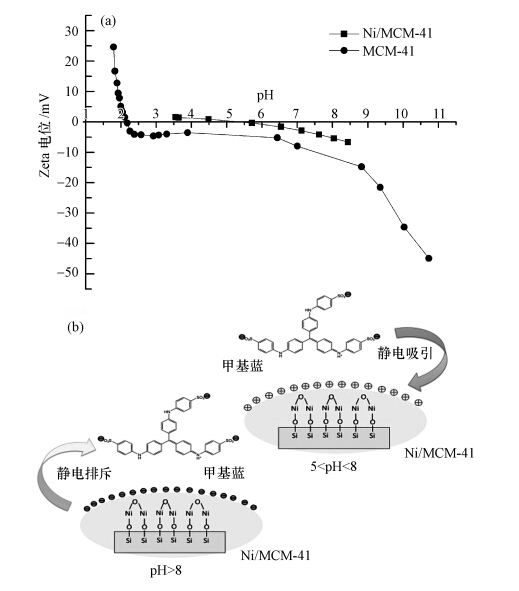 |
| 图 8 Ni/MCM-41和MCM-41吸附甲基蓝的 Zeta 电位变化(a)及Ni/MCM-41对甲基蓝吸附机理(b) Fig. 8 The zeta potential of Ni/MCM-41 and MCM-41(a) and mechanism of methyl blue adsorption(b) |
Ni/MCM-41表面所形成的水合氧化物随pH值的变化有如下的关系:
酸性溶液中:MOH + H+ = MOH+2质子化表面,
碱性溶液中:MOH + OH-= MO- + H2O 脱质子化表面.
在酸性环境下,甲基蓝分子的磺酸根端带负电,可与 MOH+2 形成化学键,在一定程度上促进了甲基蓝的吸附.而碱性环境下甲基蓝带负电,与MO-相排斥,阻碍了甲基蓝的吸附,这与Arshadi等(2013)研究纳米介孔硅材料吸附甲基橙结果相似.另外,在强酸强碱性条件下也可能降低了Ni/MCM-41的结构稳定性,破坏其均一的孔道结构,这与Juang等(2006)用MCM-41吸附染料的结果和Qin等(2009)研究氨基改性MCM-41吸附染料结果相一致.如表 2所示,发现Ni/MCM-41在强酸强碱下,均有大部分Ni溶出,而在中性pH条件下,只有少部分的Ni溶出,结合图 5分析,在 pH 6.0附近时,Ni/MCM-41对甲基蓝的去除率最大,表明Ni是吸附剂吸附甲基蓝主要活性组分,Ni改性MCM-41后,改变了MCM-41表面电荷分布,对碱性染料甲基蓝在不同吸附条件,出现不同程度吸附效果,在强酸强碱下,因为Ni溶出较多从而改变了Ni/MCM-41表面的电荷分布,所以吸附效果均不理想,但在中性条件下,Ni溶出量较少,吸附剂对甲基蓝有较好的吸附效果.从上述分析可以看出,静电作用是Ni/MCM-41对甲基蓝吸附的主要机理,吸附过程可以用图 8(b)表示.
4 结论(Conclusions)1)由水热法合成的介孔分子筛MCM-41具有良好的有序性,通过浸渍法制备的Ni/MCM-41保持了MCM-41的微观结构,Ni在MCM-41表面分散良好.
2)吸附剂投加量、吸附时间、反应温度和初始pH值都对Ni/MCM-41吸附甲基蓝过程有较大影响.甲基蓝在Ni/MCM-41上的吸附符合Freuulich和Dubinin-Radushkevich吸附等温线模型,最大吸附量随着温度的升高而升高,吸附为吸热过程.
3)通过 Zeta 电位分析认为,静电作用是染料吸附的主要机理.
| [1] | Ai L H, Jiang J. 2010. Fast removal of organic dyes from aqueous solutions by AC/ferrospinel composite[J]. Desalination, 262(1/3): 134-140 |
| [2] | Aksu Z, Kabasakal E. 2004. Batch adsorption of 2, 4-dichlorophenoxy-acetic acid (2, 4-D) from aqueous solution by granular activated carbon[J]. Separation and Purification Technology, 35(3): 223-240 |
| [3] | Arshadi M, Salimi Vahid F, Salvacion J W L, et al. 2013. A practical organometallic decorated nano-size SiO2-Al2O3 mixed-oxides for methyl orange removal from aqueous solution[J]. Applied Surface Science, 280: 726-736 |
| [4] | Jiang P, Ren D B, He D P, et al. 2014. An easily sedimentable and effective TiO2 photocatalyst for removal of dyes in water[J]. Separation and Purification Technology, 122: 128-132 |
| [5] | Juang L C, Wang C C, Lee C K. 2006. Adsorption of basic dyes onto MCM-41[J]. Chemosphere, 64(11): 1920-1928 |
| [6] | Katok K V, Tertykh V A, Brichka S Y, et al. 2006. Pyrolytic synthesis of carbon nanostructures on Ni, Co, Fe/MCM-41 catalysts[J]. Materials Chemistry and Physics, 96(2/3): 396-401 |
| [7] | Lee C K, Liu S S, Juang L C, et al. 2007. Application of MCM-41 for dyes removal from wastewater[J]. Journal of Hazardous Materials, 147(3): 997-1005 |
| [8] | Liu J S, Ma S, Zang L J. 2013. Preparation and characterization of ammonium-functionalized silica nanoparticle as a new adsorbent to remove methyl orange from aqueous solution[J]. Applied Surface Science, 265: 393-398 |
| [9] | Panic V V, Velickovic S J. 2014. Removal of model cationic dye by adsorption onto poly (methacrylic acid)/zeolite hydrogel composites: Kinetics, equilibrium study and image analysis[J]. Separation and Purification Technology, 122: 384-394 |
| [10] | Qin Q D, Ma J, Liu K. 2007. Adsorption of nitrobenzene from aqueous solution by MCM-41[J]. Journal of Colloid and Interface Science, 315(1): 80-86 |
| [11] | Qin Q D, Ma J, Liu K. 2009. Adsorption of anionic dyes on ammonium-functionalized MCM-41[J]. Journal of Hazardous Materials, 162(1): 133-139 |
| [12] | Wang S, Zhu Z H. 2006. Characterisation and environmental application of an Australian natural zeolite for basic dye removal from aqueous solution[J]. Journal of Hazardous Materials, 136(3): 946-952 |
| [13] | Wang S B, Li H T, Xu L Y. 2006. Application of zeolite MCM-22 for basic dye removal from wastewater[J]. Journal of Colloid and Interface Science, 295(1): 71-78 |
| [14] | Zhang F, Zhao Z S, Tan R Q, et al. 2012. Selective and effective adsorption of methyl blue by barium phosphate nano-flake[J]. Journal of Colloid and Interface Science, 386(1): 277-284 |
| [15] | 周琪, 赵由才. 2005. 染料对人体健康和生态环境的危害[J]. 环境与健康杂志, 22(3): 229-231 |
 2014, Vol. 34
2014, Vol. 34


