2. 国家海洋局第三海洋研究所, 厦门 361005
2. Third Institute of Oceanography, SOA, Xiamen 361005
作为一类新型持久性有机污染物,溴代阻燃剂(BFRs)的生产和使用有30多年的历史,市场上广泛使用的BFRs主要为多溴联苯醚(PBDEs)、六溴环十二烷(HBCD)以及四溴双酚A(TBBPA).目前,我国多溴联苯醚的需求量仍以每年8%的速度在增长(Mai et al., 2005),这些BFRs在生产、使用和废物处理过程中均会不同程度地流入到环境中(Alcock et al., 2003; Morris et al., 2004; 陈社军等,2005).环境中溴代阻燃剂能够进入生物体和人体,并对其产生不同的不良影响(Hurd and Whalen, 2011; Lilienthal et al., 2009; 翟璟琰等,2008).目前,对溴代阻燃剂的毒理研究,TBBPA主要集中于哺乳动物,水生生物研究较少;PBDEs的研究多以混合物为主,单体研究很少;特别是近年来被发现有更强生物蓄积性的BDE-47研究甚少(Birnbaum and Staskal, 2004),而HBCD的毒性尚缺乏急性毒性等相关数据(杜苗苗等,2012).
抗氧化系统中的酶如SOD、GST和小分子清除剂如GSH等是其发挥解毒功能的重要物质,其酶活性和小分子清除剂含量的变化与生物体受胁迫程度存在密切的关系(Song et al., 2006).近年来一些学者研究了抗氧化系统对外源胁迫因子的响应(Atli and Canli, 2010; 王素敏,2012),但是关于鱼类肝脏抗氧化系统对溴代阻燃剂污染的响应尚未有明确清晰的认识和评价,对于其是否有潜力成为溴代阻燃剂的生物标志物指标缺乏深入和完善的研究数据和结论.
Van der Oost等认为在水生生态系统中,研究与氧化相关的生物标志物指标时通常采用本地鱼群作为受试生物来研究污染物对其影响(Van der Oost et al., 2003),而罗非鱼具有适应性强、鱼病少、食性广等特点,是我国东南沿海一带重要的经济鱼类,已有报道用罗非鱼作为受试生物进行毒理学研究(王素敏,2012).有关粗酶液离体实验方法,目前已有一些文献报道(王素敏,2012; 岳宏伟,2009; Çoban et al., 1996; Han et al., 2013; 吴伟等,2009).离体实验方法与传统的体内动物实验相比,污染物与肝脏粗酶液直接接触,在较低浓度即可引起响应,并且实验过程中的物化环境参数更易精确的限定和控制,有较优的灵活性、灵敏性和重复性.本实验中将粗酶液离体暴污方法与微孔板检测系统结合,兼具同时处理数十个样品、快速、直接、灵敏的特点,这对于快速评价基数庞大并且日益增长的环境污染物对生物抗氧化系统的早期影响是十分有意义的.综上,本实验以来自于3类不同结构的4种市场上常见的BFRs单体化合物(BDE-47,BDE-209,HBCD和TBBPA,结构如图 1)为目标污染物,采用离体实验方法,系统研究了罗非鱼肝脏抗氧化系统对这4种污染物的响应,并探讨3个抗氧化生物指标作为溴代阻燃剂生物标志物的可能性.
 |
| 图 1 4种溴代阻燃剂结构式 Fig. 1 Structures of the 4 BFRs |
受试生物为罗非鱼(Mossambica tilapia),购自厦门同安养殖鱼场,体长15~18 cm,体重25~30 g,实验室暂养一周后挑选生存状态良好的个体用于实验.
2.2 仪器与试剂SpectraMax M2/M5微孔板检测系统(Molecular Devices),Mikro 220R冷冻离心机(Hettich).四溴联苯醚(BDE-47,99.5%)、十溴联苯醚(BDE-209,99%),六溴环十二烷(HBCD,>95.0%)、四溴双酚A(TBBPA)和还原型谷胱甘肽(GSH,>98%)购于sigma公司,1-氯-2,4-二硝基苯(CDNB)、邻苯三酚、邻苯二甲醛和其他实试剂均为国产分析纯.
2.3 实验方法 2.3.1 罗非鱼肝脏粗酶液样品的制备粗酶液的制备参照文献(Stegeman et al., 1979; Förlin,1980)方法.剖鱼取出肝脏后,用预冷的0.15%的KCl溶液洗涤,滤纸吸掉血渍.按1 ∶ 5(g/mL)的比例加入预冷的PBS(pH 7.4),冰浴下匀浆.匀浆液在4 ℃下,10000 g离心30 min,取上清液分装,于-80 ℃保存,用于抗氧化指标的测定.
2.3.2 离体暴污实验4种BFRs用DMSO配成一定浓度的储备液,用超纯水逐级稀释,实验同时设一个空白对照组(未经任何暴露处理的肝粗酶液样品,用NC表示),一个溶剂对照组(5%DMSO暴露处理的肝粗酶液样品,用SC表示)和11个暴污组,暴污实验参照文献(Viarengo et al., 1997)方法,分别取10 μL不同浓度的污染物,10 μL肝粗酶液样品,相应缓冲液于96孔板中混匀,室温孵育1 h,污染物终浓度分别为0.0001,0.001,0.01,0.1,0.5,1,10,50,100,500,1000 μg · L-1,每个浓度设9个平行.
2.3.3 抗氧化系统指标的测定GSH含量测定采用文献(Hissin and Hilf, 1976)的方法,略作修改.GSH在pH = 8.0下,与邻苯二甲醛(OPA)反应生成具有高度荧光的化合物.室温下,于96孔板中加入10 μL粗酶液,180 μL 0.1 mol · L-1的磷酸缓冲溶液(pH 8.0)和10 μL邻苯二甲醛的乙醇溶液(1 mg · mL-1),充分混合,室温下放置20 min.以340 nm为激发波长,在430 nm下测定荧光强度.GSH含量的变化以相对溶剂对照组的百分比表示.
GST活性检测参考文献(Habig et al., 1974)的方法,稍作修改.室温下,于96孔板中加入粗酶液10 μL,0.1 mol · L-1的磷酸缓冲溶液(pH 6.5)170 μL,30 mmol · L-1的GSH溶液10 μL,最后加入30 mmol · L-1的CDNB溶液10 μL,混匀.立即在340 nm下每30 s测定一次吸光值,测定5 min.非酶反应不加粗酶液,其它步骤同上.GST活性的变化以相对溶剂对照组的百分比表示.
SOD活性参照文献(Marklund et al., 1974; 邹国林等,1986)方法,略作修改.室温下,于96孔板中加入0.1 mol L-1的Tris-HCl溶液(pH 8.2)100 μL,超纯水90 μL,最后加入4.5 mmol · L-1的邻苯三酚溶液10 μL,混匀.立即在325 nm下每30 s测定一次吸光值,测定5 min.计算邻苯三酚自氧化速率,按以上步骤加入上清液10 μL,使自氧化速率抑制约50%.SOD活性的变化以相对溶剂对照组的百分比表示.
2.4 数据处理所有数据均以9个平行数据的平均值±标准差(Means±SD)表示.采用统计学软件SPSS 16.0进行分析,正态分布检验采用Shapiro-wilk分析,方差齐性检验采用Levene′s Test,单因素方差分析(one-way ANOVA)采用Dunnett(2-sided)分析,并以p≤0.05(*)表示差异显著,p≤0.01(**)表示差异极显著.
3 结果(Results) 3.1 4种BFRs对罗非鱼肝GSH含量的影响由图 2可知,空白对照组和溶剂对照组无差异,表明溶剂对GSH含量无影响(下同).在4种BFRs胁迫下,罗非鱼肝中GSH含量均呈现先升高后回落的变化趋势,在整个浓度范围内GSH含量均高于对照组水平.其中BDE-47和TBBPA(低溴含量污染物)处理组响应最为敏感,在0.1 ng · L-1时,GSH含量分别上升为对照组的120.61%、132.92%(p≤0.01),较于高溴含量化合物(BDE-209和HBCD),其GSH含量上升幅度更大.BDE-209和HBCD则分别在浓度为1 μg · L-1和0.5 μg · L-1时,GSH含量上升到与对照组呈显著差异(p≤0.05).GSH含量的增加与污染物浓度在一定范围呈正相关关系,而随着暴污浓度的进一步增大,GSH均回落到与对照组无显著差异水平.
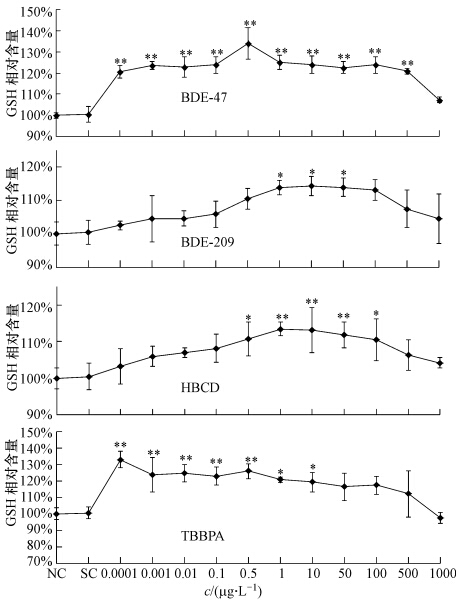 |
| 图 2 罗非鱼肝脏中GSH含量对4种BFRs的响应(*表示与对照组相比差异显著,p≤0.05,**表示与对照组差异极显著,p≤0.01) Fig. 2 Effects of 4 BFRs on GSH content in the liver of Mossambica tilapia |
如图 3所示,在4种BFRs胁迫下,罗非鱼肝中GST活性基本呈下降趋势,并且除TBBPA外,GST对其余3种BFRs(2个PBDEs同系物和HBCD)反应均十分敏感,极低浓度即被显著抑制.BDE-47和HBCD在0.1 ng · L-1时,GST活性分别为对照组的81.55%(p≤0.05)和78.58%(p≤0.01);BDE-209浓度为1 ng · L-1时,GST活性为对照组的82.10%(p≤0.01);低浓度的TBBPA对GST的影响不明显,但在高浓度(≥100 μg · L-1)时,与其它3个BFRs一样,显著抑制GST的活性.
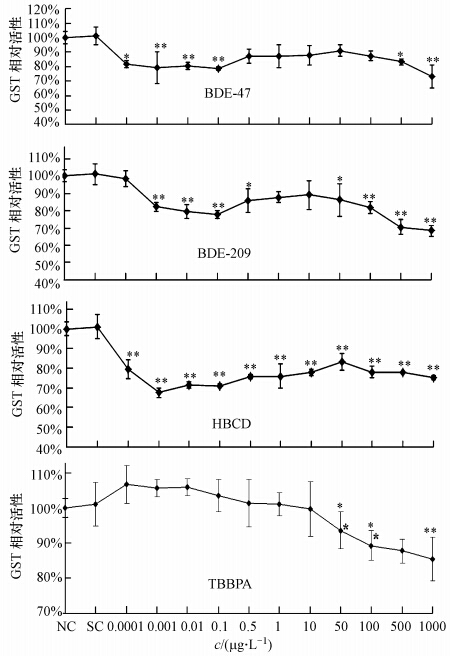 |
| 图 3 罗非鱼肝脏中GST活性对4种BFRs的响应(*表示与对照组相比差异显著,p≤0.05; **表示与对照组差异极显著,p≤0.01) Fig. 3 Effects of 4 BFRs on GST activity in the liver of Mossambica tilapia |
如图 4所示,罗非鱼肝中SOD对4种BFRs响应与GSH的变化趋势一致:均表现为浓度低时活性被诱导,高浓度时活性回落,但活性值总体高于对照组水平.SOD活性对4种BFRs响应均较为敏感:当BDE-47和BDE-209浓度为0.1 ng · L-1时,SOD活性即被明显诱导,而HBCD和TBBPA则在10 ng · L-1时,SOD活性被显著诱导.BDE-47,BDE-209,HBCD均在浓度为10 μg · L-1时,SOD活性达到最大值,而TBBPA则在1 μg · L-1,SOD活性达到最大,其中BDE-47和TBBPA(低溴含量污染物)处理组SOD活性诱导上升幅度相对更大,与GSH响应结果一致.
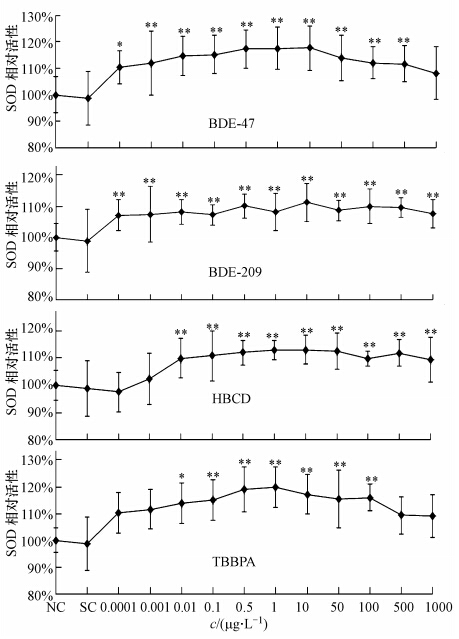 |
| 图 4 罗非鱼肝脏中SOD活性对4种BFRs的响应(*表示与对照组相比差异显著,p≤0.05,**表示与对照组差异极显著,p≤0.01) Fig. 4 Effects of 4 BFRs on SOD activity in the liver of Mossambica tilapia |
对本研究结果进行部分浓度区间的线性分析,如图 5所示.HBCD在低浓度区间(0.1 ng · L-1~10 μg · L-1)时,与GSH含量之间具有良好的浓度-效应线性关系(图 5a),线性方程为y=2.0699x+99.122(R2=0.9317),浓度跨度为105.TBBPA在整个浓度区间(0.1 ng · L-1~1 mg · L-1)GST响应与浓度线性关系良好,线性方程为y=-3.1051x+116.83(R2=0.8598),浓度跨度为107(图 5b).对于BDE-209,其高浓度区间(10 μg · L-1~1 mg · L-1)与GST活性之间线性关系良好(y=-11.31x+170.53,R2=0.9493)(图 5b).对于SOD活性指标,其与低浓度的BDE-47、HBCD和TBBPA(BDE-47和HBCD为0.1 ng · L-1~10 μg · L-1,TBBPA为0.1 ng · L-1~1 μg · L-1)存在良好的线性关系(图 5c).BDE-47和HBCD线性方程分别为y=1. 5964x+107.54(R2=0.9473),y=3.1678x+93.535(R2=0.8688),浓度跨度为105,TBBPA线性方程为y=2.3946x+104.7(R2=0.9383),浓度跨度为104.
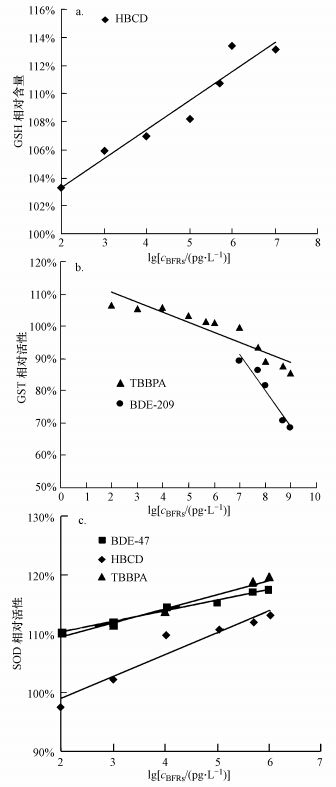 |
| 图 5 3个抗氧化指标与4种BFRs浓度之间的线性关系分析(a:GSH相对含量与BFRs浓度常用对数值线性分析,b:GST相对活性与BFRs浓度常用对数值线性分析,c:SOD相对活性与BFRs浓度常用对数值线性分析) Fig. 5 Dose-response linear regression analysis |
本实验中,4种BFRs胁迫下,罗非鱼离体肝脏中GSH含量均在低、中暴污浓度时升高,高浓度时回落到对照组水平.GSH含量升高可能是由于活性氧自由基(ROS)的形成,有研究表明ROS的存在能够诱导GSH的生成(苏燕等,2007);并且,在解毒过程中GST能够催化GSH与活性亲电化合物(主要为中间代谢产物)结合从而降低毒性,本研究结果显示GST活性显著下降,减少了GSH的消耗,因此GSH含量增加.而高浓度暴污时GSH回落,可能是由于产生的ROS超出了抗氧化系统的清除能力,整个系统平衡被打破,各项功能(包括GST和SOD)都处于下降状态.4个BFRs处理组中,GSH对低溴含量污染物(BDE-47和TBBPA)的响应更为敏感且上升幅度更大,并且SOD活性也呈现类似的响应,这可能与化合物中溴含量有关.溴含量低者(如BDE-47和TBBPA),水溶性较好,且分子体积较小,因此容易被吸收转化,因而在实验中表现出在较低浓度即可引起显著影响.Birnbaum等的研究也表明PBDEs中低溴代的BDE-47具有更强的生物蓄积性(Birnbaum et al., 2004),因此有必要加强对BDE-47和TBBPA等低溴含量污染物的环境浓度监测.虽然,本实验结果显示GSH对BDE-47和TBBPA响应敏感,但线性关系分析结果表明,GSH与两者均不存在良好的剂量-效应线性关系;GSH仅与HBCD存在较宽的线性关系浓度范围,但其对HBCD的响应不敏感,大部分线性范围区间与对照组无显著差异,因此GSH不适合作为BFRs的潜在生物标志物.
本研究中,4种BFRs胁迫下,肝粗酶液中GST活性基本呈下降趋势.有文献报道BDE-209经脱溴反应转化成低溴代二苯醚是其重要的代谢过程,而亲电性的Br·和活性氧自由基可能与GST活性中心结合从而导致抗氧化功能混乱并对GST产生毒性作用,并最终导致GST活性明显降低(Santos et al., 2004);另外脂质过氧化产物可能与蛋白中氨基酸残基结合,改变蛋白质功能,使酶活性降低.并且GST通常很容易被氧化剂灭活(Modesto and Martinez, 2010).因此,由于ROS等过量氧化剂的存在,GST抗氧化防御的过程也成为自身灭活的过程.其他研究者对生物体内的研究也得到类似的结果,Feng等通过腹腔注射给药将鲫鱼分别暴露于5、10、100 mg · L-1三个不同剂量的十溴联苯醚14 d和30 d,结果表明3个剂量组鲫鱼肝中GST活性均被抑制(Feng et al., 2013).聂芳红等将模式生物斑马鱼暴露于含不同浓度TCDD和PCB77的水体中5 d,发现与对照组相比,低剂量的TCDD(0.1 μg · L-1)和PCB77(0.2 μg · L-1)即可极显著抑制肝脏中GST活性(聂芳红等,2009),与本文中GST活性被抑制的结果一致.SOD活性变化趋势则与GSH类似,4种BFRs暴露浓度≥10 ng · L-1时,离体鱼肝中SOD活性均显著升高(p≤0.01),高浓度时又回落.周科等通过研究发现,铜锈环棱螺暴露于含有40、160、640 ng · g-1(以沉积物干重计)BDE-47的沉积物中20 d,与对照组相比,低剂量(40 ng · g-1和160 ng · g-1)实验组肝胰脏中SOD活性能够可被显著诱导,而随着BDE-47浓度升高至640 ng · g-1,SOD活性又恢复到与对照组无显著差异水平.其认为在低浓度外源胁迫作用下,SOD能够表现出一定的氧化应激效应,活性被诱导,发挥清除活性氧自由基的作用,而高浓度时SOD活性下降则说明污染物激发的O- ·2 超出了SOD的防御能力,造成抗氧化系统功能受损,致使SOD活性下降(周科等,2010),与本文研究结果一致.SOD是体内唯一直接以自由基为底物的抗氧化酶,其可以通过歧化反应直接消除O- ·2,因此在较低污染物浓度时即被显著诱导,直接发挥抗氧化功能,并在一定浓度范围内随污染物浓度升高而升高.其它研究中也发现SOD活性随污染物浓度升高而被显著诱导,认为SOD是一个非常有潜力的生物标志物(郭红岩等,2001; 王淑红等,2000).结合本实验线性关系分析和敏感性分析结果,SOD对3个BFRs均在低浓度区间存在较好的剂量-效应线性关系,且对4个BFRs均具有较好的敏感性,因此其极有可能成为BFRs污染的潜在生物标志物.而GST则与BDE-209和TBBPA存在一定的剂量-效应线性关系,且对除TBBPA外的多个BFRs有极强的敏感性,最低响应浓度仅为0.1 ng · L-1,因此其有潜力作为补充生物指标,与SOD共同成为BFRs污染的潜在生物标志物.
5 结论(Conclusions)1)实验结果表明低浓度的BDE-47和TBBPA(溴含量相对更低的污染物)可显著诱导GSH含量和SOD活性,且诱导上升幅度比高溴含量的BDE-209和HBCD更大,说明低溴含量的污染物对生物抗氧化系统可能具有更强干扰效应,因此有必要加强对其环境浓度的监测.
2)3个抗氧化系统生物指标中,相较于GSH,酶类指标(GST和SOD)对BFRs的响应,具有较好的敏感性和较宽的剂量-效应线性范围,因此酶类指标是值得进一步探索优化的候选生物标志物.
3)肝脏粗酶液含有丰富的细胞器和酶,可作为外源污染物一个相对简化的体外暴污模型.本文中3个抗氧化指标体外实验结果与文献中体内研究的结果相比,二者的结论具有一定的一致性,表明肝脏粗酶液离体实验方法可作为污染物生物抗氧化系统影响的快速预检手段,与传统体内实验共同应用于环境毒理学研究中.
| [1] | Alcock R E, Sweetman A J, Prevedouros K, et al. 2003. Understanding levels and trends of BDE-47 in the UK and North America: an assessment of principal reservoirs and source inputs[J]. Environment International, 29(6): 691-698 |
| [2] | Atli G, Canli M. 2010. Response of antioxidant system of freshwater fish Oreochromis niloticus to acute and chronic metal (Cd, Cu, Cr, Zn, Fe) exposures[J]. Ecotoxicology and Environmental Safety, 73(8): 1884-1889 |
| [3] | Birnbaum L S, Staskal D F. 2004. Brominated flame retardants: cause for concern?[J]. Environmental Health Perspectives, 112(1): 1-9 |
| [4] | 陈社军, 麦碧娴, 曾永平, 等. 2005. 珠江三角洲及南海北部海域表层沉积物中多溴联苯醚的分布特征[J]. 环境科学学报, 25(9): 1265-1271 |
| [5] | Çoban T, Bedük Y, Işcan M. 1996. In vitro effects of cadmium and nickel on glutathione, lipid peroxidation and glutathione S-transferase in human kidney[J]. Toxicology in vitro, 10(2): 241-245 |
| [6] | 杜苗苗, 张娴, 颜昌宙. 2012. 溴系阻燃剂的毒理学研究进展[J]. 生态毒理学报, 7(6): 575-584 |
| [7] | Förlin L. 1980. Effects of clophen A50, 3-methylcholanthrene, pregnenolone-16α-carbonitril and phenobarbital on the hepatic microsomal cytochrome P-450-dependen monooxygenase system in rainbow trout, Salmo gairdneri, of different age and sex[J]. Toxicology and Applied Pharmacology, 54(3): 420-430 |
| [8] | Feng M B, Li Y, Qu R J, et al. 2013. Oxidative stress biomarkers in freshwater fish Carassius auratus exposed to decabromodiphenyl ether and ethane, or their mixture[J]. Ecotoxicology, 22(7): 1101-1110 |
| [9] | 郭红岩, 陈亮, 王晓蓉, 等. 2001. 低浓度镱暴露对鲫鱼肝脏多种酶活性的影响[J]. 南京大学学报(自然科学版), 37(6): 665-670 |
| [10] | Habig W H, Pabst M J, Jakoby W B. 1974. Glutathione S-transferases the first enzymatic step in mercapturic acid formation[J]. The Journal of Biological Chemistry, 249(22): 7130-7139 |
| [11] | Han D X, Wang H Y, Yue H W, et al. 2013. Study on the in vitro effects of the mixtures of Polycyclic Aromatic Hydrocarbons (PAHs) and heavy metals on Ethoxyresorufin-O-Deethylase (EROD) activity in Mossambica tilapia liver[J]. Bulletin of Environmental Contamination and Toxicity, 91(4): 460-464 |
| [12] | Hissin P J, Hilf R. 1976. A fluorometric method for determination of oxidized and reduced glutathione in tissues[J]. Analytical Biochemistry, 74(1): 214-226 |
| [13] | Hurd T, Whalen M M. 2011. Tetrabromobisphenol A decreases cell-surface proteins involved in human natural killer (NK) cell-dependent target cell lysis[J]. Journal of Immunotoxicology, 8(3): 219-227 |
| [14] | Lilienthal H, Van Der Ven L T M, Piersma A H, et al. 2009. Effects of the brominated flame retardant hexabromocyclododecane (HBCD) on dopamine-dependent behavior and brainstem auditory evoked potentials in a one-generation reproduction study in Wistar rats[J]. Toxicology Letters, 185(1): 63-72 |
| [15] | Mai B X, Chen S J, Luo X J, et al. 2005. Distribution of polybrominated diphenyl ethers in sediments of the Pearl River Delta and adjacent South China Sea[J]. Environmental Science & Technology, 39(10): 3521-3527 |
| [16] | Marklund S, Marklund G. 1974. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase[J]. European Journal of Biochemistry, 47(3): 469-474 |
| [17] | Modesto K A, Martinez C B R. 2010. Roundup © causes oxidative stress in liver and inhibits acetylcholinesterase in muscle and brain of the fish Prochilodus lineatus[J]. Chemosphere, 78(3): 294-299 |
| [18] | Morris S, Allchin C R, Zegers B N, et al. 2004. Distribution and fate of HBCD and TBBPA brominated flame retardants in North Sea estuaries and aquatic food webs[J]. Environmental Science & Technology, 38(21): 5497-5504 |
| [19] | 聂芳红, 孔庆波, 刘连平, 等. 2009. 两种二噁英类化合物对斑马鱼肝脏MDA 、SOD和GST 的影响[J]. 食品与生物科学技术学报, 28(2): 210-213 |
| [20] | Santos M A, Pacheco M, Ahmad I. 2004. Anguilla anguilla L. antioxidants responses to in situ bleached kraft pulp mill effluent outlet exposure[J]. Environment International, 30(3): 301-308 |
| [21] | Song S B, Xu Y, Zhou B S. 2006. Effects of hexachlorobenzene on antioxidant status of liver and brain of common carp (Cyprinus carpio)[J]. Chemosphere, 65(4): 699-706 |
| [22] | Stegeman J J, Binder R L, Orren A. 1979. Hepatic and extrahepatic microsomal electron transport components and mixed-function oxygenases in the marine fish stenotomus versicolor[J]. Biochemical Pharmacology, 28(23): 3431-3439 |
| [23] | 苏燕, 范涤敏, 罗义, 等. 2007. 四溴双酚A对鲫鱼血清抗氧化系统的影响[J]. 南京大学学报(自然科学版), 43(2): 164-170 |
| [24] | Van Der Oost R, Beyer J, Vermeulen N P E. 2003. Fish bioaccumulation and biomarkers in environmental risk assessment: a review[J]. Environmental Toxicology and Pharmacology, 13(2): 57-149 |
| [25] | Viarengo A, Bettella E, Fabbri R, et al. 1997. Heavy metal inhibition of EROD activity in liver microsomes from the bass Dicentrarchus labrax exposed to organic xenobiotics: Role of GSH in the reduction of heavy metal effects[J]. Marine Environmental Research, 44(1): 1-11 |
| [26] | 王淑红, 王新红, 陈荣, 等. 2000. 荧蒽、菲、芘对菲律宾蛤仔(Ruditapes philippinarum)超氧化物歧化酶的影响[J]. 厦门大学学报(自然科学版), 39(4): 504-507 |
| [27] | 王素敏. 2012. 重金属和持久性有机污染物对罗非鱼肝脏抗氧化系统的影响[D]. 厦门: 国家海洋局第三海洋研究所. 1-71 |
| [28] | 吴伟, 聂风琴, 翟建宏. 2009. 多溴联苯醚对鲫鱼离体肝脏组织中CAT和GSH-Px的影响[J]. 生态环境学报, 18(2): 408-413 |
| [29] | 岳宏伟. 2009. 基于酶活性的海洋环境中多环芳烃重金属复合污染的生物毒性效应研究[D]. 厦门: 国家海洋局第三海洋研究所. 1-59 |
| [30] | 翟璟琰, 施华宏, 刘清波, 等. 2008. 四溴双酚A和五溴酚对红鲫甲状腺激素和脱碘酶的影响[J]. 环境科学学报, 28(8): 1625-1630 |
| [31] | 邹国林, 桂兴芬, 钟晓凌, 等. 1986. 一种 SOD 的测活方法——邻苯三酚自氧化法的改进[J]. 生物化学与生物物理进展, (4): 71-73 |
| [32] | 周科, 马陶武, 朱程, 等. 2010. 2, 2', 4, 4'-四溴联苯醚(BDE-47)污染沉积物对铜锈环棱螺肝胰脏的SOD、CAT和EROD活性的影响[J]. 环境科学学报, 30(8): 1666-1673 |
 2014, Vol. 34
2014, Vol. 34


