2. 云南大学, 云南省微生物研究所, 西南微生物多样性教育部重点实验室, 昆明 650091
2. Key Laboratory of Microbial Diversity in Southwest China, Ministry of Education, Yunnan Institute of Microbiology, Yunnan University, Kunming 650091
植物内生菌是指那些在其生活史的一定或全部阶段生活于健康植物组织内部,而不使宿主植物表现出明显感染症状的微生物菌群(邹文欣和谭仁祥,2001).其广泛分布于植物的根、茎、叶、花、果实、种子中,在促进植物生长、增强宿主抗逆性、强化植物重金属富集能力等方面起着重要作用(Luo et al., 2011; Ma et al., 2011; Shen et al., 2013; Chen et al., 2014).因此,利用植物内生菌来进行重金属污染土壤的修复,不仅可以克服微生物单独修复时生物量小、难以存活、收集困难的缺点,而且还能有效改善植物修复效果,具有较大的应用潜力(姜敏等,2007).
近年来,有关植物内生菌与宿主植物联合修复重金属污染土壤的研究也取得了一些进展,但主要都集中在利用纯培养手段分析内生菌促进宿主生长和重金属累积上,鲜有利用分子生物学技术从遗传种群结构上探讨宿主植物重金属累积对内生菌的影响(张新成,2012; Shen et al., 2013; 刘莉华等,2013; Chen et al., 2014).而对某一环境中微生物的群落结构的认识是研究该环境微生物生态功能的基础(肖炜等,2013).放线菌作为一类重要的微生物类群,在重金属污染环境中亦广泛分布,且对不同重金属具有吸附作用(Polti et al., 2007; Sun et al., 2010).有研究表明,链霉菌可通过分泌具有生物活性的代谢产物使水中的胶体悬浮物相互沉淀,从而降低重金属的毒性(Nies,1999).Luo等(2011)从镉超富集植物龙葵(Solanum nigrum)中分离得到30株镉耐受性细菌,所有细菌都能促进宿主植物生长和重金属富集,其中以放线菌门为主,占所有菌株的43%,揭示了放线菌在重金属污染修复应用中具有极大的应用潜力.
铅锌矿区土壤重金属含量高,结构不良,养分贫瘠,植物难以生长,极大的限制了矿区的修复工作(张汉波等,2004).蜈蚣草(Pteris vittata)作为一种砷超富集植物,不仅具有较强的砷富集能力,而且对铅锌等重金属也具有一定的富集能力,在铅锌矿区广泛分布,在重金属污染土壤的生物修复中具有很好的应用价值和潜力(Ma et al., 2001; 刘月莉等,2009; 谢景千等,2010).本文以采集自四川汉源铅锌矿区的蜈蚣草为研究对象,利用变性梯度凝胶电泳(Denaturing Gradient Gel Electrophoresis,DGGE)从免培养角度分析了蜈蚣草内生放线菌的种群结构和多样性,以期为挖掘重金属污染地区植物内生放线菌资源,为深入认识重金属污染环境下内生菌与植物之间的互作机制提供科学依据.
2 材料与方法(Materials and methods) 2.1 样品采集蜈蚣草及土壤样品采自四川省汉源县万顺铅锌矿区.该矿区位于四川省流沙河下游左岸,地理位置为N 29°23′17″~29°23′58″,E 102°38′02″~102°38′14″,海拔在800~1200 m之间,四季分明,年平均气温17.9 ℃,年均降雨量780 mm,无霜期300 d.野外调查发现,蜈蚣草在该矿区广泛分布.根据矿区污染情况,距离尾矿堆积区不同距离采样.4个采样区分别位于尾矿堆积区、选矿区、弃渣场、进山口,编号依次为H1~H4.随机多株采集生长良好的蜈蚣草,装入无菌密封塑料袋中,贴上标签,立即带回实验室,置于4 ℃冰箱保存.采样区土壤理化性质及部分重金属含量如表 1所示.
| 表 1 采样区土壤基本理化性质及部分重金属含量(李小林等,2011) Table 1 Part of the soil physicochemical properties and heavy metal content |
将蜈蚣草按根、叶柄和羽叶分开,先用蒸馏水洗净,再用去离子水冲洗数遍,自然风干后置于烘箱105 ℃杀青30 min,80 ℃烘干至恒重,研磨,过筛,经HNO3-HClO4(体积比4 ∶ 1)消化后,采用ICP-AES(IRIS Intrepid)光谱分析仪测定Pb、Zn、Cu和Cd的全量.
2.3 蜈蚣草内生放线菌群落结构分析 2.3.1 蜈蚣草总DNA的提取蜈蚣草总DNA的提取参照Tian等(2007)的方法进行.经1.5%的琼脂糖凝胶电泳检测后置于-20 ℃保存备用.
2.3.2 内生放线菌16S rRNA基因扩增应用S1000TM Thermal Cycler(BIO-RAD,USA)进行PCR扩增.以提取的总DNA为模板,F243(GGATGA GCCCGCGGCCTA)(5→3,下同)和R1378(CGGT GTGTACAAGGCCCGGGAACG)(Heuer et al., 1997)为引物进行巢氏PCR第一轮扩增.PCR体系(50 μL): 2× Taq PCR Master Mix 25 μL(TIANGEN),引物1(10 μmol · L-1)和引物2(10 μmol · L-1)各1.0 μL,10倍稀释的DNA模板1 μL,ddH2O补足至50 μL.扩增程序: 94 ℃预变性5 min;94 ℃变性1 min,63 ℃—53 ℃退火50 s(每个循环温度降低0.5 ℃),72 ℃延伸1.5 min,20个循环;然后94 ℃变性1 min,53 ℃退火50 s,72 ℃延伸1.5 min,15个循环,72 ℃延伸10 min.第二轮PCR扩增以第一轮PCR产物稀释100倍为模板,所用引物为R1378和F984GC(gc-AACGCGAAGAACCTTAC)(Heuer et al., 1997),gc夹子序列为(5′- CGCCCGGGGCGCGCCC CGGGCGGGGCGGGGGCACGGG-GGG-3′)(Heuer et al., 1997).PCR体系和条件与第一轮相同.产物于1.5%琼脂糖凝胶电泳检测后用上海生工的SanPrep柱式PCR产物纯化试剂盒对PCR产物进行纯化.
2.3.3 变性梯度凝胶电泳将纯化后的PCR产物用BIO-RAD公司的凝胶电泳仪进行变性梯度凝胶电泳(DGGE).聚丙烯酰胺凝胶(丙烯酰胺:双丙烯酰胺 =37.5 ∶ 1)浓度为8%,变性剂浓度范围为30%~60%(100%的变性剂为7 mol · L-1尿素,40%甲酰胺),电泳缓冲液为1×TAE,150 V电压下,60 ℃恒温电泳6 h,银染.染色后用照相机拍照.
2.3.4 DGGE条带的回收测序及系统发育分析将特征条带进行产物回收,以此为模版,用不带gc夹子的引物F984/R1378进行PCR扩增,PCR体系及条件按1.3.2节所述方法进行.用SanPrep柱式PCR产物纯化试剂盒(上海生工)对PCR产物进行纯化.将纯化后的PCR产物用pMD19-T Vector(TaKaRa)进行连接,转化大肠杆菌感受态细胞DH5α,挑选阳性克隆子,进行菌株PCR检测.测序由上海生工生物技术服务有限公司完成.所有测序结果去除载体序列,在GenBank中进行BLAST分析(http://blast.ncbi.nlm.nih.gov/),将获得的同源序列和测定序列用Clustal X进行分析,采用MEGA 5.0软件包中的Kimura2-Parameter Distance模型进行序列匹配,用邻接法(neighbor-joining)构建系统发育树,自展值(Bootstrap)为1000(Tamura et al., 2011).共获得9个有效序列,在NCBI数据库中的序列登录号:KF285432-KF285440.
2.4 数据处理与分析DGGE图谱采用Quantity One软件(BIO-RAD)分析.以多样性指数(H)、丰富度指数(S)和均匀度指数(EH)等指标来评估蜈蚣草各器官中内生放线菌的物种多样性(Hill et al., 2003).
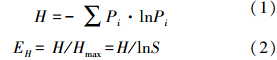
式中,Pi是蜈蚣草某个器官中单一条带的强度在该器官中所有条带强度的比率,S是蜈蚣草某个器官中所有条带数目的总和.
采用SPSS 17.0(SPSS Inc.,Chicago)软件对数据进行相关分析以及方差分析和显著性检验.
3 结果与分析(Results and analysis) 3.1 蜈蚣草中重金属含量分析对采自汉源铅锌矿区的蜈蚣草体内的4种重金 属含量分析结果表明(表 2),蜈蚣草对土壤重金属的吸收差异比较显著.与土壤中4种重金属元素相比,蜈蚣草各部分的重金属含量均相对较高,表明蜈蚣草对4种重金属元素均有一定的富集能力.与一般植物的平均含量相比(Pb 5 mg · kg-1;Zn 100 mg · kg-1;Cd 0 mg · kg-1;Cu 10 mg · kg-1)(何兰兰等,2009),蜈蚣草Pb含量是一般植物的21~117倍,Zn为10~17倍,Cu是1~6倍,Cd含量也较高.但所有重金属含量均未达到超富集植物的标准(何兰兰等,2009).Pb、Cd、Cu 3种重金属元素均呈地下部分高于地上部分的趋势,而Zn的含量则相反,即蜈蚣草对Pb、Cd、Cu 3种重金属元素的转移能力较低,而对Zn元素的转移能力较高.
| 表 2 蜈蚣草不同器官重金属含量 Table 2 Heavy metal concentrations in different organs of P. vittata |
微生物群落的多样性可以通过DGGE条带的多少在一定程度上得以反映(Gu et al., 2009).蜈蚣草内生放线菌16S rRNA基因的DGGE图谱如图 1所示.从DGGE图谱可以看出,每个泳道能检测到数目不等的条带,且各泳道条带的迁移率和亮度也不相同,表明铅锌矿区不同重金属污染程度土壤上生长的蜈蚣草各部位内生放线菌存在一定的差异.条带1R2、3S1和3S2为所有泳道中共有的条带,表明这些条带所代表的内生放线菌类群为该矿区蜈蚣草优势内生放线菌类群.
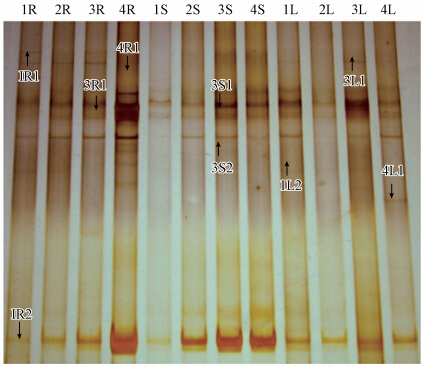 |
| 图 1 蜈蚣草内生放线菌16S rRNA基因的DGGE图谱(注:1R~4R,1S~4S,1L~4L分别代表蜈蚣草样品H1~H4的根,叶柄和羽叶) Fig. 1 DGGE analysis of endophytic actinomycetes 16S rRNA PCR products in P. vittata (Note: 1R~4R,1S~4S,1L~4L represent root,petiole and leatherleaf of the P. vittata isolated from sampling site of H1 to H4,respectively) |
根据DGGE图谱对蜈蚣草内生放线菌多样性指数(H)、丰富度指数(S)和均匀度指数(EH)进行计算,结果见表 3.从表 3可以看出,4份蜈蚣草样品不同部位内生放线菌多样性指数、丰富度指数以及均匀度指数在一定程度上都存在差异,多样性指数在2.79~3.29之间,丰富度指数在6~14之间,均匀度指数在0.99~1.47之间.其中多样性指数和丰富度指数均为地上部分大于地下部分,部分差异显著(p<0.05),而4份样品的均匀度指数之间没有显著的差异.
| 表 3 蜈蚣草内生放线菌的多样性指数、丰富度指数和均匀度指数 Table 3 Shannon-Wiener diversity index(H),Evenness(EH) and Richness(S)of endophytic actinomycetes in P. vittata |
将不同条带切胶回收并测序,共得到9条有效序列(序列编号对应条带见图 1).将所得序列进行系统发育分析,构建系统发育树(图 2).
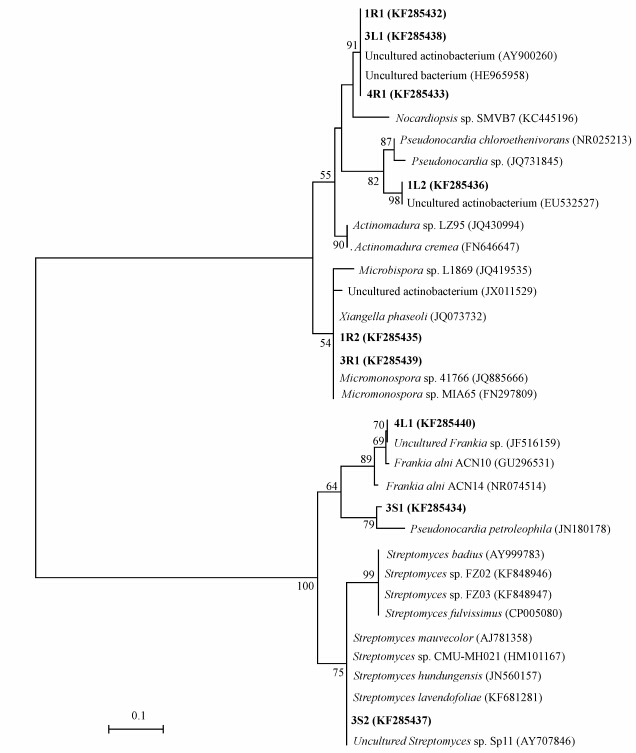 |
| 图 2 蜈蚣草内生放线菌16S rRNA DGGE条带系统发育分析 Fig. 2 Phylogenetic analysis of 16S rRNA gene sequences of endophytic actinomycetes in P. vittata from DGGE b and s. Bootstrap values were calculated from 1000 replications of Kimura 2-parameter, and bootstrap values higher than 50% are shown. The scale bar represents 0.05 changes per sequence position |
系统发育分析显示,蜈蚣草内生放线菌主要与链霉菌(Streptomyces)、假诺卡氏菌(Pseudonocardia)、拟诺卡氏菌(Nocardiopsis)、小单孢菌(Micromonospora)、小双孢菌(Microbispora)、马杜拉放线菌(Actinomadura)、弗兰克氏菌(Frankia)、 Xianggella以及一些未培养放线菌之间的相似性最近.在16S rRNA序列分析中,所有序列与GenBank中已知序列的相似性在97%~100%之间.
条带1R2、3R1、3S1和3S2是所有样品共有的序列,分别与小单孢菌、Xiangella、假诺卡氏菌和链霉菌相似性最高,代表了蜈蚣草内生放线菌共有的类群.条带1R2与Micromonospora sp. 41766(JQ885666)相似性最高,为99%,条带3S1与Pseudonocardia petroleophila(JN180178)的相似性为98%,条带3R1与Xiangella phaseoli(JQ073732)具有99%的相似性,3S2与未培养放线菌Uncultured Streptomyces sp. Sp11(AY707846)相似性达100%,表明蜈蚣草中尚存在未培养的放线菌类群.值得注意的是,Xiangella是最近才从菜豆(Phaseolus vulgaris)根内分离到的一个新属(Wang et al., 2013),而该菌在蜈蚣草中广泛分布,表明该属放线菌可能具有特殊的生态功能.条带4L1仅在H4样品的叶中检测到,序列分析结果表明其与未培养放线菌Uncultured Frankia sp.(JF516159)相似性最高,为99%.
3.5 蜈蚣草重金属含量与内生放线菌多样性指数的相关性分析从表 4可见,蜈蚣草内生放线菌多样性指数和蜈蚣草中Cu、Cd和Pb的含量之间存在显著负相关(p<0.05),而与Zn的含量呈正相关,但未达到显著水平.
| 表 4 蜈蚣草重金属含量与内生放线菌多样性指数的相关性分析 Table 4 Correlation analysis between the heavy metal amounts and Shannon-Wiener diversity index(H)of endophytic actinomycetes in P. vittata |
本文采用免培养手段PCR-DGGE研究了四川汉源铅锌矿区优势植物蜈蚣草内生放线菌类群,并分析了蜈蚣草重金属累积对放线菌类群的影响.群落结构分析表明,链霉菌、假诺卡氏菌、拟诺卡氏菌、小单孢菌、小双孢菌、马杜拉放线菌等放线菌类群在蜈蚣草中均有分布,这与之前对其他非矿区植物内生放线菌的研究结果相似,表明这些放线菌群具有广泛的生态适应性(Qin et al., 2011).相关分析表明,汉源铅锌矿区蜈蚣草内生放线菌多样性与Cu、Cd和Pb的含量之间存在显著负相关(p<0.05),而与含量最高的Zn之间相关性却不显著,推测这可能与放线菌对各重金属离子的耐受能力不同有关.这也从另一方面说明在长期受到重金属污染的自然环境中,不同重金属浓度对微生物多样性的影响可能并非简单的线性关系(谢学辉等,2012).
DGGE分析结果表明,蜈蚣草内生放线菌地下部分的多样性普遍低于地上部分(表 3),这与之前关于植物地下部分内生放线菌通常多于地上部分的结果刚好相反(赵珂等,2011).结合蜈蚣草重金属含量分析(表 2)和内生放线菌多样性指数与重金属含量之间的相关性分析(表 4),可以初步推断出现这种现象的原因可能是由于根中重金属的累积影响了内生放线菌的定殖和分布.而这一结果与之前对矿区植物内生真菌的研究结果也一致,说明重金属的富集确实改变了植物内生菌的分布格局(郑有坤等,2013).
物种多样性是指群落中物种种类的多少,是衡量群落规模和重要性的基础.一般来说,种类越多,分布越均匀,物种多样性指数越大(王慧等,2006).汉源铅锌矿区蜈蚣草内生放线菌的多样性指数在2.79~3.29之间(表 3),与已报道的非矿区植物内生放线菌多样性指数相比并不算低.如张波等(2013)报道四川甘孜地区药用植物花苜蓿(Medicago ruthenica)内生放线菌的多样性指数在2.39~2.74之间,Qin等(2012)报道西双版纳热带雨林植物滇南美登木(Maytenus austroyunnanensis)根茎叶内生放线菌的多样性指数在2.24~3.40之间.可以看出,矿区植物内生放线菌多样性还是相当高的.由此可以推测在重金属污染地区仍然存在多种重金属耐受的内生放线菌类群,这些内生放线菌的存在可能对矿区土壤的生态修复具有重要意义.但是,在多种重金属富集植物中均分离到的具有较强重金属耐受性放线菌如节杆菌(Arthrobacter)和微杆菌(Microbacterium)在本研究中却未检测到(Sun et al., 2010; Luo et al., 2011; 张新成,2012).因此,在今后的研究中可以结合纯培养手段和高通量测序来全面认识铅锌矿区蜈蚣草的内生放线菌种群资源,对这些内生放线菌资源的生理生化特性、特殊代谢产物和特殊功能基因进行深入研究,以便深入认识蜈蚣草内生放线菌资源在重金属胁迫环境中的生态功能.
5 结论(Conclusions)本文通过免培养手段分析了铅锌矿区蜈蚣草内生放线菌的种群结构特征,结果发现蜈蚣草根、叶柄和羽叶中内生放线菌的群落结构和多样性存在一定的差异,其中根部的多样性指数最低,这与重金属在根中的累积密切相关.内生放线菌多样性指数与Cu、Cd和Pb的含量之间存在显著负相关(p<0.05).链霉菌、假诺卡氏菌、拟诺卡氏菌、小单孢菌、小双孢菌、马杜拉放线菌等放线菌在蜈蚣草中均有分布,显示出蜈蚣草内生放线菌具有明显多样性特征.
| [1] | Chen L, Luo S L, Li X J, et al. 2014. Interaction of Cd-hyperaccumulator Solanum nigrum L. and functional endophyte Pseudomonas sp. Lk9 on soil heavy metals uptake[J]. Soil Biology and Biochemistry, 68: 300-308 |
| [2] | Gu Y F, Zhang X P, Tu S H, et al. 2009. Soil microbial biomass, crop yields, and bacterial community structure as affected by long-term fertilizer treatments under wheat-rice cropping[J]. European Journal of Soil Biology, 45(3): 239-246 |
| [3] | 何兰兰, 角媛梅, 王李鸿, 等. 2009. Pb、Zn、Cu、Cd的超富集植物研究进展[J]. 环境科学与技术, 32(11): 120-123 |
| [4] | Heuer H, Krsek M, Baker P, et al. 1997. Analysis of actinomycete communities by specific amplification of genes encoding 16S rRNA and gel-electrophoretic separation in denaturing gradients[J]. Applied and Environmental Microbiology, 63(8): 3233-3241 |
| [5] | Hill T C J, Walsh K A, Harris J A, et al. 2003. Using ecological diversity measures with bacterial communities[J]. FEMS Microbiology Ecology, 43(1): 1-11 |
| [6] | 姜敏, 曹理想, 张仁铎. 2007. 重金属抗性内生真菌与其宿主植物重金属抗性关系初探[J]. 农业环境科学学报, 26(6): 2038-2042 |
| [7] | 李小林, 颜森, 张小平, 等. 2011. 铅锌矿区重金属污染对微生物数量及放线菌群落结构的影响[J]. 农业环境科学学报, 30(3): 468-475 |
| [8] | 刘莉华, 刘淑杰, 陈福明, 等. 2013. 接种内生细菌对龙葵吸收积累镉的影响[J]. 环境科学学报, 33(12): 3368-3375 |
| [9] | 刘月莉, 伍钧, 唐亚, 等. 2009. 四川甘洛铅锌矿区优势植物的重金属含[J]. 生态学报, 29(4): 2020-2026 |
| [10] | Luo S L, Chen L, Chen J L, et al. 2011. Analysis and characterization of cultivable heavy metal-resistant bacterial endophytes isolated from Cd-hyperaccumulator Solanum nigrum L. and their potential use for phytoremediation[J]. Chemosphere, 85(7): 1130-1138 |
| [11] | Ma L Q, Komar K M, Tu C, et al. 2001. A fern that hyperaccumulates arsenic[J]. Nature, 409(6820): 579-579 |
| [12] | Ma Y, Prasad M N V, Rajkumar M, et al. 2011. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances, 29(2): 248-258 |
| [13] | Nies D H. 1999. Microbial heavy-metal resistance[J]. Applied Microbiology and Biotechnology, 51(6): 730-750 |
| [14] | Polti M A, Amoroso M J, Abate C M. 2007. Chromium (VI) resistance and removal by actinomycete strains isolated from sediments[J]. Chemosphere, 67(4): 660-667 |
| [15] | Qin S, Xing K, Jiang J H, et al. 2011. Biodiversity, bioactive natural products and biotechnological potential of plant-associated endophytic actinobacteria[J]. Applied Microbiology and Biotechnology, 89(3): 457-473 |
| [16] | Qin S, Chen H H, Zhao G Z, et al. 2012. Abundant and diverse endophytic actinobacteria associated with medicinal plant Maytenus austroyunnanensis in Xishuangbanna tropical rainforest revealed by culture-dependent and culture-independent methods[J]. Environmental Microbiology Reports, 4(5): 522-531 |
| [17] | Shen M, Liu L, Li D W, et al. 2013. The effect of endophytic Peyronellaea from heavy metal-contaminated and uncontaminated sites on maize growth, heavy metal absorption and accumulation [J]. Fungal Ecology, 6(6): 539-545 |
| [18] | Sun L N, Zhang Y F, He L Y, et al. 2010. Genetic diversity and characterization of heavy metal-resistant-endophytic bacteria from two copper-tolerant plant species on copper mine wasteland[J]. Bioresource Technology, 101(2): 501-509 |
| [19] | Tamura K, Peterson D, Peterson N, et al. 2011. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 28(10): 2731-2739 |
| [20] | Tian X L, Cao L X, Tan H M, et al. 2007. Diversity of cultivated and uncultivated actinobacterial endophytes in the stems and roots of rice[J]. Microbial Ecology, 53(4): 700-707 |
| [21] | 王慧, 王远鹏, 林琦, 等. 2006. 应用 PCR-DGGE 研究铜冶炼厂附近根际土壤微生物生态变化[J]. 农业环境科学学报, 25(4): 903-907 |
| [22] | Wang X J, Jia F Y, Liu C X, et al. 2013. Xiangella phaseoli gen. nov., sp. nov., a member of the family Micromonosporaceae[J]. International Journal of Systematic and Evolutionary Microbiology, 63(6): 2138-2145 |
| [23] | 肖炜, 张仕颖, 赵琴, 等. 2013. 云南个旧锡矿区可培养细菌多样性及其重金属抗性[J]. 微生物学报, 53(11): 1158-1165 |
| [24] | 谢景千, 雷梅, 陈同斌, 等. 2010. 蜈蚣草对污染土壤中As、Pb、Zn、Cu的原位去除效果[J]. 环境科学学报, 30(1): 165-171 |
| [25] | 谢学辉, 范凤霞, 袁学武, 等. 2012. 德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响[J]. 微生物学通报, 39(5): 624-637 |
| [26] | 张波, 李小林, 江华明, 等. 2013. 花苜蓿内生放线菌多样性及群落结构[J]. 草业学报, 22(5): 113-119 |
| [27] | 张汉波, 于春蓓, 施雯, 等. 2004. 不同时空铅锌矿渣中耐受重金属细菌群体的变化[J]. 农村生态环境, 20(1): 44-47 |
| [28] | 张新成. 2012. 东南景天内生菌分离鉴定及其强化重金属超积累效应与机制[D]. 杭州: 浙江大学 |
| [29] | 赵珂, 徐宽, 陈强, 等. 2011. 几种野生药用植物内生放线菌的遗传多样性及抗菌活性[J]. 四川农业大学学报, 29(2): 225-229; 279 |
| [30] | 郑有坤, 陈诚, 任丹, 等. 2013. 四川汉源铅锌矿区植物内生真菌的遗传多样性初步研究[J]. 四川农业大学学报, 31(3): 308-313 |
| [31] | 邹文欣, 谭仁祥. 2001. 植物内生菌研究新进展[J]. 植物学报, 43(9): 881-892 |
 2014, Vol. 34
2014, Vol. 34


